Как отличить токсоплазмоз от мононуклеоза
Обновлено: 19.04.2024
Инфекционный мононуклеоз – это острое вирусное заболевание (преимущественно вирус Эпштейна-Барр), которое характеризуется лихорадкой, поражением ротоглотки, лимфатических узлов, печени, селезенки и своеобразными изменениями состава крови (лимфомоноцитоз, атипичные мононуклеары).
Код(ы) МКБ-10:
| Коды МКБ-10 | |
| B27 | Инфекционный мононуклеоз |
| B27.0 | Мононуклеоз, вызванный гамма-герпетическим вирусом Мононуклеоз, вызванный вирусом Эпштейна-Барр |
| B27.1 | Цитомегаловирусный мононуклеоз |
| B27.8 | Другой инфекционный мононуклеоз |
| B27.9 | Инфекционный мононуклеоз неуточнённый |
| D82.3 | Иммунодефицит вследствие наследственного дефекта, вызванного вирусом Эпштейна-Барр |
Дата разработки/пересмотра протокола: 2017 год.
Сокращения, используемые в протоколе:
| EA | – | ранний антиген ВЭБ вируса Эпштейна-Барр |
| EBNA | – | ядерный антиген вируса Эпштейна-Барр |
| IgG | – | иммуноглобулины класса G |
| IgM | – | иммуноглобулины класса М |
| VCA | – | капсульный антиген вируса Эпштейна-Барр |
| ВИЧ | – | вирус иммунодефицита человека |
| ВОП | – | врач общей практики |
| ВЭБ | – | вирус Эпштейна-Барр |
| ДНК | – | дезоксирибонуклеиновая кислота |
| ЖКТ | – | желудочно-кишечный тракт |
| ИФА | – | иммуноферментный анализ |
| МКБ | – | международная классификация болезней |
| НПВС | – | нестероидные противовоспалительные средства |
| ОАК | – | общий анализ крови |
| ОАМ | – | общий анализ мочи |
| ПЦР | – | полимеразная цепная реакция |
| СОЭ | – | скорость оседания эритроцитов |
Пользователи протокола: врачи скорой неотложной помощи, фельдшеры, врачи общей практики, педиатры, детские инфекционисты, детские хирурги.
Категория пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
Классификация
| По типу: • типичный; • атипичный (бессимптомный, стертый, висцеральный). | По тяжести: • легкая форма; • среднетяжелая форма; • тяжелая форма. | По течению: • острое (до 3 мес.); • затяжное (3-6 мес.); • хроническое (более 6 мес.); • рецидивирующее (возврат клинических симптомов болезни через 1 месяц и более после перенесенного заболевания). |
Осложнения:
· ранние осложнения (1-3 недели болезни): разрыв селезенки, асфиксия, (вследствие фаринготонзиллярного отека), миокардит, интерстициальная пневмония, энцефалит, паралич черепных нервов, в том числе паралич Белла, менингоэнцефалит, полиневрит, синдром Гийена-Барре;
· поздние осложнения (позже 3 недели болезни): гемолитическая анемия, тромбоцитопеническая пурпура, апластическая анемия, гепатит, синдром мальабсорбции и др., как следствие аутоиммунного процесса.
Типичная форма характеризуется лихорадкой, поражением ротоглотки, лимфатических узлов, печени, селезенки и своеобразными изменениями состава крови (лимфомоноцитоз на фоне лейкоцитоза и атипичные мононуклеары в количестве 10% и более).
Атипичные формы инфекционного мононуклеоза:
· стертая форма: протекает со слабо выраженными и быстро проходящими формами, симптомами или под маской острых респираторных заболеваний, диагностируется преимущественно в эпидемических очагах;
· бессимптомная форма: протекает с отсутствием клинических симптомов, диагностируется на основании обследования гематологическими, серологическими методами и методом эпидемиологического анализа;
· висцеральная форма: отличается тяжелым течением с полиорганным поражением, с вовлечением сердечно-сосудистой, центральной и периферической нервной систем, почек, надпочечников и других жизненно важных органов.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии [1-5,9,12,15,16]:
| Признак | Характеристика |
| Лихорадка | Высокая, длительная |
| Синдром поражения рото-и носоглотки | Синдром тонзиллита с налетами или без, аденоидит, фарингит |
| Синдром поражения лимфатических узлов | Преимущественно увеличение передне- и/или заднешейных групп лимфоузлов, внутрибрюшных лимфоузлов, наиболее часто у ворот печени и селезенки, гипертрофия небных и глоточной миндалин |
| Синдром гепатоспленомегалии | Увеличение размеров печени и селезенки |
| Синдром цитолиза печеночных клеток и нарушения пигментного (билирубинового) обмена Печени | Повышение аланинаминотрансминазы, аспартатаминотрансминазы. Нарушение пигментного обмена печени, проявляющееся желтухой и повышением билирубина |
| Синдром экзантемы | Сыпь пятнисто-папулезная, реже геморрагическая с локализацией на лице, туловище, конечностях, чаще проксимальных отделов, яркая, обильная, местами сливная. Возможен кожный зуд, отечность лица. Появляется на 5-10 день болезни. |
Критерии оценки степени тяжести инфекционного мононуклеоза по клиническим признакам [1-5,9,12,15,16]:
| Признак | Характеристика признака | |||
| Легкая степень тяжести | Средняя степень тяжести | Тяжелая степень тяжести | ||
| Выраженность и длительность интоксикации | Отсутствует или легкая выраженность, 1-5 дней | Умеренной выраженности, 6-7 дней | Ярко выражена, более 8 дней | |
| выраженность и продолжительность лихорадки | повышение температуры до 38 ° С, длительность 1-5 дней | повышение температуры от 38,1 до 39 ° С, длительность 6-8 дней | повышение температуры более 39,0 ° С, длительность более 9 дней | |
| Характер воспалительных изменений в рото- и носоглотке | Воспалительные изменения катарального характера или с островчатыми, тонкими налетами, продолжительностью 1-3 дня; затруднение носового дыхания 1-4 дня | Воспалительные изменения с лакунарными налетами, продолжительностью 4-6 дней; затруднение носового дыхания 5-8 дней | ||
| ОАК | лейкопения/умеренный лейкоцитоз (12-25х109/л); лимфомоноцитоз до 70-80%; нейтропения; увеличение СОЭ до 20-30 мм/ч; атипичные мононуклеары (отсутствие или увеличение от 10 до 50%). | |
| Серологический (ИФА с определением показателя индекса авидности) | обнаружение специфических антител IgM VCA к ВЭБ и IgG VCA, IgG EA, IgG-EBNA к ВЭБ с определением показателя индекса авидности | |
Дополнительные лабораторные исследования: | ||
| Молекулярно-генетический метод (ПЦР) | обнаружение в крови ДНК вируса Эпштейна-Барр. | |
| Биохимический анализ крови (при гепатомегалии и желтухе) | определение концентрации билирубина и АЛАТ в крови: умеренная гиперферментемия, гипербилирубинемия. | |
| Бактериологическое исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы | для идентификации бактериальной этиологии острого тонзиллита. | |
| Признак | Критерии |
| Атипичные мононуклеары | Выявление атипичных мононуклеаров в периферической крови более10% (со 2-3 недели болезни) |
| Лимфомоноцитоз | Выявление лимфомоноцитоза в периферической крови |
| IgM VCA VCA, IgG-EBNA вируса Эпштейна- Барр | В острый период: IgM VCA с момента развития клинических признаков болезни и следующие 4-6 недель присутствуют и снижаются, IgG EA с первой недели болезни нарастают до нескольких лет после нее, персистируют на невысоком уровне, IgG VCA обнаруживаются через несколько недель после появления IgM VCA, нарастают, персистируют пожизненно на высоком уровне, IgG-EBNA-1, 2- отсутствуют или имеются в небольшом количестве. В период реконвалесценции: IgM VCA отсутствуют или имеются в малом количестве, IgG EA персистируют пожизненно на невысоком уровне, IgG VCA персистируют пожизненно IgG EBNA несколько недель после появления клинических признаков и персистируют обнаруживаются через пожизненно на невысоком уровне |
| Определение показателя индекса авидности | Обнаружение IgG с низкой авидностью при наличии или отсутствии IgM свидетельствует о первичной (недавней) инфекции. Присутствие высокоавидных антител IgG указывает на период реконвалесценции |
| ДНК вируса Эпштейна-Барр в крови и слюне | Выявление ДНК вируса методом ПЦР в крови (через 1-2 недели после появления клинических симптомов), слюне. |
Инструментальные исследования: нет.
Показания для консультации специалистов:
· консультация оториноларинголога: при аденоидите, формировании паратонзиллярного абсцесса, воспалительных процессах со стороны придаточных пазух носа;
· консультация гематолога: при прогрессировании гематологических сдвигов;
· консультация хирурга: при выраженном абдоминальном болевом синдроме.

Диагностический алгоритм: (схема)
Коварный инфекционный мононуклеоз: разберемся, чем он опасен и как его обнаружить
Сейчас все чаще можно услышать сложное и несколько пугающее название болезни — инфекционный мононуклеоз (ИМ). Но даже если это название для вас ново, вероятность, что вы или ваш ребенок уже столкнулись с его возбудителем, достаточно велика. При том, что распространенность этой болезни весьма широка, она не всегда диагностируется правильно. Это связано с тем, что проявляться мононуклеоз может по-разному — как у детей, так и у взрослых. Он способен умело маскироваться и имеет тенденцию к хронитизации. Неудивительно, что мононуклеоз считается крайне коварным явлением.
Давайте разберемся с его причинами, симптомами и, что особенно важно, с его диагностикой!

Что вызывает мононуклеоз?
Мононуклеоз у детей: симптомы и течение
Чаще всего первые проявления инфекционного мононуклеоза возникают у детей раннего возраста и впоследствии у подростков в пубертатном периоде. В любом случае для детского возраста характерно острое начало инфекции.
Какие симптомы в этом случае можно заметить?
В целом острая фаза инфекционного мононуклеоза длится около двух-трех недель. Как и другие разновидности герпес-вирусов, вирус Эпштейна — Барр склонен к сохранению в организме в латентном состоянии на всю жизнь.

Проявления инфекционного мононуклеоза у взрослых
Каковы проявления инфекционного мононуклеоза у взрослых?
Чем хуже обстоят дела с иммунитетом, тем чаще и мощнее будут рецидивы инфекции.
Скрытые опасности вируса Эпштейна — Барр
Ученые выявили тесную связь вируса Эпштейна — Барр с развитием некоторых видов новообразований (назофарингеальной карциономы) и болезней крови (лимфомы Бёркитта). Своевременное лечение обострений инфекционного мононуклеоза может снизить риск подобных осложнений.
Зачем нужна проверка на вирус Эпштейна — Барр?
Частые ангины, признаки ухудшения работы печени и другие перечисленные выше проявления встречаются при многих заболеваниях, что вызывает трудности в постановке диагноза на основе клинических проявлений. Возможности современных лабораторных исследований позволяют быстро прояснить ситуацию и сделать дифференциальную диагностику намного проще и точней.
Заболевания, под которые может маскироваться инфекция, вызванная вирусом Эпштейна — Барр:
Лабораторные тесты — это единственный и надежный способ обеспечить такую реализацию диагностики инфекционного мононуклеоза, результат который будет точным и информативным.

Лабораторная диагностика инфекционного мононуклеоза
Существует три главных критерия для лабораторного подтверждения диагноза:
Первые два пункта оцениваются с помощью развернутого общего анализа крови с лейкоцитарной формулой. Такой анализ позволяет установить процентное соотношение разных видов белых кровяных телец, выявить мононуклеары — измененные на фоне активности вируса Эпштейна — Барр белые кровяные клетки.
Серологический тест включает определение иммуноглобулинов класса М и G к нескольким видам вирусных антигенов (в том числе к капсидному, раннему и ядерному антигену) и позволяет сделать вывод о давности заражения, переходе инфекции в хроническую форму и ее реактивации (новом обострении).
Существует еще один метод диагностики инфекционного мононуклеоза, вызванного вирусом Эпштейна — Барр, — метод полимеразной циклической реакции (ПЦР). Данный метод молекулярной биологии, основанный на выявлении ДНК возбудителей инфекции, является сегодня одним из самых точных и чувствительных методов диагностики инфекционных заболеваний. ПЦР позволяет определять не только наличие инфекции, признаки ее реактивации, но вирусную нагрузку, то есть количественное присутствие вирусной ДНК в крови. Применение метода ПЦР в настоящее время можно считать лучшим вариантом для выявления первичной инфекции ВЭБ у детей раннего возраста, а также у лиц с иммунодефицитными состояниями, когда серодиагностика малоэффективна.
Диагностика инфекционного мононуклеоза в LAB4U

В сухом остатке:
Для первичной диагностики вируса Эпштейна — Барр у детей раннего возраста (до 3-х лет) применяется метод ПЦР-диагностики. Это исследование и ряд других, которые могут потребоваться при комплексном обследовании при наличии инфекционного мононуклеоза, можно всегда найти в каталоге онлайн-лаборатории LAB4U.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
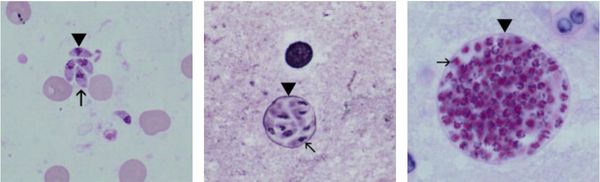
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
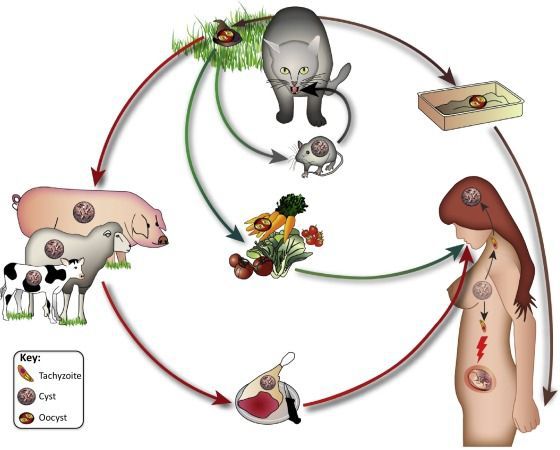
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
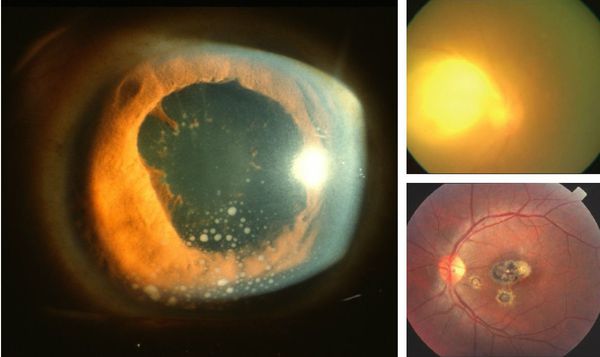
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
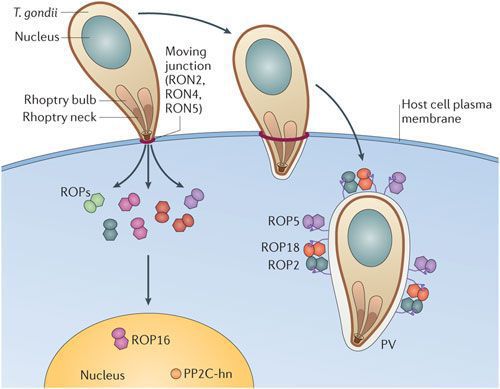
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]

Инфекционный мононуклеоз ― это инфекционное заболевание, носящее также еще несколько названий: болезнь Филатова, вирус Эпштейна – Барр (ВЭБ), моноцитарная ангина, доброкачественный лимфобластоз. Характеризуется лихорадочным состоянием, поражением зева, лимфоузлов, селезенки и печени, изменяет состав крови.
Возбудитель мононуклеоза ― ДНК-геномный вирус Эпштейна - Барр семейства герпесвирусов (Herpesviridae). Делиться на два типа А и В, которые схожи по симптоматике и течению заболевания.
Герпесвирус широко распространен ― 50% детей являются носителями, среди взрослых заболеваемость достигает 90%. В подавляющем большинстве случаев человек является носителем. Симптомы не проявляются. Такого человека называют сероположительным или серопозитивным.
Иногда болезнь вызывает серьезные осложнения: непроходимость дыхательных путей, закрытое повреждение мягких тканей селезенки и неврологические синдромы. Основной диагностический метод ― серологический анализу. Терапия носит симптоматический, поддерживающий характер. Однажды инфицированный человек становится носителем вируса на всю жизнь.
Пути передачи
Вирус не живет вне организма человека. Гибнет при высокой температуре и от дезинфицирующих средств. Передается биологическими жидкостями и воздушно-капельным путем при близком контакте здорового и серопозитивного человека. Заражение происходит как в острой, так и хронической фазе.

Наиболее частый способ передачи ― поцелуй, наиболее редкий ― при переливании крови. Инфицироваться можно при пользовании общей посуды, одежды, постельного белья и полотенец. Вспышки заболевания происходят в местах скученного проживания: общежитиях, малосемейках, детских учреждениях. Наиболее часто герпесвирус выявляют у социальных групп с низким уровнем дохода, из-за стесненных условий проживания.
Симптомы мононуклеоза
У маленьких детей до 5 лет первичная инфекция ВЭБ в большинстве случаев проходит бессимптомно. Симптомы инфекционного мононуклеоза чаще развиваются у подростков, чуть реже у взрослых людей. Средний инкубационный период равен 40 дням. В это время больной испытывает повышенную утомляемость.

Заболевание протекает в 3 фазы:
1. Лихорадка ― температура поднимается днем, достигая своего пика к вечеру. Достигает +40 С, но может быть и выше, к утру спадает.
2. Фарингит (воспаление глотки и миндалин) ― протекает тяжело, с сильным болевым синдромом. Слизистые краснеют, отекают, может наблюдается образование экссудата.
3. Аденопатии ― генерализованное увеличение лимфатических узлов. Заметить изменения можно визуально и при пальпации задне- и переднешейных лимфоузлов, подчелюстных, подмышечных и паховых. Поражение симметрично, может наблюдаться на любой группе узлов. В некоторых случаях аденопатия может быть единственным признаком инфицирования.
В зависимости от индивидуальных особенностей организма и наличия других болезней, мононуклеоз у некоторых людей может вызывать такие симптомы:
Спленомегалия ― увеличение селезенки, встречается в 50% случаев.
Гепатомегалия ― увеличение размеров печени, болезненность при постукивании.
Среди других симптомов: желтушность покровов, отечность вокруг глаз, разрыв капилляров (петехиальная сыпь).
Осложнения
При первичном инфицировании вирус Эпштейна - Барри может находится в организме бессимптомно, а в некоторых случаях вызывать серьезные последствия. В первую очередь это респираторные осложнения.
Обструкция верхних дыхательных путей ― лимфоузлы могут увеличиться до таких размеров, что дыхание будет затруднено.
Легочные инфильтраты ― замещение участка легкого нормальной воздушности на более плотные увеличенные ткани. Чаще отмечаются у детей младшего возраста.

Осложнения при мононуклеозе могут затрагивать отдельные органы:
Печень. У 95% пациентов в 2 - 3 раза повышается уровень аминотрансферазы. Кожные покровы могут приобрести легкий желтушный оттенок. Печень будет увеличена, болезненна при перкуссии.
Селезенка. При мононуклеозе селезенка и капсулы значительно увеличиваются в размерах, что приводит к разрывам. Максимальное опухание наблюдается на 10 - 21 день с момента инфицирования. В среднем осложнение наблюдается у половины больных. Разрыв может быть болезненным, а может пройти безболезненно с гипотонией (низким артериальным давлением).
Отмечаются также гематологические осложнения, которые, как правило, не требуют врачебного вмешательства, купируются самостоятельно. Сюда входят:
Гранулоцитопения ― уменьшение содержания гранулоцитов в периферической крови.
Тромбоцитопения ― снижение количества тромбоцитов, увеличение риска кровотечений.
Гемолитическая анемия ― преждевременный распад эритроцитов
Подобные симптомы наблюдают у 50% пациентов. В редких случаях гематологические осложнения проходят тяжело, могут привести к бактериальным заражениям.
Страдает от ВЭБ и нервная система. В крайне редких случаях на фоне инфекционного мононуклеоза может развиться энцефалит, синдром Гийена – Барре, параличи черепных нервов, менингит, миелит.
Диагностика
Серологический анализ на вирус Эпштейна-Барр.
Для проведения этих тестов необходимо предположить наличие вируса инфекционного мононуклеоза по типичным признакам. Среди таких симптомов увеличение лимфатических узлов на задней части шеи или генерализованная аденопатия в сочетании с увеличением печени и селезенки, экссудативным фарингитом и высокой температурой.
Следует также обратить внимание на схожие по симптоматике заболевания и исключить их.
Дифференциальная диагностика
При диагностировании необходимо убедиться в наличие у пациента именно герпесвируса, поскольку существует несколько инфекций схожих с ВЭБ. Среди них:
Первичная ВИЧ-инфекция. Ее можно исключить проведя тесты на количественное определение РНК ВИЧ в плазме крови и комбинированный иммуноферментный анализ на антитела и антиген р24.
Первичная ВИЧ-инфекция имеет симптоматику схожую с ВЭБ. Все пациенты находящиеся в группе риска должны пройти тест на ВИЧ в обязательном порядке.
Цитомегаловирус. Схож с ВЭБ во всем кроме фарингита. Для исключения этого заболевания необходимо серологическое тестирование, анализ на антигены или ДНК ЦМВ.
Токсоплазмоз. Паразитарное заболевание, которое также как цитомегаловирус отличается от мононуклеоза отсутствием фарингита. Для дифференцирования проводит серологию сыворотки крови, анализ на уровень антител IgG.
В практике встречаются случаи одновременного инфицирования несколькими типами вирусов, которые пребывают в организме в активной фазе. Дифференцирование также проводят при неэффективности лечения, длительном течении болезни, при недостаточных для ремиссии результатов.
Лабораторные методы диагностики мононуклеоза
Основной критерий в постановке диагноза ― серологический анализ на ВЭБ. Нетипичные лимфоциты могут присутствовать при гриппе, гепатите В, ВИЧ, цитомегаловирусе и других вирусных болезнях. Но, только при первичном мононуклеозе они вырабатываются в очень большом количестве.

Подтверждает серологический анализ тест на специфические (гетерофильные) антитела к ВЭБ. Наиболее продуктивно исследование при работе с биологическими материалами подростков и взрослых. У детей младше 5 лет он показывает положительный результат только в 50% случаев.
Важно знать! У ВИЧ-инфицированных анализ на гетерофильные антитела может быть ложноположительным. Рекомендуется проводить исследование два раза с перерывом в 7 - 10 дней.
Присутствие антител IgG к VCA ВЭБ свидетельствует о первичной ВЭБ-инфекции. Их можно обнаружить с первых дней заражения в течение трех месяцев. Антитела к ВЭБ-IgG вырабатываются позднее, примерно через 2 месяца после начала болезни. Они сохраняются в крови в течение всей жизни человека.
Инструментальная диагностика
Для постановки диагноза, оценки степени тяжести, контроля за терапией используются следующие виды инструментальной диагностики:
ультразвуковое исследование органов брюшины;
рентгенограмма органов грудной клетки;
рентгенограмма придаточных пазух.
Лечение инфекционного мононуклеоза
Кортикостероиды при тяжелой степени болезни.
Лечение инфекционного мононуклеоза направлено на купирование палоголических процессов, предотвращение их развития в дальнейшем, предупреждение осложнений, остаточных явлений и хронического течения заболевания.
В первую очередь больному необходимо обеспечить покой. В период увеличения селезенки под запрет попадают физические нагрузки, занятия спортом. Необходимо исключить подъем тяжестей, чтобы сократить риск разрыва селезенки. Для уменьшения симптоматики и ускорения выздоровления используют методы медикаментозного и немедикаментозного лечения.
Показаны препараты этиотропной, симптоматической терапии и иммунокоррекции:
нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы;
производные пропионовой и уксусной кислоты;
растворы, влияющие на водно-электролитный баланс для дезинтоксикации;
муколитические препараты и другие в зависимости от симптоматики.
Антибиотики назначают только при вирусно-бактериальной инфекции, подтвержденной микробиологической диагностикой. При наличие осложнений также могут быть назначены кортикостероиды. Считается, что они помогают быстрее избавиться от лихорадки и уменьшают проявление фарингита. Они полезны при таких осложнения, как угроза обструкции дыхательных путей, гемолитическая анемия, тромбоцитопения.
Наиболее эффективные методы немедикаментозного лечения включают физиотерапию, санацию носовых ходов, частое проветривание помещения. В зависимости от степени течения болезни лечение может проводиться амбулаторно и в стационаре.
Прогноз и профилактика
У большинства здоровых людей острая фаза инфекционного мононуклеоза проходит самостоятельно. Однако, человек навсегда остается носителем вируса. Тяжелое течение и осложнения наблюдаются в 10 - 20% случаев в зависимости от возрастной группы. Увеличивает риск тяжелого течения болезни наличие хронических заболеваний и иммунодефицитные состояния. Смертность низкая, менее 1%, к ней приводят осложнения, развившиеся на фоне инфекции: обструкция дыхательных путей, энцефалит, разрыв селезенки.
Продолжительность острой фазы заболевания ― около 2 недель. После этого периода при отсутствии симптоматики пациент могут вернуться в школу или на работу. Среди показаний к выписке: нормализация температуры, отсутствие признаков интоксикации и воспалительного в носоглотке, нормализация размеров лимфоузлов, печени и селезенки. Однако, необходимо продолжить щадящий режим сна - бодрствования, избегать повышенных умственных и физических нагрузок. Высокая утомляемость будет сохраняться на протяжение еще нескольких недель, у некоторых пациентов ― на протяжении многих месяцев.
После мононуклеоза увеличивается чувствительность организма к респираторным заболеваниям и вирусу герпеса. Многие отмечают начало частые поражения кожи верхней или нижней губы после выздоровления от ВЭБ.
Преимущества лабораторий АО "СЗДЦМ"
Собственная лаборатория и передовое оборудование ― гарантия получения быстрого и точного результат.
Квалифицированные сотрудники и доброжелательный персонал ― анонимность, комфортное пребывание, отсутствие очередей.
Удобное расположение терминалов ― легко доехать не только на автомобиле, но и общественном транспорте.
Несколько способов получения результатов ― лично, по указанной при регистрации, электронной почте.
Вы можете сдать анализы на инфекционный мононуклеоз в Санкт-Петербурге, Ленинградской области, Великом Новгороде, Старой Руссе, Окуловке, Калининграде и Пскове.
Эпштейна-Барр вирусная инфекция (ЭБВИ) относится к наиболее распространенным инфекционным заболеваниям человека. Антитела (Ат) к вирусу Эпштейна-Барр (ВЭБ) обнаруживают у 60% детей первых двух лет жизни и у 80–100% взрослых [3, 13]. Заболеваемость острой формой ЭБВИ (ОЭБВИ) в различных регионах мира колеблется от 40 до 80 случаев на 100 тыс. населения [2]. Хроническая форма ЭБВИ (ХЭБВИ) развивается у 15–25% лиц после ОЭБВИ [1, 5, 15]. Установлена роль ВЭБ в развитии злокачественных новообразований, аутоиммунных заболеваний и синдрома хронической усталости [3, 5, 14, 15]. Все это свидетельствует об актуальности проблемы ЭБВИ.
ВЭБ, открытый в 1964 г. M. Epstein и Y. Barr, относится к γ-герпес-вирусам [3]. ВЭБ имеет в своем составе 3 антигена: капсидный (VCA), ранний (EA) и ядерный (EBNA). Своеобразие патологического процесса при ЭБВИ определяется способностью ВЭБ к трансформации В-лимфоцитов, пожизненной персистенции в организме человека, индукции вторичного иммунодефицитного состояния (ИДС), аутоиммунных реакций, злокачественных опухолей [1, 3, 5, 12].
Источник заражения ВЭБ — больные манифестными и бессимптомными формами. 70–90% лиц, перенесших ОЭБВИ, выделяют вирус в последующие 1–18 мес. Пути передачи ВЭБ: воздушно-капельный, контактно-бытовой, парентеральный, половой, вертикальный. ОЭБВИ характеризуется эпидемическими подъемами 1 раз в 6–7 лет, чаще регистрируется в возрасте от 1 до 5 лет, в организованных коллективах [4, 7, 9].
Иммунный статус 109 больных ОЭБВИ в возрасте от 5 до 14 лет в нашей работе выявил признаки активации Т-клеточного звена иммунной системы — повышение количества Т-лимфоцитов (CD3), цитотоксических Т-лимфоцитов (CD8), клеток с маркерами поздней активации (HLA-DR); поликлональную активацию В-лимфоцитов — увеличение количества CD20-клеток, иммуноглобулинов (Ig) IgA, IgM, IgG, циркулирующих иммунных комплексов (ЦИК). Обнаружены признаки угнетения иммунной системы: нормальное содержание Т-хелперов (CD4), снижение иммунорегуляторного индекса CD4/CD8, количества естественных киллерных клеток NK (CD16), повышение готовности иммунокомпетентных клеток к апоптозу (CD95). Наблюдалась активация кислородзависимого метаболизма нейтрофилов и редукция его адаптационных возможностей.
У трети обследованных детей (33,9%) ОЭБВИ протекала в форме микст-инфекции с цитомегаловирусами (ЦМВ), вирусами простого герпеса 1 и 2 типов (ВПГ-1, ВПГ-2). При бактериологическом исследовании мазков из ротоглотки у 41,3% пациентов выделены Streptococcus (S.) viridans, у 11,9% — Candida albicans, у 8,2% — Staphilococcus (Staph.) epidermidis, у 6,4% — S. pyogenes, у 2,7% — Klebsiella (Kl.) pneumoniae, у 41,3% — ассоциация бактерий. У 43,1% пациентов — серологические маркеры активной формы хламидийной инфекции, у 30,3% — микоплазмоза.
Возможны следующие исходы ОЭБВИ: латентная инфекция, ХЭБВИ, ИДС, онкологические, аутоиммунные заболевания, синдром хронической усталости [5, 8, 10, 11]. Переход в ХЭБВИ связан с комплексом неблагоприятных факторов в анте-, интра- и постнатальном периодах, нарушением нейроиммунноэндокринной регуляции, генетической предрасположенностью.
Проведенное нами обследование 60 детей в возрасте от 5 до 14 лет с ХЭБВИ показало, что в этой группе у 86,7% матерей имел место отягощенный акушерский анамнез; у 83,3% детей обнаружены перинатальная и постнатальная патология ЦНС, ЛОР-органов и др.
Нарушения иммунного статуса приводили к активации условно-патогенной микрофлоры, вирусных и грибковых инфекций. В микробном спектре слизистой ротоглотки пациентов с ХЭБВИ выделены S. Viridans (30%), Candida albicans (28,3%), Staph. Epidermidis (25%), S. Pyogenes (20%), Kl. Pneumoniae (8,4%), ассоциация бактерий (41,7%); у 28,3% — серологические маркеры активной формы хламидиоза, у 26,7% — микоплазмоза. У 90% пациентов заболевание протекало в форме микст-инфекции с участием герпес-вирусов: ВЭБ + ЦМВ, ВЭБ + ВПГ-1, ВПГ-2.
Классификация. Общепринятая классификация заболевания отсутствует; рекомендуем использовать разработанную нами рабочую классификацию ЭБВИ.
- По периоду возникновения: врожденная, приобретенная.
- По форме: типичная (инфекционный мононуклеоз), атипичная: стертая, бессимптомная, висцеральная.
- По тяжести: легкая, среднетяжелая, тяжелая.
- По течению: острая, затяжная, хроническая.
- По фазе: активная, неактивная.
- Осложнения: гепатит, разрыв селезенки, менингоэнцефалит, полирадикулонейропатия, миокардит, синусит, отит, гемолитическая анемия, тромбоцитопения, нейтропения, панкреатит и др.
- Микст-инфекция.
Примеры оформления диагноза:
- Осн.: Приобретенная ЭБВИ, типичная тяжелая форма (инфекционный мононуклеоз), острое течение, активная фаза. Осл.: Острый гепатит.
- Осн.: Приобретенная ЭБВИ, висцеральная форма (менингоэнцефалит, гепатит, нефрит), тяжелое хроническое течение, активная фаза. Осл.: острая печеночно-почечная недостаточность. Сопp.: Респираторный хламидиоз (ринофарингит, бронхит, пневмония).
Клиническая картина острой ЭБВИ впервые была описана Н. Ф. Филатовым (1885) и Е. Пфейфером (1889). Инкубационный период длится от 4-х дней до 7 нед. Полный симптомокомплекс формируется к 4–10-му дням болезни [4, 7].
Нами обследованы 109 детей с ОЭБВИ. У большинства пациентов заболевание начинается остро, с повышения температуры тела и появления симптомов интоксикации; реже отмечается постепенное начало: несколько дней наблюдается недомогание, слабость, вялость, снижение аппетита. Температура тела субфебрильная или нормальная. Ко 2–4-му дням болезни температура достигает 39–40 °С; лихорадка и симптомы интоксикации могут сохраняться в течение 2–3 и более недель.
Тонзиллит — наиболее частый и ранний симптом ОЭБВИ, сопровождается увеличением миндалин до II-III степени. Лакунарный рисунок подчеркнут за счет инфильтрации ткани миндалин или сглажен из-за лимфостаза. На миндалинах — налеты желтовато-белого или грязно-серого цвета в виде островков, полосок. Они исходят из лакун, имеют шероховатую поверхность (напоминают кружево), легко снимаются без кровоточивости, растираются, не тонут в воде. Характерно несоответствие размера налета и степени увеличения регионарных ЛУ. При фибринозно-некротическом характере налетов в случае их распространения за пределы миндалин необходим дифференциальный диагноз с дифтерией. Налеты на миндалинах исчезают, как правило, через 5–10 дней.
Гепатомегалия может быть обнаружена с первых дней болезни, однако чаще выявляется на второй неделе. Нормализация размеров печени происходит в течение полугода. У 15–20% больных в качестве осложнения развивается гепатит.
Спленомегалия относится к поздним симптомам, встречается у большинства больных. Нормализация размеров селезенки происходит в течение 1–3 нед.
Экзантема при ОЭБВИ появляется на 3–14-й дни болезни, имеет полиморфный характер — пятнистая, папулезная, пятнисто-папулезная, розеолезная, мелкоточечная, геморрагическая. Определенной локализации нет. Сыпь наблюдается в течение 4–10 дней, иногда оставляет пигментацию. У детей, получавших ампициллин или амоксициллин, сыпь появляется чаще (90–100%).
Гематологические изменения включают лейкоцитоз (10–30 х 10 9 /л), нейтропению с палочкоядерным сдвигом влево, увеличение количества лимфоцитов, моноцитов, атипичных мононуклеаров до 50–80%, повышение СОЭ до 20–30 мм/час. Характерный гематологический признак — атипичные мононуклеары в количестве 10–50%: они появляются к концу первой недели заболевания, сохраняются в течение 1–3 нед.
Хроническая ЭБВИ является исходом ОЭБВИ или развивается как первично-хроническая форма [2, 5, 8, 10, 11, 15]. Нами обследовано 60 детей с ХЭБВИ, клиника которой включала хронический мононуклеозоподобный синдром и полиорганную патологию. У всех пациентов обнаружены лимфопролиферативный синдром (генерализованная лимфаденопатия, гипертрофия небных и глоточной миндалин, увеличение печени и селезенки) и признаки хронической интоксикации (длительный субфебрилитет, слабость, снижение аппетита и др.). Вследствие развития ИДС наблюдались острые инфекции респираторного тракта и ЛОР-органов с обострениями до 6–11 раз в год: ринофарингиты (28,3%), фаринготонзиллиты (91,7%), аденоидиты (56,7%), отиты (11,7%), синуситы (20%), ларинготрахеиты (18,3%), бронхиты (38,3%), пневмонии (25%). Обращала внимание высокая частота полиорганной патологии, обусловленная длительной репликацией ВЭБ, вторичным ИДС, аутоиммунными реакциями (патология ЦНС; хронический гастрит, дискинезия желчевыводящих путей; кардиальный синдром, артралгии).
В последние годы описана врожденная ЭБВИ. Установлено, что риск ее при первичной ЭБВИ во время беременности составляет 67%, при реактивации — 22%. Клиника врожденной ЭБВИ сходна с ЦМВИ.
Установлена роль ВЭБ в развитии онкологических заболеваний и паранеопластических процессов — лимфомы Беркетта, назофарингеальной карциномы, лимфогранулематоза, опухолей желудка, кишечника, слюнных желез, матки, лейкоплакии языка и слизистой ротовой полости, а также ряда аутоиммунных заболеваний — системной красной волчанки, ревматоидного артрита, синдрома Шегрена, лимфоидного интерстициального пневмонита, хронического гепатита, увеита и др. [3, 5, 14, 15]. ВЭБ, наряду с вирусами герпеса человека 6 и 7 типов, является этиологическим фактором синдрома хронической усталости и наиболее частой причиной (15%) развития длительной лихорадки неясного генеза.
Диагностика ЭБВИ основана на учете групп риска, ведущих клинических синдромов и данных лабораторного исследования [8–11]. К группам риска у матери относят отягощенный анамнез, маркеры герпес-вирусных инфекций и др., у ребенка — перинатальное поражение ЦНС, аллергический фенотип, ИДС, маркеры герпес-вирусных инфекций и др. Ведущими клиническими синдромами ЭБВИ являются мононуклеозоподобный, общеинфекционный синдромы, экзантема, синдром полиорганной патологии.
В обязательный стандарт диагностики ЭБВИ входят клинический анализ крови, общий анализ мочи, биохимическое исследование крови, бактериологическое исследование слизи ротоглотки и носа, серологические маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм, УЗИ органов брюшной полости, консультация ЛОР-врача, по показаниям — рентгенография придаточных пазух носа, органов грудной клетки, ЭКГ. Дополнительный стандарт диагностики (в специализированном лечебно-профилактическом учреждении): маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм методом полимеразной цепной реакции (ПЦР), иммунограмма второго уровня, консультация иммунолога, по показаниям — коагулограмма, морфологическая картина стернальной пункции, консультация гематолога, онколога.
Методом иммуноферментного анализа (ИФА) определяют Ат к антигенам ВЭБ, что позволяет осуществить лабораторную диагностику ЭБВИ и определить период инфекционного процесса.
Ат класса IgM к VCA появляются одновременно с клиникой ОЭБВИ, сохраняются в течение 2–3 мес, повторно синтезируются при реактивации ВЭБ. Длительная персистенция высоких титров этих Ат характерна для ХЭБВИ, ВЭБ-индуцированных опухолей, аутоиммунных заболеваний, ИДС.
Ат класса IgG к EA достигают высокого титра на 3–4-й нед ОЭБВИ, исчезают через 2–6 мес. Они появляются при реактивации, отсутствуют при атипичной форме ЭБВИ. Высокие титры Ат данного класса выявляют при ХЭБВИ, ВЭБ-индуцированных онкологических и аутоиммунных заболеваниях, ИДС.
Ат класса IgG к EBNA появляются через 1–6 мес после первичной инфекции. Затем их титр уменьшается и сохраняется в течение всей жизни. При реактивации ЭБВИ происходит повторное увеличение их титра.
Большое значение имеет исследование авидности Ат класса IgG (прочности связывания антигена с Ат). При первичной инфекции сначала синтезируются Ат с низкой авидностью (индекс авидности (ИА) менее 30%). Для поздней стадии первичной инфекции характерны Ат со средней авидностью (ИА — 30–49%). Высокоавидные Ат (ИА — более 50%) образуются через 1–7 мес после инфицирования ВЭБ.
Серологическими маркерами активной фазы ЭБВИ являются Ат IgM к VCA и Ат IgG к EA, низкая и средняя авидность Ат IgG к маркерам неактивной фазы, Ат IgG к EBNA.
Материалом для ПЦР служат кровь, ликвор, слюна, мазки со слизистой ротоглотки, биоптаты органов и др. Чувствительность ПЦР при ЭБВИ (70–75%) ниже, чем при других герпесвирусных инфекциях (95–100%). Это связано с появлением ВЭБ в биологических жидкостях лишь при иммуноопосредованном лизисе инфицированных В-лимфоцитов.
На основании опыта лечения 169 детей с ЭБВИ нами разработан стандарт лечения этого заболевания.
Базисная терапия: охранительный режим; лечебное питание; противовирусные препараты: вироцидные препараты — инозин пранобекс (Изопринозин), аномальные нуклеозиды (Валтрекс, Ацикловир), Арбидол; препараты ИФН — рекомбинантный ИФН α-2β (Виферон), Кипферон, Реаферон-ЕС-Липинт, интерфероны для в/м введения (Реаферон-EC, Реальдирон, Интрон А, Роферон А и др.); индукторы ИФН — Амиксин, сверхмалые дозы антител к γ-ИФН (Анаферон), Циклоферон, Неовир. По показаниям: локальные антибактериальные препараты (Биопарокс, Лизобакт, Стопангин и др.); системные антибактериальные препараты (цефалоспорины, макролиды, карбапенемы); иммуноглобулины для внутривенного введения (Иммуновенин, Габриглобин, Интраглобин, Пентаглобин и др.); витаминно-минеральные комплексы — Мульти-табс, Вибовит, Санасол, Киндер Биовиталь гель и др.
Интенсификация базисной терапии по показаниям:
Симптоматическая терапия.
При лихорадке — жаропонижающие препараты (парацетамол, ибупрофен и др.); при затруднении носового дыхания — назальные препараты (Изофра, Полидекса, Називин, Виброцил, Адрианол и др.); при сухом кашле — противокашлевые препараты (Глаувент, Либексин), при влажном кашле — отхаркивающие и муколитические препараты (АмброГЕКСАЛ, бромгексин, ацетилцистеин и др.).
Эффективность этиотропной терапии ОЭБВИ оценена в двух группах больных. Пациенты 1-й группы (52 человека) получали инозин пранобекс (Изопринозин) в сочетании с рекомбинантным ИФН α-2β (Вифероном), больные 2-й группы (57 детей) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Клинико-серологические показатели до начала лечения и через 3 мес терапии представлены в табл. 1. У пациентов обеих групп в динамике отмечалось достоверное уменьшение таких симптомов, как генерализованная лимфаденопатия, тонзиллит, аденоидит, гепатомегалия и спленомегалия. Вместе с тем на фоне комбинированной терапии, положительная динамика клинических показателей была более значительной; острые респираторные инфекции (ОРИ) лишь у 19,2% больных 1-й группы и у 40,3% больных 2-й группы (p < 0,05). На фоне комбинированной терапии наблюдалось более быстрое исчезновение серологических маркеров репликации.
Эффективность этиотропной терапии исследована у 60 больных ХЭБВИ. Пациенты 1-й группы (30 детей) получали инозина пранобекс (Изопринозин) и рекомбинантный ИФН α-2β (Виферон), 2-я группа (30 человек) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Независимо от схемы лечения через 3 мес после начала терапии отмечалось достоверное уменьшение частоты генерализованной лимфаденопатии, гипертрофии небных и глоточной миндалин, спленомегалии, интоксикационного, инфекционного и вегето-висцерального синдромов (табл. 2). Комбинация инозина пранобекса (Изопринозина) с рекомбинантным ИФН α-2β (Вифероном) способствовало более существенной динамике клинических показателей. Количество эпизодов ОРИ снизилось с 6–11 (7,9 ± 1,1) до 4–6 (5,2 ± 1,2) в год на фоне монотерапии рекомбинантным ИФН α-2β (Вифероном), и до 2–4 (2,5 ± 1,4) в год на фоне комбинированной терапии (p < 0,05). В обеих группах уменьшалась частота репликации ВЭБ, однако при сочетанном применении противовирусных препаратов этот эффект был более выраженным.
Побочных эффектов при использовании инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона) не было.
Результаты проведенного исследования свидетельствуют о потенцировании эффектов при комбинации инозина пранобекса (Изопринозина) с рекомбинантным ИФН a-2b (Вифероном) у больных ЭБВИ.
Потенцирование противовирусных, иммуномодулирующих и цитопротекторных эффектов этих препаратов приводит к более существенной, чем при монотерапии, положительной динамике проявлений клинических симптомов ЭБВИ, к исчезновению серологических маркеров активности инфекционного процесса. Следует отметить высокую эффективность и безопасность комбинированной терапии с использованием инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона).
Реабилитация. Ребенок наблюдается участковым врачом и инфекционистом, снимается с учета через 6–12 мес после исчезновения клинико-лабораторных показателей активности инфекционного процесса. Кратность осмотров — 1 раз в месяц. По показаниям рекомендуют консультацию ЛОР-врача, иммунолога, гематолога, онколога и др. Лабораторные и инструментальные исследования пациентов включают: клинический анализ крови 1 раз в месяц в течение 3 мес, затем 1 раз в 3 месяца, по показаниям — чаще; серологические маркеры ВЭБ методом ИФА один раз в три месяца, по показаниям — чаще; ПЦР крови, мазков из ротоглотки 1 раз в 3 месяца, по показаниям — чаще; иммунограмма — 1 раз в 3–6 мес; биохимическое и инструментальное исследования — по показаниям.
Реабилитационная терапия включает: охранительный режим, лечебное питание, противовирусные препараты по пролонгированным схемам. Под контролем иммунограммы осуществляют иммунокоррекцию. По показаниям назначают локальные антибактериальные препараты, курсы витаминно-минеральных комплексов, про- и пребиотиков, препаратов метаболической реабилитации, энтеросорбентов, антигистаминные препараты, гепато-, нейро- и ангиопротекторы, кардиотропные препараты, ферменты, гомеопатические средства, немедикаментозные методы лечения.
Таким образом, ЭБВИ характеризуется широким распространением, длительным течением с периодической реактивацией инфекционного процесса у части пациентов, возможностью развития осложнений и неблагоприятных исходов (онкозаболеваний, аутоиммунной патологии). Важную роль при ЭБВИ играет формирование вторичного ИДС. Ведущими клиническими синдромами ЭБВИ являются острый и хронический мононуклеозоподобный синдромы, интоксикационный, инфекционный, церебральный, гастроинтестинальный, кардиальный и артралгический синдромы. Диагностика ЭБВИ основана на анализе групп риска, выделении ведущих клинических синдромов и лабораторном исследовании. Лечение ЭБВИ является комплексным и включает этиотропные средства (виростатические препараты, интерферон и его индукторы), препараты патогенетической, иммуномодулирующей, симптоматической терапии. Сочетанное пролонгированное использование инозина пранобекс (Изопринозина) и рекомбинантного ИФН α-2β (Виферона), потенцирующих свои иммунокорригирующие и цитопротекторные эффекты, существенно повышает эффективность лечения. Больные ЭБВИ нуждаются в длительной реабилитации с обязательным контролем клинико-лабораторных показателей активности инфекционного процесса.
По вопросам литературы обращайтесь в редакцию.
Э. Н. Симованьян, доктор медицинских наук, профессор
В. Б. Денисенко, кандидат медицинских наук
Л. Ф. Бовтало, кандидат медицинских наук
А. В. Григорян
Ростовский ГМУ, Ростов-на-Дону
Читайте также:

