Как отследить хантавирус по крови
Обновлено: 17.04.2024
Many hantaviruses, such as, HTNV, PUUV, SEOV, SNV and ANDV, have been isolated in cell culture, mostly in Vero E6 cells (green monkey kidney cells) [38–40] . Hantavirus isolation is a laborious and time-consuming procedure that can only be performed by trained personnel in biosafety level 3 laboratories that, unfortunately, are not present in many countries where these viruses occur. [39] Hantavirus isolation has been carried out from fragments of organs, such as lung and liver of infected rodents and, less commonly, from human samples. Lacking cell-culture isolates, many hantaviruses have been detected and characterized only by molecular methods. [41]
Future Virology. 2009;4(4):383-389. © 2009 Future Medicine Ltd.
Cite this: Laboratory Diagnosis of Human Hantavirus Infection: Novel Insights and Future Potential - Medscape - Jul 01, 2009.
Tables
References
Authors and Disclosures
Authors and Disclosures
Alex Martins Machado
School of Medicine of the University of São Paulo in Ribeirão Preto, Av. Bandeirantes 3900, Ribeirão Preto, SP, 14049-14900, Brazil Tel.: +55 163 602 3271 Fax: +55 163 602 3376
Glauciane Garcia de Figueiredo
School of Medicine of the University of São Paulo in Ribeirão Preto, Av. Bandeirantes 3900, Ribeirão Preto, SP, 14049-14900, Brazil Tel.: +55 163 602 3271 Fax: +55 163 602 3376
Gilberto Sabino dos Santos Jr
School of Medicine of the University of São Paulo in Ribeirão Preto, Av. Bandeirantes 3900, Ribeirão Preto, SP, 14049-14900, Brazil Tel.: +55 163 602 3271 Fax: +55 163 602 3376
Sidebar
Sidebar
Serological diagnosis
First serologic tests used in Europe and Asia were indirect immunofluorescence assays.
The most commonly used serological tests for hantavirus are indirect IgG and IgM ELISAs, as well as IgM antibody capture ELISAs.
Neutralization test is one tool used for serodiagnosis. This test is the most specific of serological tests, but it is laborious and expensive.
POC-PUUMALA™ is a new immunochromatographic assay for hantavirus. This test has a high sensitivity and specificity.
The immunoblot has also been used for the serologic diagnosis of hantavirus infection. It is more sensitive and specific compared with ELISA and has been used to confirm the presence of antibodies when ELISA results are dubious.
A new rapid diagnostic method for hantavirus has been developed based on a highly dispersed immunoelectrode prototype amperometric immunosensor. It demonstrated high sensitivity without any pretreatment of the samples in a well-defined time interval and can be used in field conditions.
An immunochromatographic test produced by Nanocore Biotecnologia Ltda for fast diagnosis of hantavirus cardiopulmonary syndrome, using the nucleocapsid-recombinant protein of Araraquara virus (ARAV) as antigen, allows to detect, in 10–15 min, antihantavirus IgM and IgG antibodies in patient sera with high sensitivity and specificity. However, ARAV antigen is not yet in use by laboratories that perform routine diagnosis of hantavirus infection.
While there are many approaches with different antigens for quick tests, most of them are not routinely used.
Hantavirus isolation
Hantaviruses have been isolated in cell culture, mostly in Vero E6 cells, and should be performed in biosafety level 3 laboratories. However, this process is cumbersome, time consuming and far from being consistently successful.
The Hantavirus genome can be detected by reverse transcription (RT)-PCR in clinical samples.
RT-nested-PCR assay using primers selected for matching high homology regions in the nucleocapsid protein in situ of ARAV is a rapid and efficient tool for diagnosis without the need for biosafety level 3 laboratories.
The real-time modality of RT-PCR is a rapid and sensitive test for diagnosis of hantavirus infection. This test demonstrates high levels of sensitivity and specificity compared with conventional PCR. Real-time RT-PCRs for hantavirus diagnosis also identifies the specific virus causing the infection and the viral load.
The combination of a serologic test, such as IgM ELISA with RT-PCR, is a highly sensitive and suitable approach for laboratory diagnosis of hantavirus infection. However, it is currently not possible to amplify virus nucleic acids from all acute cases. The IgM ELISA is useful in diagnosing cases during the later clinical course of hantavirus infection.
Comments
Comments on Medscape are moderated and should be professional in tone and on topic. You must declare any conflicts of interest related to your comments and responses. Please see our Commenting Guide for further information. We reserve the right to remove posts at our sole discretion.
Comments on Medscape are moderated and should be professional in tone and on topic. You must declare any conflicts of interest related to your comments and responses. Please see our Commenting Guide for further information. We reserve the right to remove posts at our sole discretion.
Клиника хантавирусной инфекции. Диагностика хантавирусного синдрома
Мало изучен. В отличие от вируса геморрагической лихорадки с почечным синдромом возбудитель обладает тропностью к эндотелию капилляров легких, вызывая системное поражение мелких кровеносных сосудов (капилляров, артериол и венул). Повреждение микроциркуляторного русла сопровождается выработкой эндогенных медиаторов, которые усиливают развитие ДВС-синдрома.
Вследствие этого наблюдается выход плазмы крови за пределы стенки сосудов; развиваются периваскулярныи отек, гемоконцентрация, нарушение микроциркуляции, гиповолемия. В микроциркуляторном русле легких нарастают сосудистые повреждения и развивается быстро прогрессирующий отек легких (дистресс-синдром). При патогистологическом исследовании находят типичные хантавирусные включения в эндотелиальных клетках сосудов не только легких, но и миокарда, лимфатических узлов, селезенки и других органов. Сочетанное поражение легких и миокарда приводит к выраженным нарушениям его сократительной функции, развитию сердечно-сосудистых осложнений, вплоть до кардиогенного шока.
Инкубационный период от 3 дней до 6 недель. В развитии болезни наблюдается три периода: 1) продромальный; 2) кардиопульмональный (собственно разгар болезни); 3) период реконвалесценции.
Продромальный период длится 3-5 суток (иногда до 7-10 дней). Появляются общие симптомы интоксикации, как и при других вирусных инфекциях (недомогание, слабость, ломящая боль в пояснице, мышечная боль), наблюдаются также озноб, повышение температуры тела, сухой кашель; возможны рвота и диарея, боль в животе, артралгии.

Кардиопульмональный период продолжается от 1 до 5 дней. Типичными признаками этого периода болезни является сухой кашель, затем - с гнойной мокротой. Появляются и усиливаются одышка, чувство нехватки воздуха. Нарастает тахикардия, снижается АД. Прогрессируют общая слабость, головокружение, возникает обильное потоотделение и появляется боль в груди. При аускультации и рентгенологически выявляется отек легких, быстро нарастающий. Возникающая боль в животе сочетается с появлением периферических отеков, олиго- и анурии, катаральных явлений в верхних дыхательных путях, а также сыпи геморрагического характера.
Усиливаются симптомы интоксикации, выявляется ригидность затылочных мышц и другие менингеальные знаки. Быстро нарастает отек легких, острая дыхательная недостаточность. В этот период часто наступает летальный исход. Летальность раньше достигала 80%; в последнее время снизилась до 40%.
Реконвалесценция в случае благоприятного течения болезни медленная (до 1,5-2 недель), но довольно быстро (за 1-2 дня) уменьшается дыхательная недостаточность, восстанавливаются нарушения гемодинамики и диурез. Восстановление нарушенных функций легких идет медленно. Для полного их восстановления требуются месяцы (иногда до 6 мес).
Быстро прогрессирующий отек легких и острая дыхательная недостаточность (ОДН) могут быть и при других клинических ситуациях, но они, как правило, в отличие от ХКПС сопровождаются выраженным поражением других органов и систем. Решающее значение в установлении диагноза имеют данные эпиданамнеза: наличие большого количества грызунов в жилых помещениях, их экскрементов, сезон года.
Из специфических методов обнаружения вируса и антител к нему применяют ПЦР, твердофазный метод ИФА и реакцию иммуноблота; проводят определение специфических lgM-антител в острой стадии болезни и IgG в позднем периоде с целью ретроспективной диагностики случаев заболеваний с остро развивающейся картиной кардиопульмонального синдрома. В периферической крови -лейкоцитоз с нейтрофильным сдвигом влево, тромбоцитопения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусные тропические лихорадки: диагностика, лечение, профилактика
В роли возбудителей энцефалита и геморрагической лихорадки могут выступать свыше сотни различных вирусов. Практически все они избирают человека в качестве хозяина случайно, при вторжении последнего в их жизненный цикл. Передача осуществляется при прямом контакте с заражённой кровью или физиологическими жидкостями, а также при укусах членистоногих (комаров, клещей и мошек). Некоторые инфекции характеризуются достаточно высокой смертностью пациентов.
Желтая лихорадка. Возбудитель жёлтой лихорадки — оболочечный однонитевой плюс-РНК-вирус. Заражение происходит при укусе комара Aedes aegypti. Жёлтая лихорадка — зоонозная инфекция, при этом человек становится случайным хозяином (джунглевая форма). Вспышки возникают периодически также при проникновении возбудителя в городскую среду (городская форма).
Методы диагностики — культивирование вируса, серологическое исследование. Профилактика — введение живой аттенуированной (ослабленной) вакцины и контроль над распространением переносчиков (комаров).
Лихорадка Денге
Переносчики лихорадки Денге — комары рода Aedes. Возбудитель — флавиви-рус, похожий по своим свойствам на вирус жёлтой лихорадки. Установлено 4 серотипа вируса. Инкубационный период 2—15 дней. При возникновении лихорадки наблюдают виремию, продолжающуюся несколько дней. Вирус лихорадки Денге распространён на территории стран тропической зоны и Ближнего Востока. Эпидемии возникают при появлении нового серотипа либо при массовом попадании неиммунных людей в места обитания вируса; в городах распространяются очень быстро, заболевание протекает тяжело.
После внезапного возникновения жара, головной боли и общего недомогания пациенты начинают жаловаться на боли в суставах и костях. Лихорадка может быть двухволновой. В некоторых случаях отмечают небольшую сыпь. Наиболее тяжёлая и опасная форма заболевания сопровождается геморрагическим синдромом, характеризующимся развитием шока и геморрагического диатеза (геморрагическая форма денге). Смертность 5—10%.
Методы диагностики — серологическое исследование, культивирование вируса, молекулярно-генетические методы. Единственный способ профилактики заболевания — количественный контроль переносчиков. Лечение симптоматическое.
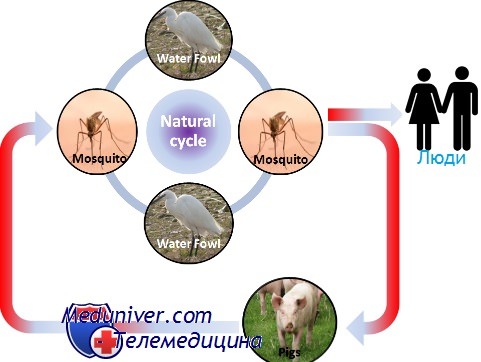
Эпидемиология японского энцефалита
Японский энцефалит В
Возбудитель японского энцефалита В — флавивирус; переносчики — комары. Природным источником вируса являются свиньи. В клинической картине доминируют симптомы тяжёлого энцефалита с высокой летальностью. Болезнь начинается остро с лихорадки, сильной головной боли, тошноты и рвоты.
В некоторых случаях отмечают судороги. При обследовании обнаруживают поражение черепных нервов и пирамидного пути. Для профилактики применяют вакцину.
Вирус лихорадки западного Нила
Заражение вирусом лихорадки западного Нила происходит так же, как при лихорадке Денге и японском энцефалите В. Вирус впервые был обнаружен в Северной Америке в 1999 г. и быстро проник на территорию Канады, Латинской Америки и Карибского бассейна.
Геморрагическая лихорадка Ласса
Ласская лихорадка — тяжёлая геморрагическая лихорадка, вызываемая аренавирусом. Передача инфекции осуществляется посредством контактного механизма от крыс к человеку, а затем и от человека к человеку. Вирус поражает все органы и системы организма. Пациенты жалуются на лихорадку, изъязвления в ротовой полости, мышечную боль и геморрагическую сыпь. Диагноз устанавливают на основании данных клинической картины и анамнеза заражения пациента.
Для его подтверждения применяют молекулярно-генетический метод с использованием обратной транскриптазы или серологические методы. На ранних стадиях заболевания и после контакта с инфицированными людьми назначают рибавирин.
Инфекции вирусов лихорадки Эбола и марбургской болезни
Инфекции вирусов лихорадки Эбола и марбургской болезни - филовирусные инфекции распространены на территории Африки и передаются человеку от приматов и грызунов. Они характеризуются развитием тяжёлой геморрагической лихорадки и высоким уровнем смертности. Инфекция также передаётся при тесном контакте с инфицированными (особенно во внутрибольничной среде). Основной метод лечения — поддерживающая терапия и введение гипериммунной сыворотки.
Профилактику внебольничных инфекций затрудняет отсутствие возможности изоляции источника заболевания. Для предотвращения распространения внутри-больничной инфекции необходимо соблюдать строгие меры предосторожности при контакте с кровью и физиологическими жидкостями больных пациентов. Вакцина на основе вируса везикулярного стоматита, кодирующего антигены вируса лихорадки Марбург, способна защитить приматов даже при введении после заражения.
Хантавирус - хантавирусная лихорадка
Возбудитель передаётся человеку от грызунов, относится к группе буньявирусов. Инфекция, вызванная им, характеризуется геморрагической лихорадкой с почечным синдромом или хантавирусным лёгочным синдромом. Вирус широко распространён во всём мире. Передача от человека к человеку невозможна. По окончании инкубационного периода (2—3 нед) возникают лихорадка, головная боль, боль в спине, поражение конъюнктивы и нёба, а позднее — гипотензия, шок, олигурия, почечная недостаточность. Смертность около 5%.
Методы диагностики — серологическое исследование, молекулярно-генетические с использованием обратной транскриптазы. Предполагают, что рибавирин способен уменьшать вероятность смертельного исхода, но необходимые клинические исследования проведены не были.
Вирус Нипах
Парамиксовирус Нипах — возбудитель тяжёлых инфекций у людей и животных. Впервые выделен в Малайзии; обнаруживают на территории многих азиатских стран. Вызываемое им заболевание сопровождается развитием лихорадки и энцефалита и характеризуется высоким уровнем смертности. Источник инфекции — летучие мыши, питающиеся фруктами. Заражение происходит при контакте с мышами или промежуточными хозяевами (свиньями). Кроме того, возможна передача инфекции от человека к человеку.
Родственный вирусу Нипах вирус Хендра встречают реже. Переносчиками также служат летучие мыши. В клинической картине доминирует гриппоподобный синдром или энцефалит.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Хантавирусная инфекция. Геморрагическая лихорадка с почечным синдромом (ГЛПС)
Хантавирусная инфекция — группа широко распространенных нетрансмиссивных зоонозных болезней человека, протекающих в виде геморрагической лихорадки со специфическим поражением почек в странах Старого Света или в виде прогрессирующей легочной недостаточности вследствие респираторного дистресс-синдрома в странах Нового Света.
Возбудители этой группы болезней — вирусы рода Hantavirus семейства Bunyaviridae, адаптированы к паразитированию у различных видов грызунов семейства Muridae порядка Rodentia. В отличие от арбовирусов хантавирусы передаются человеку от грызунов с помощью аэрозоля из экскретов инфицированных животных, реже при употреблении зараженных воды и продуктов или при контакте кожи и слизистых оболочек с инфицированными объектами внешней среды и тканями грызунов. Естественная передача вирусов человеку от грызунов через укус кровососущих членистоногих не установлена.
Из 14 известных хантавирусов 4 вида являются возбудителями геморрагической лихорадки с почечным синдромом (ГЛПС) в Европе, Азии и Африке и 6 видов—возбудителями хантавирусного легочного синдрома (ХЛС) в странах Америки.
Геморрагическая лихорадка с почечным синдромом (ГЛПС) — природно-очаговая хантавирусная болезнь с разнообразными нетрансмиссивными путями заражения, протекающая в виде остролихорадочного заболевания с развитием геморрагического синдрома и нефрозонефрита.
Вирусная природа болезни установлена А.А. Смородинцевым в 1940-1944 гг. и подтверждена МЛ. Чумаковым в 1956 г. В 1976-1977 гг. H.W. Lee, P.W. Lee в легких полевки Apodemus aerarius, отловленной в Корее вблизи реки Хантаан, выявили вирус, получивший название Hantaan virus. Изучению инфекции способствовала разработка в 1981 г. методов клеточного культивирования вируса, выделенного в самостоятельный род Hantavirus. В последующем были выявлены другие виды вирусов, вызывающие сходные с ГЛПС заболевания в Европе, Азии и Африке.
Возбудители — 4 вида вирусов рода Hantavirus семейства Bunyaviridae, различающиеся по антигенным свойствам, адаптации к разным видам грызунов и вызывающие различные нозогеографические варианты заболеваний: Hantaan virus, распространенный в Восточной Европе и Азии; Seoul virus с повсеместным распространением; Dobrava-Belgrade virus, распространенный в Западной и Южной Европе, Средиземноморье и европейской части России, и Puumala virus, распространенный в странах Европы, в европейской части России, в Западной, Северной и Центральной Азии.
Хантавирусы являются сферическими частицами диаметром 90-110 нм, имеют липидную оболочку, содержащую гликопротеины (Gl, G2), и нуклеокапсид, заключающий односпиральную (-) РНК. Вирусы инактивируются в течение получаса при нагревании до 50 °С, сохраняются при температуре холодильника в течение 12 час, разрушаются многими дезинфектантами. В отличие от других буньявирусов хантавирусы не патогенны для лабораторных животных, с трудом культивируются на клеточных линиях позвоночных животных.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Хантавирус представляет собой РНК-содержащий инфекционный возбудитель, распространяющийся зоонозным путем – человеку от животных. Его сферические вирионы покрыты липидной оболочкой и имеют размер около 120 нм. Большой сегмент генома вируса кодирует фермент РНК-репликазу, средний – гликопротеины внешней мембраны, малый – матриксный белок нуклеокапсид.
Причины и факторы риска заражения хантавирусом
Признаки и симптомы
Существует 2 вида хантавирусов, которые носят название Старого и Нового света. Первые провоцируют развитие геморрагической лихорадки, выраженность клинических проявлений которой зависит от тяжести течения инфекционного процесса:
- легкая форма характеризуется общей слабостью, снижением работоспособности, кожной сыпью, частичным нарушением функционирования почек;
- тяжелая форма сопровождается резким повышением температуры (более 39°C), подкожными кровоизлияниями, почечной недостаточностью.
Вторая категория хантавирусов вызывает кардио-пульмонологический синдром – его симптоматика схожа с коронавирусной инфекцией. Пациенты жалуются на головную боль, высокую температуру, кашель, диспепсию. Спустя несколько дней снижается кровяное давление, угнетается сознание, возникает сердечная и дыхательная недостаточность.
Как можно заразиться хантавирусом?
Данный инфекционный возбудитель передается человеку при укусе зараженного грызуна (хомяка, мыши, крысы) либо при:
- контакте с их экскрементами;
- вдыхании испарений выделений;
- употреблении продуктов, испорченных зубами грызунов.
Методы диагностики
Дифференциальное диагностирование хантавирусной инфекции основано на результатах:

- Сбора эпидемиологического анамнеза.
- Физикального осмотра пациента.
- Электрокардиографии.
- Магниторезонансной томографии легких. , позволяющей обнаружить маркеры инфекционно-воспалительного процесса – увеличение СОЭ, численности лейкоцитов и лимфоцитов. – для выявления признаков нарушения функционирования мочевыделительной системы. – для определения уровня содержания мочевины и креатинина. – для обнаружения наличия иммунных антител, направленных на борьбу с возбудителем инфекции.
- Молекулярно-биологического исследования – для выявления фрагментов генома хантавируса.
Лечение хантавирусной инфекции
Лечебные мероприятия включают:
- использование жаропонижающих и обезболивающих средств;
- оксигенотерапию;
- искусственную вентиляцию легких;
- диетическое питание, позволяющее снизить нагрузку на пораженные почки;
- гемодиализ.
Профилактика
Для предотвращения распространения хантавируса сокращают поголовья грызунов, создают препятствия на пути их проникновения в человеческие жилища, отказываются от употребления продуктов, поврежденных животными, хранят воду в закрытых емкостях, которые регулярно моют и чистят.
Читайте также:

