Как правильно пить исландский мох при туберкулезе
Обновлено: 19.04.2024
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению?
Какова роль фторхинолонов в лечении туберкулеза легких?
Таблица. Стандартные концентрации ПТП, используемые для выявления лекарственной устойчивости МБТ
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью ПТП в течение 2-3 месяцев, что ведет к подавлению размножающейся микобактериальной популяции, уменьшению ее количества и предотвращению развития лекарственной резистентности. На первом этапе используется комбинация препаратов, состоящая из изониазида, рифампицина, пиразинамида, стрептомицина и/или этамбутола.
Второй этап — менее интенсивной химиотерапии — проводится, как правило, двумя-тремя ПТП. Цель второго этапа — воздействие на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. Здесь главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения.
Такой методический подход к лечению ЛЧТЛ позволяет к концу первого этапа комбинированной химиотерапии под непосредственным медицинским наблюдением абациллировать 100%, а к завершению всего курса лечения — закрыть каверны в легких у более чем 80% больных с впервые выявленным и рецидивным туберкулезом легких [5].
Намного сложнее вопрос о проведении этиотропного лечения второго варианта, к которому мы относим ЛУТЛ, вызванный лекарственно резистентными (ЛР) МБТ к одному и более ПТП и/или их сочетанию. Особенно тяжело протекает ЛУТЛ у больных с множественной ЛР МБТ к изониазиду и рифампицину, то есть к основным и самым эффективным ПТП. Поэтому поиск новых концептуальных путей повышения эффективности лечения ЛУТЛ и разработка современной методологии специфического воздействия на ЛР МБТ является одним из важнейших и приоритетных направлений современной фтизиатрии.
Развитие ЛР у МБТ к ПТП — одна из главных причин недостаточно эффективной этиотропной химиотерапии. Больные туберкулезом, выделяющие ЛР-штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих ЛР-возбудителем. Чем больше число больных, выделяющих ЛР МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной резистентностью не только к основным, но и к резервным ПТП.
Феномен ЛР МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является ЛР. В активно размножающейся бактериальной популяции всегда имеется небольшое количество ЛР-мутантов, которые практического значения не имеют, но по мере уменьшения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством ЛР и устойчивых МБТ [5]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. Следовательно, в клинической практике необходимо исследовать ЛР МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [5].
По определению экспертов ВОЗ [3], ЛУТЛ — это случай туберкулеза легких с выделением МБТ, резистентных к одному и более ПТП. По данным Центрального НИИ туберкулеза РАМН, у каждого второго впервые выявленного и ранее не леченного противотуберкулезными препаратами больного в мокроте выявлялись ЛР к ПТП МБТ, при этом у 27,7% из них наблюдалась устойчивость к двум основным противотуберкулезным препаратам — изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота вторичной ЛР МБТ возрастает до 95,5%.
По нашему мнению, и это составляет основу нашей концепции, для повышения эффективности лечения туберкулеза, вызванного ЛР МБТ, необходимо в первую очередь использовать ускоренные методы выявления ЛР МБТ, что позволяет своевременно изменять режим химиотерапии.
Исследование лекарственной устойчивости МБТ в настоящее время возможно по прямому и непрямому методам.
Непрямой метод определения лекарственной чувствительности МБТ требует от 30 до 60, а иногда до 90 суток, ввиду того что вначале производится посев мокроты на твердые питательные среды и только после получения культуры МБТ производят ее пересев уже на среды с добавлением ПТП. При этом коррекция химиотерапии носит отсроченный характер, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
В последнее время для ускоренного определения лекарственной устойчивости нами применялся радиометрический метод с использованием автоматической системы ВАСТЕС-460 ТВ (Becton Dickinson Diagnostic Systems, Sparks, MD), которая позволяет выявлять лекарственную резистентность МБТ на жидкой среде Middlebrook 7H10 через 6-8 дней.
Не менее важно правильное лечение впервые выявленных больных туберкулезом легких и применение современных режимов химиотерапии с использованием в начале лечения комбинации из четырех-пяти основных противотуберкулезных препаратов до получения результатов лекарственной устойчивости МБТ [2]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной ЛР МБТ бактериостатическое действие окажут два или три химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных и рецидивных больных и назначение ими только трех ПТП является грубой врачебной ошибкой, что в конечном счете ведет к формированию наиболее трудно поддающейся лечению вторичной ЛР МБТ.
Наличие у больного туберкулезом легких ЛР МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и летальных исходов. Особенно тяжело протекают специфические поражения легких у больных с полирезистентными МБТ, которые обладают множественной ЛР, как минимум к изониазиду и рифампицину, т. е. к основным и самым активным противотуберкулезным препаратам. ЛР МБТ имеет не только чисто клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных резервными ПТП обходится намного дороже, чем больных с чувствительными МБТ к основным химиопрепаратам.
В этих условиях расширение списка резервных ПТП, воздействующих на ЛР МБТ, является актуальным и крайне важным для повышения эффективности лечения больных с ЛУТЛ. Кроме того, присоединение к ЛУТЛ неспецифической бронхолегочной инфекции существенным образом утяжеляет течение специфического процесса в легких, требуя назначения дополнительных антибиотиков широкого спектра. В этом плане применение антибиотиков, воздействующих как на МБТ, так и на неспецифическую патогенную бронхолегочную микрофлору, является научнообоснованным и целесообразным.
В этом плане хорошо себя зарекомендовал в России такой препарат из группы фторхинолонов, как офлоксацин (таривид) [3]. Мы же свой выбор остановили на ломефлоксацине, как препарате, который еще не столь широко применяется при лечении туберкулеза и у которого, судя по имеющимся данным, практически не выявляются побочные эффекты и крайне редко формируется ЛР возбудителей инфекционных заболеваний [2].
Ломефлоксацин (максаквин) — антибактериальный препарат из группы фторхинолонов. Как и все представители производных оксихинолонкарбоновой кислоты, максаквин обладает высокой активностью против грамположительных (включая метициллин-устойчивые штаммы Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных (включая Pseudomonas) микроорганизмов, в том числе по отношению к различным типам Micobacterium tuberculosis).
Механизм действия максаквина заключается в ингибировании хромосомной и плазмидной ДНК-гиразы, фермента, ответственного за стабильность пространственной структуры микробной ДНК. Вызывая деспирилизацию ДНК микробной клетки, максаквин ведет к гибели последней.
Максаквин обладает иным механизмом действия, нежели другие антибактериальные средства, поэтому к нему не существует перекрестной устойчивости с другими антибиотиками и химиотерапевтическими препаратами [2].
Основной целью настоящего исследования явилось изучение клинической и микробиологической эффективности максаквина при комплексном лечении больных деструктивным ЛУТЛ, выделяющих ЛР МБТ к изониазиду, рифампицину и другим ПТП, а также при сочетании туберкулеза с неспецифической бронхолегочной инфекцией.
Под наблюдением находилось 50 больных деструктивным ЛУТЛ, выделяющих с мокротой ЛР МБТ к изониазиду, рифампицину и ряду других ПТП. Эти люди в возрасте от 20 до 60 лет составили основную группу.
В контрольную группу вошли также 50 больных деструктивным ЛУТЛ легких в той же возрастной группе, выделяющие ЛР МБТ к изониазиду, рифампицину и другим ПТП. Эти пациенты лечились только протионамидом, амикацином, пиразинамидом и этамбутолом.
У 47 больных основной группы и 49 контрольной в мокроте микробиологическими методами были выявлены различные возбудители неспецифической бронхолегочной инфекции.
Среди больных основной группы диссеминированный туберкулез был установлен у 5 человек, инфильтративный — у 12, казеозная пневмония — у 7, кавернозный — у 7 и фиброзно-кавернозный туберкулез — у 17 человек. Большинство больных (45 пациентов) имели распространенный туберкулез легких с поражением более двух долей, у 34 больных был двусторонний процесс. У всех больных основной группы в мокроте были обнаружены МБТ, как методом микроскопии по Цилю — Нильсену, так и методом посева на питательные среды. При этом у них МБТ были устойчивы как минимум к изониазиду и рифампицину. Необходимо отметить, что все пациенты уже ранее неоднократно и неэффективно лечились основными ПТП, и специфический процесс у них приобрел рецидивирующий и хронический характер.
В клинической картине преобладали симптомы интоксикации с высокой температурой тела, потливостью, адинамией, изменениями в крови воспалительного характера, лимфопенией, увеличенной СОЭ до 40-50 мм в час. Следует отметить наличие грудных проявлений болезни — кашель с выделением мокроты, подчас значительного количества, слизисто-гнойной, а у половины больных — гнойной, с неприятным запахом. В легких выслушивались обильные катаральные явления по типу мелко-, средне-, а подчас и крупнопузырчатых влажных хрипов.
У большинства больных преобладали клинические проявления, которые скорее укладывались в картину неспецифического бронхолегочного поражения (бронхита, острой пневмонии, абсцедирования) с частыми и практически не стихающими обострениями.
Основным возбудителем неспецифической инфекции был Streptococcus hemoliticus — у 15,3% и Staphilococcus aureus — у 15% больных. Среди грамотрицательной микрофлоры преобладал Enterobacter cloacae в 7,6% случаев. Следует отметить высокую частоту ассоциации возбудителей неспецифической бронхолегочной инфекции.
МБТ были обнаружены у всех 50 больных. У 42 человек определялось обильное бактериовыделение. У всех пациентов выделенные штаммы МБТ были устойчивы к изониазиду и рифампицину. При этом у 31 больного лекарственная устойчивость МБТ к изониазиду и рифампицину сочеталась с другими ПТП.
Определение минимальной ингибирующей концентрации (МИК) максаквина проводили на лабораторных штаммах H37Rv и Academia, а также клинических штаммах (изолятах), выделенных от 30 больных, из которых 12 изолятов были чувствительны ко всем основным химиопрепаратам и 8 обладали резистентностью к изониазиду, рифампицину и стрептомицину. В опытах in vitro подавление роста лабораторных штаммов МБТ наблюдалось в зоне 57,6±0,04 до 61,8±0,02 мкн/мл, что почти в семь раз больше, чем показатели, характерные для остальных ПТП .
Таким образом, в ходе микробиологических исследований было установлено выраженное бактериологическое действие максаквина на МБТ, при этом более выраженный эффект наблюдался при его воздействии на лекарственно чувствительные штаммы и изоляты. Однако при повышенных концентрациях максаквина эффект также заметен при воздействии на полирезистентные МБТ, устойчивые к основным ППТ.
Лечение максаквином проводилось у всех 50 больных основной группы в разработанной нами комбинации с другими резервными препаратами: протионамидом, амикацином, пиразинамидом и этамбутолом.
Максаквин назначали в дозе 800 мг в сутки перорально однократно в утренние часы сразу вместе с другими противотуберкулезными препаратами для создания максимальной суммарной бактериостатической концентрации в крови и очагах поражения. Доза максаквина выбрана с учетом микробиологических исследований и соответствовала МИК, при которой отмечалось существенное подавление роста МБТ. Терапевтический эффект определяли через месяц — для оценки воздействия его на неспецифическую патогенную бронхолегочную микрофлору и через два месяца — для оценки воздействия на полирезистентные МБТ. Длительность курса лечения резервными химиопрепаратами в сочетании с максаквином составляла два месяца.
Через месяц комплексного лечения было отмечено значительное улучшение состояния больных основной группы, что проявлялось в уменьшении количества мокроты, кашля и катаральных явлений в легких, снижении температуры тела, при этом более чем у двух третей больных — до нормальных цифр.
У всех больных к этому сроку в мокроте перестал определяться рост вторичной патогенной бронхолегочной микрофлоры. К тому же у 34 больных значительно уменьшилась массивность выделения микобактерий туберкулеза. Практически у всех больных нормализовались анализы крови.
Следует отметить, что у 28 пациентов рентгенологически через месяц лечения максаквином в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом отмечалось частичное рассасывание специфических инфильтративных изменений в легких, а также существенное уменьшение перикавитарной воспалительной реакции. Это позволило применить на данном этапе искусственный пневмоторакс, который является обязательным методом в лечении ЛУТЛ и составляет вторую и не менее важную часть нашей концепции повышения эффективности лечения больных деструктивным туберкулезом легких, выделяющих полилекарственнорезистентные МБТ.
При анализе эффективности специфического действия комбинации резервных противотуберкулезных препаратов в сочетании с максаквином на полирезистентные МБТ при лечении 50 больных основной группы мы делали основной акцент на показатель прекращения бактериовыделения, как по микроскопии мокроты по Цилю — Нильсену, так и по посеву на питательные среды через два месяца после химиотерапии.
Анализ частоты прекращения бактериовыделения у больных основной и контрольной группы через два месяца лечения показал, что у пациентов, получавших максаквин в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом, прекращение бактериовыделения было достигнуто в 56% случаях. В контрольной группе больных, не получавших максаквина, — только в 30% случаев.
Следует отметить, что у остальных больных основной группы за этот период времени существенно уменьшилась массивность выделения МБТ.
Инволюция локальных изменений в легких у 50 больных контрольной группы также шла более замедленными темпами, и только у 25 больных к концу второго месяца удалось достичь частичного рассасывания перикавитарной инфильтрации и применить к ним искусственный пневмоторакс. К 39 из 50 пациентов основной группы был применен искусственный пневмоторакс в течение 1,5-2 месяцев, и 17 из них удалось достигнуть закрытия каверн в легких. 11 оставшихся больных, имеющих противопоказания к проведению искусственного пневмоторакса, в этот период были подготовлены к плановому оперативному вмешательству.
При определении лекарственной устойчивости МБТ к максаквину через два месяца лечения у больных основной группы только в 4% случаев была получена вторичная лекарственная устойчивость, сформировавшаяся в процессе двухмесячной химиотерапии, что в конечном итоге потребовало его отмены и замены на другой химиопрепарат, к которому МБТ сохранили свою чувствительность.
К концу второго месяца у 4% больных отмечались явления непереносимости максаквина — в виде диспепсических явлений и диареи, связанной с дисбактериозом, аллергических кожных проявлений и эозинофилии до 32%, что привело к полной отмене препарата. Во всех остальных случаях при двухмесячном ежедневном применении максаквина в суточной дозе 800 мг побочных явлений не отмечалось.
Проведенная после окончания курса лечения максаквином комбинированная химиотерапия резервными препаратами и динамическое наблюдение за этими же больными показали, что достигнутый ко второму месяцу положительный результат в абациллировании мокроты оказал положительное влияние и на конечный результат излечения больных с ЛУТЛ.
Таким образом, применение максаквина в дозе 800 мг в сутки в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом у больных деструктивным ЛУТЛ с сопутствующей неспецифической бронхолегочной инфекцией показало его достаточную эффективность как антибиотика широкого спектра, воздействующего на грамотрицательную и грамположительную микрофлору, и препарата, действующего на туберкулезное воспаление.
Максаквин с полной уверенностью может быть отнесен к группе резервных ПТП. Он эффективно действует не только на МБТ, чувствительные ко всем ПТП, но и на ЛУ МБТ к изониазиду и рифампицину, что и обусловливает целесообразность его назначения таким больным. Тем не менее максаквин не следует рассматривать как основной препарат в схемах лечения больных с впервые выявленным туберкулезом легких, он должен оставаться в резерве и применяться только при ЛУТЛ и сопутствующей неспецифической бронхолегочной инфекции.
Для изониазида это составляет 1 мкг/мл, для рифампицина — 40 мкг/мл, стрептомицина — 10 мкг/мл, этамбутола — 2 мкг/мл, канамицина — 30 мкг/мл, амикацина — 8 мкг/мл, протионамида (этионамида) — 30 мкг/мл, офлоксацина (таривида) — 5 мкг/мл, циклосерина — 30 мкг/мл и для пиразинамида — 100 мкг/мл.
Литература
1. Лечение туберкулеза. Рекомендации для национальных программ. ВОЗ. 1998. 77 с.
2. Мишин. В. Ю., Степанян И. Э. Фторхинолоны в лечении туберкулеза органов дыхания // Русский медицинский журнал. 1999. № 5. С. 234-236.
3. Рекомендации по лечению резистентных форм туберкулеза. ВОЗ. 1998. 47 с.
4. Хоменко А. Г., Мишин В. Ю., Чуканов В. И. и др. Эффективность применения офлоксацина в комплексном лечении больных туберкулезом легких, осложненным неспецифической бронхолегочной инфекцией // Новые лекарственные препараты. 1995. Вып. 11. С. 13-20.
5. Хоменко А. Г. Современная химиотерапия туберкулеза // Клиническая фармакология и терапия. 1998. № 4. С. 16-20.

Исландский мох, или цетрария исландская – это напочвенный лишайник из семейства Пармелиевых, не имеющий отношения к мхам (симбиоз гриба и водоросли). Произрастает в Европе, Азии, Австралии и Африке. Прекрасно чувствует себя на болотах, в хвойных лесах, верещатниках, тундрах и лесотундрах Алтая, Карелии, Кавказа и Сибири. Встречается также на коре пней деревьев или прямо на земле, любит открытые места, на которых порой образует густые заросли.
Исландский мох предъявляет повышенные требования к чистоте атмосферы. В случае недостаточной влажности лишайник высыхает, впадает в анабиоз, который может длиться несколько лет. В условиях достаточной влажности оживает за несколько часов. Лишайник весьма чувствителен к загрязненности своего ареала и может служить природным показателем чистоты экологии. В загрязнённых местностях лишайник постепенно вымирает.
Лекарственные и вкусовые свойства и противопоказания исландского мха известны людям с глубокой древности, что допускает его применение не только в медицине, но и в кулинарии. Растение обладает горьковатым привкусом – эскимосы используют его в качестве пряности, добавляя в пиво, выпечку, рыбные блюда. В лишайнике имеется слизь, благодаря которой остуженный отвар его превращается в кисель. Лишайник также является ценным источником питания для животных.
Из послереволюционных книг известно, что в период голода использовался запас сухого лишайника, имевшегося во многих московских аптеках. Его вымачивали в содовом растворе, высушивали, измельчали в порошок, добавляли к ржаной муке в соотношении 1:1 и пекли хлеб.
Морфологическое описание цетрарии
Слоевище лишайника представляет собой рыхлую деринку длиной до 10-15 см, состоящую из желобчато-свернутых плоских лопастей. Нижняя часть светлого, почти белого оттенка, имеет белые пятна и разрывы, сквозь которые поступает воздух.
Лопасти плоские и узкие, с короткими тёмными ресничками и приподнятыми краями. В зависимости от падения света наружная сторона лопастей имеет зеленоватый или коричневый оттенок. Цепляется мох за землю либо кору с помощью ризоидов.
Плоды появляются на конечных частях расширенных лопастей и имеют уплощенную блюдцеобразную форму 1,5 см в диаметре, коричневого оттенка.
Сбор и заготовка исландского мха
Собирают и заготавливают слоевище цетрарии летом, в сухую погоду, отрывая от субстрата и очищая от грязи (мыть водой нельзя). Высушивают на солнце или в тени на сквозняке. Хранят в полотняных мешочках до 2-х лет.
Химический состав
Слоевище цетрарии содержит: углеводы (глюкозу, сахарозу, галактозу), белки, горечи, жиры, камедь, витамины группы А и В, крахмал, летучие пахучие вещества, ферменты, минералы: натрий, йод, титан, никель, бор, хром, медь, марганец, молибден; иридоид цетрарин, лишайниковые кислоты, слизь (до 70 %).
Применение исландского мха в фармацевтике
Применение исландского мха для лечения впервые упоминалось в народных трактатах Норвегии, Исландии и Швеции: скандинавцы использовали лишайник при простудах, для укрепления иммунитета, обрабатывали настоями лишайника раны, ожоги, трещины кожи. Только в ХХ веке были изучены антибактериальные и антитуберкулёзные свойства растения. В настоящее время лишайник внесен в фармакопею ряда европейских стран, в т.ч. России.
Исландский мох эффективен при лечении многих болезней благодаря антисептическим, отхаркивающим, тонизирующим, антибактериальным, слабительным, противовоспалительным, обволакивающим, желчегонным, ранозаживляющим и противомикробным действиям. Является сильным природным антибиотиком.
Издавна исландский мох используют как мощное откашливающее и противорвотное средство. Успешно справляется лишайник с заболеваниями, сопровождающимися сильным и мучительным кашлем - пневмонией, бронхитом, плевритом, коклюшем. Обладает противовирусным и антибактериальным действиями (цитомегаловирус, аденовирус, риновирус, вирус ОРЗ и др.).
В народной медицине исландский мох используется:
- при дистрофии, анемии, общем истощении организма, преждевременном старении, как общеукрепляющее средство после оперативного вмешательства, затяжных мучительных заболеваний.
- при заболеваниях кожи: гнойных процессах, угревой сыпи, ожогах, фурункулах, трофических язвах.
- при заболеваниях ЖКТ (гастрит, колит, панкреатит, язва желудка), регулирует работу кишечника как при поносах, так и при запорах благодаря наличию слизи, дающей обволакивающий эффект, горечей и ферментов.
- при воспалительных процессах ротовой полости, глотки, кишечника и желудка.
- для лечения мастопатии у женщин и повышения потенции у мужчин.
Детям лишайник назначается при бронхите, коклюше, возникновении приступов сильного кашля, местно – для обработки высыпаний при ожогах и дерматите.
Исландский мох является незаменимым средством для похудения!
Лечебные свойства и рецепты лишайника позволяют его применять при самых различных заболеваниях, но лучше делать это после консультации лечащего врача.
Научные исследования цетрарии исландской
Экспериментальное лечение исландским мхом и лекарствами из него проводилось перед самым распадом СССР в Институте фтизиапульмонологии г. Ленинграда. Было создано мощное лекарство, которое, давало успешный результат в лечении больных туберкулезом. Позднее, биохимические механизмы действия лишайника активно изучали в научных лабораториях США, Австрии, Исландии, Японии. Так, японскими врачами было выявлено, что исландский мох, соединённый с зеленым чаем и рядом других трав является лекарством для лечения и профилактики онкозаболеваний.
Был выявлен также сильный антиоксидантный эффект цетрарии – растение восстанавливает организм и останавливает его преждевременное старение.
Рецепты народной медицины
Лекарственные рецепты помогают при условии строгого соблюдения правил приготовления препаратов исландского мха – это должны помнить все больные.
Чай от коклюша:
1. Взять по ½ чайной ложки тимьяна и исландского мха, залить 250 мл кипятка и настоять 5 мин, процедить. Принимать по 250 мл 3 раза в сутки.
2. Рецепт от кашля, который можно использовать и для детей. Взять 2 ст.л. сухого мха и залить 200 мл холодной воды, довести до кипения в кастрюле и кипятить на слабом огне около 1 часа – консистенция отвара должна напоминать кисель. Принимать по 2-3 глоточка в течение дня в теплом виде. Для улучшения вкуса отвара можно добавлять к нему мед. Хранить в холодильнике не более 2-х дней.
Отвар при язве желудка:
Соединить мох, семя льна и корень алтея. Взять 1,5 столовой ложки этой смеси, залить 500 мл кипятка и поставить на огонь на 7 минут. Полученный отвар процедить и остудить. Принимать 5 раз в сутки по 70 мл за полчаса до еды.
Спиртовая настойка лишайника для лечения удушающего кашля, заболеваний ЖКТ, отсутствия аппетита:
На 40 г мха взять стакан 60 % спирта, оставить настаиваться на 7 дней. Принимать 2 раза в сутки по 10-15 капель ежедневно.
Отвар для лечения туберкулеза:
4 столовые ложки мха залить 500 мл кипяченой остуженной воды, поставить на самый медленный огонь на 5 мин, процедить. Принимать в остуженном виде по 2 глотка 3 раза в сутки.
Отвар при атонии желудка:
3 стол. ложки мха залить 750 мл воды, поставить на медленный огонь на 30 минут. После остывания получится отвар, похожий на кисель, который нужно принять за 1 раз. Принимать по такому объему 3-5 дней подряд.
Лекарство при кашле и бронхите:
В эмалированную кастрюлю налить 1 стакан молока, добавить 1 ст.л. сухого измельченного лишайника. Кипятить на самым медленном огне 30 минут, после чего накрыть крышкой. Принимать перед сном по 2 глотка в горячем виде.
Экстракт для лечения запоров:
100 сухого лишайника залить 1 литром холодной воды. Настоять сутки, процедить и поставить на водяную баню, пока объем не упарится вдвое. Принимать 3 раза в день за 30 минут до еды.
Универсальный отвар лишайника при всех кожных болезнях:
1 ст.л. сухого лишайника залить 2 стаканами кипятка и прокипятить на водяной бане 5 минут, процедить. Принимать 3-5 раз в день по 1 ст.л.
Сбор трав от хронического ринита:
Взять по 1 ст. ложке лишайника, травы зверобоя, софоры японской, добавить 2 ст. л. травы шалфея. Залить все 1 л. воды, прокипятить полчаса, остудить до теплого состояния, процедить. Перед сном этим отваром промывать нос при помощи резиновой груши или шприца без иголки.
Отвар от аллергии:
Взять горсть сухого лишайника, залить холодной водой и настоять 2 часа. Затем слить воду и добавить к сырью пол-литра кипятка, прокипятить 25 мин на медленном огне. Пить натощак по 100 мл.
Средство для профилактики и лечения онкологии:
Взять по 2 части лишайника, спорыша, чистотела, зверобоя, добавить по 3 части подорожника, водяного перца, и листьев крапивы, смешать со 100 частями зеленого чая. Перемешать и сделать отвар из 4 ч.л. смеси растений и 4 стаканов горячей воды, настоять 1 час, процедить и пить в тёплом виде по 1 стакану 4 раза в день.
В косметологии остывший отвар лишайника используется в качестве лосьона для протирания при проблемной коже с прыщами и фурункулами, для ополаскивания при тонких и слабых волосах, при старении кожи лица и тела.
Аптечные препараты
На территории России и СНГ выпускаются следующие лекарства из лишайника:
- сироп Исландский мох (Гербион, Пектолван). Назначается при кашле, инфекциях верхних дыхательных путей
- пастилки для рассасывания Исла-моос - при воспалительных процессах верхних отделов дыхательных путей, осиплости голоса, сухом кашле, першении в горле и повышенной нагрузке на голосовые связки. Способствует также укреплению местного иммунитета.
- крем разогревающий с лишайником. Содержит такие полезные компоненты, как: мед, пчелиный воск, медвежий жир, эвкалипт, календулу. Используется при кашле, вывихах, ушибах, простудных заболеваниях, суставных болях. Наружно наносится на раны и трещины, при кашле им можно растирать грудь, втирать в позвоночник и больные суставы.
- в аптеках исландский мох продается также в виде сухого сырья, стоит недорого и потому является доступным средством при многих заболеваниях.
- кристаллический порошок Натрия уснинат (масляной и спиртовой раствор и порошок). Эффективное наружное противомикробное средство, используемое при ранах, трещинах и ожогах.
Западные компании выпускают серии косметики на основе исландского мха: кремы, маски, лосьоны, гели.
Противопоказания и побочные эффекты
Противопоказаниями к приему препаратов из исландского мха являются: температура выше 39 С, обострение холецистита и панкреатита, обострение бронхиальной астмы, гипертонус кишечника, обострение язвенного колита и гастрита, аутоиммунные заболевания, спастический запор, индивидуальная непереносимость, детский возраст до 1 года (по некоторым источникам, может применяться у детей и до 1 года);
Детский возраст, беременность и лактация не являются противопоказаниями к применению лишайника (только после консультации с врачом!). При длительном использовании возможны нарушения работы пищеварительного тракта, дискомфорт в области печени.
Конечно, нельзя считать исландский мох и препараты из него единственным средством лечения тяжелых заболеваний, таких как пневмония, туберкулез, онкология. В данных случаях необходимо серьезное комплексное лечение, подобранное грамотным врачом-фитотерапевтом.
Туберкулез возник около 70 тысяч лет назад в Восточной Африке. В 2013 году швейцарский ученый Себастьян Ганье провел исследование, в ходе которого расшифровал эволюцию этой болезни и смог отследить ее миграцию вместе с древними людьми. У них, кстати, не было иммунитета к заболеванию, но и бактерия тогда не была способна на массовые убийства. Триггером стало развитие сельского хозяйства около 9-10 тысяч лет до н.э., несмотря на то, что палочка, в отличие от многих других заболеваний, не передавалась человеку от одомашненного скота (она существовала гораздо раньше). По мнению исследователей Института тропиков и общественного здоровья, резкое увеличение рождаемости и освоение новых территорий помогло туберкулезу освоиться на новой земле и начать передвигаться от человека к человеку. К слову, туберкулез находили даже у древнеегипетских мумий.
по теме

Лечение
"Записки Чахоточной"
До исследований Коха причинами возникновения туберкулеза считали сидячий образ жизни, неестественные позы во время работы и даже онанизм. В особо запущенных случаях врачи рекомендовали женщинам обрезание, а мужчинам тугую повязку на пенис. С лекарствами тоже было туго: кровопускание, горькие отвары, исландский мох, препараты из ртути и свинцовый сахар, — лучшее, что могла предложить медицина того времени. А романтизация этого заболевания привела к тому, что многие и вовсе не желали лечиться. Так, лорд Байрон мечтал умереть от туберкулеза, однако, до сих пор неясно, была ли причиной такого желания полнота поэта или роль сыграли его романтические душевные переживания.
Гораздо позже, в 1882 году в берлинской клинике Шарите, которая ведет исследовательскую работу и по сей день, немецкий микробиолог Роберт Кох открыл туберкулезную палочку, палочку Коха. Тогда же ему удалось обнаружить, что бактерия не переносит солнечный свет и выделить туберкулин — вещество, которое вводят для реакции Манту. Эти события стали отправной точкой в борьбе с заболеванием, которое было основной причиной смертности в то время.
Туберкулез развивается не только в легких
Сейчас туберкулез называют лидером по смертности среди инфекционных заболеваний. Ежегодно от него умирают около 2 млн человек, более 200 тысяч из которых — дети. При этом заболевают каждый год, по данным ВОЗ, около 10 миллионов человек. В 80-90% случаев при туберкулезе поражаются органы дыхания, однако очаги поражения могут находиться и в других органах. Внелегочные формы встречаются существенно реже и могут дать о себе знать лишь спустя десятилетия после заражения.
Палочка может атаковать:
кожу и подкожно-жировой слой
кости и суставы
мозг и нервную систему
Туберкулез протекает в открытой и закрытой формах. Заразна только первая. В этом случае в мокроте больного присутствуют бактерии, и он способен передать палочку еще 10-15 людям. В противотуберкулезном диспансере проводят анализ, в ходе которого выявляют, есть ли в мокроте больного бациллы и является ли он опасным для окружающих. Выявить заболевание возможно и с помощью флюорографии, рентгена или компьютерной томографии.
Заболеть туберкулезом не просто
Чаще всего инфекция передается от больного легочным туберкулезом, который не получает достаточного лечения. По данным ВОЗ, треть населения мира инфицирована бактериями туберкулеза, но пока еще не заболела им и не может передавать болезнь. Так, бактерия, подавляемая иммунитетом, может прожить в организме много лет. Вероятность заболеть у таких людей от 5 до 15% (в зависимости от иммунитета), но сильный стресс, недостаточное потребление витаминов и полезных веществ, плохой сон, курение, диабет или заболевания иммунитета могут спровоцировать болезнь.
по теме

Мнение
Вечное клеймо
Когда человек с открытой формой туберкулеза кашляет или чихает, он распространяет взвесь частиц с бактериями. Если в организм здорового человека попадет одна такая бактерия, она, скорее всего, не осядет в легких, а выйдет при выдохе или погибнет. Если же скопление микобактерий туберкулеза слишком велико, то при вдохе они, вероятнее всего, останутся на задней стенке горла, откуда попадут в желудок и кишечник, где и погибнут.
В целом, заболеть туберкулезом не так-то просто, должен совпасть целый ряд факторов: идеальный размер капельки с бактериями, идеальная взвесь бактерий в этой капельке и сниженный иммунитет. И даже в этом случае, активная фаза болезни может миновать. В больницах и диспансерах принято считать, что палочка передается через общую посуду, рукопожатия, одежду и постельное белье. Эти принципы изоляции сохранились с давних пор, несмотря на то, что давно доказано обратное.
Однако риск заражения возможен, если зайти в помещение, где недавно находился больной. Поэтому чрезвычайно важно, чтобы оно хорошо проветривалось.
Как лечат туберкулез?
Важно помнить, что туберкулез излечим. Основа его лечения — антибактериальная химиотерапия четырьмя препаратами: рифампицином, изониазидом, пиразинамидом и этамбутолом. Эти препараты оказывают воздействие на бациллы, предотвращают привыкание и не дают палочке мутировать. Лечение обычно занимает от 6 до 8 месяцев. Для эффективной терапии необходима поддержка врача и постоянное наблюдение. При приеме курса важно соблюдать все предписания специалистов, чтобы не распространять болезнь дальше и избежать рецидива.
По данным ВОЗ, благодаря своевременной диагностике и грамотному лечению туберкулеза с 2000 по 2016 год было спасено 53 миллиона человеческих жизней. Но это, к сожалению, самый радужный из возможных прогнозов. Если не принимать таблетки в одно и то же время суток, концентрация препарата в организме снижается и бактерия получает шанс на развитие множественной лекарственной устойчивости (резистентности). Такой туберкулез не чувствителен к изониазиду и рифампицину и требует лечения препаратами так называемого второго ряда (терапия, основанная на других препаратах, к которым у штамма нет устойчивости).
Почему туберкулез до сих пор опасен?
Бактерия, вызывающая туберкулез, — это сложный организм с совершенной системой приспособления к факторам внешней агрессии: и к химическим, и к физическим. Она способна мутировать и развивать привыкание к препаратам, поэтому до начала лечения проводят специальные тесты на устойчивость болезни к активным компонентам препаратов. Резистентность развивается по нескольким причинам:
неправильное назначение лечения
плохое качество лекарств
ненадлежащее применение препаратов
преждевременное прекращение лечения
Лечение туберкулеза терапией второго ряда может занимать до двух лет, оно гораздо дороже, а лекарства токсичнее. Более того, варианты лечения в этом случае ограничены, поэтому необходимо постоянно продолжать исследования в поисках новых противотуберкулезных препаратов.
по теме

Мнение
Дьявольский дуэт
Вера Зимина, доктор медицинских наук, врач-фтизиатр, врач-инфекционист, профессор кафедры инфекционных болезней с курсами эпидемиологии и фтизиатрии РУДН:
Худший вариант развития событий — туберкулез с широкой лекарственной устойчивостью. Он вызывается бактериями, которые не реагируют на активные препараты второй линии. В таких ситуациях к лечению подходят индивидуально, требуется время на подбор нужной схемы. По оценкам ВОЗ, хуже всего ситуация с устойчивым туберкулезом обстоит в Индии, Китае и России. На эти страны приходится почти половина всех случаев.
Противотуберкулезный курс лечения также вызывает множество побочных эффектов, поэтому вместе с основными препаратами врачи назначают терапию сопровождения: спазмолитики, седативные, противорвотные, ферменты и т.д.
ВИЧ + туберкулез
Примерно 12-14 млн населения нашей планеты инфицированы одновременно ВИЧ и микобактериями туберкулеза. Такое сочетание особенно опасно, это фактически бомба для иммунитета. Но излечение возможно даже в этом случае. Важно, чтобы в период лечения туберкулеза пациент получал антиретровирусную терапию (АРВТ), если по каким-то причинам он не принимал ее ранее. Поскольку туберкулез более опасен для ВИЧ-положительных людей, им в качестве профилактики рекомендуют делать флюорографию дважды в год как группе риска. Кроме того, на поздних стадиях ВИЧ проба Манту и Диаскинтест показывают отрицательные значения и не реагируют на палочку, поэтому в таких случаях эффективными методами диагностики могут стать компьютерная томография с контрастным веществом и ПЦР.
Так как вероятность заболеть туберкулезом у ВИЧ-инфицированного человека в 20-30 раз выше, чем у ВИЧ-отрицательных людей, пациентам с низким уровнем лимфоцитов назначают химиопрофилактику. Это либо монотерапия одним препаратом, либо комбинированное лечение, которое не дает инфекции перейти в болезнь.
Профилактика
В настоящее время в России новорожденных прививают вакциной БЦЖ, ее делают из искусственно выращенной ослабленной туберкулезной палочки. Привитые дети либо получают иммунитет, либо не имеют возможности заболеть тяжелой формой туберкулеза.
по теме

Лечение
Гид по вакцинам. Когда и какую прививку сделать? А главное: надо ли вообще прививаться? (Спойлер: конечно, надо)
Ревакцинация считается спорной из-за того, что БЦЖ в некоторых случаях может вызывать у взрослых осложнения. Поэтому подростки и взрослые люди находятся в группе риска. В январе 2018 года в Университете Орегона были проведены испытания новой вакцины, в результате которых она показала эффективность в 68% случаев. Она основана на цитомегаловирусе и позволяет держать в тонусе лимфоциты, которые отвечают за убийство инфекционных агентов в организме. Ожидается, что испытания новой прививки на людях начнутся после 2019 года.
Самые простые, но самые важные способы профилактики заболевания — это здоровый образ жизни, отсутствие хронического психоэмоционального стресса, хороший сон и качественное питание.
Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ? С чем связаны возможны
 |
| Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания |
Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ?
С чем связаны возможные ошибки в диагностике?
Какова основная роль b-агонистов в терапии бронхиальной астмы?
Как назначаются кортикостероиды?
Несмотря на возросшую компетентность врачей и доступность эффективных методов лечения, смертность от бронхиальной астмы остается высокой. Предотвратить многие смертельные исходы и даже избежать большинства случаев госпитализации можно было бы при проведении правильного лечения.
Необходимо помнить, что ведение больных астмой — процесс сложный и длительный.
Недооценка степени несостоятельности дыхания. Тяжесть состояния пациента и степень несостоятельности его дыхательной системы можно не распознать, если пренебречь тщательным выяснением всех проявлений болезни и построением диаграммы измерений максимальной скорости потока (МСП) выдыхаемого воздуха.
Зачастую у больных астмой снижены виды на будущее, хотя некоторые и склонны недооценивать серьезность симптомов своего заболевания. Чтобы выявить такую недооценку, нужно подробно расспросить пациента, бывает ли у него кашель или хриплое дыхание ночью или при физической нагрузке.
Если пациентам не удается достичь наилучшей возможной функции легких, то для коррекции этого состояния необходимо для начала вычислить нормальную МСП выдыхаемого воздуха для данного пациента, пользуясь диаграммой, прилагаемой к пикфлуометру.
Если измеренная МСП более чем на 20% меньше вычисленной, стоит провести исследование обратимости этого состояния, что делается путем сопоставления МСП или жизненной емкости легких (ЖЕЛ) до и после лечения.
Необходимая терапия может состоять всего лишь в однократном приеме бронходилятатора, но если это не увеличивает МСП на 20%, то есть до вычисленного уровня, могут понадобиться более серьезные меры, например трехнедельный курс системных кортикостероидов (30 мг преднизолона в день для взрослых). Таким образом выясняется наилучший достижимый уровень МСП, на который ориентируются в последующем лечении.
Иногда пациенты сообщают об уменьшении одышки, но при этом значения МСП не изменяются. В таких случаях необходимо провести измерение ЖЕЛ с помощью спирометра, которое может подтвердить улучшение, не определяемое по МСП (рис. 2). Спирометрами в настоящее время укомплектованы все врачебные приемные.
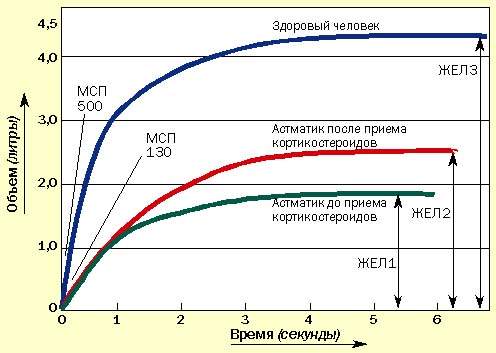 |
| Рисунок 2. Изменение ЖЕЛ под влиянием курса кортикостероидов. МСП может не измениться, но увеличение ЖЕЛ свидетельствует об улучшении состояния |
Бронхиальная астма, замаскированная под хроническое обструктивное заболевание легких (ХОЗЛ). Страдающие одышкой пациенты, которым поставлен диагноз ХОЗЛ или эмфизема, могут иметь скрытый бронхоспастический элемент, обусловленный бронхиальной астмой.
Таким пациентам необходимо провести исследование обратимости процесса, как описано выше. Любое улучшение функции легких можно поддержать, проводя адекватное лечение бронхиальной астмы. При отсутствии улучшения легочной функции назначение кортикостероидов ничем не оправдано, а только приводит к нежелательным побочным эффектам, таким как остеопороз.
Что должен помнить врач, наблюдающий больных с бронхиальной астмой
- Сказал ли я, что нужно применять спейсер при ингалировании кортикостероидов?
- Проверил ли я навыки ингаляции?
- Осмотрел ли я всех пациентов, недавно перенесших тяжелые приступы или госпитализацию?
- Все ли пациенты с повторными назначениями регулярно приходят на прием?
- Все ли я сделал, чтобы исключить астму у пациентов с ХОЗЛ?
- Проводятся ли регулярные проверки для достижения единообразного подхода к ведению астматиков?
Постоянный прием b-агонистов короткого действия. Показано, что лечение астмы постоянным приемом b-агонистов увеличивает гиперреактивность легких и утяжеляет бронхиальную астму [1]. Если пациент использует b-агонисты скорее регулярно, чем случайно, их применение должно сопровождаться назначением ингаляционных кортикостероидов или, если кортикостероиды уже применяются, увеличением их дозы до достаточной, чтобы контролировать астму. Таким образом, b-агонисты оставляют на случаи одышки и хрипов.
Последние методические указания по лечению бронхиальной астмы в Британии рекомендуют начинать с высокой дозы ингаляционных или системных кортикостероидов для достижения быстрого контроля, затем постепенно снижать дозу до минимальной, обеспечивающей нормальное самочувствие пациента и оптимальные значения МСП или ЖЕЛ на фоне минимального применения бронходилятатора (рис. 3). Быстрое облегчение состояния, достигаемое при применении кортикостероидов, улучшает настроение пациента и увеличивает его доверие к лечению.
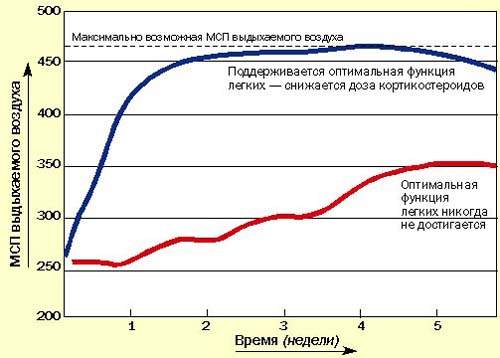 |
| Рисунок 3. Рекомендуется начинать с высоких доз кортикостероидов, а затем постепенно снижать дозу до минимальной (оптимальные значения МСП или ЖЕЛ) |
Последние данные свидетельствуют о том, что назначать кортикостероиды нужно как можно раньше всем астматикам, и не только для контролирования симптомов, но и для предотвращения прогрессирующих структурных повреждений легких, обусловленных хроническим воспалением [2,3]. Это означает, что кортикостероиды следует предпочесть b-агонистам, как только диагноз подтверждается МСП-диаграммой. b-агонисты остаются препаратами резерва на крайний случай.
Возможность альтернативного лечения. Хотя ингалируемые кортикостероиды должны быть краеугольным камнем в лечении астмы, в случаях, трудно поддающихся лечению, можно использовать и некоторые другие препараты. Доказано, что противовоспалительным эффектом обладают теофиллины в достаточно небольших дозах, но надо учитывать в каждом индивидуальном случае их возможное взаимодействие с другими препаратами.
Пожилым пациентам целесообразно назначать ипратропиум. Иногда оказываются эффективными недокромил и кромогликат.
Бронходилятаторы длительного действия, такие как сальметерол, могут облегчать состояние, особенно ночью, блокируя бронхоконстрикторные механизмы. Однако необходимо, чтобы все вышеперечисленные препараты сопровождались применением адекватных доз кортикостероидов.
Техника ингаляции. Нужно добиться, чтобы у пациентов выработались правильные навыки обращения с ингалятором. Врач должен помочь подобрать тот тип ингалятора, который наиболее удобен пациенту, и проверить его работоспособность. Для этого в кабинете врача должен быть полный набор ингаляторов.
Спейсеры. Применяемые вместе с аэрозольными ингаляторами, спейсеры облегчают проникновение препарата в легкие и снижают как накопление его в глотке, так и системное всасывание за счет проглатывания.
Спейсеры помогают координировать выброс препарата со вдохом. Это особенно важно при ингалировании кортикостероидов. Так как кортикостероиды применяются только дважды в день, громоздкий спейсер можно хранить дома.
Спейсеры обеспечивают лучшее накопление препарата в легких, чем распылители. Необходимо правильно их применять: встряхнуть ингалятор, чтобы лекарство смешалось с носителем, и однократно впрыснуть смесь с последующим скорейшим вдохом [4].
Триггерные факторы. Нераспознанные триггерные факторы могут быть и дома, и на работе, и на отдыхе, то есть практически в любом месте. Выявить источник поможет анамнез. Например, при профессиональной бронхиальной астме состояние улучшается во время отпуска и в выходные дни. Отсутствие раздражителя уменьшает или устраняет проявления болезни и снижает необходимость в лекарствах.
Проблемой, которую часто не принимают во внимание, может быть пассивное курение. Такие препараты, как b-блокаторы и нестероидные противовоспалительные средства (НПВС), также могут вызывать астму.
Использование распылителей (небулайзеров) без фоновой кортикостероидной терапии. При лечении острого астматического приступа без назначения пероральных кортикостероидов все еще используют распылители, которые обеспечивают проникновение более высокой дозы b-агонистов. Это действительно снимает бронхоспазм, но поскольку высокая доза b-агонистов не воздействует на сопутствующий воспалительный процесс, необходимо сразу же дать больному кортикостероиды внутрь, чтобы предотвратить нарастание приступа; эффект бронходилятаторов снижается по мере увеличения отека слизистой.
Если тяжесть приступа такова, что требуется небулайзер, необходимо назначить системные кортикостероиды. Даже при умеренном приступе бронходилятаторы сами по себе приносят лишь временное облегчение и есть опасность повторения приступа — возможно, глубокой ночью!
Несвоевременное назначение оральных кортикостероидов. Если не проводить противовоспалительной терапии, у больных нарастает отек слизистой, что приводит к повторению приступов. Такие пациенты часто нуждаются в госпитализации и назначении высоких доз кортикостероидов в течение нескольких дней, прежде чем у них наступит стабилизация состояния.
Пациенты, подверженные быстроразвивающимся приступам, нуждаются в как можно более раннем назначении кортикостероидов и бронходилятаторов. Они должны уметь распознавать ухудшение состояния, всегда иметь под рукой кортикостероиды и знать, как их использовать. Не следует заставлять этих пациентов дожидаться прихода к ним врача (рис. 4).
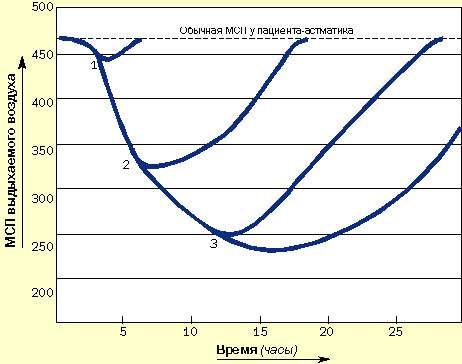 |
| Рисунок 4. Зависимость развития острых приступов от времени назначения кортикостероидов и как результат применения длительных курсов системной кортикостероидной терапии. (1) Кортикостероиды назначены сразу после возникновения приступа: выздоровление наступает быстро. (2) Кортикостероиды назначены через 6 часов: выздоровление замедлено. (3) Кортикостероиды назначены позже чем через 12 часов: приступ тяжелый и длительный, выздоровление наступает медленно |
Пациенты с постепенным развитием приступов могут подождать и посмотреть, помогает ли увеличенная доза ингаляционных кортикостероидов в сочетании с бронходилятаторами.
Неадекватный курс системных кортикостероидов. Иногда назначенные кортикостероиды отменяют до полного купирования приступа, что ведет к сохранению гиперреактивности бронхов и очередному приступу.
Подобная цепь событий может привести пациента к ложному заключению, что у него бронхиальная астма, трудно поддающаяся лечению.
Прекращение наблюдения за пациентом после острого приступа или госпитализации. Трудности возникают при отмене системного кортикостероида и назначении ингаляционного. В этот переходный период необходимо тщательное наблюдение; по достижении стабилизации состояния дозу ингалируемого кортикостероида постепенно снижают до минимально необходимой, чтобы заболевание никак себя не проявляло и функция легких была оптимальной.
Целью последующего лечения становится поддержание наивысшей МСП, достигнутой в больнице после курса системных кортикостероидов.
Консультация, проведенная через некоторое время после выписки, дает хорошую возможность проверить план ведения пациента, выяснить, что не так, и внести соответствующие поправки.
Кашель и хрипы с гнойной мокротой иногда принимают за легочную инфекцию. Однако мокрота больных астмой содержит гораздо больше эозинофилов, чем полиморфных клеток и бактерий. В пожилом возрасте левожелудочковая недостаточность и сердечная астма должны наводить на мысль о предшествующей бронхиальной астме. Будьте осторожны с b-блокаторами!
Внезапная одышка может быть обусловлена пневмотораксом или легочной эмболией. Хрипы встречаются при туберкулезе легких, бронхиальной карциноме или инородном теле и могут быть четко локализованы. Следовательно, у любого пациента с астмой, развившейся во взрослом возрасте, необходимо провести рентгенологическое исследование органов грудной клетки.
После установления диагноза основная цель врача — освободить пациента от проявлений болезни и оптимизировать функцию легких, а также установить контроль за болезнью. Для этого специально обученный медперсонал должен обучать больных и проверять правильность выполнения ими всех назначений.
Конечно, в некоторых случаях это может оказаться затруднительным, однако план предписанных действий способно усвоить абсолютное большинство больных.
Все пациенты должны:
- уметь распознать начало приступа
- знать, как применять высокие дозы b-агонистов;
- самостоятельно начать прием преднизолона внутрь;
- знать, когда звонить врачу или отправляться в больницу;
- все страдающие от приступов, должны быть обеспечены кортикостероидами.
Литература
1. Sears M. R., Taylor D. R. et al. Regular inhaled b-agonist treatment in bronchial asthma. Lancet 1990;336:1491–1396.
2. Tari Haahtela et al. Comparinson of terbutaline with budesonide in newly detected asthma. N Engl J Med 1991;325:388–392.
3. Redingon A. K., Howarth P. H. Airway remodelling in asthma. Thorax 1997;52:310–312.
4. O'Callaghan C., Barry P. Spacer devices in the treatment of asthma. BMJ 1997;314:1061–1062.
Спирометрия при хронической бронхиальной астме
Бочкообразная грудная клетка при хронической бронхиальной астме возникает из-за задержки воздуха в периферических отделах легких, что приводит к постоянному поддержанию грудной клетки в состоянии вдоха. Задержанный воздух не выдыхается и бесполезно занимает большую часть легких (остаточный объем). Это снижает объем воздуха (жизненную емкость легких), входящего в легкое.
Воздух задерживается из-за хронического воспаления, вызывающего отек слизистой периферических бронхиол. При лечении кортикостероидами отек спадает и воздух высвобождается. Это доказывается увеличением ЖЕЛ, определенной спирометрически. МСП может не изменяться (см. рис. 2.)
Читайте также:

