Как происходит заражение человека трихоцефалезом
Обновлено: 24.04.2024
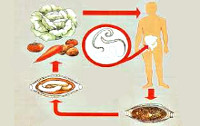
Это паразитарное заболевание, вызываемое круглыми гельминтами – власоглавами (Trichocephalus trichiurus). Основным хозяином - является человек. Главными факторами передачи возбудителя является растениеводческая продукция и сырье (овощи, ягоды, столовая зелень), загрязненная частичками почвы, содержащие яйца власоглава. Заражение может произойти и через загрязненные почвой руки.
При попадании в тонкий кишечник организма человека оболочка яйца разрушается и из нее выходит личинка, которая внедряется в слизистую на 10 дней, необходимых для развития во взрослую особь. Далее гельминт мигрирует в просвет кишечника и спускается в слепую кишку, внедряется в ее стенку и питается кровью. Взрослая самка откладывает несколько тысяч яиц, и при попадании в почву (это обязательное условие), яйца созревают в ней и цикл заражения повторяется. Т. trichiurus паразитирует только у человека. Длительность жизни паразита в организме человека 5-7 лет.
Трихоцефалез широко распространен на всем земном шаре, преимущественно в тропиках и субтропиках. Чуть реже трихоцефалез регистрируют в странах с умеренным климатом. Не встречается вообще в зонах пустынь и полупустынь. Восприимчивость к трихоцефалезу всеобщая, однако, чаще заболевание выявляют у детей в возрасте от 1 до 14 лет. Пик заболеваемости приходится на май – октябрь.
Трихоцефалез является одной из самых распространенных инвазий, во многом благодаря тому, что болезнь часто протекает бессимптомно и человек на протяжении длительного времени может не знать о наличии паразитов, являясь при этом источником заражения для всех окружающих.
Заболевание характеризуется хроническим течением с поражением пищеварительного тракта и развитием анемии, поскольку на первых стадиях заболевания симптомы могут отсутствовать. Тем не менее, гельминты оказывают на организм человека механическое и токсическое воздействие. Нарушая целостность тканей, власоглавы открывают доступ бактериям и вирусам, способствуют развитию воспалений и кровотечений, вызывают некротические изменения в тканях кишечника. Токсическое действие паразитов заключается в выделении в организм человека продуктов их жизнедеятельности, которые отравляют человека и способны вызывать тяжелые аллергии. Кроме того, при трихоцефалезе может наблюдаться развитие анемии и серьезного дисбаланса жизненно важных микроэлементов (особенно при тяжелых формах инвазии).
К основным симптомам трихоцефалеза относят:
- патологии со стороны желудочно-кишечного тракта: расстройство пищеварения, тошнота, диарея или, наоборот, запоры, возможны боли в области аппендикса;
- расстройство нервной системы: повышенная утомляемость и возбудимость, раздражительность, нарушение нормального режима сна, у детей – капризность;
Диагноз ставится на основании обнаружения в фекалиях больного яиц власоглава микроскопическими методами.
Профилактические мероприятия основаны на гигиеническом воспитании населения - соблюдение правил личной гигиены: мытье рук после туалета и перед едой, мытье рук после улицы, мытье фруктов, овощей, ягод. Одним из направлений профилактики является своевременное выявление больных и их лечение, уход за местами скопления детей – рыхление песочниц (яйца власоглава погибают под действием солнечного света).
© Федеральное бюджетное учреждение здравоохранения
"Центр гигиены и эпидемиологии в Липецкой области", 2014-2022 гг.
Дифиллоботриоз – кишечный паразитоз из группы цестодозов, вызываемый ленточными червями семейства Diphyllobothriidae, чаще всего широким лентецом. Дифиллоботриоз протекает с тошнотой, болями в животе, снижением аппетита, слюнотечением, похуданием, расстройством стула, анемическим синдромом; в тяжелых случаях развивается кишечная непроходимость. Диагноз дифиллоботриоза подтверждается исследованиями кала, позволяющими обнаружить яйца гельминта или фрагменты его стробилы. Специфическая дегильминтизация при дифиллоботриозе проводится препаратами празиквантел или никлозамид.
МКБ-10


Общие сведения
Дифиллоботриоз - кишечный гельминтоз, возникающий вследствие инвазированности человека паразитическими червями-лентецами. Возбудители дифиллоботриоза паразитируют в тонкой кишке, вызывая диспепсические проявления и мегалобластную анемию. Природные очаги дифиллоботриоза располагаются преимущественно в районах умеренного и холодного климата (северной Европе, Канаде, США). На территории России эндемичными признаны районы Карелии, Кольского полуострова, о. Сахалин, бассейнов рек Северной Двины, Оби, Лены, Енисея, Амура, где ежегодно регистрируется более 20 тыс. случаев дифиллоботриоза. Заболеваемость данным видом гельминтоза тесно связана с рыбным промыслом и переработкой рыбы.

Причины дифиллоботриоза
Возбудителями дифиллоботриоза человека могут выступать 12 видов паразитических червей–лентецов, наиболее частым представителем которых является Diphyllobothrium latum (лентец широкий). D. Latum – крупный паразитический червь, длина которого может достигать 7-10 м. Стробила (тело) широкого лентеца состоит из 3-4 тысяч члеников – проглоттид; сколекс (головка) снабжена двумя щелевидными присосками, посредством которых он крепится к стенке тонкой кишки.
Жизненный цикл развития широкого лентеца предполагает смену трех хозяев; при этом окончательным хозяином выступает человек или животные (кошки, собаки, лисы, медведи), промежуточным - пресноводные рачки, дополнительным - пресноводные рыбы (окунь, щука, ерш, налим, лососевые). Из кишечника окончательного хозяина яйца лентеца с фекалиями попадают в окружающую среду.
Их дальнейшее развитие происходит в воде, где через несколько недель из яиц выходят личинки – корацидии. В воде они заглатываются промежуточными хозяевами - веслоногими рачками, в организме которых переходят в следующую личиночную стадию развития - процеркоиды. Инвазированные рачки служат пищей для пресноводных рыб, в организме которых процеркоиды превращаются в инвазионных для человека личинок – плероцеркоид. В мышцах, икре, печени рыб личинок лентеца можно рассмотреть невооруженным глазом.
Заражение человека дифиллоботриозом происходит при употреблении в пищу сырой, плохо термически обработанной, малосольной рыбы или икры, содержащей плероцеркоиды. Попадая в тонкую кишку окончательного хозяина, личинки прикрепляются к ее слизистой оболочке и превращаются в половозрелых гельминтов, способных выделять яйца. В организме человека широкий лентец способен паразитировать 20-25 лет. Человек, больной дифиллоботриозом, для окружающих не заразен.
Патогенез
В патогенезе дифиллоботриоза ведущая роль принадлежит механическому повреждению стенки кишки, изъязвлению, некрозу и атрофии травмируемых участков. Катаральное воспаление (энтерит) приводит к нарушению процессов пищеварения. Массивная гельминтная инвазия может вызывать кишечную непроходимость. Сенсибилизация к антигенам гельминта обусловливает развитие катаральных явлений и эозинофилии в раннем периоде дифиллоботриоза. В основе мегалобластной анемии лежит дефицит витамина В12 и фолиевой кислоты, которые не усваиваются вследствие выделения гельминтом специфического рилизинг-фактора. При длительном паразитировании широкого лентеца анемия приобретает злокачественные черты и приводит к поражению нервной системы.
Симптомы дифиллоботриоза
Течение дифиллоботриоза может быть латентным или клинически выраженным (манифестным). Однако и в том и в другом случае специфическим признаком служит отхождение с каловыми массами крупных фрагментов стробилы гельминта в виде белесых лент. От момента заражения до развития клинических симптомов проходит около 1,5 месяцев. Проявления дифиллоботриоза развиваются постепенно и вначале неспецифичны: снижение аппетита, тошнота, неустойчивый стул, субфебрилитет, утомляемость, похудание. Характерны схваткообразные боли в животе, гиперсаливация.
Осложнения
При тяжелом течении дифиллоботриоза отмечается увеличение печени и селезенки, снижение желудочной секреции вплоть до ахилии. Скопление большого количества гельминтов в тонком кишечнике может вызвать обтурационную кишечную непроходимость. В связи с тяжелой В12-дефицитной анемией у больных дифиллоботриозом могут развиваться неврологические нарушения: астено-невротический синдром, парестезии, атаксия, гиперрефлексия, раздражительность, депрессия и т. д.
Диагностика
Для постановки диагноза дифиллоботриоза информативен эпидемиологический анамнез (употребление рыбы, пребывание в эндемичных районах), а также клинические данные (диспепсический синдром, анемия). В периферической крови отмечается эозинофилия, снижение количества эритроцитов и гемоглобина, нейтропения, лимфоцитоз, ускорение СОЭ. Характерно снижение содержания витамина В12 в сыворотке крови.
Основным методом диагностики дифиллоботриоза служит исследование кала, при котором обнаруживаются яйца гельминтов или обрывки стробилы широкого лентеца. В рамках диагностических мероприятий дифиллоботриоз дифференцируется с гемолитической и гиперхромной анемией, а также другими гельминтозами, сопровождающимися анемическим синдромом (анкилостомидозом, трихоцефалезом).

Лечение дифиллоботриоза
К лечению дифиллоботриоза приступают незамедлительно после подтверждения диагноза. Больным назначается полужидкая легкоусвояемая диета, прием препаратов железа, фолиевой кислоты, инъекции цианокобаламина. Специфическая терапия дифиллоботриоза проводится антигельминтными препаратами празиквантел или никлозамид. Возможно использование фитопрепаратов - мужского папоротника или отвара семян тыквы. После проведения дегельминтизации двукратно выполняются контрольные исследования кала; при обнаружении яиц гельминта назначается повторное лечение.
Прогноз и профилактика
При своевременном распознавании дифиллоботриоза и проведении эффективной антигельминтной терапии прогноз благоприятный. Однако иммунитет после лечения нестойкий; возможно повторное заражение дифиллоботриозом. Профилактика дифиллоботриоза предполагает охрану водоемов от фекальных загрязнений, соблюдение технологии разделки и приготовления рыбы, просвещение населения в очагах распространения гельминтной инвазии. Обязательно проведение паразитологического обследования работников рыбной промышленности и промысловых рыб, поступающих в торговую сеть.
Трихоцефалез – кишечная инвазия, вызываемая паразитированием круглого гельминта – власоглава и протекающая с преимущественным нарушением функции пищеварительного тракта и нервной системы. Дисфункция ЖКТ при трихоцефалезе характеризуется снижением аппетита, слюнотечением, тошнотой, рвотой, болями в животе, поносами или запорами; поражение ЦНС приводит к головным болям, головокружению, нарушению сна, иногда – обморокам и судорогам. Трихоцефалез диагностируется на основании обнаружения яиц власоглава в кале или взрослых гельминтов в просвете кишечника с помощью эндоскопии. Лечение трихоцефалеза проводится антигельминтными препаратами (албендазол, мебендазол, карбендацим и др.).
Общие сведения
Трихоцефалез - кишечный нематодоз, характеризующийся хроническим течением с развитием диспепсического, астенического и анемического синдромов. Трихоцефалез имеет практически повсеместное распространение; чаще встречается в зонах тропического и субтропического климата, где инвазия выявляется у 40-50% местного населения. На территории РФ спорадические случаи трихоцефалеза регистрируются на Северном Кавказе и в Центральном Черноземье, преимущественно в сельской местности. В эндемичных регионах трихоцефалез является вторым по распространенности гельминтозом после аскаридоза. Наибольшая заболеваемость трихоцефалезом отмечается среди детей в возрасте от 5 до 15 лет.

Причины трихоцефалеза
Заражение трихоцефалезом реализуется по фекально-оральному механизму при занесении зрелых яиц в рот загрязненными руками или при проглатывании вместе с загрязненными землей ягодами, фруктами, зеленью, овощами, водой. В желудочно-кишечном тракте человека вышедшие из яиц личинки внедряются в стенку тонкого кишечника. Через 5-10 суток они опускаются до слепой кишки, где вновь внедряются в слизистую и в течение 1-1,5 месяцев превращаются во взрослых особей. Своей головной частью власоглав проникает в стенку кишки, а его задний конец свободно свисает в просвете кишечника. Продолжительность паразитирования гельминта в кишечнике человека достигает 5-7 лет. Трихоцефалезом чаще заболевают дети, у которых недостаточно сформированы гигиенические навыки, а также лица, имеющие контакт с почвой (садоводы, землекопы, строители), работники ЖКХ. Инфицирование чаще происходит с конца весны по начало осени.
Патологические эффекты при трихоцефалезе обусловлены травмированием слизистого, подслизистого и мышечного слоев кишки, выделением гельминтами ферментов и метаболитов, что сопровождается развитием местной воспалительной и общей токсико-аллергической реакции. Возможно возникновение инфильтратов, эрозий и язв слизистой оболочки, геморрагий. Раздражение нервных окончаний кишечника вызывает нарушение моторной и секреторной функции кишечника. Следствием расстройства всасывания жидкости в толстом кишечнике служит развитие диарейного синдрома. В случае присоединения вторичной микрофлоры развивается тифлит - воспаление слепой кишки. Будучи факультативными гематофагами по способу питания, власоглавы вызывают развитие железодефицитной анемии.
Симптомы трихоцефалеза
Выраженность клинической симптоматики трихоцефалеза зависит от остроты и интенсивности инвазии. Течение трихоцефалеза делится на острую и хроническую стадии, а также на компенсированную, субклиническую, манифестную и осложненную формы. Субклиническое течение отмечается при умеренной степени заражения гельминтами; в этих случаях возникают редкие спастические или колющие боли в правой подвздошной области.
При манифестной форме трихоцефалеза выражены признаки поражения желудочно-кишечного тракта и ЦНС. Основные симптомы связаны с нарушением пищеварения и включают отсутствие аппетита, слюнотечение, тошноту, рвоту, метеоризм, неустойчивый стул (диарею чередующуюся с запорами). При высокоинтенсивной гельминтной инвазии могут развиваться тяжелые колиты с некупируемыми поносами с примесью крови, тенезмами, выпадением прямой кишки. Боли в животе могут фокусироваться в эпигастрии, правой подвздошной области или не иметь четкой локализации. Боли в эпигастрии при трихоцефалезе нередко симулируют клинику язвенной болезни желудка и двенадцатиперстной кишки, а боли в нижних отделах живота – хронический аппендицит.
Изменения со стороны центральной нервной системы при трихоцефалезе включают общую слабость, плохой сон, раздражительность, головокружение, головные боли, у детей – обмороки, судорожный синдром, отставание в физическом развитии. Течение трихоцефалеза может осложняться дисбактериозом кишечника, острым аппендицитом, кахексией, анемией. Тяжелые формы инвазии отмечаются при сочетании трихоцефалеза с острыми кишечными инфекциями, аскаридозом, амебиазом.
Диагностика
При наличии соответствующей клинической картины проводится комплексное клинико-инструментальное и лабораторное обследование. Учитывается принадлежность пациента к группе профессионального риска по развитию трихоцефалеза. При исследовании гемограммы определяется умеренная эозинофилия, гипохромная анемия. Эндоскопическое исследование кишечника (ректороманоскопия или колоноскопия) выявляет гиперемированную, отечную слизистую с поверхностными эрозиями и точечными геморрагиями; иногда удается увидеть свисающих в просвет сигмовидной или прямой кишки гельминтов. Диагноз трихоцефалеза не вызывает сомнений при обнаружении яиц власоглава в фекалиях методами обогащения. На этапе дифференциальной диагностики исключаются вирусные и бактериальные гастроэнтериты, язвенный колит, другие гельминтозы (аскаридоз, дифиллоботриоз), шигеллезы, аппендицит. При подозрении на те или иные патологические состояния показаны консультации гастроэнтеролога, проктолога, хирурга.
Лечение трихоцефалеза
Обычно больные трихоцефалезом не нуждаются в госпитализации, за исключением случаев тяжелых сопутствующих заболеваний и осложнений. Противогельминтная терапия проводится препаратами албендазол, мебендазол, карбендацим и др. Контрольное исследование кала на яйца гельминтов выполняется через 3-4 недели после окончания курса лечения трихоцефалеза. При необходимости повторный курс противопаразитарной терапии повторяется другим препаратом. Сопутствующее медикаментозное лечение включает назначение витаминов группы В, ферментов, пробиотиков, препаратов железа.
Прогноз и профилактика
В случае проведения своевременной диагностики и специфической терапии трихоцефалеза прогноз благоприятен. При массивной инвазии заболевание опасно своими осложнениями. Пациент, переболевший трихоцефалезом, и члены его семьи находятся на диспансерном наблюдении в течение 2-х лет после излечения. Профилактика аналогична таковой при других кишечных гельминтозах. Ее главными звеньями служат соблюдение гигиены (кипячение воды, мытье рук, овощей и фруктов), охрана почвы от фекального загрязнения, повышение уровня гигиенического воспитания населения. Необходимо проведение регулярного копроовоскопического обследования детей и декретированных групп, своевременной дегельминтизации больных трихоцефалезом.
Фасциолез – это паразитарная инвазия, вызываемая печеночной или гигантской двуусткой и характеризующаяся преимущественным поражением гепатобилиарной системы. Течение фасциолеза сопровождается недомоганием, лихорадкой, крапивницей, тошнотой, болями в правом подреберье, увеличением размеров печени, желтухой. В диагностике фасциолеза информативны серологические методы (ИФА, РИФ, РИГА), исследование дуоденального содержимого и фекалий на яйца гельминтов, УЗИ печени и желчевыводящих путей. В комплексную терапию фасциолеза включают диету, прием антигельминтных средств (триклабендазол, празиквантел), желчегонных, антигистаминных препаратов.
МКБ-10
Общие сведения
Фасциолез - внекишечный гельминтоз, обусловленный паразитированием в паренхиме печени и желчных путях печеночной или гигантской фасциолы (сосальщика). Наряду с описторхозом, клонорхозом, парагонимозом, шистосомозами фасциолез относится к наиболее распространенным трематодозам человека. Фасциолез, вызываемый печеночным сосальщиком, распространен в Австралии, странах Европы и Южной Америки. Фасциолез, связанный с гигантским сосальщиком, встречается в Африке, Восточной Азии, районах Средней Азии и Закавказья. Описаны, как спорадические, так и массовые вспышки заболевания, охватывавшие сотни человек. Согласно имеющимся данным, фасциолезом поражено от 2,5 до 17 млн. населения планеты.

Причины фасциолеза
Характеристика возбудителя
Механизм передачи
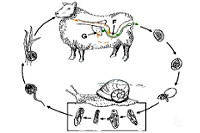
Окончательными хозяевами сосальщиков служат травоядные сельскохозяйственные животные, реже – человек. Паразитируя в желчевыводящей системе, гельминты откладывают яйца, которые с испражнениями попадают в окружающую среду и свое дальнейшее развитие проходят в пресной воде. Там вышедшие из яиц личиночные стадии (мирацидии) внедряются в тело брюхоногих моллюсков, являющихся промежуточными хозяевами возбудителя фасциолеза.
Во внутренних органах моллюсков мирацидии превращаются сначала в спороцисты, а затем в хвостатые церкарии. Через 1-2 месяца церкарии снова выходят в воду, инцистируются, превращаясь в адолескарий, и прикрепляются к поверхности водных растений или водной пленке. В этой стадии личинки становятся инвазионными, т. е способными вызывать фасциолез у животных и человека.
Заражение животных фасциолезом происходит при поедании травы на выпасе, загрязненной личинками двуустки; инфицирование человека возможно при употреблении в пищу дикорастущих или огородных растений, полив которых осуществлялся водой из пресных водоемов; питье некипяченой воды; во время купания и т. д. В желудочно-кишечном тракте личинки фасциолы высвобождаются из оболочек, через стенку кишечника выходят в брюшную полость, где через капсулу внедряются в паренхиму печени и таким образом попадают в желчные протоки. Возможен гематогенный путь миграции – через кишечные и воротную вены в печеночные протоки.
Через 3-4 месяца паразитирования в организме окончательного хозяина фасциолы достигают половозрелой стадии и начинают откладывать яйца. В гепатобилиарной системе человека возбудители фасциолеза способны паразитировать 5-10 и более лет.
Патогенез
Развивающиеся в миграционную фазу инвазии токсико-аллергические реакции связаны с сенсибилизацией организма антигенами личинок, а также механическим травмированием тканей на пути их продвижения. В хронической стадии фасциолеза патологические эффекты обусловлены паразитированием гельминтов в желчных протоках. Половозрелые гельминты вызывают повреждение печеночной паренхимы с развитием микроабсцессов и фиброзных изменений печени.
Скапливаясь в желчных ходах, фасциолы могут способствовать их обструкции и нарушению оттока желчи, развитию пролиферативного (а в случае присоединения вторичной инфекции – гнойного) холангита. Общетоксическое воздействие на организм при фасциолезе обусловлено поступлением в кровь продуктов жизнедеятельности гельминтов и распада печеночной ткани. В исходе длительного течения фасциолеза может развиваться цирроз печени и портальная гипертензия.
Симптомы фасциолеза
В развитии фасциолеза выделяют инкубационный период, острую (миграционную) и хроническую (связанную с паразитированием взрослых гельминтов) стадии. В зависимости от инвазирующей дозы, инкубационный период может длиться от 1 до 8 недель.
В миграционную фазу главным образом выражены общетоксические и аллергические симптомы. Больные фасциолезом жалуются на подъемы температуры, слабость, недомогание, головную боль. Лихорадка может быть субфебрильной или высокой (до 39-40°С), носить ремитирующий или волнообразный характер. На этом фоне появляется крапивница и кожный зуд, отек Квинке, высокая (до 80-85%) эозинофилия в крови. Развиваются диспепсические расстройства: тошнота, рвота, боли в эпигастрии и правом подреберье; происходит увеличение размеров печени, сопровождающееся желтухой. В раннем периоде часто развивается аллергический миокардит, характеризующийся загрудинными болями, артериальной гипертензией, тахикардией. Через несколько недель клинические проявления острого фасциолеза значительно или полностью стихают.
Спустя 3-6 месяцев заболевание вступает в хроническую стадию, симптомы которой обусловлены непосредственным поражением печени и желчных путей. Течение хронического фасциолеза сопровождается гепатомегалией, приступообразными болями в правом боку; в периоды обострения – желтухой. Длительная инвазия приводит к развитию диспепсического синдрома, анемии, гепатита, цирроза печени.
Вторичное инфицирование чревато возникновением гнойного холецистита и холангита, абсцессов печени, стриктуры желчных путей. В литературе описаны казуистические случаи фасциолеза с нетипичной локализацией сосальщиков в головном мозге, легких, молочных железах, евстахиевых трубах, гортани, подкожных абсцессах.
Диагностика
Чаще всего фасциолез диагностируется уже в хронической стадии, когда с беспокоящими жалобами больные обращаются к терапевту или гастроэнтерологу. Предположительный диагноз основывается на совокупности эпидемиологических данных и клинических данных. В пользу фасциолеза свидетельствует наличие ранее зафиксированных случаев инвазии на данной территории, групповая заболеваемость, употребление в пищу салатных растений, питье воды из открытых источников или использование ее для мытья посуды, фруктов, овощей и пр.
- Методы выявления возбудителя. В раннем периоде фасциолеза диагноз подтверждается серологическими методами (РИФ, ИФА, РИГА, РСК). В хронической стадии информативно обнаружение яиц фасциол в фекалиях или дуоденальном содержимом. Паразиты могут быть обнаружены с помощью ультразвукового исследования печени и желчного пузыря, КТ печени.
- Биохимия крови. В биохимических пробах печени отмечается повышение активности трансаминаз и щелочной фосфатазы, гипопротеинемия, гипоальбуминемия.
Фасциолез необходимо отличать от описторхоза, клонорхоза, вирусных гепатитов, панкреатита, холангита, холецистита другой этиологии.
Лечение фасциолеза
Лечение фасциолеза проводится стационарно. В острую фазу назначается щадящая диета, десенсибилизирующие препараты; при развитии миокардита и гепатита показаны глюкокортикостероиды. К противопаразитарной терапии переходят только после стихания острых явлений. В качестве этиотропных препаратов при фасциолезе используются триклабендазол, гексахлорпараксилол, празиквантел. С целью изгнания погибших фасциол из желчных протоков назначаются желчегонные средства.
Контрольное паразитологическое обследование (анализ кала на яйца гельминтов, дуоденальное зондирование с исследованием порций желчи) проводится спустя 3 и 6 месяцев. В случае развития гнойных осложнений требуется назначение антибиотиков и проведение хирургического вмешательства (дренирования абсцесса печени, дренирования желчных протоков и др.).
Прогноз и профилактика
Ранняя диагностика фасциолеза позволяет провести своевременную терапию и добиться выздоровления. При высокоинтенсивной инвазии или вторичной бактериальной инфекции прогноз может быть серьезным, вплоть до летального исхода. Индивидуальная профилактика фасциолеза заключается в недопущении употребления сырой воды из водоемов, плохо промытой огородной зелени. Меры общественного контроля включают очистку водоемов, их защиту от фекального загрязнения, ликвидацию промежуточных хозяев фасциолеза – моллюсков, ветеринарное обследование и дегельминтизацию скота, санитарно-просветительскую работу.

Власоглав человеческий относится к нематодам (круглым червям), вызывающим один из самых распространенных гельминтозов – трихоцефалез. Согласно статистике, этим гельминтом в мире заражено от полумиллиарда до миллиарда человек. Заболевание, вызываемое этими гельминтами, по распространенности и охвату территорий занимает 3 место среди других заболеваний паразитарной этиологии.
Власоглав человеческий относится к так называемым кишечным гельминтам , так как обитает в кишечнике человека, а именно, в слепой кишке.
Передний конец тела паразита настолько острый, что легко проходит сквозь слизистую оболочку кишечника и стенки кровеносных сосудов. Червь питается полужидким субстратом клеток слизистой и кровью.

Окраска червя варьируется от беловато-сероватых тонов до красноватых; при более внимательном рассмотрении можно заметить на его теле поперечные черточки.
Trichocephalus trichiurus – геогельминт, так как для созревания его яйцам необходимы почва и кислород. Они попадают во внешнюю среду вместе с фекалиями, выделяемыми инфицированным человеком, и при благоприятных условиях в теплое время года за несколько недель (месяц и более) вызревают в земле. Солнце для них губительно.
Если яйца попали в почву в холодное время года, т. е. при неблагоприятных условиях, например, осенью, то их развитие приостанавливается и возобновляется лишь весной. Пока процесс созревания не завершится, яйца гельминта не представляют опасности.
У этого празита нет промежуточных хозяев, его главный и единственный хозяин – человек. Яйца паразита попадают в организм человека через рот вместе с инфицированными продуктами питания и водой либо просто заносятся грязными руками.
В желудочно-кишечном тракте яйца локализуются в тонкой кишке, где из них вскоре появляются личинки, проникающие в слизистую оболочку, где их развитие продолжается. Через 7-10 дней происходит перемещение личинок в толстую кишку, где они располагаются среди ворсинок и питаются кровью.

Для достижения половозрелого возраста личинкам требуется 2-3 месяца, после чего самка начинает выделять до 60 тысяч яиц в сутки, которые вместе с фекалиями выходят наружу и, таким образом, жизненный цикл паразита начинается заново.
Количество особей в организме человека может составлять от нескольких десятков до нескольких тысяч, каждый из них потребляет ежесуточно до 0,5 мл крови, а срок жизни паразита в человеческом организме доходит до 5-6 лет.
Путь заражения фекально-оральный, т. е. заразиться можно при потреблении зараженных яйцами фруктов, ягод, овощей, не проходящих термическую обработку, а также воды из источников, колодцев и пр., не входящих в централизованную систему водоснабжения.
Еще один, наиболее частый у детей , источник заражения – грязные руки. Переносчиками яиц могут быть также мухи.
В регионах с теплым и влажным климатом опасность заражения трихиуриазом сохраняется на протяжении всего года. Массовое инфицирование людей происходит в течение 5-6 теплых месяцев.
В группе риска находятся:
- дети до 10 лет (они не уделяют необходимое внимание важности личной гигиены);
- работники ЖКХ (преимущественно те, кто связан непосредственно с городской канализацией);
- люди, работающие с почвой (садовники, огородники).
К мерам возможно профилактики относят:
- надлежащая обработка продуктов перед употреблением в пищу (мытье, термическая обработка);
- употребление только фильтрованной воды;
- тщательная гигиена;
- наблюдение ранее инфицированного, но вылеченного пациента в течение 2-х лет;
- наблюдение членов семьи и иных людей, входящих в группу риска в течение 2-х лет.
Каждый пострадавший должен помнить, что насколько бы ни была деликатна проблема, при малейших нарушениях необходимо обращаться к специалисту. При выявлении глистной инвазии, крайне важно сообщить об этом семье или людям, проживающим на одной территории с зараженным, во избежание их инфицирования.
Читайте также:

