Как убить кишечную палочку на масле
Обновлено: 18.04.2024
Пищевое отравление — вещь крайне неприятная, и чаще всего мы сталкиваемся с этой проблемой летом. Наиболее распространенные бактерии, вызывающие отравление, — это кампилобактер, сальмонелла, кишечная палочка и листерия.
Разбираемся, можно ли отравиться, если выпить парного молока в деревне, какие симптомы возникают при разных типах отравлений и как лечиться в каждом из случаев.
Причины отравлений
Пищевое отравление возникает, если съесть или выпить что-то, что заражено вредными бактериями или вирусами. Каждый 6-й человек в мире получает пищевое отравление хотя бы раз в год. К счастью, в большинстве случаев это легко текущее заболевание, которое быстро проходит благодаря отдыху и соблюдению питьевого режима. Однако некоторые случаи требуют медицинской помощи.

— Причин отравлений может быть много. Перечислю основные из них.
- Употребление в пищу продуктов с просроченным сроком годности или неправильно хранившихся. В них, особенно в молочных продуктах, начинают развиваться вредные микроорганизмы, которые и вызывают отравление.
- Прием в пищу блюд, не прошедших до конца необходимую обработку, например приготовленных из мяса или рыбы.
- Употребление грибов, растений или ягод, непригодных для еды.
- Случайное попадание в организм вместе с пищей каких-либо химических веществ.
- В первую очередь возникает беспокойство в пищеварительной системе, которое после отравления провоцирует частую диарею или рвоту; бывают случаи их одновременного появления. Стул при этом может быть с примесями слизи.
- В животе появляются болезненные ощущения (особенно в области желудка).
- Ухудшается общее состояние, повышается температура тела, появляются слабость, сонливость, пропадает аппетит.
- Если рвота и диарея частые, то может наступить обезвоживание организма. Оно выражается заострением черт лица, а также сухостью кожи. Кроме этого, могут наблюдаться судороги.

Что такое кампилобактер?
Кампилобактер — это вид бактерий, которые обитают в кишечнике животных, особенно домашней птицы, такой как курица и индейка.
Источники попадания кампилобактерий в организм:
- недоваренная домашняя птица или моллюски, употребляемые в пищу;
- питьевая вода, в которой содержатся следы кала зараженных людей или животных.
Инкубационный период для развития кампилобактериального отравления — от 2 до 5 дней .
Спустя это время появляются симптомы, которые обычно длятся от 2 до 10 дней и включают в себя:
- диарею, которая может быть кровавой;
- тошноту и рвоту;
- спазмы желудка, боль в области живота;
- головную боль;
- высокую температуру.
Лечение кампилобактериальной инфекции
Большинство людей выздоравливают сами по себе, главное — обеспечить адекватную гидратацию и поддерживать электролитный баланс. Однако в тяжелых случаях, когда болезнь долго не проходит, нужно обязательно обращаться к врачу.

— Что при отравлении можно делать самостоятельно?
- Для начала необходимо обеспечить больного постоянным питьем, для того чтобы избежать обезвоживания организма при отравлении. Это должна быть чистая, кипяченая вода комнатной температуры. Детям старше 5 лет можно давать отвары ромашки, шиповника или чай.
- Далее нужно принять сорбенты, это может быть активированный уголь, который впитывает в себя вредные вещества и выводит их из организма. Однако прием сорбентов запрещен, если наблюдается желудочное кровотечение или непроходимость кишечника.
- Также в этот период необходимо тщательно следить за питанием. В первые сутки лучше воздержаться от приема пищи. На следующий день можно давать больному сухари, каши на воде, легкие бульоны, чаи, лечебные отвары или простую воду. Такого питания лучше придерживаться несколько дней, аккуратно возвращаясь к прежнему, исключая, соответственно, продукты, способные вызвать отравление.
Следует помнить, что на время лечения отравления лучше не прибегать к тем лекарствам и продуктам, которые способны закрепить стул. Лучше, если все вредные вещества будут выходить из организма естественным путем, ведь для этого в нем и включается защитная функция в виде диареи или тошноты.

Как предотвратить кампилобактериальную инфекцию
Поскольку основным источником кампилобактерий является домашняя птица, крайне важно правильное обращение с ней.
- Убедитесь, что вы готовите домашнюю птицу при температуре не ниже 75 градусов по Цельсию.
- Вымойте посуду, которую вы используете для обработки сырого мяса, в горячей мыльной воде.
Что такое сальмонелла?
Сальмонелла — одна из самых распространенных причин пищевого отравления. Сальмонелла — это вид бактерий, которые живут в кишечнике человека и животных и могут загрязнять многие виды пищи. Свежие фрукты и овощи, яйца и все виды мяса, молоко, сливочное масло могут быть источниками сальмонеллы .
Симптомы отравления сальмонеллой обычно возникают через 12-72 часа после употребления загрязненной пищи и могут не проходить до недели .
Наиболее распространенные симптомы сальмонеллеза:
- длительная диарея с сильными режущими болями в животе и метеоризмом;
- тошнота, длительная рвота;
- отсутствие аппетита;
- головная боль, повышение температуры тела;
- озноб и общая слабость организма.

Лечение сальмонеллеза
При признаках обезвоженности врачи вводят пациентам жидкость внутривенно, также рекомендуется прием противорвотных лекарств, если тошнота не проходит.
В случаях, когда наблюдается высокая температура и сильное обезвоживание от рвоты и диареи, назначают антибиотики. Они также могут быть необходимы людям с ослабленной иммунной системой или пожилым пациентам.
В большинстве случаев симптомы сальмонеллеза не являются серьезными и проходят сами по себе. Однако сильная рвота, обезвоживание, кровавая диарея, сильная боль в животе и в целом отсутствие улучшения состояния пациента в течение продолжительного времени — все это причины обратиться за медицинской помощью.
Как предотвратить заражение сальмонеллой
Лучший способ избежать заражения сальмонеллой — не употреблять в пищу сырое мяса и яйца. Сальмонелла может находиться и на поверхности фруктов и овощей, поэтому их всегда следует тщательно мыть перед едой.

Что такое кишечная палочка?
Кишечная палочка (лат. Escherichia coli) — это тип бактерий, которые обитают в кишечнике людей и животных и помогают переваривать пищу. И хотя некоторые штаммы кишечной палочки полезны, другие могут вызывать заболевания и даже могут быть опасны для жизни .
Источники кишечной палочки — зараженная ею пища , в частности, говяжий фарш, непастеризованное молоко и сырые овощи и зелень, например шпинат. При отравлении кишечной палочкой симптомы могут проявиться уже на следующий день — и вплоть до 10 дней после употребления неблагоприятной пищи.
Наиболее распространенные симптомы острой кишечной инфекции, вызванной кишечной палочкой:
- сильная и иногда кровавая диарея;
- рвота;
- боли в животе;
- озноб, лихорадка.
Лечение кишечной инфекции, вызванной кишечной палочкой
Как правило, в данном случае лечение не требует похода к врачу.
Инфекция кишечной палочки обычно не лечится антибиотиками, поскольку антибиотики могут только усугубить симптомы. Все дело в том, что, когда бактерии E. coli быстро умирают, они выделяют большое количество токсинов и ухудшают самочувствие человека.
Вместо этого лечение заключается во вводе жидкости внутривенно, если есть симптомы обезвоживания, и устранении симптомов инфекции. На то, чтобы выздороветь, обычно требуется 5-7 дней .
В некоторых случаях кишечная палочка может вызвать опасное для жизни заболевание почек — гемолитический уремический синдром (ГУС). Общими симптомами ГУС являются редкое мочеиспускание, моча темного цвета, бледный цвет лица. В таком случае следует немедленно обратиться за медицинской помощью.
Как предотвратить заражение кишечной палочкой
Чтобы избежать заражения кишечной палочкой, всегда тщательно готовьте мясо и избегайте непастеризованного молока. Кишечная палочка также может обитать на поверхности свежих фруктов и овощей, поэтому всегда важно тщательно мыть их перед их употреблением.

Что такое листерия?
Листерии (лат. Listeria monocytogenes) — бактерии, которые живут во многих средах, включая воду, почву и экскременты животных . Наиболее распространенные каналы заражения листериями — это прием в пищу:
- загрязненных мягких сыров, таких как бри или кесо фреско;
- зараженных мясных деликатесов или хот-догов;
- непастеризованного молока;
- грязных фруктов и овощей.
После употребления пищи, зараженной листериями, симптомы могут появиться в течение недели, но в некоторых случаях они возникают и спустя месяц.
Основные симптомы заражения листериями — листериоза:
- диарея;
- озноб, лихорадка;
- головные и мышечные боли;
- тошнота, рвота.
Иногда отмечается бессимптомное течение болезни.
Лечение листериоза
Большинство случаев листериоза являются легкими и не требуют особенного лечения. Обычно люди начинают чувствовать себя лучше сами по себе уже через несколько дней . Но для беременных женщин, новорожденных детей и людей с ослабленным иммунитетом листериоз является опасным заболеванием.
Беременным с листериозом рекомендуется пройти курс лечения антибиотиками, чтобы инфекция не повлияла на ребенка. Беременные пациентки могут чувствовать такие симптомы листериоза, как усталость, лихорадка и боль в мышцах .
Как предотвратить заражение листерией
Если вы находитесь в группе риска по листериозу, вам следует избегать мягких сыров, мясных деликатесов и хот-догов, если перед подачей на стол они не подвергались такой температурной обработке, когда внутри блюда температура составляет не меньше 75 градусов.
Люди, которые не находятся в группе риска, должны соблюдать обычные меры предосторожности: тщательно готовить мясо и мыть руки при работе с продуктами.


— Что касается детских пищевых отравлений, клиника любой инфекционной болезни наступает быстрее из-за особенностей детского организма. Но ребенок не всегда может адекватно оценить свои жалобы и состояния, поэтому важен контроль со стороны родителей и своевременное обращение к врачу, особенно если есть следующие симптомы:
- жидкий стул больше 5 раз в день;
- наличие крови в стуле даже однократно;
- непрекращающаяся рвота;
- повышение температуры;
- наличие других признаков интоксикации (слабость, вялость).
Для детей обезвоживание, нарушение электролитного баланса при отравлении намного опаснее, чем для взрослых. Ребенок не всегда будет соблюдать рекомендации, поэтому в лечении крайне важно непосредственное участие родителей.
Снижение аппетита у ребенка при отравлениях — это нормально. Тактика лечения здесь — холод, голод и покой. Главное — напоить ребенка. А препараты (адсорбенты, пробиотики, антибиотики и нормальную флору) уже назначает врач.
Еще не так давно считалось, что гастрит вызывают неправильное питание, еда всухомятку, стрессы и отсутствие горячего супа на обед. Потом ученые обнаружили связь этой болезни с бактерией хеликобактер пилори — и с тех пор подход к лечению заболеваний ЖКТ кардинально изменился.
Можно ли заразиться через посуду в ресторане, вызывает ли хеликобактер рак и нужно ли избавляться от бактерии, которая живет в организме 80% белорусов, рассказал врач-гастроэнтеролог с 40-летним опытом работы Георгий Матвеевич Усов.

Георгий Усов,
врач-гастроэнтеролог высшей категории
Минского клинического консультативно-диагностического центра,
кандидат медицинских наук
— Что такое хеликобактер? Это патогенная бактерия или условно-патогенная?
— Хеликобактер пилори (Helicobacter pylori) — бактерия, которая была открыта австралийскими учеными Робином Уорреном и Барри Маршаллом. За это открытие в 2005 году они получили Нобелевскую премию.
Хеликобактер — патогенная бактерия. Наличие ее в организме человека приводит к поражению слизистой оболочки желудка и двенадцатиперстной кишки и развитию таких заболеваний, как хронический гастрит, язва желудка и двенадцатиперстной кишки, рак желудка, мальтома желудка.
Сегодня хеликобактер — самая распространенная хроническая инфекция в мире.
— Какие факторы в таком случае провоцируют развитие гастрита, язвы, рака? И могут ли эти болезни возникнуть без участия хеликобактера?
— При наличии хеликобактера у всех людей выявляется какое-либо заболевание желудка. Выявление конкретного заболевания зависит от штамма хеликобактера. Штаммы H. руlori, имеющие в своем составе определенные генотипы, предрасполагают к развитию язвенной болезни и рака желудка. И если язвой желудка и двенадцатиперстной кишки или онкологическими заболеваниями заболевают не все инфицированные люди, то гастритом — все.

Верно и то, что данные болезни могут возникать и без хеликобактер пилори.
- Кроме гастритов, связанных с хеликобактером, имеются гастриты, связанные с забросом содержимого двенадцатиперстной кишки в желудок, так называемые рефлюксные (химические) гастриты, гастриты, связанные с образованием антител к слизистой оболочке желудка (аутоиммунные гастриты).
- Причиной язв может быть прием нестероидных противовоспалительных препаратов, ацетилсалициловой кислоты, изредка нервные факторы, погрешности в еде.
- Причиной раковых заболеваний могут быть погрешности в питании, канцерогенные вещества, поступающие в пищу, курение, наследственная предрасположенность и др.
— Как передается эта бактерия человеку? Можно ли заразиться от животных? А в ресторане через посуду?
— Путь передачи хеликобактера контактно-бытовой. Бактерия передается:
- через недостаточно чистую посуду, когда люди едят из одной тарелки или пьют из одной чашки, едят пищу друг у друга;
- в семье, когда родители пробуют пищу перед тем, как дать ее ребенку, или облизывают соску малыша;
- в случае использования людьми одной зубной щетки;
- через губную помаду;
- при отсутствии мытья рук после туалета и перед едой;
- через сексуальные поцелуи.
Хеликобактер также выявлен у кошек и собак, вследствие чего существует возможность заражения человека от них. Что касается ресторана, то, если грязная посуда плохо обрабатывается, появляется высокая возможность заражения хеликобактером.
— Какой процент людей в Беларуси живет с хеликобактером? Почему этот показатель выше, чем в Западной Европе и США?
— Качественных эпидемиологических исследований по распространению хеликобактера среди населения Беларуси не проводилось. Проводились лишь относительно небольшие исследования среди населения отдельных областей и отдельных групп населения.
Считается, что распространенность хеликобактера среди белорусов составляет около 70-80%.
Среди населения РФ по ряду исследований в отдельных российских регионах распространенность составляет от 65 до 90%. Данный показатель выше, чем в Западной Европе и США, в связи с недостаточно качественным соблюдением гигиены в нашей стране.

— Какие симптомы должны заставить человека сдать анализ на хеликобактер? Какие из них неочевидные, не связанные напрямую с ЖКТ?
— Диспепсические расстройства (боли, жжение в эпигастральной области — верхних отделах живота, тошнота, плохой аппетит, тяжесть в эпигастральной области, рвота и т. д.) требуют обследования на хеликобактер.
В некоторых случаях хеликобактер может быть причиной также:
- железодефицитной анемии;
- халитоза (плохого запаха изо рта);
- крапивницы.
Однако следует помнить, что данные заболевания могут возникать и по множеству других причин.
— Какие анализы на выявление хеликобактер существуют? Какие из них самые объективные?
— Существует несколько разновидностей анализов.
- Гистологическое исследование биопсийного материала из слизистой желудка, причем следует исследовать слизистую как антрального отдела, так и тела желудка.
- Быстрый уреазный тест. Тест выполняется в момент гастроскопии. Биопсия слизистой берется из полости желудка, помещается в среду, содержащую мочевину и такой индикатор, как феноловый красный. Уреазы преобразуют мочевину в аммиак, вследствие чего повышается рН среды, и желтый цвет образца (отрицательный) меняется на красный (положительный).
- С13-уреазный дыхательный тест на немецкой аппаратуре, достоверность которого более 92%.
- Российская модификация дыхательного теста — хелик-тест, достоверность которого, по данным ряда российских авторов, составляет от 30 до 80%.
- Определение антител к хеликобактеру IgM и IgG в крови.
- Исследование антигенов хеликобактера в кале.

Самыми объективными из анализов являются гистологический тест, С13-уреазный дыхательный тест на аппаратуре немецкой фирмы FAN, исследование антигенов хеликобактера в кале и быстрый уреазный тест. Исследование крови на антитела к хеликобактер пилори приемлемо при первичном исследовании до лечения хеликобактера. В то же время для контрольного исследования оно не годится, так как антитела к хеликобактеру остаются повышенными в течение нескольких лет в крови после излечения от хеликобактера, давая ложноположительный результат.
Хелик-тест из-за низкой достоверности нигде в мире, кроме нескольких стран СНГ, не применяется.
— Что делать, если анализ положительный? Влияет ли, например, количественное значение антител в крови на степень опасности бактерии для здоровья?
— При положительном анализе на хеликобактер решается вопрос о проведении антихеликобактерной терапии. На степень опасности для здоровья количественное значение хеликобактера существенного значения не имеет, ибо высокая обсемененность хеликобактером в ряде случаев в наших исследованиях приводила к значительно меньшим изменениям слизистой оболочки, чем низкая, или существенно не отличалась. Причина — в индивидуальной резистентности (восприимчивости) организма к хеликобактеру.
При незначительных превышениях IgA желательно провести другой метод исследования хеликобактера, например С13-уреазный дыхательный тест или исследование кала на антигены хеликобактера, чтобы подтвердить или опровергнуть положительный результат.

— Всегда ли положительный анализ говорит о необходимости лечения? В каких случаях хеликобактер не лечат?
— Раньше считалось, что лечение хеликобактера следует проводить, только если имеются клинические проявления заболевания. Сейчас в связи с выявлением существенной роли хеликобактера в развитии рака желудка лечение рекомендуют проводить всем больным с хеликобактерной инфекцией.
В некоторых странах, в частности, Японии, лечение хеликобактера проводится всем больным бесплатно. При этом тем людям, которые отказываются лечиться от хеликобактера, при развитии у них рака желудка не оплачивают страховку.
У лиц с язвами желудка и двенадцатиперстной кишки санация хеликобактера приводит к уменьшению появления новых язв в три раза.
Лечение хеликобактера НЕ проводят:
- больным с аллергией и/или непереносимостью препаратов, предназначенных для лечения хеликобактера;
- тем, у кого все схемы лечения оказались неэффективными;
- отказывающимся от лечения пациентам.
На мой взгляд, больным с хроническим гастритом, у которых имеются лишь незначительные изменения слизистой оболочки желудка, от лечения можно временно воздержаться.
Лечение детей не проводят: существует большая вероятность повторного заражения из-за нахождения в детском коллективе и развития ряда побочных реакций, особенно при повторном лечении. Для детей желательно выделение отдельной посуды и соблюдение правил личной гигиены.

— Какое лечение назначается?
— Излечиться от хеликобактера полностью возможно только при назначении антибиотиков и блокаторов протоновой помпы (антисекреторных лекарственных средств — прим. ред.), усиливающих эффект антибиотиков, в ряде случаев в сочетании с препаратами висмута.
В последнее время выявлено бактерицидное действие некоторых пробиотиков в отношении хеликобактера.
Например, существует препарат, содержащий инактивированные бактерии пробиотического штамма Lactobacillus reuteri. Однако подобные препараты полностью от хеликобактера не излечивают.
— Должны ли параллельно лечиться домашние? Может ли такое быть, что у одного из членов семьи есть хеликобактер, а у остальных — нет?
— Да, лечение взрослых членов семьи при наличии у них хеликобактера должно проводиться, детям из-за указанных выше причин — нет. При этом наличие хеликобактера у всех членов одной семьи необязательно. Это зависит от индивидуальной резистентности организма к бактерии. В исследованиях и клинической практике неоднократно были случаи, когда хеликобактер не обнаруживался у отдельных членов семьи. Поэтому лечению всегда должны предшествовать анализы.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
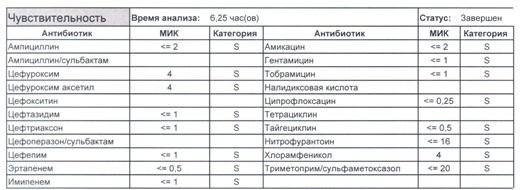
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
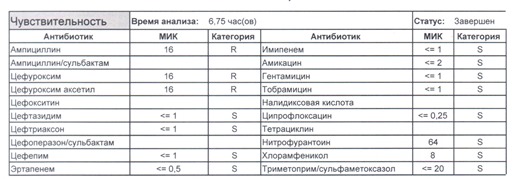
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
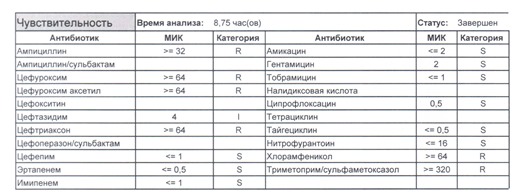
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
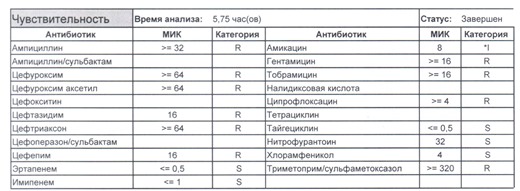
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Врага, как известно, надо знать в лицо. Просторы интернета принесли вот такое симпатичное фото нашего противника.
Данного возбудителя невозможно перепутать ни с чем, особенно, когда процесс зашел далеко. Практически все отделение будет в курсе наличия такого больного из-за непередаваемого аромата, разносящегося из его пораженных областей.
Pseudomonas aeruginosa бывает дикой, ее нам приносят пациенты из внешнего мира и нашей, госпитальной, которая живет внутри больничных отделений (чаще хирургических и реанимационных) и вызывает тот самый суеверный ужас практически у всех, обремененных медицинским образованием.
Синегнойная палочка является вольным жителем тех мест, где тепло и влажно. Она живет в прудах (дикая), в раковинах, в банках с фурацилином и другими дезенфектантами, диализных жидкостях и наркозных аппаратах в стационарах.
А потому, если в отделение что-то такое выросло, борьба с синегнойной инфекцией должна начинаться со смены сантехники (старой на новую) и линолеума вокруг раковины. С отказа от фурацилина, со сроком изготовления более суток и с просушивания трубок аппаратуры для вентиляции легких.
Больной у нас тоже теплый и, как и любой человек, на 70% состоит из воды. А еще у него множество вольных открытых пространства – мокнущие раневые поверхности, ожоговые раны, свищевые ходы, пролежни, цистостомы, трахеостомы, катетеры. То есть все те условия, которые палочка очень любит. А еще теплой и влажной поверхностью у нас является роговица глаза и если промедлить с лечением – этот самый глаз можно потерять за несколько часов.
- Гангренозную пневмонию
- Эмпиему
- Наружный отит
- Инфекции глаз (особенно после травм и хирургических вмешательств)
- Фурункулез (после горячих ванн)
- Септицемию
- Эндокардит
- Менингит
- Часто инфицирует ожоговые поверхности, свищевые ходы, изъязвленные пролежни.
Синегнойная инфекция развивается чаще всего на фоне иммуносупрессии или массированной антимикробной терапии, так как сам возбудитель природно устойчив абсолютному большинству антибактериальных препаратов, а массовая гибель конкурентов, дает ей селективное преимущество. Кстати, основными препаратами, селектирующими в отделениях Pseudomonas aeruginosa являются цефалоспорины третьего и четвертого поколений.
- на руках
- на общих полотенцах в ординаторских, процедурных и манипуляционных (многоразовых)
- на фонендоскопах
- на мобильных телефонах
- на авторучках, которые у нас торчат из карманов и т.д.
И достаточно в отделении появиться одному пациенту с этим возбудителем, а персоналу забыть о путях распространения – к вечеру все 100% пациентов будут обсеменены этим возбудителем. А дальше как повезет… пациентам…
Если инфицирование все-таки произошло, и у пациента возникла синегнойная инфекция, чем же мы будем ее лечить?
В этом списке нет цефоперазона и цефоперазона/сульбактама, о которых нам с института говорят, что они антисинегнойные. Дело в том, что единственным действительно антисинегнойным цефалоспорином является цефтазидим, а данные о якобы высокой чувствительности к цефоперазону и цефоперазону сульбактаму существуют только в России, так как нет ни одной рекомендации по использованию этих препаратов ни в США, ни на medscape.com, ни на EUCAST. Более того, эти источники не дают даже критериев определения чувствительности Pseudomonas aeruginosa к этим препаратам. И откуда взялись наши российские выводы о высокой чувствительности вообще не понятно. Более того, комбинация Цефоперазон/сульбактам существует только в 2-х странах – России и Турции. FDA в свое время очень быстро отменила его регистрацию.
Цефалоспорин третьего поколения. Препарат с явной и очень высокой антисинегнойной активностью. Первые несколько лет после появления он был самым мощным препаратом против грам(-) флоры. Однако в связи с увеличением количества как госпитальных, так и внебольничных беталактамаз расширенного спектра (БЛРС), его значение было пересмотрено и сейчас он используется в качестве индикатора для выявления БЛРС у грам(-) бактерий. Проще говоря, если кишечная палочка или клебсиелла устойчивы к цефтаздиму, то любой, сколь угодно большой диаметр зоны на чашке Петри вокруг диска с цефотаксимом или цефтриаксоном в расчет уже не принимаются.
Если антибиотикограммы еще нет, но есть пациент предлеченный цефтазидимом без эффекта, то не нужно выбирать ему препарат среди III генерации цефалоспоринов, по причине того, что использование их будет бесполезным, при этом, если пациента с грамотрицательной инфекцией лечили цефалоспоринами 2-3-й генерации, то вполне допустима терапия цефтазидимом, потому что, во-первых, он активен против синегнойки, а во вторых бета-лактамаза цефуроксимаза, рушит все цефалоспорины, но не цефтазидим.
Еще одной особенностью цефтазидима является его возможность создавать высокие концентрации в ликворе, проникая через гематоэнцефалический барьер, поэтому его используют для лечения менингитов, вызванных грамотрицательной микрофлорой, при условии чувствительности к нему возбудителей.
3. Карбопенемы обладают антисинегнойной активностью, но она слабее чем у цефтазидима и анисинегнойными они стали только из-за того, что существует Эртапенем, у которого нет никакой антисинегнойной активности. Да, применять можно, но только в комбинации с другими антисинегнойными препаратами.
4. Амикацин, как и все аминогликозиды, обладает более мощным бактерицидным действием, чем бета-лактамы и минимальным количеством аллергических реакций. Но он должен нами рассматриваться, как и другие антисинегнойные препараты, как препарат резерва и не использоваться широко в стационаре. Другие аминогликозиды прекрасно отработают Гр (-) флору и без него, нам важно сохранить чувствительность нашей, местной синегнойки к нему как можно дольше.
Дозируем амикацин, как вы помните, на килограмм массы тела и детям и взрослым и обязательно с учетом клиренса креатинина. (подробнее о дозировании смотрите обзорную статью по аминогликозидам, которая располагается по этой ссылке /vracham/Informatsiya-dlya-spetsialistov/Antibiotikoterapiya/Obzory-antibiotikov-razlichnyh-grupp/Obzory-antibiotikov-razlichnyh-grupp_411.html)
И, к сожалению, препарат, который нам скоро уничтожат коллеги из поликлинического звена, потому что назначают его направо и налево. Да и в стационарах коллеги грешат его необоснованным назначением, так как он относительно дешев и более чем доступен из-за огромного количества дженериков. Как результат, нам уже приходится использовать дозировки не 400 мг в сутки, а 800-1200 мг. И, слава богу, что механизм резистентности нам это еще позволяет. Является одним из самых безопасных антисинегнойных препаратов, а потому беречь его мы должны как самое дорогое.
Он может использоваться в стационаре в случаях не синегнойной инфекции только тогда, когда другим способом помочь пациенту невозможно.
Это препарат такого же глубокого резерва как амикацин. И может использоваться только под контролем клинического фармаколога в отличие от других фторхинолонов.
И один из самых страшных моих, и не только моих, кошмаров – это панрезистентная синегнойная палочка. Это та палочка которая устойчива абсолютно ко всем известным на данный момент антимикробным средствам и здесь мы совершенно бессильны. А потому наша основная цель состоит в том, чтобы не дать ей у нас в стационаре появиться. Для этого требуется соблюдать несложные правила асептики, а именно, мыть и обрабатывать руки после каждого пациента, менять перчатки, обрабатывать фонендоскопы и к пациентам с гнойным воспалением не заходить с мобильниками и чем либо еще, что мы можем схватить руками, сами того не замечая. Ну и никаких общих полотенец в ординаторских и сестренских.
Читайте также:

