Как увеличить количество бактероидов в кишечнике
Обновлено: 19.04.2024
Распространено мнение, что дисбактериоз связан исключительно с нарушениями работы желудочно-кишечного тракта. Если у человека частые запоры, поносы, боли в животе, повышенное газообразование, то это можно считать признаками дисбактериоза.
На самом деле, понятие дисбактериоза гораздо шире. Под дисбактериозом понимают клинико-лабораторный синдром, связанный с изменениями качественного и/или количественного состава микрофлоры кишечника, с последующим развитием метаболических и иммунологических нарушений. То есть, в первую очередь в организме человека происходят нарушения обменных процессов и сбои в работе иммунной системы, и уже потом к этому могут присоединиться нарушения работы желудочно-кишечного тракта.
Какие симптомы могут указывать на развитие дисбактериоза в организме человека:
- нарушения в работе желудочно-кишечного тракта;
- частые ОРВИ, хронические ЛОР-заболевания;
- грибковые заболевания и др.
При появлении таких симптомов рекомендуется сдать анализ на дисбактериоз.
Анализ кала на дисбактериоз
Наиболее распространенный метод обследования – обычный анализ кала на дисбактериоз. Он показывает состав микрофлоры только впросвете толстого кишечника. Оценивается соотношение полезных, условно-патогенных и патогенных микроорганизмов. Анализ проводится в течение 5-7 дней.
Как сдавать анализ. Кал нужно собрать в стерильную емкость и как можно быстрее отвезти в лабораторию (не более чем за 2-3 часа). Чем быстрее будет проведено исследование, тем достовернее будут результаты.Нельзя накануне сдачи анализа ставить ректальные свечи или клизму.
Почему анализ на дисбактериоз не всегда бывает результативным?
Но, к сожалению, анализ кала на дисбактериоз не всегда бывает информативен. Дело в том, что он показывает состав микрофлоры лишь в просвете толстого кишечника. Просветная флора – это те бактерии, которым не хватило сил найти себе место на слизистой оболочке кишечника и удержать это место за собой.
Более важный показатель – пристеночная флора. Это те бактерии, которые смогли закрепиться на слизистой оболочке. Именно они формируют биопленку кишечника. Микроорганизмы, сумевшие закрепиться на слизистых оболочках и сформировать приэпителиальные биопленки, получают огромные преимущества перед конкурентами, не сумевшими это сделать.Они намного сильнее и активнее своих менее удачливых собратьев. Поэтому от микробного состава биопленки, от того какие именно микроорганизмы будут в ней преобладать, зависит, насколько полноценными будут наша защита от инфекций, пищеварение, усвоение полезных компонентов пищи и наше здоровье в целом.
Полезные, условно-патогенные и патогенные бактерии в организме постоянноборются между собой за питание и лучшие места проживания, в том числе и в кишечнике. И более приспособленные микроорганизмы вытесняют менее приспособленных. Так, например, полезные лактобактерии и условно-патогенные бактерии клебсиеллы – это прямые антагонисты, претендующие на одни и те же места и питание в кишечнике; кто из них победит – зависит от множества условий. А от результатов их схватки зависит, насколько успешно будет работать наш организм, например, будут ли у нас воспалительные заболевания кишечника, мочевого пузыря, аллергия и многое другое.
Но оценить состояние пристеночнойфлоры и определить начальную стадию дисбактериоза с помощью обычногоанализа кала на дисбактериоз часто бывает просто невозможно.
Другие методы обследования
Существует другой, менее распространенный, но более точный и быстрый метод микробиологического обследования – хромато-масс-спектрометрия микробных маркеров (ХМС, или как еще его называют МСММ). Он разработан доктором биологических наук Г.А. Осиповым и используется в некоторых лабораториях.
Этот метод позволяет исследовать микробиологический состав разного биологического материала – крови, мочи, слюны, отделяемого влагалища и др. Анализ проводится в течение 3 часов и позволяет определить наличие 50 микроорганизмов в исследуемом материале без посева, по так называемым сигнальным молекулам (микробным маркерам).
Лечение дисбактериоза
Если в организме выявлены недостаток бифидо- и лактобактерий и превышение числа условно-патогенных либо появление патогенных микроорганизмов, то это говорит о том, что необходимо восстановление нормальной микрофлоры. Для лечения дисбактериоза используются пробиотики. Полноевосстановление собственноймикрофлоры организма, не только по составу, но и по активности, возможно только с помощью препаратов, содержащих бифидо- и лактобактерии наиболее физиологичных (характерных) для человека видов. Полезные бактерии занимают свое место в кишечнике и изменяют состояние его среды, постепенно вытесняя представителей патогенной и условно-патогенной флоры.
Что важно учитывать при выборе пробиотиков:
1. Пробиотики должны содержать штаммы тех бактерий, которые характерны для человеческого организма. Из бифидобактерий в кишечнике человека в первую очередь представлены бактерии B . bifidum и B . longum . Следовательно, они должны составлять основу препарата.
2. Чтобы пробиотик эффективно действовал, титр бактерий в препарате должен быть не менее 10 10 степени (основная масса пробиотическихпрепаратов имеет титр бактерий 10 7 ).
3. Жидкие пробиотики обладают большей эффективностью, чем сухие. Они начинают действовать, как только попадают в организм человека (в сухих препаратах бактерии находятся в состоянии анабиоза, из которого выходят только через 5-8 часов после приема; поэтому по-настоящему они начинают действовать почти через сутки, когда окрепнут и достаточно размножатся). Кроме того, толькожидкие пробиотики (и то не все) имеют способность адгезироваться (прикрепляться к стенкам кишечника), формируя биопленку.
Жидкий пробиотик Бифидум БАГ– эффективный препарат для лечения дисбактериоза. В его состав входят активные штаммы бифидобактерий видовB. bifidum (4 штамма) и B. longum (2 штамма). Титр бактерий - 10 11 . Разрешен к применению с первых дней жизни.
В комплексе с этим пробиотиком рекомендуется прием препарата Трилакт,в состав которого входят активные штаммы лактобактерий L. acidophilus, L. casei и L. plantarum. Титр бактерий - 10 10 . Препарат разрешен с 1 года (ранее – по показаниям врачей).
Экофлор содержит бифидо- и лактобактерии, их метаболиты, а также ультраселективныйэнтеросорбент. Кроме эффективной очистки организма от токсинов, аллергенов, шлаков и условно-патогенной микрофлоры э нтеросорбент обеспечивает защиту закрепленных на нем пробиотических бактериальных штаммов и повышает эффективность их воздействия на организм. Рекомендован с 3 лет.
Бифидум БАГ, Трилакт и Экофлор быстро восстанавливают микрофлору кишечника и избавляют от дисбактериоза.
Кишечная микробиота и нарушение обмена веществ

Микробиота кишечника: ключевой регулятор метаболических заболеваний
Резюме
Распространенность ожирения и диабета 2 типа, двух тесно связанных метаболических нарушений, растет во всем мире. За последнее десятилетие связь между этими расстройствами и микробиотой кишечника стала основным направлением биомедицинских исследований, при этом недавние исследования продемонстрировали фундаментальную роль кишечной микробиоты в регуляции и патогенезе метаболических нарушений. Однако из-за сложности сообщества микробиоты основные молекулярные механизмы, с помощью которых микробиота кишечника связана с метаболическими нарушениями, остаются плохо изученными. В этом обзоре мы обобщаем недавние исследования, в которых изучается роль микробиоты как у людей, так и у животных моделей болезней, и обсуждаем соответствующие терапевтические цели для будущих исследований. [Отчеты BMB 2016; 49 (10): 536-541]
Микробиота слизистой оболочки кишечника
Кишечник человека населен до 100 триллионов (1014) клеток, включая бактерии, грибы, вирусы и другие виды микробов и эукариот (1, 2). Эти сложные, очень разнообразные сообщества обеспечивают огромную ферментативную способность и, таким образом, играют фундаментальную роль в управлении физиологией хозяина (3, 4). Хорошо известно, что пять бактериальных типов, Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria и Verrucomicrobia, являются доминирующими компонентами микробиоты кишечника человека (5). Более 90% бактериальных популяций являются грамотрицательными анаэробами. Бактериальные популяции включают преобладающие роды Bacteroides, Eubacterium, Bifidobacterium и Fusobacterium (6). Кроме того, микробиота кишечника необходима для ферментации углеводов и усвоения питательных веществ (1), защиты от патогенных бактерий (7) и регуляции метаболических нарушений (8).
Кишечник хозяина уникален тем, что он постоянно подвергается воздействию множества антигенов из ежедневного приема пищи и экзогенных бактерий. Резидентная микробиота кишечника содержит ряд компонентов, способных активировать ответы как врожденного, так и адаптивного иммунитета (3, 9). Например, большинство кишечных бактерий являются грамотрицательными анаэробами, снабженными разнообразными агентами, такими как липополисахариды ( ЛПС ) и жгутики, что позволяет передавать врожденную сигнализацию кишечным эпителиальным клеткам через toll-подобные рецепторы ( TLR ) (10). Сегментированные нитчатые бактерии ( SFB ), внедренные в подвздошную кишку, также могут стимулировать адаптивные ответы Т-хелперов 17 ( TH17 ) и индуцировать выработку антител к иммуноглобулину A ( IgA ) слизистой оболочки (11). Кроме того, бутират, полученный из комменсальных микробов, связан с дифференцировкой регуляторных T (Treg)-клеток в толстой кишке (12).
Микробиота кишечника и нарушения обмена веществ
По данным Всемирной организации здравоохранения, в 2014 году более 1,9 миллиарда взрослых имели избыточный вес, причем более 600 миллионов из них были классифицированы как страдающие ожирением. Ожирение является результатом энергетического дисбаланса и связано с другими метаболическими осложнениями, такими как диабет 2 типа. Впервые о взаимосвязи между микробиотой кишечника и метаболическими заболеваниями сообщила Лаборатория Джеффри Гордона (laboratory of Jeffrey Gordon) в Вашингтонском университете. В частности, Лаборатория Гордона продемонстрировала, что лептиндефицитные мыши, отличающиеся чрезмерным аппетитом и глубоким ожирением, содержали меньше Bacteroidetes и больше Firmicutes , чем контрольные мыши (13). Это исследование предоставило первое прямое доказательство различий в микробных сообществах худых и тучных животных. В подтверждение этого вывода последующее исследование, проведенное Лабораторией Гордона, выявило меньшее количество Bacteroidetes и больше Firmicutes у людей с ожирением, чем у худых людей (14). Кроме того, доля бактероидов увеличивалась при ограничении жиров или углеводов и последующей потере веса. У людей, похудевших после процедуры обходного желудочного анастомоза (т.е. потерявших вес после процедуры желудочного шунтирования), повышенный уровень Bacteroides и Prevotella отрицательно коррелировал с потреблением энергии и ожирением (15). Однако другие исследования не наблюдали сдвига в соотношении Firmicutes и Bacteroidetes у людей с потерей веса (16-18). Таким образом, хотя возможно, что определенные виды микробов в кишечнике человека способствуют увеличению веса, а другие - снижению веса, также возможно, что любые наблюдаемые изменения в микробиоте кишечника являются результатом изменения веса.
Чтобы решить эту проблему, с тех пор были приняты эксперименты по трансплантации микробиоты. Первоначальное исследование, проведенное Gordon et al., показало, что конвенционализация мышей без микробов с нормальной микробиотой приводила к увеличению содержания жира в организме и резистентности к инсулину в течение 14 дней, несмотря на снижение потребления пищи (19). Это исследование предоставило первое механистическое доказательство того, что кишечные микробы могут увеличить способность хозяина накапливать жировые отложения. Кроме того, у мышей без микробов, получавших кишечные микробы от тучного донора-близнеца, наблюдалось увеличение общей массы тела и жира, а также метаболических фенотипов, связанных с ожирением, по сравнению с теми, кто получал микробиоту худого близнеца (20). Интересно, что микробиота кишечника худой мыши могла вторгаться в микробиоту тучной мыши и обеспечивать защиту от увеличения веса, но это влияние зависело от диеты. Другие исследования показали, что безмикробные мыши, которым пересажена микробиота, связанная с ожирением, набирали вес, но не до чрезмерного ожирения (21). Таким образом, необходимо учитывать роль диеты и других факторов.
Диета изменяет микробиоту кишечника
Диета является одним из основных факторов ожирения, а также помогает формировать микробиоту кишечника. Исследования на людях за последнее десятилетие показали, что кишечная микробиота быстро реагирует на большие изменения в рационе; во многих случаях состав и функции кишечной микробиоты меняются в течение 1-2 дней (22, 23). Несмотря на такую стремительную динамику, долгосрочные диетические привычки по-прежнему играют решающую роль в определении состава кишечника человека (24), а эффективность конкретной диеты в значительной степени зависит от исходного состава кишечной микробиоты (25).
Обширные исследования показали, что кишечная микробиота традиционного сельского населения (т. е. высоковолокнистая, низкожировая диета) более разнообразна и содержит различные таксоны, чем микробиота западных популяций (т. е. низковолокнистая, высокожировая диета) (26). Сохранение микробного разнообразия с помощью диеты с высоким содержанием клетчатки и низким содержанием жиров позволяет людям максимизировать потребление энергии из клетчатки, а также защищает их от воспаления и неинфекционных заболеваний толстой кишки. Хотя неясно, способствует ли увеличение микробного разнообразия защите от метаболических заболеваний, несколько метагеномных исследований показывают, что улучшение исходов при метаболических заболеваниях связано с увеличением микробного разнообразия (27, 28). Например, группа исследователей секвенировала микробиомы 169 человек с ожирением и 123 человека без ожирения и обнаружила, что люди делятся на две группы: группа с низким уровнем разнообразия микробных генов и группа с высоким разнообразием (27). Люди с меньшим количеством генов, как правило, имели более выраженное ожирение, инсулинорезистентность и дислипидемию, чем люди, содержащие более разнообразную микробиоту кишечника. Кроме того, люди с ожирением и меньшим бактериальным разнообразием со временем прибавляли в весе больше. Эти данные предполагают, что манипулирование разнообразием микробов в кишечнике может быть многообещающим средством улучшения метаболических нарушений.
Регулирования микробных метаболитов
Кишечная микробиота производит большое количество метаболитов. Например, микробиота вносит свой вклад в метаболическую эффективность хозяина, увеличивая доступность энергии за счет производства короткоцепочечных жирных кислот ( SCFAs ), таких как ацетат, бутират и пропионат (29). Предыдущие исследования показали, что уровни SCFA были повышены у тучных людей и животных моделей, что согласуется с тем фактом, что SCFAs обеспечивают дополнительные калории для хозяина (8, 16). Совсем недавно исследователи заметили, что усиленная выработка ацетата увеличивает вероятность ожирения, вызывая секрецию грелина, гормона, вызывающего аппетит (30). Напротив, другие исследования показали, что SCFAs непосредственно способствуют защите хозяина от метаболических заболеваний. Например, SCFAs являются важным источником энергии для эпителиальных клеток кишечника за счет активации рецепторов, связанных с G-белком , таких как GPR41 и GPR43 , которые влияют на энтероэндокринную регуляцию (31, 32). Бутират действует как основной источник энергии для колоноцитов (33), а пропионат может индуцировать кишечный глюконеогенез, таким образом защищая хозяина от вызванного диетой ожирения через нервную ось кишечник-мозг (34). Интересно, что потребление сложной диеты привело к повышению уровня SCFAs и увеличению разнообразия кишечной микробиоты (26). Снижение потребления углеводов с пищей для людей с ожирением, однако, привело к снижению уровня бутирата в их кале и коррелировало с уменьшением количества бактерий, продуцирующих бутират (например, Roseburia spp. и Eubacterium rectale) (17). Кроме того, уровень пропионата определенно коррелирует с количеством Bacteroidetes в кишечнике (35).
В дополнение к продукции SCFAs, микробиота формирует желчные кислоты от холестерина хозяина. Желчные кислоты - это семейство стероидных кислот, синтезируемых из холестерина в печени и главным образом секретируемых в просвет кишечника для контроля переваривания и всасывания пищевых жиров и жирорастворимых витаминов (36). Комменсальная микробиота играет ключевую роль в преобразовании первичных желчных кислот в нижней части тонкого кишечника и толстой кишки для получения вторичных желчных кислот (37, 38). Хотя стало ясно, что желчные кислоты действуют как сигнальные молекулы для метаболических путей, фундаментальные вопросы остаются относительно того, может ли дополнительное введение специфических комменсальных бактерий регулировать метаболизм желчных кислот и потенциальную роль этих измененных желчных кислот в метаболических заболеваниях, таких как ожирение и диабет 2 типа (39, 40). Недавнее исследование продемонстрировало, что профили желчных кислот в кишечнике и сыворотке контрольных мышей довольно сильно отличаются от таковых у мышей, свободных от микробов (41), в то время как другое исследование на животных показало, что желчные кислоты, конъюгированные с таурином, преобладали в безмикробных и обработанных антибиотиками группах мышей (42). Кроме того, введение пробиотиков изменяло состав микробиоты кишечника и усиливало деконъюгацию желчных кислот и экскрецию с калом (43). Примечательно, что увеличение количества про биотических бактерий было связано с индукцией синтеза желчных кислот в печени через фарнезоидный X-рецептор ( FXR ) (43). Микробиота кишечника также регулирует G-белок -связанный рецептор желчных кислот 1 (известный как TGR5 ) (44). Наша группа обнаружила повышенный уровень желчных кислот в фекальной ткани, а также TGR5 в жировой ткани мышей, которых кормили B. acidifaciens (45). Дополнительные исследования показали, что сигнальные пути желчная кислота - TGR5 - цАМФ увеличивают расход энергии в жировой ткани (46, 47). В целом, специфическая комменсальная микробиота может регулировать метаболические действия хозяина посредством модуляции синтеза или реабсорбции желчных кислот и взаимодействия с рецепторами, такими как FXR и TGR5.

Рис. 1. Взаимодействие между микробиотой кишечника и метаболизмом хозяина. На микробиоту кишечника может влиять целый ряд внешних факторов, в том числе состояние хозяина, тип диеты и медикаментозное лечение. Дисбаланс кишечной микробиоты может привести к серьезным метаболическим нарушениям (например, ожирению), изменяя чувствительность хозяина к инсулину или энергетический гомеостаз.
Микробная регуляция воспаления
Несколько линий доказательств указывают на роль кишечной микробиоты в индукции системного воспаления и воспаления жировой ткани (49, 50). Например, кишечная микробиота производит значительное количество факторов, вызывающих воспаление, включая ЛПС и пептидогликан . Кроме того, моноколонизация кишечной палочки мышам без микробов способствовала накоплению макрофагов в белых жировых тканях и поляризовала макрофаги в сторону воспаления, предполагая, что эндотоксины кишечной микробиоты, такие как ЛПС, играют определенную роль в регуляции ожирения (10). Кроме того, пищевая микробиота усиливала С-С-мотив хемокинового лиганда 2 ( CCL2 )-зависимую инфильтрацию макрофагов в белых жировых тканях через сигнализацию TLR. (51). На моделях мышей ожирение связано с увеличением количества эффекторных Т-клеток и уменьшением количества регуляторных Treg-клеток (52, 53). Поскольку многие исследования продемонстрировали, что микробиота-генерированные SCFAs способствуют противовоспалительному ответу в слизистой оболочке и системных тканях через Treg-клетки (12, 54, 55), есть соблазн предположить, что микробиота кишечника может контролировать ожирение посредством генерации Treg-клеток.
Симбионты при метаболических заболеваниях
Существует несколько стратегий борьбы с метаболическими заболеваниями с помощью одного вида кишечной микробиоты (таблица 1). Одна из таких стратегий - потребление полезных бактерий в виде пребиотиков или пробиотиков. Например, Akkermansia muciniphila , известная как бактерия, разлагающая муцин (56), может вводиться для снижения вероятности ожирения и диабета. Этот микроб обычно составляет 3-5% микробного сообщества кишечника человека и более распространен у здоровых людей, чем у пациентов с ожирением / диабетом или животных (57-59). В одном исследовании лечение мышей, получавших высоко-жировую диету (HFD), метформином, широко назначаемым терапевтическим агентом для лечения диабета 2 типа, улучшило гликемический профиль и привело к более высокому содержанию A. muciniphila (60). Более того, пероральное введение A. muciniphila мышам, получавшим HFD, без лечения метформином приводило к противодиабетическим эффектам. Интересно, что воздействие холода привело к значительным изменениям в составе кишечной микробиоты, а восстановление подавленной холодом A. muciniphila снизило потребление калорий (61).
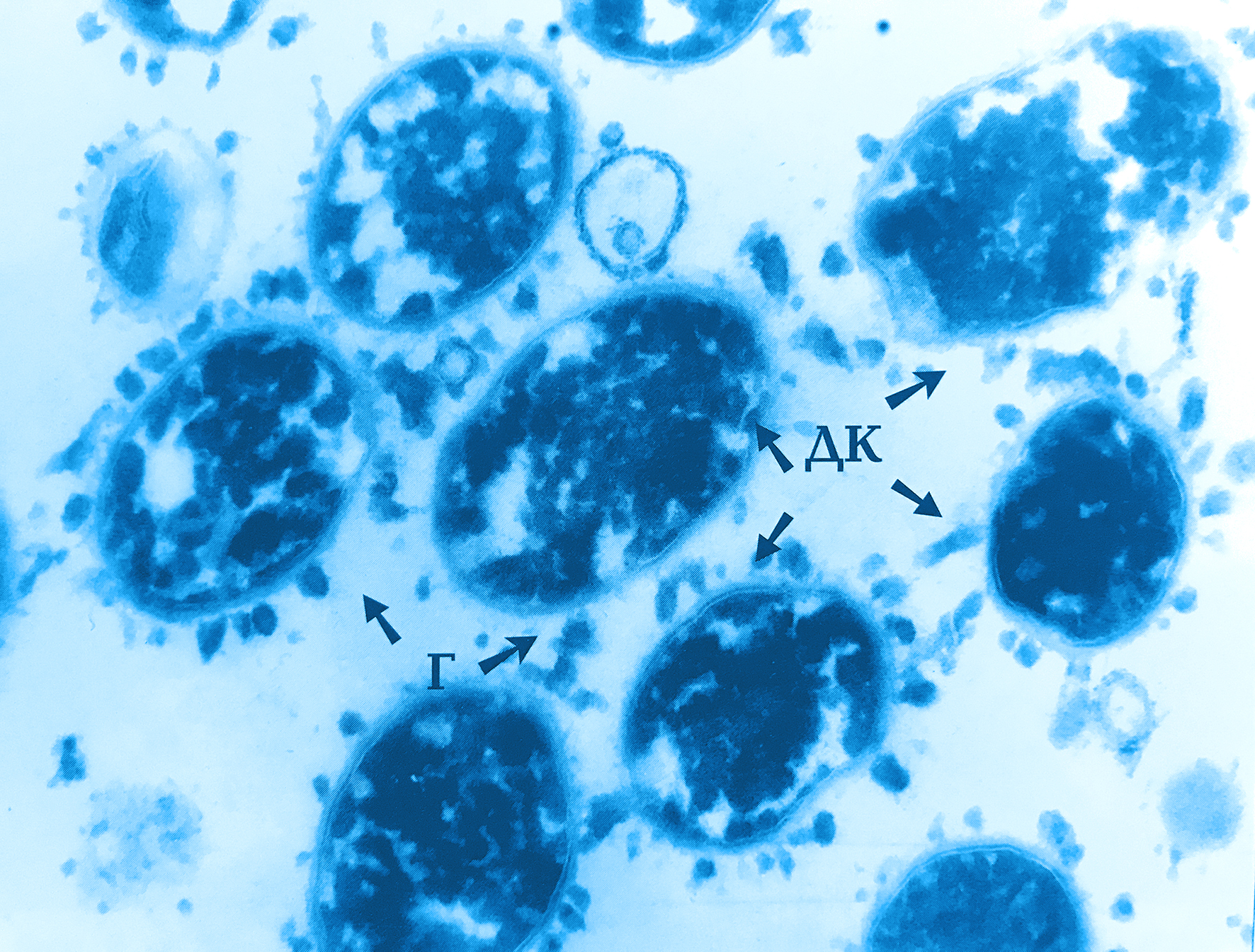
Бактероиды (Bacteroides) были впервые обнаружены в 1898 году учеными Вейоном и Зюбером (A. Veillon, H. Zuber). Микроорганизмы выделены у больного с абдоминальным абсцессом и получили название Bacillus fragilis. Спустя 14 лет Дистазо (A. Distaso) обнаружил их у здоровых людей, а через семь лет Кастеллани (A. Castellani) и Чалмерс (A. J. Chalmers) дали этим палочкам название Бактероиды.
Внешний вид под микроскопом
Бактероиды при микроскопии могут иметь разную форму. Преимущественно это небольшие палочки, не окрашивающиеся по Граму. У отдельных видов эти палочки не обособляются при размножении, в результате чего получаются скопления бактерий, напоминающие ветви. Иногда у бактероидов имеются в одном из концов утолщенные вакуоли, за счет чего клетка приобретает форму кеглей или булавы. Поэтому их легко спутать с коринебактериями или спорообразующими бактериями. Бактероиды имеют жгутики и способны к образованию капсулы, позволяющей переждать неблагоприятные для жизни условия.
Где обитает
В норме представители Bacteroides у человека колонизируют толстую кишку и являются типичными представителями нормофлоры, наряду с лакто- и бифидобактериями. В фекалиях здорового человека около 40-50% всех микробных клеток составляют бактероиды.
Классификация
Царство
Bacteria
Тип
Bacteroidetes
Класс
Bacteroidia
Порядок
Bacteroidales
Семейство
Bacteroidaceae
Род
Bacteroides
Prevotella
Свойства
Бактероиды способны утилизировать сахарозу, мальтозу, глюкозу, рамнозу. Продуцируют янтарную, изовалериановую, уксусную и масляную кислоту. Вырабатывают вещества, способные инактивировать антибиотики пенициллового и цефалоспоринового ряда. Для роста необходим углекислый газ в концентрации 5-10% и температурный диапазон от +25 до +45°С. Оптимальная температура +37°С.
Функции
Биологическая роль бактероидов в толстом кишечнике изучена недостаточно. Однако доказана их антагонистическая активность по отношению к сальмонеллам, шигеллам и некоторым патологическим эшерихиям. Можно предположить, что, колонизируя толстый кишечник, представители Bacteroides защищают своего хозяина от инфекционных энтероколитов, вызванных патогенными микроорганизмами.
Вызываемые заболевания
В условиях нарушения иммунитета бактероиды проявляют свою патогенную активность. Они не вырабатывают эндотоксичные вещества, но, поскольку имеют полисахаридную капсулу, могут спровоцировать выработку антител в организме хозяина. В ассоциации с другими патогенными и условно-патогенными бактериями, Bacteroides способны вызывать перитонит, кольпит, пневмонию, пародонтоз, абсцессы, аппендицит, эндокардиты, заболевания слизистых оболочек и кожи.
Профилактика и лечение
Для подавления роста и размножения бактероидов используются антибиотики, в частности, ципрофлоксацин, офлоксацин, метронидазол, клиндамицин, левомицитин. Общеукрепляющие процедуры и элементарная гигиена, защита от стрессов и нормализация пищевого поведения (отказ от голодания и переедания), а также сбалансированный рацион питания способствуют защите от чрезмерного размножения бактероидов.

Faecalibacterium prausnitzii представляют собой разновидность анаэробных бактерий грамположительного типа, которые в норме могут составлять не более 5% от количества бактерий, присутствующих в организме человека в области толстого кишечника. Они населяют исключительно человеческий организм – других мест расположения бактерий этого типа в настоящее время не выявлено.
Faecalibacterium prausnitzii можно назвать одной из главных причин образования в толстой кишке бутиратов (масляной кислоты). Она выполняет заметную роль в протекании физиологических процессов в организме, для эпителиоцитов становится главным энергетическим сырьем, обеспечивает поддержку кишечному гомеостазу. С ее помощью развитие клеток протекает в соответствии норме, удается предотвратить различные болезни кишечника. Также Faecalibacterium prausnitzii принимают участие в расщеплении в организме целлюлозы.
Бактерии Faecalibacterium prausnitzii – доминантный вид
Согласно современным представлениям, бактерии вида Faecalibacterium prausnitzii по количеству способны превосходить любой другой вид из тех, что можно обнаружить в толстой кишке человека. Но следует иметь в виду, что с течением возраста носителя численность бактерий этого вида постепенно уменьшается.
Что представляет собой вид Faecalibacterium prausnitzii в систематике бактерий
Согласно подготовленной в результате исследований систематике вид бактерий Faecalibacterium prausnitzii относят к роду Faecalibacterium, семейство Ruminococcaceae. Причисляют к царству Бактерий.
Как меняется число Faecalibacterium prausnitzii при различных болезнях
После проведения разнообразных исследований, в процессе которых производилось выяснение поведения данной бактерии в человеческом организме, удалось установить:
- При низком уровне Faecalibacterium prausnitzii в организме это может быть свидетельством болезни Крона.
- При раке прямой кишки количество данной бактерии в толстой кишке также может быть понижено.
- При полипозах толстой кишки содержание Faecalibacterium prausnitzii в каловых массах выше нормы.
Выполнение метагеномного анализа образцов кала пациентов, больных атопическим дерматитом, демонстрирует уменьшение количества бактерий, тогда как у пациентов контрольной группы оно осталось почти неизмененным. У больных дерматитом отмечалось и уменьшение скорости образования кишечной микрофлорой жирных короткоцепочечных кислот. Была обнаружена связь между уменьшением количества бактерий и проблемами с барьером эпителия, из-за чего воспаления могли возникать вторично. Из-за проблем с кишечным барьером при обнаруженном дисбиозе могут начаться проникновения антигенов, токсинов различных микробов непосредственно в кровоток. Они вступают во взаимодействия с тканями, провоцируя или увеличивая реакцию иммунной системы, которая способны привести к еще большему поражению тканей.
Для людей, которые страдают диабетом второго типа или ожирением, характерны серьезные перемены в составе кишечной микрофлоры. В частности, значительно снижается количество видов, за счет которых активно вырабатывается вещество бутират. По некоторым данным, он оказывает на организм противодиабетическое влияние.
От питания человека во многом зависит состояние микрофлоры кишечника. Одни продукты содержат полезные бактерии, другие – способствуют росту этих бактерий, третьи – помогают бороться с условно-патогенной флорой.
Польза кисломолочных продуктов
Как известно, один из основных источников полезных бактерий для человека – кисломолочные продукты. В магазинах выбор кисломолочных продуктов сейчас достаточно широк, причем некоторые из них дополнительно обогащаются бифидо- и лактобактериями. Можно ли, включая ежедневно в свой рацион кефир или йогурт, не беспокоиться о микрофлоре кишечника? К сожалению, нет.
Во-первых, многие кисломолочные продукты имеют достаточно длительный срок хранения, который достигается благодаря стерилизации и ультрапастеризации продукта. В результате таких процессов гибнут не только вредные, но и полезные бактерии, что значительно снижает ценность продукта.
Во-вторых, при производстве кисломолочных продуктов часто используются не те виды бактерий, которые нужны нашему организму, а те, с которыми удобнее работать производителю. Так, например, в производстве йогуртов активно используются закваски, содержащие Bifidobacteriumanimals, которые в организме человека находятся в небольшом количестве и не очень для него характерны.
Если вы хотите употреблять в пищу кисломолочные продукты, которые действительно содержат полезные бифидо- и лактобактерии, то покупайте кефиры и йогурты с небольшим сроком годности (не более 5-7 дней). Другой вариант – готовить кисломолочные продукты дома самостоятельно на основе молока и сухих заквасок.
Квашеные продукты
Во времена наших предков значительную долю питания составляли квашеные продукты. На зиму в большом количестве заготавливали квашеную капусту, солили в бочках огурцы, помидоры. И это неслучайно – квашеные продукты (и особенно квашеная капуста) несут большую пользу для нашего организма.
Квашение – это способ приготовления, в основе которого лежит молочнокислое брожение. Квашеные продукты содержат молочнокислые бактерии, которые помогают поддерживать микрофлору кишечника. При этом в сквашиваемом продукте накапливается молочная кислота, которая выделяется участвующими в процессе молочнокислыми бактериями и является естественным консервантом.
Главное – готовить такие продукты методом естественного брожения, без добавления уксуса и сахара.
Растительная пища
Недостаточно просто получать с пищей бифидо- и лактобактерии, нужно, чтобы в кишечнике поддерживались хорошие условия для их существования, чтобы полезные бактерии тоже получали питание. Для этого необходимо, чтобы ежедневно с пищей человек получал достаточное количество пищевых волокон, которые содержатся в злаках, овощах, фруктах, бобовых.
Если в рационе преобладает растительная пища, то в кишечнике активно растут бифидо- и лактобактерии. Когда в рационе преобладает белковая пища, в кишечнике размножаются бактероиды, эшерихии, клостридии, протей.
Ягоды, травы, овощи, фрукты
Наши предки активно использовали в пищу ягоды, лук, чеснок, хрен, зелень. С одной стороны, все это было несложно собирать в лесу или выращивать на огороде, а, с другой стороны, это представляло большую ценность для организма. Многие ягоды и травы содержат массу полезных витаминов и минералов, а, кроме того, помогают организму бороться с условно-патогенной флорой.
Овощи и травы, угнетающие рост условно-патогенной микрофлоры
Фрукты и ягоды, угнетающие рост условно-патогенной микрофлоры
Антибиотики и гормоны роста в продуктах
Однако даже если современный человек придерживается правильного питания, это не означает, что в его организме не будет нарушений микрофлоры. Продукты, которые мы употребляем каждый день, - молоко, мясо, яйца - в небольшом количестве содержат антибиотики и гормоны роста, которые используются при выращивании животных. Эти вещества со временем накапливаются в организме человека, отравляют его. Даже в небольшом количестве антибиотикиприводят к гибели полезных бактерий в организме человека.
Что делать?
Если в вашем организме, несмотря на правильное питание, наблюдается дисбиоз кишечника, то вам необходимы пробиотики. Они содержат значительно больше полезных бактерий, чем кисломолочные продукты.
Читайте также:

