Как выглядят таблетки от вич фото
Обновлено: 24.04.2024
С самого зарождения эпидемии ВИЧ медицинское научное сообщество было занято поиском эффективного способа предотвращения передачи ВИЧ-инфекции.
Кроме использования средств барьерной контрацепции (презервативов) существуют и иные способы обезопасить себя от ВИЧ-инфекции. Самый главный из них — PrEP, или так называемая доконтактная профилактика (ДКП).
Препараты PrEP — это те же вещества, которыми лечат ВИЧ, но принимаются они по усеченной, неполной схеме. Механизм действия ДКП прост: если лекарство успело попасть в организм заранее, то при попадании в него вируса оно способно убить ВИЧ еще до того, как тот успеет закрепиться в нем.
Защита, которую предлагает PrEP, достаточно надежна и приближается к 100 %, если принимать таблетки правильно.
Что это за таблетки?
Сразу стоит дать названия, существуют две схемы ДКП, которые рекомендованы для использования:
(в одной таблетке — тогда они называются Трувада, либо по отдельности);
Почему именно эти препараты? Для того чтобы ответить на вопрос, можно или нет использовать конкретное лекарство для ДКП, надо провести клиническое исследование. Без клинических исследований подтвердить такой тезис невозможно. Поэтому придерживаться стоит тех схем, которые уже были испытаны и утверждены в качестве PrEP.
Именно поэтому, когда мы говорим о доконтактной профилактике, как правило, речь идет о двух препаратах, как это уже было сказано: тенофовире и эмтрицитабине. Если вы обратитесь в аптеку, то их комбинация в одной таблетке будет стоить порядка 14 000 рублей. Однако допустимо применение и других апробированных для ДКП лекарств. Например, тенофовира и ламивудина. Эта схема также одобрена Всемирной организацией здравоохранения (ВОЗ), они, купленные по отдельности, будут стоить не 14 000, а порядка 1000 рублей.
Какой схемой воспользоваться — решать вам. В целом ДКП сейчас доступна в разных формах для пациентов с разным достатком, и самые дешевые ее схемы могут стоить не более двух тысяч рублей в месяц.
А можно подробнее про механизм действия?
Можно. Итак, доконтактная профилактика заключается в приеме двух препаратов, относящихся к классу ингибиторов обратной транскриптазы, ВИЧ-отрицательными людьми. То есть людьми, в чьем организме вируса пока еще нет.
Что делают эти препараты? На картинке ниже вы можете увидеть жизненный цикл вируса иммунодефицита, как он прикрепляется к клетке и вбрасывает внутрь нее свой генетический материал.
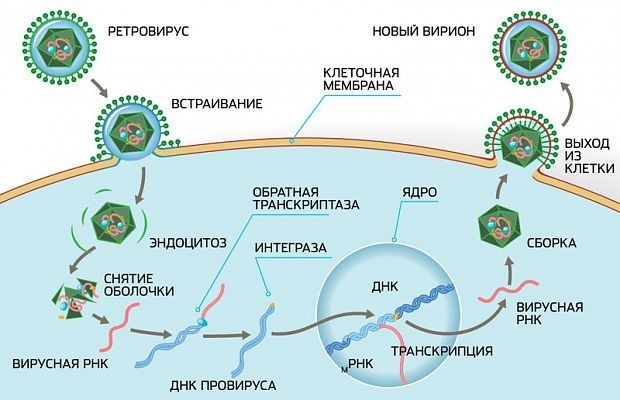
Этот генетический материал под воздействием особого фермента — обратной транскриптазы — запускает процесс репликации новых вирусов.
Два исследования — iPrEx и Partners (оба они проводились в США и Западной Европе) — продемонстрировали крайне высокую эффективность защиты PrEP, в отдельных случаях приближающуюся к 99 %.
В обоих лекарство тенофовир + эмтрицитабин, известное как Трувада, тестировалось на людях, относящихся к ключевым, то есть наиболее уязвимым для эпидемии, группам, — на мужчинах, практикующих секс с мужчинами, и трансгендерных женщинах (mtf). И именно у них этот метод профилактики показал свою наибольшую эффективность.
(Противо)показания к началу ДКП
В настоящее время в России ДКП одобрена Министерством здравоохранения в качестве дополнительного метода профилактики ВИЧ-инфекции и даже попала в клинические рекомендации, так что врач, пусть пока и не имеет возможности выдавать ее бесплатно, как выдаются препараты АРВТ, все же может легально рассказать своим пациентам, где можно приобрести необходимые таблетки, что для этого нужно сделать и как их принимать.
Главным противопоказанием к началу ДКП, конечно, является наличие у пациента ВИЧ-инфекции или симптомов, указывающих на так называемую острую фазу ВИЧ, которая имеет место примерно через две недели после проникновения вируса в организм.
Побочные эффекты
Безопасна ли ДКП? Да. Она безопасна. Оба режима одинаково эффективны. Всего в настоящий момент мы знаем лишь о семи случаях получения вируса на PrEP. А учитывая, что во всем мире примерно полмиллиона человек принимают доконтактную профилактику, семь случаев — это весьма немного.
Два из них были связаны с низкой приверженностью (пропуском приема профилактического препарата), два — с наличием резистентного к эмтрицитабину штамма ВИЧ. Два человека были инфицированы еще до начала доконтактной профилактики. Буквально недавно мировые СМИ сообщили о еще одном случае инфицирования ВИЧ на доконтактной профилактике. На этот раз вирус получил активист в Австралии, который более пяти лет принимал PrEP именно в разовом режиме.
Сейчас идет расследование этого инцидента, и мы пока не знаем точно, в чем была его причина. Что же касается побочных эффектов, они встречаются крайне редко и при должном внимании врача легко контролируются.
Долгосрочные эффекты, например деминерализация костной ткани, появляются не сразу, и, по большому счету, слишком бояться их не стоит. Деминерализация костной ткани, связанная с тенофовиром, проходит в течение, как правило, месяца после остановки приема и не является необратимой. То же самое касается снижения функции почек.
Когда он появится на наших прилавках — сказать сложно. Но в любом случае стоит помнить: даже если это лекарство и появится в России, ДКП — это не витамины, которые можно принимать самостоятельно. Любые побочные эффекты должен отслеживать врач, равно как и назначать сам препарат. Кому стоит обратиться к ДКП, а кому повременить? В идеале такое решение должен принимать не сам пациент в режиме самолечения, а специалист, обладающий достаточной квалификацией.
Как правильно приостановить прием ДКП?
Если вы мужчина или трансгендерная женщина и хотите безопасно прекратить прием доконтактной профилактики, вам необходимо принимать ДКП как минимум еще два дня после последнего рискованного полового контакта. И только через два дня в случае отсутствия в течение этого времени опасных контактов перестать пить таблетки.
Для женщин на ДКП необходимо как минимум семь дней приема ДКП после последнего рискованного контакта. Это связано с особенностями женского организма и того, как ведут себя препараты PrEP в нем.
Чтобы возобновить прием доконтактной профилактики, вы должны быть уверены в отсутствии рисков в период без ДКП. Если риски все же были, то необходимо сделать тест на ВИЧ. Но помните про период серонегативного окна — 4-6 недель с момента последнего риска.
Чтобы начать пить доконтактную профилактику на постоянной основе, необходимо непрерывно принимать ДКП на протяжении семи дней до первого рискованного контакта. Либо (только для мужчин) можно принять двойную дозировку, а затем каждые 24 часа принимать по одной дозе ДКП.
Постконтактная профилактика ВИЧ (ПКП)
Если опасный контакт все-таки случился, а вы не успели обезопасить себя ни с помощью презерватива, ни с помощью препаратов ДКП, и со времени контакта прошло не более 72 часов, избежать инфицирования вам может помочь так называемая постконтактная профилактика.
Заключается она в том, что в указанный срок вам необходимо начать прием препаратов, которыми обычно лечат ВИЧ-инфекцию, но, в отличие от PrEP, тут принимать лекарства придется в полной дозировке, такой, какую принимают люди, у которых уже диагностирована инфекция.
Многочисленными исследованиями доказано: если начать такой прием вовремя, есть большой шанс, что вирус не успеет закрепиться в организме и заболевания удастся избежать. Идеально начать прием лекарств в первые два часа или хотя бы в первые сутки после контакта. Чем позже будет начат такой прием, тем меньше вероятность, что терапия сработает.
Курс профилактики длится 28 дней, и по завершении его необходимо сделать тест, чтобы удостовериться в его эффективности.
Важно! Лекарства, которые вам придется принимать, по факту продаются БЕЗ РЕЦЕПТА, но найти их можно не в каждой аптеке. Поэтому времени на раздумья у вас немного. Возможно, на то, чтобы собрать необходимую комбинацию таблеток, у вас может уйти более суток, так что поиск стоит начать прямо сейчас.
Всего вам придется купить три препарата и принимать нужно будет все три. По отдельности они не работают.
Общая информация
Более 20 лет прошло с тех пор, как на фармацевтическом рынке появился новый класс антиретровирусных препаратов — ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ). В 1996 году американское Управление по санитарному надзору по качеству пищевых продуктов и медикаментов FDA одобрило невирапин, в 1997 году — делавирдин, а годом позже — эфавиренц. Однако, у значительной части пациентов с помощью ННИОТ не удалось добиться оптимального терапевтического ответа вследствие накопленной устойчивости вируса к монотерапии и/или неоптимальных режимов комбинированной терапии, поэтому усилия учёных всего мира были направлены на разработку новых молекул, с улучшенным профилем устойчивости. И они увенчались успехом.
Сегодня FDA одобрено применение пяти ННИОТ [1]:
-
;
- делавирдина;
- эфавиренца;
- этравирина;
- рилпивирина.
Представители ННИОТ принадлежат к разным классам ЛС по химической структуре, но имеют общий уникальный механизм действия: их взаимодействие с обратной транскриптазой ВИЧ-1 запускает цепь изменений, подавляющих активность этого фермента. Для ННИОТ характерна специфичность к ВИЧ-1, что делает их селективными ингибиторами вируса [1, 2].
Сегодня разрабатываются ННИОТ следующего, третьего поколения. Для улучшения приверженности лечению и снижения риска ошибок в дозировках при приёме препаратов была создана комбинация эфавиренц + два НИОТ (эмтрицабин и тенофовир) в одной таблетке, которую принимают один раз в день.
Фармакологическое действие
По всей видимости, ННИОТ вмешиваются в различные этапы реакций обратной транскриптазы ВИЧ-1. За счёт этого препараты блокируют активность РНК- и ДНК-зависимой ДНК-полимеразы, вызывая разрушение активного центра фермента [1, 2].
ННИОТ не оказывают значимого ингибирующего эффекта на ДНК-полимеразу клеток эукариот, таких как ДНК-полимеразы человека.
Следует отметить, что большинство ННИОТ не активны в отношении ВИЧ-2 — второго серотипа вируса иммунодефицита, который встречается гораздо реже ВИЧ-1 (преимущественно в Африке), является менее вирулентным и агрессивным по сравнению с первым серотипом [2]. При этом, исследования in vitro демонстрируют активность этравирина в отношении ВИЧ-2 [3].
Устойчивость к ННИОТ
ВИЧ-инфекция характеризуется очень высокой скоростью репликации: вирус производит от 1 до 10 миллиардов новых вирусных частиц в день у нелеченного инфицированного. Наряду со специфическими свойствами обратной транкриптазы ВИЧ, а также большой длиной вирусного генома (около 10 000 нуклеотидов) это создаёт предпосылки к высокой частоте развития мутаций: мутантный ген в каждом положении нуклеотида в вирусном геноме вырабатывается каждый день.
Как правило, развитие мутаций тесно связано с неоптимальной схемой лечения, например, монотерапией. Оно также ставит под угрозу эффективность последующих схем антиретровирусной терапии, поскольку в каждом классе препаратов наблюдается перекрёстная резистентность [4].
Мутации в домене гена обратной транскриптазы изменяют способность ННИОТ связывать фермент. Устойчивость препаратов первого поколения была связана с мутациями в нескольких кодонах. Однако, чтобы вызвать клиническую неэффективность делавирдина, эфавиренца или невирапина, достаточно наличия мутации К103N или Y181C [4].
Препараты второго поколения более устойчивы, для развития резистентности к ним необходимо более одной мутации. Клинические исследования выявили 17 мутаций устойчивости, связанных со снижением ответа на терапию этравирином [5]. Различные мутации в разной степени влияют на восприимчивость вирусов к этравирину. Рилпивирин, будучи препаратом с более высоким генетическим барьером, чем ННИОТ первого поколения, всё же связан с более частыми случаями развития устойчивости по сравнению с этравирином [6].
Фармакокинетика ННИОТ
ННИОТ демонстрируют значительную индивидуальную фармакокинетическую вариабельность. Все одобренные в настоящее время препараты этой группы используют систему цитохрома Р450 для метаболизма и оказывают или индукционное, или ингибирующее действие на определённые изоферменты (например, CYP3A4, CYP2C9). Это приводит к значительному потенциалу лекарственного взаимодействия [7].
За исключением невирапина, ННИОТ в существенной степени связываются с белками (98–99 %), в первую очередь с альбумином и альфа-кислотным гликопротеином. Периоды полураспада ННИОТ в сыворотке крови довольно продолжительны и составляют от 25 до 55 часов, за исключением делавирдина, имеющего более короткий период полувыведения (2–11 часов) [7].
Побочные эффекты
Самым частым побочным эффектом ННИОТ считается сыпь: она развивается в течение первых нескольких недель терапии и проходит при продолжении лечения. Все препараты этого класса, за исключением этравирина, обладают определённой гепатотоксичностью. Так, делавирдин и эфавиренц могут повышать уровень трансаминаз, в то время как невирапин способен вызывать тяжёлое поражение печени, включая некроз [8].
Эфавиренц способен вызывать неблагоприятные реакции со стороны центральной нервной системы — бессонницу, яркие сновидения, головокружение, спутанность создания и галлюцинации. Рилпивирин также связан с неврологическими побочными эффектами, но реже, чем эфавиренц [6].
Устойчивость к побочным эффектам со стороны ЦНС на фоне приёма эфавиренца обычно возникает после нескольких недель терапии. Их можно корректировать за счёт приёма препарата перед сном и отказа от применения во время еды. Лишь у небольшого числа пациентов воздействие на ЦНС может сохраняться и даже потребовать отмены препарата [9].
Использование эфавиренца также связано с повышением риска суицидов примерно в два раза по сравнению с плацебо. Они присутствуют как в начале лечения, так и при длительном применении. К группам риска по развитию суицидальной наклонности на фоне лечения эфавиренцом относятся пациенты, принимающие психоактивные препараты, имеющие психиатрический анамнез, с массой тела менее 60 кг, а также употребляющие инъекционные наркотические средства [10].
Особенности отдельных ННИОТ
Невирапин
Используется, как минимум, в сочетании с двумя другими антиретровирусными препаратами. Относительно безопасен при беременности. Хорошо проникает через гематоэнцефалический барьер, подвергается печёночному метаболизму (период полувыведения — 28 часов). Препарат индуцирует и собственный метаболизм, поэтому дозу увеличивают постепенно. В начале терапии его назначают один раз в день, а спустя две недели увеличивают кратность приёма до двух раз в день (при хорошей переносимости) [1, 4, 10].
Как правило, невирапин применяется в странах третьего мира, в том числе и для антиретровирусной терапии во время беременности. Результаты исследований показали, что он превосходит зидовудин по эффективности при однократном введении во время родов, однако приводит к развитию резистентности у леченных матерей, что может отрицательно повлиять на терапевтический ответ антиретровирусной терапии в дальнейшем [1, 8].
Делавирдин
Принадлежит к семейству бис (гетеро-арил) пиперазинов, открытых учёными компании Upjohn Laboratories. Имеет более объёмную кристаллическую структуру по сравнению с другими ННИОТ, благодаря чему выступает за пределы гидрофобного кармана, с которым связывается. Это объясняет его особый профиль устойчивости. Мутация, связанная с развитием резистентности к делавирдину, расположена на участке места связывания ННИОТ с карманом. Она вызывает гиперчувствительность ко всем другим препаратам этой подгруппы [1, 4].
Как и невирапин, делавирдин применяют в схемах лечения, когда возникает резистентность, которую невозможно предотвратить. Сегодня этот препарат назначают крайне редко.
Эфавиренц
Представитель подкласса бензоксазинов, открытый исследователями Merck в 1995 году. В отличие от невирапина и делавирдина, был изучен в исследованиях III фазы в качестве компонента лечения ННИОТ и продемонстрировал высокую эффективность.
Этравирин
Принадлежит к семейству диарилпиримидиновых соединений, стал результатом многолетних исследовательских усилий учёных из компаний Janssen Research Foundation и Tibotec, направленных на открытие новых ННИОТ с оптимальным профилем устойчивости и повышенным генетическим барьером для развития резистентности. In vitro демонстрирует более высокий генетический барьер устойчивости по сравнению с невирапином и эфавиренцем [4].
Период полувыведения этравирина составляет 41 час. Препарат назначают два раза в день после еды. Самый распространённый побочный эффект — сыпь, которая, как правило, появляется в течение первых 6 недель терапии. Также на фоне применения нередко развивается периферическая нейропатия [1, 10].
Обладает активностью против штаммов ВИЧ, резистентных к ННИОТ. Из-за потенциально значительных побочных эффектов не применяют в комбинации с другими ННИОТ. Обладает аддитивной противовирусной активностью в комбинации с ингибиторами протеазы ВИЧ, нуколеозидными ингибиторами обратной транскриптазы, а также с ингибитором слияния энвуфиртидом [4].
Рилпивирин
Ещё одно соединение, ставшее результатом дальнейшей оптимизации в рамках ННИОТ, направленной на создание препарата с лучшим профилем устойчивости. In vitro демонстрирует профиль резистентности и генетический барьер, сопоставимый с таковым у этравирина. Отличается высокой биодоступностью, в том числе по сравнению с этравирином. Фармакокинетические свойства позволяют применять один раз в день. Переносится лучше, чем эфавиренц, с более низкой частотой невропсихиатрических нежелательных явлений, сыпью, меньшим количеством липидных нарушений [4, 10].
История антиретровирусной (АРВ) терапии едва разменяла третий десяток, но это был колоссальный путь. Если в 1996 году пациентам были доступны только токсичные и малоэффективные лекарства, которые нужно было пить каждый день и горстями, то уже сейчас вовсю испытывают инъекции, способные подавлять размножение вируса на несколько месяцев. Но это на западе.
Если вы живете в России, то таблетки все еще нужно пить каждый день и (часто) горстями. Тем временем, весь мир стремительно переходит на комбинированные препараты. Сейчас их нельзя назвать революцией в терапии ВИЧ-инфекции, но комбинированные формы - их еще называют таблетками “все в одном” – определенно гораздо лучше обычной АРВ-терапиии.
Во-первых, они берут количеством: для подавления вирусной нагрузки человек принимает всего одну таблетку в день вместо четырех – восьми. Благодаря этому людям, живущим с ВИЧ, не приходится подчинять свое расписание приёму лекарств, не приходится таскать с собой мешок таблеток на случай, если ночуешь не дома, не приходится испытывать столько дискомфорта при проглатывании таблеток (да, для некоторых людей это стресс), не приходится ловить на себе косые взгляды и объяснять случайным людям особенности своего диагноза.
Приверженность к лечению – аккуратный и ежедневный прием лекарств –главное условие успешной терапии ВИЧ-инфекции. Чтобы ее достичь, таблеток в схеме должно быть меньше.
Плохая новость: в России пока недоступны все комбинированные формы, которые есть в мире. Но нужно подготовиться к тому, что когда-то они будут и у нас. Поэтому мы решили вспомнить историю таблеток “все в одном” с момента их появления.
Все больше исследований доказывают, что терапия ВИЧ-инфекции таблетками “все в одном” показывает лучшие результаты, чем схемы с несколькими таблетками, прежде всего, благодаря большей приверженности: у таких пациентов меньше случаев прерываний терапии и достоверно чаще отмечается неопределяемая вирусная нагрузка. Широкое внедрение “монорежимов” – это не прихоть, а необходимость.
Атрипла
Препарат одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США 12 июля 2006 года.
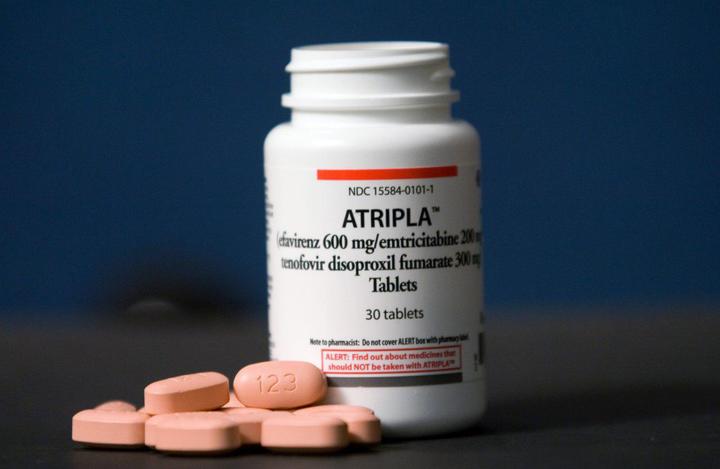
Ветеран монорежима представляет собой комбинацию из 200 мг эмтрицитабина, 300 мг тенофовира дизопроксила фумарата (TDF) и 600 мг эфавиренза. Препарат имеет ряд побочных эффектов. Среди них головокружение, головная боль, боли в животе. Длительный прием TDF может негативно влиять на состояние костей и почек. Препарат рекомендуют принимать на пустой желудок или с пищей (нежирной) – в зависимости от реакции организма. Лекарство также может взаимодействовать с другими препаратами.
Несмотря на все недостатки, Атрипла остается одним из двух препаратов “все в одном”, которые доступны в России.
Эвиплера/ Комплера
Препарат одобрен FDA в августе 2011 года.
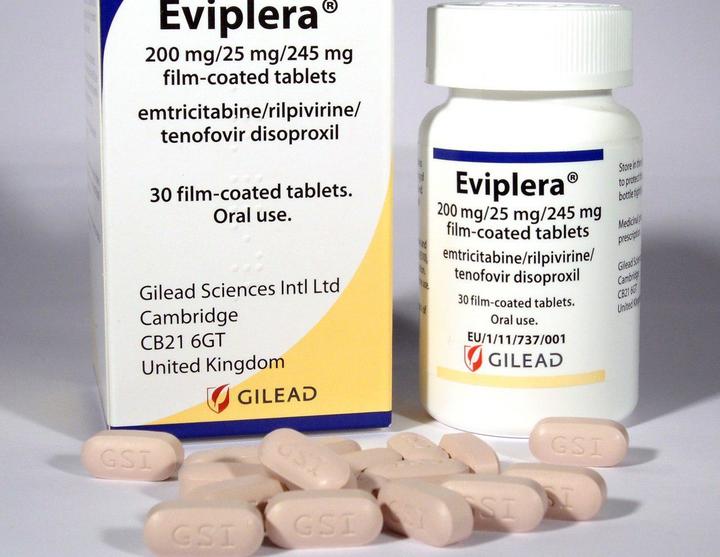
Содержит 200 мг эмтрицитабина, 300 мг TDF и 25 мг рилпивирина. Принимают с едой. Препарат подходит как для новичков, которые раньше не принимали терапию, так и для тех, кто хочет перейти на него с другой схемы лекарств.
Побочные эффекты (повышенный уровень холестерина, потеря аппетита, депрессия, слишком яркие сны, тошнота, рвота, головные боли) выражены меньше, чем у Атриплы, за счет содержания рилпивирина вместо эфавиренза.
Эвиплеру стоит с осторожностью принимать с препаратами против эпилепсии (карбамазепин, окскарбазепин, фенобарбитал), антибиотиками для лечения туберкулеза (рифампицин, рифабутин) и со зверобоем. Действие препарата также могут блокировать лекарства от изжоги (Гевискон, Ренни), препараты из группы омепразола. Поэтому пациентов настоятельно просят сообщать врачу, принимают ли они лекарства для желудка, даже если это происходит не ежедневно.
Второй и пока последний в списке препарат, доступный в России.
Стрибилд (Стрибильд)
Препарат одобрен FDA в августе 2012 года.
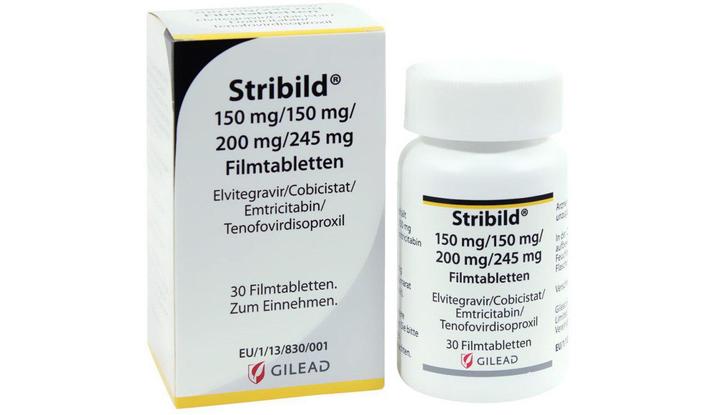
Комбинация 200 мг эмтрицитабина, 300 мг TDF, 150 мг элвитегравира и 150 мг кобицистата (препарат-бустер). Принимают один раз в день с едой.
Побочные эффекты схожи с Эвиплерой. Противопоказано пить препарат одновременно с добавками, содержащими кальций, железо, магний, алюминий или цинк. Промежуток между приемом должен составлять не менее 4 часов. Совместный прием гормональных препаратов требует консультации специалиста.
Триумек (Трайомек)
Препарат одобрен FDA в августе 2014 года.
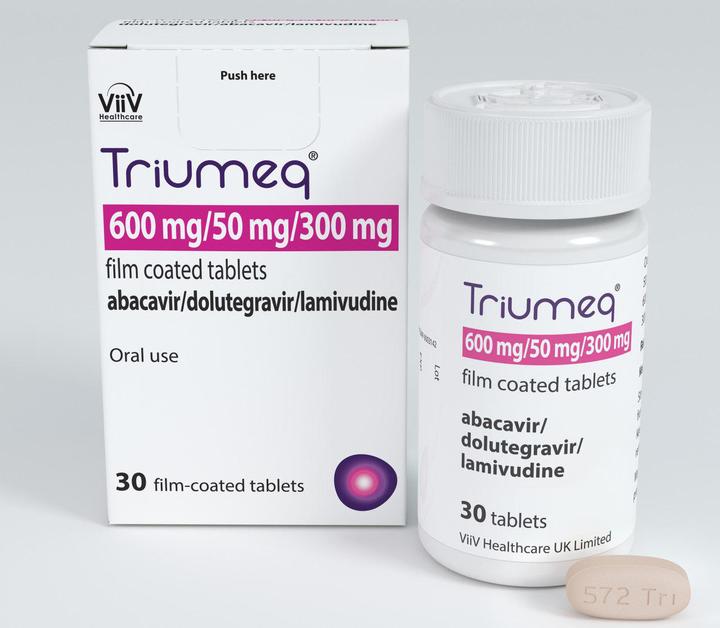
Объединяет 50 мг долутегравира, 600 мг абакавира и 300 мг ламивудина. Лекарство нужно принимать с едой или без еды, но лучше утром, поскольку вечерний прием долутегравира может вызвать бессонницу.
Помимо стандартных побочных эффектов (сонливость, депрессия, головная боль) выделяют боли в суставах, ринит, кашель, желудочный рефлюкс и потерю аппетита. Как и Стрибилд, Триумек плохо сочетается с препаратами кальция и железа. Кроме того, абакавир и долутегравир могу вызывать аллергическую реакцию.
Генвойя
Препарат одобрен FDA в ноябре 2015 года.
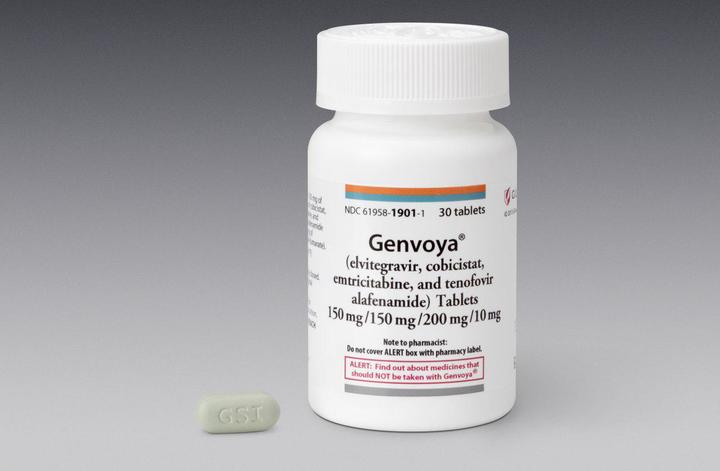
Генвойя – это 200 мг эмтрицитабина, 10 мг тенофовира алафенамида (TAF), 150 мг эльвитрагравира и 150 мг кобицистата. Принимается с едой.
Побочные эффекты фактически аналогичны тем, что наблюдаются у Стрибилда, но с небольшой разницей. В составе Генвойи содержится так называемый “новый” тенофовир. При равном противовирусном эффекте и практически одинаковой цене, схема с TAF имеет значительно меньше побочных эффектов. Благодаря этому FDA исключило из аннотации к препарату предупреждение о негативном воздействии на костную ткань. Стоит отметить, что в США уже обновляют рекомендации по лечению ВИЧ-инфекции, где Стрибилд отходит на второй план как устаревший, а предпочтение отдают Генвойе.
Одефси
Препарат одобрен в марте 2016 года.
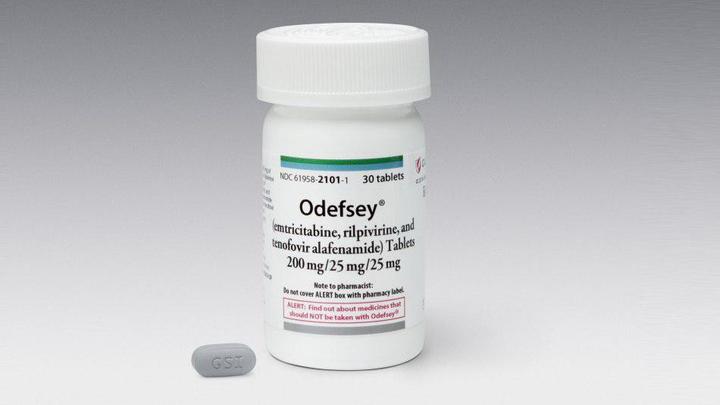
Состоит из 25 мг рилпивирина, 200 мг эмтрицитабина и 25 мг TAF. Аналог Эвиплеры/Комплеры, но с “новым” тенофовиром вместо “старого”.
Принимают один раз в день с пищей. Побочные эффекты и рекомендации по лекарственной сочетаемости аналогичны Эвиплере. Одефси, как и Генвойя, гораздо меньше влияет на состояние почек и костей за счет содержания TAF.
Не рекомендуется применять совместно с омепразолом (препарат для лечения гастрита и язвы). Кроме того, некоторые антибиотики для лечения туберкулеза могут снижать уровень TAF.
Юлука (Джулука)
Препарат одобрен FDA в ноябре 2017 года.

Первый полный безнуклеозидный режим терапии, в котором содержится только два препарата вместо трёх и более, как в стандартных схемах лечения ВИЧ-инфекции. Содержит 50 мг долутегравира и 25 мг рилпивирина. Подходит для продолжения терапии пациентов, чья вирусная нагрузка стабильно подавлена последние полгода или дольше.
Побочные эффекты те же, что и у долутегравира и рилпивирина. Но уже сейчас специалисты FDA отмечают, что токсичность препарата ниже, чем у классических схем из трех-четырех препаратов. Это связано с меньших количеством действующих веществ и отсутствием в схеме нуклеозидных (нуклеотидных) аналогов.
Перед началом приёма стоит исключить мутации вируса, которые ведут к резистентности к рилпивирину.
Биктарви
Препарат одобрен FDA в феврале 2018 года.
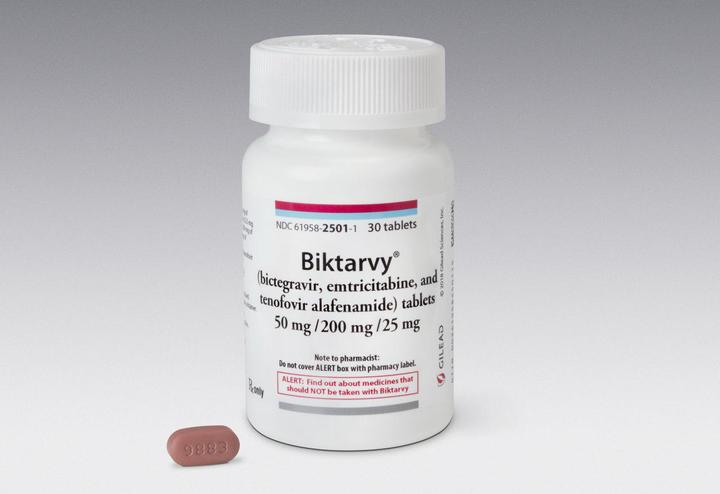
Содержит 200 мг эмтрицитабина и 25 мг TAF и 50 мг нового препарата под названием биктегравир. Известно, что производитель биктегравира пока не собирается выпускать его в форме отдельной таблетки – только в составе комбинированной формы.
Новый препарат считается одним из самых минимальных по количеству действующего вещества. При приеме "Биктарви" рекомендуют контролировать функцию почек.
Symfi и Symfi Lo
Препарат одобрен FDA в марте 2018 года.

Symfi включает 600 мг эфавиренза, 300 мг ламивудина и (внезапно) 300 мг TDF. Symfi Lo содержит 400 (а не 600) мг эфавиренца, 300 мг ламивудина и 300 мг TDF. Принимать рекомендуют натощак.
За счёт содержания TDF препарат может вызывать проблемы с почками и костями. У некоторые пациентов на фоне приёма препарата развивается депрессия.
У Symfi Lo лучше переносимость, благодаря меньшей дозе эфавиренза.
Symtuza
Препарат одобрен FDA в июле 2018 года.
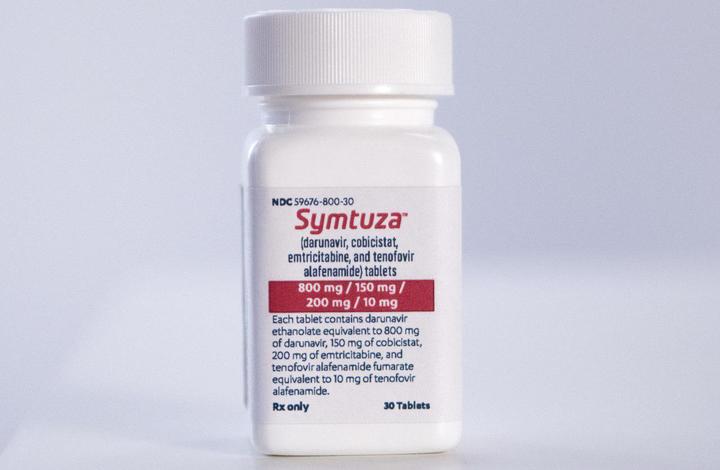
Новейший препарат включает 800 мг дарунавира, 150 мг кобицистата, 200 мг эмтрицитабина и 10 мг TAF.
Противопоказания и побочные эффекты аналогичны препаратам с теми же действующими веществами. Однако токсичное влияние на почки и скелет ниже, благодаря малому содержанию тенофовира.
При этом, кобицистат может усиливать действие других препаратов, потенциально увеличивая риск серьезных побочных эффектов.
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
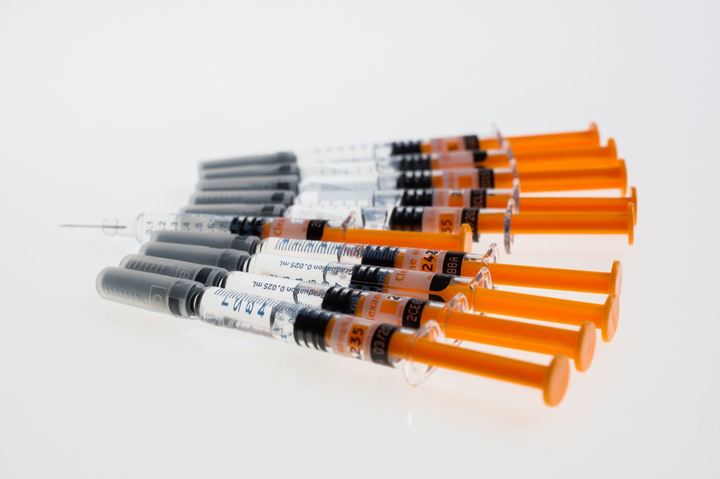
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
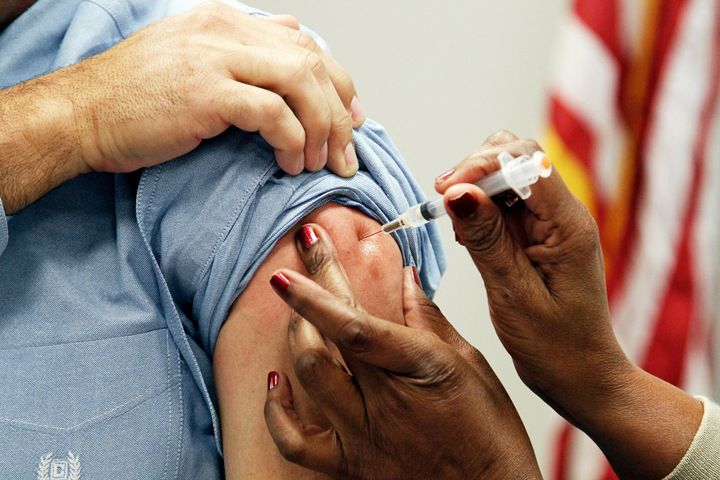
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
Более 90% ВИЧ-инфицированных людей страдают от высыпаний на коже. Сыпь при ВИЧ принимает форму любого кожного заболевания и вызывает несвойственные кожным болезням симптомы. Раздражения на коже – первый признак заражения, появляются в первый месяц после инфицирования. Терапия высыпаний направлена на уменьшение интенсивности и подавление неприятных ощущений.

Причины появления сыпи при ВИЧ-инфекции
Причиной высыпаний становится ослабление иммунитета и барьерных функций кожи, вследствие которых вирусы и бактерии не встречают сопротивления и вызывают кожные болезни.
На какой стадии проявляется сыпь?
Первые высыпания появляются уже через неделю после заражения, но способны проявиться и через месяц – это зависит от изначального иммунитета и наличия хронических болезней. У женщин ВИЧ может никак не давать о себе знать до года.
Важно! Сначала появляются малочисленные очаги кожного раздражения и синяки, которые не привлекают внимания. По мере развития заболевания проявления усиливается.
Где появляются высыпания?
Наиболее часто при вирусе ВИЧ лизии (кожные поражения) локализуются на лице, шее, животе, груди, руках и в области паха. В этих местах сыпь проявляется в первую очередь. Реже высыпания возникают на спине, бёдрах, голенях, предплечьях.
Для ВИЧ характерно также распространение высыпаний по всей поверхности тела, включая кожу головы и слизистые.
Как выглядит сыпь у людей больных ВИЧ
Характеристики сыпи зависят от вызвавшего её кожного заболевания. Единственное, что объединяет все виды высыпаний при ВИЧ-инфекции, это более выраженные краснота и зуд, сложность в лечении, частые рецидивы. На фото ниже можно более подробно увидеть характер высыпаний при разных заболеваниях.
Кожные болезни у ВИЧ-инфицированных людей проходят тяжелее, чем у неинфицированных, и сопровождаются повышением температуры, увеличением лимфоузлов, расстройством кишечника, болью в теле и горле, потливостью.
Себорейный дерматит
Выражается в появлении бляшек красного цвета, которые со временем покрываются корками. Воспаления появляются сначала на лице, затем распространяются на кожу головы, внутреннюю сторону колен и локтей.

Бляшки, характерные для себорейного дерматита, формируются на ранней стадии болезни у половины заразившихся.
Стоматит
На слизистых рта появляются пузырьки, налёт белого цвета и язвы разных размеров, также покрытых белым налётом.

Стоматит у ВИЧ-инфицированного, возникший на фоне аллергии, сопровождается температурой, першением в горле. Высыпания во рту – один из первых внешних признаков заражения ВИЧ.
Аллергия
У больных иммунодефицитом отмечают аллергическую крапивницу, которая сопровождается появлением красных пятен и сыпи, похожей на укус насекомого.

Саркома Капоши
Характеризуется кожными пятнами и уплотнениями в виде шишек бордового цвета. Высыпания локализуются на лице, во рту (на языке), половых органах, откуда распространяются на туловище, руки и ноги. Через год после заражения ВИЧ болезнь переходит в последнюю стадию, при которой на коже и слизистых больного возникает множество злокачественных новообразований.
Саркома Капоши чаще встречается у ВИЧ-инфицированных мужчин.
Грибок
При грибковых болезнях, таких как кандидоз, лишай, руброфития, на коже больного появляются очаги воспаления с ярко-выраженным шелушением, краснотой, сильным зудом, белым налётом.

Раздражения сначала локализуются на кистях, стопах и паховой области, затем быстро распространяются по всему телу.
Экзантема
Высыпания возникают при заражении организма инфекцией. Экзантема проявляется в виде бесцветной или ярко-красной папулёзной сыпи. Локализация высыпаний зависит от возбудителя, но чаще всего проявляется в области туловища и паха.

У ВИЧ-инфицированных людей экзантему вызывают вирус герпеса, цитомегаловирус, вирус Коксаки, энтеровирусы, вирус гепатита С, контагиозный моллюск, вирус папилломы человека.
Псориаз
Проявляется красными бляшками с чёткими границами, покрытыми серыми чешуйками.

Выраженность кожных поражений зависит от степени нарушения иммунной системы.
Чесотка
Чесоткой болеют до 30% ВИЧ-инфицированных. Для болезни характерен интенсивный зуд, усиливающийся по ночам.

На руках, между пальцами, на молочных железах, под мышками, в паху появляются чесоточные ходы S-образной формы белого или красного цвета.
Пиодермиты
Высыпания возникают на фоне воспаления волосяных фолликул и имеют форму бордовых прыщей и гнойничков, напоминающих подростковую сыпь.

Сифилис
При вторичном сифилисе на теле больного появляется пятнисто-папулёзная сыпь розового или красного цвета, которая распространяется по всему телу.

Вторичный сифилис возникает спустя 3-4 месяца после заражения бледной трепонемой.
К какому врачу обратиться при кожной сыпи?
Для лечения кожных высыпаний обратитесь к дерматовенерологу или венерологу, если сыпь появилась на половых органах.
При подозрении на ВИЧ обратитесь к инфекционисту.
Диагностика высыпаний на теле
При ВИЧ и СПИДе визуально определить вид сыпи сложно – характер протекания кожных воспалений у инфицированных людей отличается.

Для определения вида сыпи и её причины проводят следующие диагностические мероприятия:
- Клинический анализ крови и мочи.
- Анализ крови на вирусы, передаваемые половым путём.
- Соскоб кожи. Метод применяют для обнаружения внутрикожных клещей и грибков-возбудителей кожных заболеваний.
- Исследование крови на антитела к аллергенам и аллергологические кожные пробы.
- Исследования гормонального фона.
- Биопсия кожных образований. Выявляют наличие раковых клеток, актуально для диагностики саркомы Капоши.
Лечение сыпи при вирусе иммунодефицита человека
Терапия кожных раздражений затруднена, так как многие препараты для лечения сыпи вступают в лекарственное взаимодействие с антиретровирусными препаратами, назначаемыми при ВИЧ.
При иммунодефиците полностью вылечить кожную сыпь невозможно, терапия направлена на уменьшение симптомов и увеличение периода ремиссии.

Для лечения сыпи применяют:
- противогрибковые таблетки и мази (Тербинафин, Флуконазол, Гризеофульвин);
- противовирусные препараты (Ганцикловир, Ацикловир, Фоскарнет);
- глюкокортикостероидные мази (Элоком, Триакорт, Дермовейт);
- антигистаминные таблетки (Телфаст, Фексадин, Эриус);
- противопсориатические препараты (Ацитретин, Неотигазон);
- противопаразитарные мази (Кротамитон, Спрегаль);
- антибиотики для борьбы с ЗППП (Цефтриаксон, Офлоксацин);
- дерматопротекторные увлажняющие мази (Радевит, Линин, Альгимаф).
Выбор и комбинация препаратов зависит от состояния иммунной системы заболевшего, тяжести раздражений и причины появления высыпаний.
При папулёзных высыпаниях и псориазе применяют светолечение УФ-лучами. При ВИЧ инфекции наиболее эффективны лучи длиной 311 нм.
Важно! Полностью излечиваются только те высыпания, которые возникли на фоне аллергии.
Не пренебрегайте лечением кожных болезней при ВИЧ – без должной терапии количество высыпаний увеличивается, и они принимают характер, при котором уменьшить интенсивность раздражений будет невозможно.

Догоспитальная диагностика ВИЧ представляет сложности, мало кто из больных людей обращает внимание на первые признаки заболевания, и часто начальные проявления ВИЧ путают с гриппом или мононуклеозом. Невнимательное отношение к симптомам и запоздалое обращение в медучреждение делает лечение ВИЧ и сопровождающих его болезней малоэффективным, что может привести к скорой смерти заболевшего.
Читайте также:

