Как я умру вич цирроз грыжа кандидоз
Обновлено: 18.04.2024
ВИЧ-инфекция — один из факторов, который во много раз повышает вероятность развития рака. Выяснили, какие именно онкозаболевания чаще всего могут возникать при положительном ВИЧ-статусе, как их вовремя обнаружить, и на какие факторы риска еще нужно обратить внимание людям, живущим с ВИЧ.
Мишень вируса
Главная мишень вируса — CD4-Т-лимфоциты. Они передают сигнал другим клеткам, которые защищают организм от рака. В результате вмешательства вируса количество CD4-T-лимфоцитов постепенно уменьшается. Критически низкий уровень этих клеток - одна из причин отсутствия согласованной работы между звеньями иммунитета и главный механизм, приводящий к развитию СПИДа.
СПИД-индикаторные опухоли
Иммунитет человека с ВИЧ-инфекцией перестает контролировать процессы избыточного клеточного деления и злокачественной трансформации клеток. Вместе с уменьшением количества CD4-T-лимфоцитов происходит накопление раковых клеток. В результате у человека развиваются несколько видов опухолей, которые называют СПИД-индикаторными: появление такого вида рака с очень большой вероятностью означает наличие у человека СПИДа.
Однако повышается риск появления не только СПИД-индикаторных опухолей, но и тех видов рака, которые развиваются из-за потери иммунного контроля над несколькими онкогенными инфекциями: вирусом герпеса человека 8 типа (ВГЧ-8), вирусом папилломы человека (ВПЧ), вирусами гепатита В и С (ВГВ, ВГС), вирусом Эпштейна-Барр (ВЭБ) и другими.
Все эти состояния развиваются у людей с ВИЧ-инфекцией преимущественно на фоне снижения количества CD4-T-лимфоцитов до уровня менее 200 клеток/мкл (при разбросе в норме от 500 до 1100 клеток), но также могут возникать при нормальном или близком к нормальному уровню CD4-T-лимфоцитов.
Саркома Капоши
Саркома Капоши (СК) — СПИД-индикаторная опухоль, при которой происходит злокачественная трансформация клеток лимфатических и кровеносных сосудов. Риск развития СК у пациентов с ВИЧ-инфекцией увеличивается в несколько сотен раз. Различные белки ВИЧ-1 способны усиливать воспаление и нарушать регуляцию в эндотелиальных клетках. Это приводит к тому, что саркома Капоши может развиться до того, как уровень CD4-T-лимфоцитов упадет ниже 200 клеток/мкл. Еще одно обязательное условие для возникновения СК — наличие в организме вируса герпеса человека 8 типа.
Саркома Капоши развивается в виде папулы, пятна, узелка, бляшки коричневого, розового, красного или темно-красного цвета от нескольких миллиметров до нескольких сантиметров в диаметре. Обычно высыпания концентрируются на ногах, голове, шее, на слизистой оболочке — в области неба, десен, конъюнктивы.
До эры внедрения лекарств от ВИЧ — антиретровирусной терапии (АРТ) 5-летняя выживаемость (с момента диагностики опухоли) пациентов с саркомой Капоши составляла менее 10%. Применение АРТ значительно улучшило ситуацию — сейчас речь идет о 74%, — а также позволило снизить риск развития СК.
Более половины случаев СК (56%) диагностируются сейчас в локальной форме — до того, как опухоль распространится на лимфатические узлы, слизистую ЖКТ, печень, селезенку и другие органы. Прием антиретровирусной терапии помогает значительно замедлить прогрессию болезни и предотвратить распространение СК по всему организму.
Однако, человеку с ВИЧ и его амбулаторному врачу-инфекционисту необходимо учитывать несколько факторов риска развития этой опухоли:
- Этническая принадлежность: люди еврейского или средиземноморского происхождения, а также экваториальные африканцы;
- Мужской пол;
- Иммунодефицит: Люди с уровнем CD4-клеток менее 200 кл/мкл, те, кто перенес трансплантацию органов или костного мозга или постоянно принимает глюкокортикостероиды;
- Сексуальная ориентация: мужчины, имеющие секс с мужчинами(МСМ), подвержены более высокому риску развития СК.
Опухоли, связанные с ВПЧ
К онкологическим заболеваниям, ассоциированным с вирусом папилломы человека, относятся инвазивный рак шейки матки (ИРШМ), сквамозный (чешуйчатый) рак головы/шеи, рак анального канала, вульвы и влагалища. СПИД-индикаторной из них является только ИРШМ.
Распространенность генитальной онкогенной инфекции ВПЧ среди женщин, живущих с ВИЧ, в целом выше, чем у остального населения.
Вирус папилломы человека способен к самопроизвольной элиминации — исчезновению из организма. У ВИЧ-положительных женщин этот процесс занимает больше времени, что увеличивает вероятность появления патологических изменений в шейке матки.
Продолжительный прием АРТ приводит к более низкой распространенности ВПЧ высокого риска и поражений шейки матки и даже предотвращает новые случаи ИРШМ.
Раннее начало антиретровирусной терапии, приверженность лечению обеспечивают снижение вирусной нагрузки — количества вируса в крови. Эти меры очень эффективны в отношении местного иммунитета слизистой оболочки и профилактики ИРШМ.
Скрининг ИРШМ заключается в проведении ПАП-теста и ВПЧ-теста (ПЦР). Женщины с ВИЧ-инфекцией в возрасте от 21 до 29 лет должны пройти ПАП-тест во время первичной диагностики ВИЧ, затем — через 12 месяцев, если анализ не показал патологии. Некоторые эксперты рекомендуют делать следующий ПАП-тест через 6 месяцев после первого. Если результаты трех последовательных мазков без отклонений, повторные тесты следует проводить каждые 3 года. ВПЧ-тест не рекомендуется подключать к ПАП-тесту до 30 лет — высока вероятность положительного результата, при этом оснований для активных действий нет. Лечения ВПЧ не существует, а для развития РШМ требуется, как правило, от 10 лет.
Также для предотвращения ИРШМ девочкам с сопутствующей ВИЧ-инфекцией старше 9 лет и до 26 лет крайне рекомендуется вакцинация от ВПЧ-инфекции (вакцины: 2-валентный Церварикс, 4-валентный Гардасил, в Европе/США - 9-валентный Гардасил-9). Кроме ИРШМ и дисплазии вульвы и влагалища у женщин, вакцинация предотвращает развитие рака анального канала. У ВИЧ+ гетеросексуальных мужчин и МСМ риск этого вида рака возрастает в 19 раз.
О чем еще нужно знать
У пациентов с ВИЧ-инфекцией повышается риск развития:
Гепатоцеллюлярная карцинома
К факторам риска развития ГЦК у пациентов с ВИЧ относятся: цирроз печени, ожирение, диабет, возраст старше 60 лет, мужской пол.
Скрининг ГЦК проводится с помощью анализа крови на альфа-фетопротеин (АФП), который может продуцироваться раковыми клетками, или инструментальных методик диагностики — УЗИ, КТ, МРТ.
В последние годы всё чаще используется фиброскан для оценки стадии фиброза и близости к циррозу, независимому фактору риска ГЦК.
Предотвратить появление гепатоцеллюлярной карциномы можно с помощью своевременной вакцинации и ревакцинации от вирусного гепатита В и контроля вирусной нагрузки.
Неходжкинские лимфомы (НХЛ)
Несмотря на появление АРТ, НХЛ остаются актуальной проблемой для людей, длительное время живущих с ВИЧ. Хотя в большом количестве случаев неходжкинские лимфомы являются СПИД-индикаторными, они способны развиваться при нормальном уровне CD4-клеток и являются одной из наиболее частых причин смерти среди ВИЧ-положительных.
Общая выживаемость у пациентов с этим диагнозом низкая: более половины умирают в течение пяти лет от момента постановки диагноза
Отсюда возникают факторы риска развития НХЛ при ВИЧ-инфекции:
- наличие ко-инфекции вирусными гепатитами В, C, H.pylori;
- наличие вирусной нагрузки вируса Эпштейна-Барр или цитомегаловируса;
- наличие аутоиммунных заболеваний до постановки диагноза ВИЧ-инфекция;
- наличие специфических изменений в протеинограмме до или во время ВИЧ-инфекции;
- наличие минимальной вирусной нагрузки ВИЧ, несмотря на АРТ;
- снижение CD4-Т-лимфоцитов.
К скринингу неходжкинских лимфом относятся мониторинг вирусной нагрузки ВЭБ, ВГС, ВГВ и проведение инструментальной диагностики (КТ, МРТ, УЗИ, ФГДС).
С помощью контроля факторов риска и своевременного скрининга можно не только найти опухоль на ранней стадии, но и предотвратить заболевание.
Если рак все же обнаружили, ни в коем случае нельзя прерывать антиретровирусную терапию — она проводится по жизненным показаниям, что означает высокую вероятность неблагоприятного исхода противоопухолевой терапии без сопутствующего противовирусного лечения.
1. Мой тест на ВИЧ положительный. Могло ли это быть ошибкой?
Хотя ложноположительный результат встречается нечасто, для проверки полученных результатов необходимо провести контрольный тест, то есть повторить анализ. Вероятность получения двух ложноположительных результатов теста крайне низка. Если первый тест проводился в домашних условиях, для выполнения повторного анализа обратитесь к врачу или в медицинскую лабораторию.
2. Если у моего партнера отрицательный результат теста на ВИЧ, то он не инфицирован?
3. Как я мог получить ВИЧ?
4. Это моя вина?
5. Но я думал, что активные партнеры не могут заразиться ВИЧ?
Действительно, вероятность инфицирования ВИЧ для активного партнера значительно ниже как при анальном, так и при вагинальном сексе. Согласно данным одного исследования, проведенного в 2012 году, для партнеров, занимающих активную позицию при анальном сексе, характерно снижение риска заражения на 86 процентов. Однако это не отменяет того факта, что активные партнеры могут инфицироваться и инфицируются ВИЧ при незащищенных половых контактах.
6. Правда ли, что у многих ВИЧ-положительных людей есть гепатит С?

7. Если я ВИЧ-положительный, значит у меня СПИД?
8. Я умру?
Да, но не завтра и не потому, что у вас ВИЧ. Дело в том, что при надлежащем лечении ВИЧ-положительные пациенты могут жить так же долго и полноценно, как и здоровые люди. Вы имеете гораздо больше шансов погибнуть в автомобильной катастрофе, чем умереть от ВИЧ. Конечно, как и при любом хроническом заболевании (например, сахарном диабете), у вас могут развиться определенные осложнения. Кроме того, вы можете быть подвержены различным заболеваниям, как и все люди. Существуют данные, что при длительном применении антиретровирусных препаратов, которые необходимо принимать ВИЧ-положительным, увеличивается риск раннего развития некоторых заболеваний, связанных с возрастом, таких как остеопороз. Однако не забывайте, что приверженность лечению позволит вам прожить долгую и активную жизнь, несмотря на ВИЧ.

9. Когда необходимо начать лечение?
Прямо сейчас. Лечение должно быть начато как можно скорее, лучше всего в день получения положительного результата анализа на ВИЧ. Раннее начало лечения ВИЧ-инфекции приводит к значимым долгосрочным преимуществам. Но даже при отсутствии симптомов инфекция ослабляет иммунную систему. По мнению ученых, откладывание начала антиретровирусной терапии приводит к увеличению объемов скрытых резервуаров ВИЧ-инфекции. Напротив, раннее начало лечения уменьшает вирусную нагрузку. Содержание вируса в крови может снизиться до уровня ниже определяемого, при котором вероятность передачи ВИЧ партнеру крайне мала. Так что немедленно получите рецепт и начните прием препаратов.
10. Я должен принимать антиретровирусные препараты каждый день?
Всю жизнь? И да, и нет. По данным исследования, проведенного в 2015 году, только при сочетании раннего начала лечения с регулярным приемом препаратов соотношение CD4 и CD8 клеток становится близким к норме. Чем ближе этот показатель к нормальному, тем больше клеток борются с ВИЧ и дают вам силы, здоровье и продолжительность жизни человека без ВИЧ-инфекции. Не стоит пренебрегать такой ощутимой пользой для здоровья. Однако и врачи, и фармацевтические компании понимают, что необходимость ежедневно принимать лекарства превращается в настоящее испытание, и поэтому разрабатывают новые возможности лечения. В этом году было проведено исследование, по результатам которого было выявлено, что инъекция препарата два раза в месяц так же эффективна, как и ежедневный прием таблеток (хотя может пройти один-два года, прежде чем такие препараты станут продаваться в аптеках). Да, пока вам придется придерживаться лечения с религиозным рвением (представьте, будто это поход в спортзал или ежедневный прием витаминов), однако это не означает, что вы обречены до конца жизни ежедневно принимать таблетки.

11. Если я ВИЧ-положителен, значит, мне нельзя заниматься сексом?
Нет, это не так. На самом деле большинство врачей поощряют продолжение полноценных сексуальных отношений. Оргазм сам по себе может быть чудесным лекарством: чувство сексуального удовлетворения помогает заснуть, стимулирует повышение уровня иммуноглобулинов (которые борются с инфекцией), уменьшает стресс, чувство одиночества и депрессию. Однако присутствие ВИЧ в организме подразумевает, что необходимо защищать себя и своих сексуальных партнеров.
12. Как я могу защитить моих сексуальных партнеров?
Есть разные способы защитить себя и своего партнера. Честно и подробно обсудите свой ВИЧ-статус и связанный с ним риск передачи инфекции. Всегда используйте презерватив и поддерживайте сексуальные отношения с партнером, применяющим доконтактную профилактику (PrEP). Следите за поддержанием вирусной нагрузки ниже определяемого уровня. Важен даже правильный выбор смазки для презерватива (избегайте двух составляющих: поликватерниума и поликватерниума-15, так как оба типа полимера увеличивают риск передачи ВИЧ).
14. Что такое ДКП (PrEP)? ДКП (PrEP)
15. Какой риск у людей, употребляющих неинъекционные наркотики и алкоголь?
Люди, употребляющие неинъекционные наркотики и алкоголь, более склонны к рискованному сексуальному поведению и незащищенным контактам. Многие люди, принимающие наркотики или алкоголь, прежде всего, выбирают сексуальных партнеров из своего круга общения. Сюда могут войти люди, которые употребляли наркотики внутривенно, занимались сексом за деньги или наркотики, стали жертвами травматической ситуации, или сидели в тюрьме. Во всех этих уязвимых группах риск передачи ВИЧ высокий.
Справка: что такое гепатит С
Вирусные гепатиты — это инфекционные заболевания, поражающие печень. Существуют разные вирусные гепатиты (их обозначают латинскими буквами). Симптомы заболеваний могут быть схожими (а чаще всего их вообще нет), но их возбудители по-разному распространяются и влияют на организм человека. Например, гепатит А — это кратковременная инфекция, а В и С могут протекать десятилетиями, незаметно повреждая печень. С распространением гепатитов А и В успешно борются с помощью прививок, а вот против гепатита С вакцины не существует.
Заражение вирусом гепатита С обычно происходит через контакт с кровью инфицированного человека:
- через шприц у лиц, употребляющих инъекционные наркотики (по статистике это наиболее распространенный способ заражения);
- при незащищенном сексе (риск выше при более травматичных формах, например, анальном сексе);
- через нестерильные медицинские инструменты (например, при экстренных вмешательствах в ограниченных условиях, при стоматологических процедурах и др.);
- через предметы личного пользования (например, бритву);
- при нарушении условий переливания крови (встречается редко, так как компоненты и доноры крови проходят тщательный отбор и обследование);
- от инфицированной матери новорожденному.
Основной способ диагностики гепатита С — анализ крови. Поэтому сложно назвать реальное количество людей, которые являются носителями этого вируса. В 2021 году некоторые эксперты говорили о том, что в России гепатитом С могут быть заражены около 5,7 млн человек.
— Как гепатит С лечили раньше?
— Сначала для терапии использовали рибавирин — неспецифический противовирусный препарат, у которого есть немало побочных эффектов. Потом его стали использовать в комбинации с препаратами интерферона, задача которого — усилить иммунный противовирусный ответ в организме. Но и у интерферона есть побочные явления и нередко — противопоказания к применению. Существуют заболевания, при которых применение интерферона невозможно или дает очень высокие риски осложнений. Зачастую приходилось выбирать, кому из больных проводить терапию по этой схеме, а кому отказывать. Эффективность тоже была заведомо невысокой, можно даже сказать, мы играли в лотерею. Переносимость интерферона, сопутствующие заболевания, риск нежелательных явлений, изменение показателей крови, стадия цирроза печени и в целом состояние печени на момент лечения — от всего этого зависело, можно ли было назначать лечение. Плюс мы выявляли у пациентов определенные генетические показатели, при которых его применение заведомо могло быть малоэффективным.
— Таких пациентов совсем не лечили?
— Гепатопротекторы бесполезны при гепатите?
— Итак, старая схема давала высокие риски, побочные эффекты и низкую эффективность. Что удалось изменить в новых рекомендациях?
— Принципиальный момент, который, наверное, будет самым важным для всех нас — и для пациентов, и для врачей, — возможность назначать терапию на любой стадии хронического гепатита С. Не запущенные стадии, как было раньше, когда у пациента уже возникали фиброз и цирроз печени. Сейчас у нас единственное показание к лечению, как и во всем мире, что мне очень приятно, — это сам факт выявления вируса гепатита С в крови. Поэтому врачам теперь не нужно решать, кому назначать противовирусную терапию, а кому — нет.
— Терапию теперь можно проводить сразу после того, как вирус обнаружили в крови?
— По современным российским рекомендациям это нужно сделать не позднее трех месяцев после обнаружения вируса в крови — возможно начать терапию сразу, иногда понаблюдать 6–12 недель. Это можно делать, потому что в определенных случаях организм побеждает вирус сам. Процент таких больных действительно есть, хотя он намного ниже, например, чем в случаях с гепатитом В (он реже становится хроническим).
— Мы убрали это слово, сейчас такого подхода нет. Конечно, приоритет все равно дается пациентам с циррозом печени или с другими рисками (например, с раком печени и вирусным гепатитом или поражением других органов). Пациенты после после пересадки печени получают лечение незамедлительно, так как инфицирование нового органа наступает неизбежно.
— Схема лечения тоже изменилась?
— Это еще один принципиальный момент, над которым мы целенаправленно работали. Из рекомендаций исчезли препараты интерферона. Это влечет за собой целый ряд позитивных изменений. Как я уже говорил, интерферон многими пациентами переносится тяжело, возникают побочные эффекты, и результаты невысоки, особенно при циррозе печени.
Теперь мы перешли полностью на таблеточные схемы, их эффективность приближается к 100%. Это позволяет бюджетным медицинским учреждениям больше не тратить деньги на закупку интерферона, а закупать только таблеточные формы лекарств и использовать безинтерфероновые высокоэффективные схемы. При этом нужно сказать, что большая часть тех препаратов, которые есть в мире и, в частности, в западных странах, присутствуют и в России.
— Новые схемы лечения эффективнее прежних?
— Они перекрывают все существующие в России типы вирусов гепатита С. Это так называемая пангенотипная схема: когда одна таблетка, одна комбинация препаратов, может вылечить все типы вирусов. К примеру, в России встречаются в основном три типа вируса гепатита С (1а, 1b, 3), и их раньше по разным причинам не всегда удавалось лечить эффективно, особенно на стадии цирроза. Сейчас эта проблема уже не имеет значения. Во всем мире принята следующая концепция упрощенного подхода к лечению: выявляют вирус, но не определяют ни его количество, ни его разновидность, для того чтобы выбрать конкретный препарат. Вместо этого назначают лекарства, которые одинаково эффективны при разных вариантах инфекции.
Наличие хронического гепатита С (ХГС) и ВИЧ-инфекции одновременно ассоциируется со значительной частотой неблагоприятных исходов вследствие развития цирроза и/или первичного рака печени, а также общностью эпидемиологических, социальных и экономических факторов. При сочетании этих инфекций отмечаются более высокий титр вируса гепатита С, выраженное прогрессирование хронического гепатита и высокий риск цирроза печени. При этом цирроз печени развивается быстрее и в 3 раза чаще у ВИЧ-инфицированных, чем у больных моноинфекцией гепатита С.
Цель исследования: выявить клинические и лабораторные особенности больных ХГС и ВИЧ-инфекцией.
Материал и методы: в исследование включены 173 пациента с ХГС и ВИЧ-инфекцией. Стандартную терапию ХГС (пегилированный интерферон альфа-2а + рибавирин) получали 45 больных, антиретровирусную терапию — 29. Чаще определялся генотип 1 вируса гепатита С (91 пациент, 52,6%). ХГС преобладал у пациентов мужского пола (в группе 1 — 64,3%, в группе 2 — 71,1%) и в наиболее трудоспособном возрасте от 20 до 30 лет (в группе 1 — 68,8%, в группе 2 — 80%).
Результаты исследования: среди больных, поступивших в стационар, 55,5% имели смешанную форму гепатита (ХГС + токсический гепатит) и у 17,2% выявлен цирроз печени. У 22,6% больных противовирусная терапия была отменена вследствие развития побочных реакций или неэффективности. Значительное количество пациентов до поступления в стационар злоупотребляли алкоголем (54,7%), наркотиками (25,8%), имели хронические заболевания: панкреатит, бронхит.
Заключение: среди пациентов с ХГС и ВИЧ-инфекцией, поступающих в стационар, преобладают больные со смешанной формой гепатита (ХГС + токсический гепатит). Большинство больных не получают стандартную противовирусную терапию ХГС вследствие выраженного иммунодефицита, злоупотребления алкоголем, приема психотропных веществ или отказа от лечения.
Ключевые слова: ВИЧ-инфекция, хронический гепатит С, цирроз печени, противовирусная терапия, антиретровирусная терапия, интерферон альфа-2а, рибавирин, генотип, оппортунистические инфекции.
Для цитирования: Сундуков А.В., Мельников Л.В., Евдокимов Е.Ю. Характеристика больных хроническим гепатитом С и ВИЧ-инфекцией. РМЖ. Медицинское обозрение. 2018;2(7(II)):64-67.
A.V. Sundukov 1 , L.V. Melnikov 2 , E.Yu. Evdokimov 3
1 Evdokimov Moscow State University of Medicine and Dentistry
2 Penza State University
3 Central Research Institute of Epidemiology, Moscow
The presence of HIV infection together with chronic hepatitis C (CHC) is associated with a significant incidence of an adverse events due to the development of cirrhosis and/or primary liver cancer, as well as a similarity of epidemiological, social and economic factors. In the case of these infections, there is a higher titer of hepatitis C virus, significant progression of chronic hepatitis and a high risk of the liver cirrhosis. At the same time, liver cirrhosis develops faster and 3 times more often in HIV-infected patients than in patients with hepatitis C monoinfection.
Aim: to identify the clinical and laboratory features of patients with CHC and HIV infection.
Patients and Methods: the study included 173 patients with CHC and HIV infection. 45 patients underwent standard therapy (pegylated interferon alfa-2a + ribavirin) of CHC. Antiretroviral therapy was followed by 29 patients. The 1 genotype of the hepatitis C virus was identified more frequently (91 patients, 52.6%). CHC prevailed in male patients (group 1 — 64.3%, group 2 — 71.1%) at the most working age from 20 to 30 years (group 1 — 68.8%, group 2 — 80%).
Results: among the patients admitted to the hospital, 55.5% had a mixed form of hepatitis (CHC + toxic hepatitis) and 17.2% had cirrhosis of the liver. In 22.6% of patients, antiviral therapy was canceled due to the development of adverse events or non-
response to therapy. A significant number of patients before admission to the hospital abused alcohol (54.7%), drugs (25.8%), had chronic diseases: pancreatitis, bronchitis.
Conclusion: patients with mixed hepatitis (CHC + toxic hepatitis) prevail among patients with CHC and HIV infection admitted to hospital. Most patients do not receive standard antiviral therapy for CHC due to pronounced immunodeficiency, alcohol abuse, psychotropic substances intake, or refusal of treatment.
Key words: HIV infection, chronic hepatitis C, liver cirrhosis, antiviral therapy, antiretroviral therapy, interferon alfa-2a, ribavirin, genotype, opportunistic infections.
For citation: Sundukov A.V., Melnikov L.V., Evdokimov E.Yu. Characteristics of patients with chronic hepatitis C and HIV infection // RMJ. Medical Review. 2018. № 7(II). P. 64–67.
В статье приведены характеристика больных хроническим гепатитом С и ВИЧ-инфекцией с целью определения клинических и лабораторных особенностей больных с данными заболеваниями.
Введение
Актуальность проблемы вируса иммунодефицита человека (ВИЧ) и хронического гепатита С (ХГС) определяется широким распространением этих инфекций, многообразием клинических форм, значительной частотой неблагоприятных исходов вследствие развития цирроза и/или первичного рака печени, а также общностью эпидемиологических, социальных и экономических факторов. Эпидемиологическая ситуация в России по ВИЧ и ХГС остается сложной, и в последнее время отмечается увеличение смешанной инфекции (ВИЧ/ХГС). Из 42 млн ныне живущих ВИЧ-инфицированных людей примерно у 20% (8,4 млн) диагностирован ХГС [1–3]. Как правило, у данной категории пациентов в анамнезе отмечают случаи внутривенного введения наркотиков [4].
В настоящее время более 80% всех случаев ВИЧ-инфекции приходится на потребителей инъекционных наркотиков, и в этой группе маркеры вирусного гепатита С определяются более чем у 90% больных [4–7]. Наличие ХГС и ВИЧ-инфекции одновременно ассоциируется с более высоким титром вируса гепатита С, выраженным прогрессированием хронического гепатита и возрастающим риском цирроза печени. При этом цирроз печени развивается быстрее и в 3 раза чаще у ВИЧ-инфицированных, чем у больных моноинфекцией гепатита С [4, 7, 8].
Цель настоящего исследования: выявить клинические и лабораторные особенности больных ХГС и ВИЧ-инфекцией.
Материал и методы
Работа выполнялась с 2013 по 2017 г. на базе инфекционной клинической больницы (ИКБ) № 2 Москвы и Московского городского центра по борьбе с ВИЧ/СПИД.
Всего под нашим наблюдением находилось 173 пациента с ХГС и ВИЧ-инфекцией. При постановке диагноза использовались эпидемиологические, клинические, биохимические, инструментальные методы исследования. Этиологический диагноз основывался на определении специфических серологических маркеров вирусных гепатитов и результатах молекулярно-биологических исследований с определением генотипа вируса гепатита С в лаборатории ИКБ № 2.
Стадия ВИЧ-инфекции определялась по Российской классификации ВИЧ-инфекции (В.И. Покровский, 2001 г.) [4].
В зависимости от схемы лечения все больные были разделены на 2 группы. Группа 1 включала 128 (74%) больных, которые получали только патогенетическую дезинтоксикационную терапию: раствор 5% глюкозы, солевые растворы, витамины (аскорбиновая кислота, витамины группы В), абсорбенты, гепатопротекторы. Из них 29 (22,6%) человек получали антиретровирусную терапию (АРТ): ламивудин, зидовудин, ставудин, абакавир, эфавиренз и др. Среди не получающих АРТ были пациенты, которым по иммунологическим характеристикам было показано лечение против ВИЧ-инфекции. Однако на фоне злоупотребления алкоголем у этих пациентов отмечалось обострение ХГС, в связи с чем АРТ не назначалась.
Группа 2 состояла из 45 (26%) человек — 32 (71,1%) мужчин и 13 (28,9%) женщин. Они получали стандартную противовирусную терапию (пегилированный интерферон альфа-2а + рибавирин). Пегилированный интерферон альфа-2а назначался в дозе 180 мг 1 р./нед. подкожно, рибавирин — по 800–1200 мг/кг в зависимости от массы тела. Длительность терапии составила 48 нед. Лечение в группе 2 проводилось амбулаторно, назначение АРТ не требовалось.
Статистическую обработку данных проводили с использованием MS Excel 2003 и подсчетом критерия Стьюдента (t).
Результаты исследования
Распределение пациентов в группах в зависимости от генотипа вируса гепатита С представлено на рисунках 1 и 2. Распределение по генотипам ХГС было сопоставимо, при этом генотип 1 встречался наиболее часто: у 67 (52,3%) больных в группе 1 и у 22 (48,9%) — в группе 2. У остальных пациентов в группе 1 генотип 2 встречался у 28 (21,9%) человек, генотип 3 — у 33 (25,8%); в группе 2 — соответственно у 9 и 14 (20,0 и 31,1%).
Большинство больных имели III (бессимптомную) или IVА стадию ВИЧ-инфекции (табл. 1): в группе 1 таких было 95 (74,2%) человек, в группе 2 — 45 (100%). В группе 2 не было больных с поздними стадиями ВИЧ-инфекции, т. к. это является абсолютным противопоказанием для назначения этиотропной терапии ХГС (интерферон + рибавирин).
Смешанную форму гепатита (ХГС + токсический гепатит) диагностировали у 71 (55,5 %) пациента. Хронический гепатит с исходом в цирроз печени отмечался в 22 случаях (17,2 %). Данные представлены на рисунке 3.
Распределение больных в зависимости от пола и возраста представлено в таблице 2.
Чаще ХГС встречался у пациентов мужского пола (в группе 1 — 64,3%, в группе 2 — 71,1%) и в наиболее трудоспособном возрасте от 20 до 30 лет (в группе 1 — 68,8%, в группе 2 — 80%).
Распределение пациентов в зависимости от сопутствующей патологии и оппортунистических инфекций представлено в таблице 3.
Как видно из представленных данных, сопутствующие заболевания встречались в обеих группах, однако, учитывая, что пациенты группы 2 лечились амбулаторно и к врачу обращались в плановом порядке, частота встречаемости сопутствующей патологии у данной группы больных была достоверно ниже. Анализ больных показал, что в группе 1 наиболее часто встречались такие заболевания, как обострение хронического панкреатита (31,3%), обострение хронического бронхита (27,3%), пневмония (19,5%). Выявлена высокая частота наркомании в обеих группах (25,8% и 13,3% соответственно). Часть больных в группе 1 не получала стандартную (этиотропную) терапию ХГС вследствие ряда объективных и субъективных факторов, которые приведены в таблице 4.
Из представленных данных видно, что чаще всего стандартная терапия не назначалась из-за злоупотребления алкоголем и/или приема психоактивных веществ, а также вследствие выраженного иммунодефицита (СД4+ лимфоциты менее 350 клеток). Также большую группу составили пациенты, которым стандартная терапия назначалась, но была отменена в результате развития побочных эффектов (16,4%) и/или неэффективности лечения (6,2%).
В качестве иллюстрации отказа от противовирусной терапии ХГС приводим собственное наблюдение.
Клинический пример
Выводы
Таким образом, в результате анализа клинических и лабораторных данных больных ХГС и ВИЧ-инфекцией можно сделать следующие выводы:
среди пациентов с ХГС и ВИЧ-инфекцией, поступающих в стационар, преобладают больные со смешанной формой гепатита (ХГС + токсический гепатит);
среди токсических причин поражения печени в абсолютном большинстве случаев отмечено злоупотребление алкоголем;
большинство пациентов имеют генотип 1 вируса гепатита С;
основные причины неназначения противовирусной терапии гепатита С: злоупотребление алкоголем, наркомания, низкий иммунный статус и отказ пациента от лечения.
Для цитирования: Яковлев А.Б. Дерматологические симптомы цирроза печени: значимость междисциплинарной проблемы. РМЖ. 2014;20:1471.
Печень взрослого человека весит около 1,5 кг. Она покрыта тонкой прочной соединительнотканной оболочкой – глиссоновой капсулой [1]. Большая часть печени располагается в правой стороне туловища. Печень проецируется на переднюю брюшную стенку надчревной области. Верхняя граница печени в норме начинается в 10-м межреберье справа по средней подмышечной линии. Отсюда она круто поднимается кверху и медиально. По правой сосковой линии граница печени может достигать в норме 4-го межреберья. Далее граница печени опускается влево, пересекает грудину несколько выше основания мечевидного отростка, верхняя граница печени доходит до середины расстояния между левой грудинной и левой сосковой линией.
Нижняя граница печени также начинается в 10-м межреберье справа, но идет наискосок и медиально, пересекает 9-й и 10-й реберные хрящи справа, идет по области над чревьем наискосок влево и вверх, пересекает реберную дугу на уровне 7-го левого реберного хряща и в 5-м межреберье соединяется с верхней границей [2]. Расположение нижней границы печени – одна из наиболее важных клинических характеристик ее размера. В норме она определяется ниже края реберной дуги справа, выступ должен быть не более чем 2 см.
Печень состоит из 2-х главных долей, правая доля значительно крупнее левой. Нижняя поверхность печени называется висцеральной и соприкасается с некоторыми частями ЖКТ и правой почкой. Верхняя поверхность печени гладкая, непосредственно прилежит к диафрагме. На нижней поверхности печени имеется короткая глубокая поперечная борозда – ворота печени.
Относительная массовая доля печени неодинакова в различные периоды жизни человека: у новорожденного печень занимает большую часть брюшной полости, а масса составляет 1:20 массы тела; у взрослого масса печени – 1:50 массы тела, а ее скелетотопия соответствует описанной выше [2].
Печень состоит из паренхимы, формируемой гепатоцитами, и соединительнотканной стромы. Гепатоциты – функциональные клетки печени, выполняющие не менее 500 различных функций – от накопительных (гликоген) до детоксицирующих (глюкуронид).
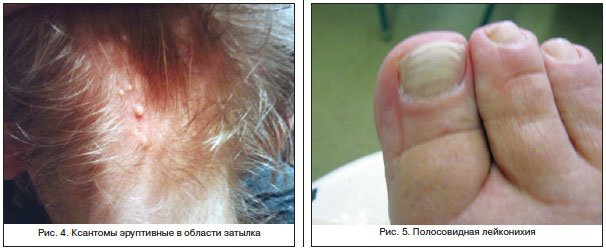
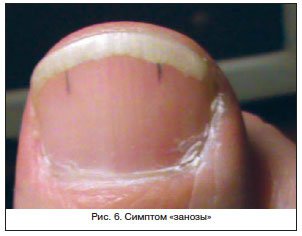
Гипертрофические поражения ногтей, их чрезмерное уплотнение (склеронихия), гиппократовы ногти для цирроза печени не характерны.
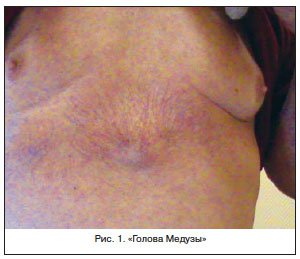
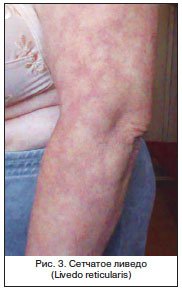
Классическим признаком длительно пьющего человека всегда считалась эритема лица – симптом, описанный во многих художественных произведениях. Между тем сама по себе эритема лица, или розацеа, напрямую не коррелирует с тяжестью поражения печени, а лишь выдает факт злоупотребления алкоголем. Именно под действием алкоголя происходит расширение сосудов лица, которое в дальнейшем становится стойким. Однако считается, что крайняя степень розацеа – ринофима все же определенным образом коррелирует с тяжестью поражения печени и может служить ориентировочным симптомом сформировавшегося цирроза, дающим основание для целенаправленного поиска. Такими ориентировочными симптомами являются многие из описанных кожных изменений. Считается, что ринофима представляет собой завершающую инфильтративно-продуктивную стадию развития розацеа. Процесс может локализоваться в области не только носа (ринофима), но и подбородка (гнатофима), на ушах (отофима), веках (блефарофимоз) [15]. Из 4-х видов ринофимы (гландулярная, фиброзная, фиброангиоматозная, актиническая) для цирроза печени в большей степени характерна форма, связанная с инсоляцией, – актиническая. Но могут наблюдаться все перечисленные формы ринофимы.
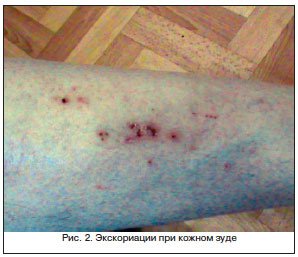
Крапивница является неспецифическим синдромом и в целом для цирроза не характерна. Но она может быть одним из признаков активного вирусного гепатита. В далеко зашедших случаях цирротического поражения появление крапивницы обусловлено скорее токсическими влияниями [1, 16].
Читайте также: