Какая анемия при туберкулезе
Обновлено: 18.04.2024
В обзоре представлены данные из 55 источников литературы об особенностях обмена железа в организме человека, в том числе при заболевании туберкулезом. Дано описание процессов, направленных на изолирование железа от патогенов и способствующих приобретению железа патогенами от макроорганизма. Снижение содержания циркулирующего в сыворотке крови железа при туберкулезе является прежде всего компонентом системного воспалительного ответа и относится к механизмам врожденного иммунитета, ограничивающим в организме человека размножение инфекционного возбудителя. При этом в падении уровня циркулирующего железа может участвовать его истинный дефицит.
Ключевые слова
Об авторах
Абдуллаев Ризван Юсиф оглы – доктор медицинских наук, профессор, ведущий научный сотрудник отдела патанатомии, электронной микроскопии и биохимии, заведующий лабораторией биохимии.
107564, Москва, Яузская аллея, д. 2.
Комиссарова Оксана Геннадьевна – доктор медицинских наук, заместитель директора по научной и лечебной работе.
107564, Москва, Яузская аллея, д. 2.
Терентьева Ольга Романовна – заочный аспирант.
107564, Москва, Яузская аллея, д. 2.
Список литературы
1. Абдуллаев Р. Ю., Комиссарова О. Г., Герасимов Л. Н. Выраженность системного воспалительного ответа у больных туберкулезом, ассоциированным с ВИЧ-инфекцией // Туб. и болезни легких. ‒ 2017. – Т. 95, № 6. – С. 36-40.
3. Волошина В. В. Фомичева Н. И. Эффективность лечения больных с впервые выявленным деструктивным туберкулезом легких на фоне сопутствующей железодефицитной анемии // Пробл. туб. – 2002. ‒ № 2. ‒ С. 10-12.
4. Волошина Н. Б., Осипенко М. Ф., Литвинова Н. В., Волошин А. Н. Гемохроматоз – современное состояние проблемы // Терапевтический архив. – 2018. ‒ Т. 90, № 3. – С. 107-112. doi: 10.26442/terarkh2018903107-112.
5. Долгов В. В., Луговская С. А., Морозова В. Т., Почтарь М. Е. Лабораторная диагностика анемий. – М.: Тверь, 2009. – 148 с.
6. Каминская Г. О., Абдуллаев Р. Ю., Батурова Г. А., Комиссарова О. Г. Особенности обеспеченности организма железом у больных туберкулезом легких на фоне лечения // Туб. и болезни легких. ‒ 2009. ‒ № 7. ‒ С. 46-55.
7. Каминская Г. О., Абдуллаев Р. Ю., Комиссарова О. Г. Место растворимых рецепторов трансферрина в выявлении природы железодефицитных состояний у больных туберкулезом легких // Туб. и болезни легких. ‒ 2013. ‒ № 8. ‒ С. 21-27.
8. Лукина Е. А., Деженкова А. В. Метаболизм железа в норме и при патологии // Клиническая онкогематология. – 2015. – Т. 8, № 4. – С. 355-361.
9. Мильто И. В., Суходоло И. В., Прокопьева В. Д., Климентьева Т. К. Молекулярные и клеточные основы метаболизма железа у человека (обзор) // Биохимия. – 2016. ‒ Т. 81, № 6. ‒ С. 725-742.
10. Abella V., Scotece M., Conde J. et al. The potential of lipocalin-2/NGAL as biomarker for inflammatory and metabolic diseases // Biomarkers. – 2015. – Vol. 20, № 8. – P. 565-571. doi: 10.3109/1354750X.2015.1123354.
11. Arnold F. M., Weber M. S., Gonda I. et al. The ABC exporter IrtAB imports and reduces mycobacterial siderophores // Nature. – 2020. – Vol. 580, № 7803. – P. 413-417. doi:10.1038/s41586-020-2136-9.
12. Berlin T., Meyer A., Rotman-Pikielny P. et al. Soluble transferrin receptor as a diagnostic laboratory test for detection of iron deficiency anemia in acute ilness of hospitalized patients // IMAJ. ‒ 2011. ‒ Vol. 13. ‒ P. 96-98.
13. Camaschella C. Iron and hepcidin: a story of recycling and balance // Hematol. Am. Soc. Hematol. Educ. Program. – 2013. ‒ № 2013. ‒ Р. 1-8. doi: 10.1182/asheducation-2013.1.1.
17. Cronje L., Bornman L. Iron overload and tuberculosis: a case for iron chelation therapy // Int. J. Tuberc. Lung Dis. – 2005. ‒ Vol. 9. – P. 2-9.
18. D’Angelo G. Role of hepcidin in the pathophysiology and diagnosis of anemia // Blood Res. ‒ 2013. ‒ Vol. 48, № 1. ‒ P. 10-15.
19. Dai Y., Shan W., Yang Q. et al. Biomarkers of iron metabolism facilitate clinical diagnosis in Mycobacterium tuberculosis infection // Thorax. ‒ 2019. ‒ Vol. 74. – P. 1161-1167.
20. De Voss J. J., Rutter K., Schroeder B. G. et al. The salicylate-derived mycobactin siderophores of Mycobacterium tuberculosis are essential for growth in macrophages // Proc. Natl. Acad. Sci. U.S.A. – 2000. ‒ Vol. 97. – P. 1252-1257.
21. Delanghe J. R., Langois M. R. Haptoglobin polymorphism and body iron stores // Clin. Chem. Lab. Med. – 2002. ‒ Vol. 40, № 3. ‒ P. 212-216.
22. Eid Ch., Hemadi M., Ha-Duong N.-T., Chahine J-M. Iron uptake and transfer from ceruloplasmin to transferrin // Biochim. Biophys. Acta. – 2014. ‒ Vol. 1840, № 6. – P. 1771-1781. doi: 10.1016/j.bbagen.2014.01.011.
23. Flo T. H., Smith K. D., Sato S. et al. Lipocalin 2 mediates an innate immune response to bacterial infection by sequestrating iron // Nature. ‒ 2004. – Vol. 432. – P. 917-921.
24. Gangaidzo I. T., Moyo V. M., Mvundura E. et al. Association of pulmonary tuberculosis with increased dietary iron // J. Infect. Dis. – 2001. – Vol. 184. – P. 936-939.
25. Gomes M. S., Boelaert J. R., Appelberg R. Role of iron in experimental Mycobacterium avium infection // J. Clin. Virol. ‒ 2001. ‒ Vol. 20, № 3. ‒ P. 117-122.
26. Gordeuk V. R., Moyo V. M., Nouraie M., Gangaidzo I. T., Murphree N. L., Gomo Z. A. R., Boelaert R., Weiss G. Circulating cytokines in pulmonary tuberculosis according to HIV status and dietary iron content // Int. J. Tuberc. Lung Dis. – 2009. – Vol. 13, № 10.- P. 1267-1273.
27. Hao L., Shan Q., Wei J., Ma F., Sun P. Lactoferrin: major physiological functions and applications // Curr. Protein. Pept. Sci. – 2019. – Vol. 20, № 2. – P. 139-144. doi: 10.2174/1389203719666180514150921.
28. Harrington-Kandt R., Stylianou E., Eddowes L. A. et al. Hepcidin deficiency and iron deficiency do not alter tuberculosis susceptibility in a murine M. tb infection model // PLoS ONE. – 2018. ‒ Vol. 13, № 1. ‒ P. e0191038.
29. Hella J., Cercamondi C. I., Mhimbira F., Sasamalo M., Stoffel N., Zwahlen M. et al. Anemia in tuberculosis cases and household controls from Tanzania: Contribution of disease, coinfections, and the role of hepcidin // PLoS ONE. ‒ 2018. – Vol. 13, № 4. – P. e0195985.
30. Isanaka S., Aboud S., Mugusi F. et al. Iron status predicts treatment failure and mortality in tuberculosis patients: A prospective cohort study from Dar es Salaam, Tanzania // PLoS ONE. – 2012. ‒ Vol. 7, № 5. – P. e38350.
31. Isanaka S., Mugusi F., Urassa W., Willett W. C., Bosch R. J., Villamor E. et al. Iron deficiency and anemia predict mortality in patients with tuberculosis // J. Nutr. – 2012. ‒ Vol. 142. ‒ P. 350-357.
32. Johnsona E. E., Wessling-ResnickbIron M. Metabolism and the innate immune response to infection // Microbes Infect. ‒ 2012. ‒ Vol. 14, № 3. ‒ P. 207-216.
33. Kumar N. P., Banurekha V. V., Nair D., Dolla Ch., Kumaran P., Babu S. Modulation of iron status biomarkers in tuberculosis-diabetes co-morbidity // Tuberculosis (Edinb). ‒2018. ‒ Vol. 108 ‒ P. 127-135.
34. Kurthkoti K., Amin H., Marakalala M. J. et al. The capacity of Mycobacterium tuberculosis to survive iron starvation might enable it to persist in iron-deprived microenvironments of human granulomas // MBio. ‒ 2017. – Vol. 8, № 4. – P. e01092.
37. Lounis N., Maslo C., Truffot-Pernot C., Grosset J., Boelaert R. J. Impact of iron loading on the activity of isoniazid or ethambutol in the treatment of murine tuberculosis // Int. J. Tuberc. Lung Dis. ‒ 2003. ‒ Vol. 7. ‒ P. 575-579.
38. Minchella P. A., Donkor S., McDermid J. M., Sutherland J. S. Iron homeostasis and progression to pulmonary tuberculosis disease among household contacts // Tuberculosis. ‒ 2015. ‒ Vol. 60. ‒ P. 764-772.
40. Nairz M., Theurl I., Wolf D., Weiss G. Iron deficiency or anemia of inflammation? // Wien Med. Wochenschr. – 2016. – Vol. 166. – P. 11-423. DOI 10.1007/s10354-016-0505-7.
41. Niederweis M., Wolschendorf F., Mitra A., Neyrolles O. Mycobacteria, metals, and the macrophage // Immunol. Rev. – 2015. – Vol. 264, № 1. – P. 249-263. doi:10.1111/imr.12265.
43. Pfeiffer C. M., Looker A. C. Laboratory methodologies for indicators of iron status: strengths, limitations, and analytical challenges // Am. J. Clin. Nutr. – 2017. – Vol. 106 (Suppl. 6). – p.1606S-1614S. doi: 10.3945/ajcn.117.155887.
44. Phelan J. J., Basdeo S. A., Tazoll S. C. et al. Modulating iron for metabolic support of TB // Host Defense. Front. Immunol. – 2018. – Vol. 9. – P. 2296. doi: 10.3389/fimmu.2018.02296.
45. Schaible U. E., Collins H. L., Priem F., Kaufmann S. H. Correction of the iron overload defect in beta-2-microglobulin knockout mice by lactoferrin abolishes their increased susceptibility to tuberculosis // J. Exp. Med. ‒ 2002. – Vol. 196. ‒ P. 1507-1513.
46. Sritharan M. Iron homeostasis in Mycobacterium tuberculosis: mechanistic insights into siderophore-mediated iron uptake // J. Bacteriol. ‒ 2016. – Vol. 198. ‒ P. 2399-2409.
47. Taha D. A., Thanoon Imad A.-J. Antioxidant status, C-reactive protein and iron status in patients with pulmonary tuberculosis // SQU Med. J. – 2010. ‒ Vol. 10. ‒ P. 361-369.
48. Theil E. C. Iron homeostasis and nutritional iron deficiency // J. Nutr. ‒ 2011. – Vol. 141. – P. 724S-728S.
49. van Lettow M., West C. E., van der Meer J. W. et al. Low plasma selenium concentrations, high plasma human immunodeficiency virus load and high interleukin-6 concentrations are risk factors associated with anemia in adults presenting with pulmonary tuberculosis in Zomba district, Malawi // Eur. J. Clin. Nutr. ‒ 2005. ‒ Vol. 59. ‒ P. 526-532.
50. Wang B., Timilsena Y. P., Blanch E., Adhikari B. Lactoferrin: structure, function, denaturation and digestion // Crit. Rev. Food Sci. Nutr. – 2019. – Vol. 59, № 4. – P. 580-596. doi: 10.1080/10408398.2017.1381583.
51. Wang J., Pantopoulos K. Regulation of cellular iron metabolism // Biochem. J. – 2011. – Vol. 434. – P. 365-381.
52. Ward P. P., Mendoza-Meneses M., Park P. W., Conneely O. M. Stimulus-dependent impairment of the neutrophil oxidative burst response in lactoferrin-deficient mice // Am. J. Pathol. – 2008. – Vol. 172. – P. 1019-1029.
53. Weiss G., Schaible Ulrich E. Macrophage defense mechanisms against intracellular bacteria // Immunol. Rev. – 2015. – Vol. 264. – P. 182-203.
54. Wilson B. R., Bogdan A. R., Miyazawa M. et al. Siderophores in iron metabolism: from mechanism to therapy potential // Trends. Mol. Med. – 2016. – Vol. 22, № 12. – P. 1077-1090. doi: 10.1016/j.molmed.2016.10.005.
55. Xiao X., San B. Y., Vijay-Kumar M. Lipocalin 2: an emerging player in iron homeostasis and inflammation // Annu Rev. Nutr. – 2017. – Vol. 21, № 37. – P. 103-130. doi: 10.1146/annurev-nutr-071816-064559.
Биохимия крови при туберкулезе. Биохимические показатели крови.
Из многих биохимических тестов, широко используемых в настоящее время в клинической практике, определенное значение имеет изучение состава белков крови, которые играют весьма важную роль в физиологических функциях и гомеостазе организма, в состоянии иммунитета, развитии и течении воспалительных реакций и т. д.
Сдвиги в белковом составе крови при туберкулезе зависят не только от его формы, но главным образом от фазы процесса, его осложнений и различных сопутствующих заболеваний. У больных с неактивными специфическими изменениями в легких и других органах в сыворотке крови определяется нормальное содержание общего белка, фибриногена, белковых фракций и гликопротеидов; отсутствует С-реактивный белок, не увеличена РОЭ, нет отклонений в коагуляционных пробах и т. д. При свежих, особенно остро протекающих, формах болезни, а также при обострении и прогрессировании хронического процесса наблюдается диспротеинемия, а иногда и гипопротеинемия, т. е. наступают количественные и качественные изменения в составе белков как проявление неспецифической гуморальной реакции на патологические сдвиги в организме. В таких случаях нарастает РОЭ, изменяются коагуляционные пробы, появляется С-реактивный белок, повышается уровень фибриногена, нарушается количественное соотношение белковых фракций и содержание белково-углеводных соединений (глико- и мукопротеидов, серомукоидов) в сыворотке и плазме крови.
Как показывают многочисленные исследования, в частности проведенные в клинике туберкулеза ЦОЛИУ врачей И. В. Алфимовой (1965), К. В. Бережковой (1955), Л. Н. Бринбауэр (1965), Р. А. Иоффе (1962) и др., эти сдвиги характеризуются уменьшением содержания альбуминов и повышением уровня глобулинов и гликопротеидов. При инфильтративной фазе процесса заметно увеличивается концентрация фракции глобулинов и гликопротеидов, а при фиброзно-кавернозном туберкулезе и эмпиеме плевры значительно нарастает, кроме того, уровень их фракции. При этих формах болезни снижается также концентрация липопротеидов и несколько повышается уровень Р-фракций. Чем острее и неблагоприятнее протекает туберкулез и чем тяжелее его осложнения, например амилоидозом, тем больше содержится в крови связанных с белками гек-соз, гексозаминов, серомукоидов и сиаловой кислоты. По мере затихания болезни протеинограмма постепенно приходит к норме, но медленнее, чем ускоренная РОЭ. Вместе с тем содержание глобулинов и гликопротеидов оказывается нередко повышенным в ранней фазе процесса. По данным Р. А. Иоффе (1962), из 119 больных различными формами туберкулеза легких у 65 при нормальных показателях РОЭ отмечались те или иные сдвиги в белковых фракциях сыворотки крови, главным образом в содержани альбуминов, глобулинов.
В связи с этим исследование белкового профиля важно при определении активности и динамики процесса, а также при оценке эффективности лечения. Оно играет меньшую роль в дифференциальной диагностике туберкулеза и других воспалительных или опухолевых заболеваниях легких, так как и при них имеют место подобные нарушепия белкового состава крови. Тем не менее при некоторых состояниях этот биохимический показатель приобретает известное значение, например в тех случаях, когда туберкулез напоминает по своей клинико-рентгенологической картине рак, саркоидоз, легочные проявления коллагенозов, при которых диспро-теинемия часто имеет более выраженный и своеобразный характер.
Тот же вывод следует сделать, оценивая результаты исследования содержания фибриногена в крови при различных заболеваниях органов дыхания. Как показали наблюдения Л. Н. Бирнбауэр (1965), проведенные в нашей клинике, его уровень обычно находится в пределах нормы при очаговом, инфильтративном и диссеминированном туберкулезе в фазе рассасывания и уплотнения или при стабильных туберкуломах. Он повышается при выраженных инфильтративных и деструктивных изменениях. Концентрация фибриногена, как и других белковых компонентов, повышается при раке, абсцессе, злокачественных опухолях средостения, но не претерпевает существенных сдвигов при саркоидозе, гамартохондроме, ненагноившихся кистах и т. д. Учет этих данных, конечно, в сочетании с основпыми клинико-рентгенологическими признаками важен при дифференциальной диагностике указанных заболеваний.
Из других показателей белкового обмена заслуживают внимания данные о составе свободных и, в частности, незаменимых аминокислот в сыворотке кроЕи. При активных формах туберкулеза легких часто уменьшается содержание цистеина, цистина, орнитина, валина, аргинина, гистидина и т. д. Эти сдвиги нарастают по мере утяжеления болезни и, наоборот, устраняются при ее затихании.
В то же время при изучении экскреции аминокислот с мочой у больных с эволютивными формами туберкулеза отмечается обратное соотношение: повышается суммарное содержание аминокислот и отдельных из заменимых (аспарагиновая кислота, серии, цистеин) и незаменимых ингредиентов (гистидин, аланин, тирозин, треонин, глутаминовая кислота и др.). Эти показатели в той или иной степени также нормализуются при благоприятном течении болезни. Характерно, что у больных саркоидозом органов дыхания даже при II и III стадиях, как показали наши наблюдения, существенные отклонения в аминокислотном составе крови не отмечаются.
Приведенные данные свидетельствуют, таким образом, о целесообразности изучения состояния белкового обмена при туберкулезе, что важно как в прогностическом, так и в диагностическом отношении.
Существенную роль в оценке функционального состояния и органических повреждений печени при туберкулезе и его осложнениях приобретают, как указывалось раньше, биохимические тесты: определение содержания в крови билирубина, альдолазы и активности аминотрансфераз, выделения конго красного, бромсульфалеина, исследование уровня сахара в крови после нагрузки глюкозой или галактозой.
Для выявления нарушений функции почек важно определение содержания остаточного азота в крови, мочевины, креатинина, индикана и т. д. О состоянии коры надпочечников можно судить по содержанию 17-кетостероидов в моче, а также свободных и белковосвязанных 11-оксикортикостероидов. Ценными являются сведения о нарушении обмена некоторых витаминов (тиамин, рибофлавин, пиридоксин, никотиновая кислота и др.), на уровень которых влияют не только туберкулезная интоксикация, но и различные химиопрепараты.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Обратимые сидеробластные анемии при алкоголизме, отравлениях и дефиците меди
Анемия, наблюдающаяся у многих больных алкоголизмом, обычно обусловлена комплексом причин. Одним из гематологических проявлений алкоголизма является сидеробластная анемия. Кольцевые сидеробласты в костном мозге выявляются у 25-30% пациентов, что связано с ингибирующим воздействием этанола на биосинтез гема.
Уровень гемоглобина обычно в пределах 60-100 г/л. Показатель MCV в норме или повышен. У 1/3 больных в периферической крови определяются сидероциты. В костном мозге нередко обнаруживается мегалобластический тип кроветворения. Частой находкой являются вакуолизированные клетки эритроидного ряда. Количество кольцевидных сидеробластов в костном мозге колеблется от 10 до 70%. Уровень ферритина сыворотки крови и сатурация трансферрина обычно повышены.
Спустя некоторое время после прекращения токсического действия алкоголя (от нескольких дней до двух недель) кольцевые сидеробласты исчезают из костного мозга. Уровень гемоглобина восстанавливается обычно через несколько недель. Быстрое восстановление нормального кроветворения может сопровождаться ретикулоцитозом, эритроидной гиперплазией костного мозга и симулирует гемолитическую анемию.
Обратимые сидеробластные анемии, связанные с приемом медикаментов
Противотуберкулезные препараты как причина сидеробластных анемий. Обратимая сидеробластная анемия на фоне лечения туберкулеза отмечается преимущественно при использовании изониазида, редко — пиразинамида и циклосерина. Все эти медикаменты нарушают метаболизм витамина В6 в организме, что в конечном итоге отражается на синтезе гема.
Вероятность развития сидеробластной анемии при туберкулезе невелика. В этих случаях анемия развивается спустя 1-10 месяцев после начала лечения изониазидом и часто бывает тяжелой. Характерны гипохромия и микроцитоз эритроцитов в периферической крови. Количество кольцевых сидеробластов в костном мозге различно. Анемия обычно купируется после прекращения приема препарата или при использовании высоких доз пиридоксина на фоне лечения противотуберкулезными медикаментами.
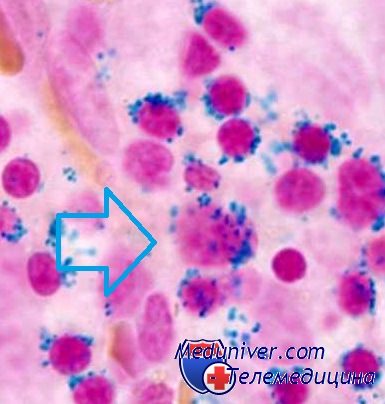
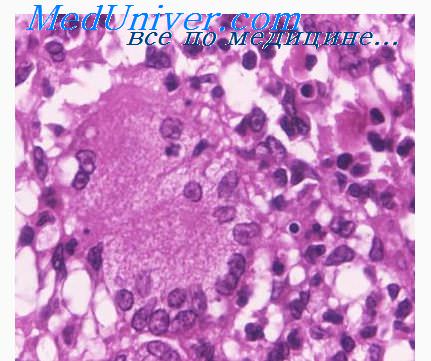
Хлорамфеникол как причина сидеробластных анемий. Хлорамфеникол (левомицетин) обладает дозозависимой обратимой гематологической токсичностью, проявляющейся супрессией эритропоэза и появлением кольцевых сидеробластов. Патогенез связан с ингибирова-нием синтеза белков мембраны митохондрий.
При обследовании определяются анемия, ретикулоцитопения, повышение концентрации сывороточного железа, кольцевые сидеробласты в костном мозге. Все изменения исчезают после прекращения приема препарата.
Обратимые сидеробластные анемии, ассоциированные с дефицитом меди
Дефицит меди достаточно редко развивается у человека, так как ее ежедневная потребность намного ниже количества, которое поступает с пищей. Снижение уровня меди в организме обычно наблюдается после гастрэктомии, а также на фоне длительного парентерального питания. При дефиците меди вторично страдает обмен железа, что и является основным патогенетическим механизмом развития анемического синдрома.
При несвоевременной диагностике анемия постепенно прогрессирует и достигает тяжелой степени (уровень гемоглобина может снижаться до 40-50 г/л). Уровень MCV обычно в пределах нормы или незначительно повышен, хотя в мазке периферической крови встречаются гипохромные микроциты. Характерны лейкопения и нейтропения (содержание гранулоцитов чаще всего ниже 1 • 10 9 /л). Количество тромбоцитов в пределах нормы.
В костном мозге отмечается гипоплазия эритроидного и гранулоцитарного ростка, кольцевые сидеробласты. Уровень сывороточного железа и сатурация трансферрина обычно в пределах нормы. При устранении дефицита меди происходит быстрое и полное восстановление нормального кроветворения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кровь при туберкулезе. Гематологические показатели туберкулеза.
В результате интоксикации, изменения реактивности организма и тканевых повреждений у больных туберкулезом наступают различные по характеру сдвиги в кроветворной системе. Существенную роль играют при этом не столько форма, сколько фаза и динамика процесса. При ограниченных и малоактивных его формах количество эритроцитов обычно находится в пределах нормы и отсутствуют признаки анемии. При массивных инфильтратах или творожистой пневмонии, при распространенном казеозном лимфадените, специфическом поражении кишечника, вовлечении в процесс печени, селезенки, костного мозга, а также после больших легочных или послеоперационных кровотечений отмечаются падение количества эритроцитов и изменение их морфологии (олиго- и полихромазия), а иногда мегалобластическая, апластическая или анемия смешанного типа (мегалобластическая и железодефицитная). При этом увеличивается содержание не вполне созревших эритроцитов — ретикулоцитов (свыше 0,5—1 % ) и количество кровяных пластинок (более 250 000—300 000). Подобным образом изменяется и эритропоэтическая функция костного мозга.
Чаще и в большей мере при туберкулезе, но главным образом при выраженных, прогрессирующих и осложненных его формах изменяется лейкограмма. В части случаев может отмечаться умеренный лейкоцитоз (до 10000—15 000 лейкоцитов), реже лейкопения. Так, Е. Л. Кан (1972) наблюдала лейкопению у 20,7% больных с ограниченными и легко протекавшими формами процесса и у 12,5% — при деструктивном и прогрессирующем туберкулезе легких.
Наиболее часто сдвиги наступают в лейкоцитарной формуле. Увеличивается количество нейтрофилов как в абсолютном, так и в относительном выражении за счет палочкоядерных форм (до 15—20%). Одновременно уменьшается содержание лимфоцитов (до 8—15%). При выраженном и затянувшемся инфильтративном процессе и обширном бронхогенном обсеменении появляется патологическая зернистость нейтрофилов. При диссеминации, по наблюдениям Н. Н. Боброва (1950) и Н. А. Шмелева (1959), нарастает моноцитоз (до 10—18%).
Заслуживает внимания указание на увеличение абсолютного количества базофилов при активном туберкулезном процессе. Тромбоцитарный профиль периферической крови характеризуется увеличением удельного веса форм раздражения и дегенеративных элементов, что обусловлено степенью активности процесса и интоксикации.
Таким образом, отдельные фазы туберкулеза легких характеризуются следующими гематологическими синдромами.
Фаза инфильтрации: умеренный или значительный лейкоцитоз, выраженный сдвиг пейтрофилов влево, нормальное или повышенное содержание нейтрофилов с патологической зернистостью, умеренное или значительное ускорение РОЭ, смещение тромбоцитограммы вправо за счет повышения содержания форм раздражения и дегенеративных элементов.
Фаза распада: небольшой лейкоцитоз или нормальное количество лейкоцитов, увеличение процента нейтрофилов с патологической зернистостью и сдвигом влево, иногда с появлением миелоцитов, уменьшение количества эозинофилов и лимфоцитов, значительное ускорение РОЭ.
Фаза гематогенной диссеминации: нормальное количество лейкоцитов, абсолютный и относительный моноцитоз.
Фаза рассасывания: увеличение количества эозинофилов и лимфоцитов, отсутствие ядерного сдвига влево.
Фаза уплотнения: нормальные показатели гемограммы, иногда лимфоцитоз.
Гемограмма у больных туберкулезом изменяется в процессе лечения. В благоприятных случаях нормализуется количественный и качественный состав кровяных клеток. Такие положительные сдвиги наступают обычно спустя 2—3 мес, т. е. через более длительный срок после исчезновения лихорадки и других симптомов интоксикации. Гематологические сдвиги исчезают тем быстрее, чем успешнее терапевтическое вмешательство, т. е. чем скорее прекращается интоксикация, рассасываются очаги и зоны инфильтрации, закрываются каверны, прекращается бацилловыделение.
Вместе с тем следует иметь в виду воздействие на гемопоэз различных антибактериальных препаратов. Они нередко вызывают эозинофилию, в отдельных случаях — лейкоцитоз, а чаще лейкопению; иногда при этом угнетается образование нейтрофилов вплоть до аграпулоцитоза и может стимулироваться лимфоидно-ретикулярная реакция. Эти изменения наступают в результате аллергизирующего или токсического действия препаратов на костный мозг.
При развитии агранулоцитоза необходимо прекратить прием вызвавшего его медикамента. Аллергизация к препарату определяется лабораторными пробами (тест Шелли, реакция Уанье). Назначение нуклеината натрия или пентоксила, кортикостероидных гормонов, поливитаминов, гемотрансфузии способствует восстановлению костно-мозгового кроветворения.
Таким образом, систематический гематологический контроль и правильный анализ полученных при этом результатов имеют существенное значение для оценки клинического состояния больного, динамики процесса и эффективности применяемого лечения. Гематологические данные приобретают определенное значение и при дифференциальной диагностике туберкулеза и других заболеваний органов дыхания.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

1. Баласанянц Г.С., Суханов Д.С., Айзиков Д.Л. Побочные действия противотуберкулезных препаратов и методы их устранения: учебное пособие. СПб. 2011. 353 с.
2. Иванова Д.А. Гематологические осложнения противотуберкулезной химиотерапии // Туберкулез и социально значимые заболевания. 2014. №4. С.56-65.
3. Иванова Д.А., Борисов С.Е, Рыжов А.М., Иванушкина Т.Н. Частота и риск развития тяжелых нежелательных реакций при лечении впервые выявленных больных туберкулезом // Туберкулез и болезни легких. 2012. №12. С.15-22.
4. Клинические рекомендации по диагностике и лечению туберкулеза органов дыхания у взрослых. Национальная ассоциация фтизиатров. М., 2013. 48 с.
5. Смирнова Н.Г., Чефу С.Г., Коваленко А.Л. Влияние инфузионного гепатопротектораремаксол на функцию печени крыс на модели обтурационной желтухи // Экспериментальная и клиническая фармакология. 2010. № 9. С. 24-28.
Изменения показателей общего анализа крови – нередкое явление у больных туберкулезом. Они отражают тяжесть интоксикации, особенности реактивности организма, степень тканевых повреждений, наличие сопутствующей патологии и нарушений нутритивного статуса, в редких случаях свидетельствуют о специфическом поражении органов кроветворной системы 2. Как правило, успешное лечение туберкулеза сопровождается нормализацией гемограммы. Однако у части больных в ходе противотуберкулезной терапии появляются негативные сдвиги гематологических показателей, свидетельствующие о нежелательном побочном действии противотуберкулезных препаратов. Частота гематологических побочных реакций невелика – от 1,2 до 22,8%. Нарушения в системе крови – редкое, но потенциально опасное осложнение противотуберкулезной химиотерапии. Среди гемотоксических побочных реакций наиболее значимыми являются цитопенические синдромы. Противотуберкулезные препараты могут вызывать уменьшение тех или иных пулов кровяных клеток вследствие миелосупрессии (подавления их образования в костном мозге) либо ускоренного разрушения в кровяном русле [4, 5]. Представляем клинический случай гемотоксической побочной реакции на фоне противотуберкулезной химиотерапии.
Цель исследования: показать клиническое наблюдение гемотоксической реакции на фоне проводимой противотуберкулезной терапии у пациентки 20 лет.
15.11.2016 г. проведена ЦВК по оценке эффективности и исхода химиотерапии туберкулеза № 267 по плановому контролю. Пациентка получила 120 доз по I режиму химиотерапии. В динамике отмечается прекращение бактериовыделения, сохраняются мелкие полости распада S1-2 правого легкого. С учетом данных рекомендуется продлить интенсивную фазу режима химиотерапии до 150 доз. 09.12.2016 г. проведена консультация торакального хирурга. Заключение после проведенной консультации: показано хирургическое лечение. В связи с сохранением полостей распада рекомендован перевод в хирургическое отделение после 09.01.2017 г.
20.01.2017 г. переведена в хирургическое отделение Клиники № 1 на оперативное лечение.
25.01.2017 г. проведен 1-й этап хирургического лечения: резекция S1-2 левого легкого. 09.02.2017 г. проведен 2-й этап хирургического лечения: атипическая резекция S1-3 правого легкого.
С 27.02.2017 г. послеоперационный период протекал без осложнений. Переведена в детское отделение № 2 с диагнозом: диссеминированный туберкулез легких с формированием туберкулом. Резекция S1-2 левого легкого 25.01.2017 г., S1-3 правого легкого 09.02.2017 г.
01.03.2017 г. проведена ЦВК с целью проведения анализа эффективности и исхода химиотерапии туберкулеза № 46 на внеплановый контроль. Решением ЦВК рекомендована терапия с 02.03.2017 г. ИФ РХТ: изониазид, пиразинамид, этамбутол, ПАСК (HZEPas) на 2 месяца. Далее на 4 месяца назначить фазу продолжения. Очередной контроль в мае 2017 г. после приема 60 доз.
06.03.2017 г. – 11.03.2017 г. периодически отмечает появление болей в суставах верхних и нижних конечностей, появление скованности в суставах. Визуально суставы не изменены. Отечности и гиперемии нет.
12.03.2017 г. Жалобы на насморк, кашель с мокротой, першение в горле, боли в суставах. Диагноз: ОРВИ. Острый фарингит.
13.03.2017 г. Пациентка предъявила жалобы на боли в суставах верхних и нижних конечностей, общую слабость, отмечено повышение температуры тела до 37 о С.
14.03.2017 г. 13.00 час. Осмотрена педиатром. Жалобы на першение в горле, редкое покашливание. Самочувствие не страдает. Общее состояние ближе к средней степени тяжести. Поведение активное. Легкая гиперемия зева. На мягком нёбе единичные петехии. Кожные покровы бледные, на голенях единичные бледные синяки.
Температура тела 36,6 о С. АД 110/60 мм рт. ст. ЧСС 90 ударов в 1 минуту.
Заключение. Нормохромная анемия 3-ей степени. Тромбоцитопения.
Рекомендовано: назначить общий анализ крови и мочи. Провести УЗИ внутренних органов, рентгенографию органов грудной клетки. Отменить лечение. Назначить консультацию гематолога.
В результате проведенного обследования получены следующие результаты.
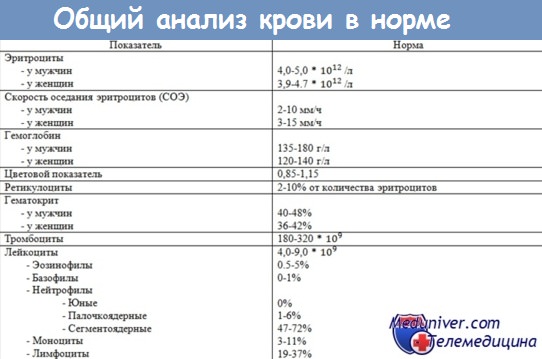
Показатели анализа крови от 12.00 час, 13.03.2017 г. получены 14.03.2017 г.: эритроциты 2,06, гемоглобин 62, лейкоциты 4,7, тромбоциты 17, СОЭ 57 мм/час, сегментоядерные гранулоциты 55, палочкоядерные гранулоциты 11, эозинофилы 3, моноциты 4. По результатам показателей в общем анализе крови выявлены анизоцитоз, нормохромная анемия тяжелой степени (табл. 1).
Читайте также:

