Какая инфекция может быть в крови у ребенка при рождении
Обновлено: 18.04.2024
Общий анализ крови у детей в норме. Причины отклонений
Общий анализ крови в педиатрической практике имеет не менее важное значение чем в диагностике заболеваний взрослого человека. От этого исследования начинают отталкиваться при любом обращении к врачу, а первый обязательный общий анализ крови проводят уже на пятый день жизни ребенка. Картина крови ребенка обладает рядом особенностей и отличий от таковой у взрослых, поэтому любому профессиональному педиатру необходимо знать множество нюансов, чтобы поставить правильный диагноз или вовремя распознать развитие какого-либо заболевания.
Первой важной особенностью общего анализа крови у детей является высокая изменчивость результатов, которая зависит от множества факторов - возраста ребенка, его диеты, физической активности, даже эмоционального состояния и атмосферы в семье. Особой лабильностью отличается кровь детей возрастом до двенадцати месяцев, поэтому нормы основных показателей общего анализа крови в этот период можно лишь приблизительно выразить в такой таблице:
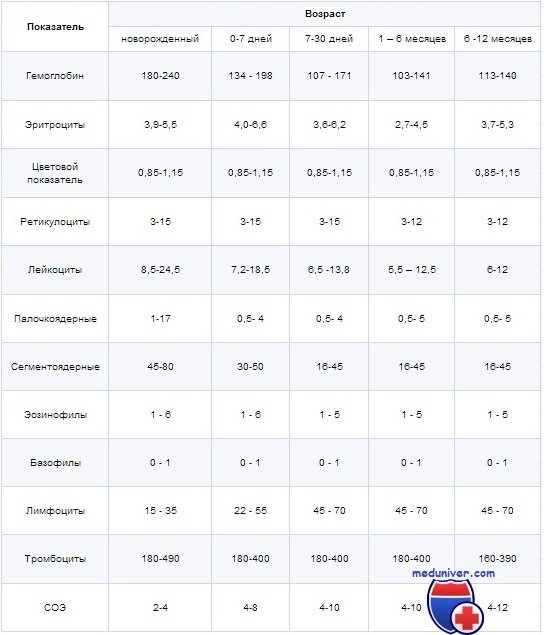
Как видим, картина крови разительно меняется уже в первые несколько дней жизни ребенка, особенно это касается гемоглобина, эритроцитов и лейкоцитарной формулы. Эритроцитоз ребенка связан с относительно низким содержанием кислорода в крови матери, поэтому для нормального обеспечения тканей и органов необходимо много гемоглобина и к тому же особого строения - так называемого гемоглобина F, который легче связывает молекулы газов. После рождения и начала работы дыхательной системы необходимость в таком количестве гемоглобина отпадает и начинается массированный распад эритроцитов и образование новых со "взрослым" гемоглобином А, что служит причиной, помимо изменения картины общего анализа крови, еще и транзиторной (физиологической) желтухи.
В крови новорожденного ребенка, в отличии от взрослого, наблюдается довольно сильный лейкоцитоз (повышение уровня лейкоцитов). Причины этого понятны - после рождения малыш начинает контактировать с огромным количеством новых антигенов окружающий среды, что и является сильным стимулятором образования новых иммунокомпетентных клеток. Лейкоцитоз в первые месяцы жизни ребенка является нормальным этапом формирования и развития иммунной системы.
Не менее разительные изменения происходят не только в количественном, но и качественном составе лейкоцитов, которые состоят из нескольких типов клеток. Рождается ребенок с преобладанием нейтрофилов, особенно их сегментоядерной фракции (такая же картина наблюдается и у взрослого человека), однако сразу после рождения их количество начинает падать при одновременном росте числа лимфоцитов. Все это приводит к тому, что примерно к концу первой недели жизни их количество уравнивается (так называемый, первый физиологический перекрест лейкоцитарной формулы), а затем лимфоцитов становиться значительно больше, чем нейтрофилов. Такое распределение лейкоцитов в общем анализе крови ребенка сохраняется на несколько лет, вплоть до дошкольного периода. Причиной такого явления также являются особенности развития иммунной системы ребенка.
В последующие годы жизни картина крови уже не меняется столь динамично, но, тем не менее, наблюдается постепенный рост многих параметров и их изменение под значения взрослого человека. Картина общего анализа здоровых детей до начала подросткового периода представлена в таблице:
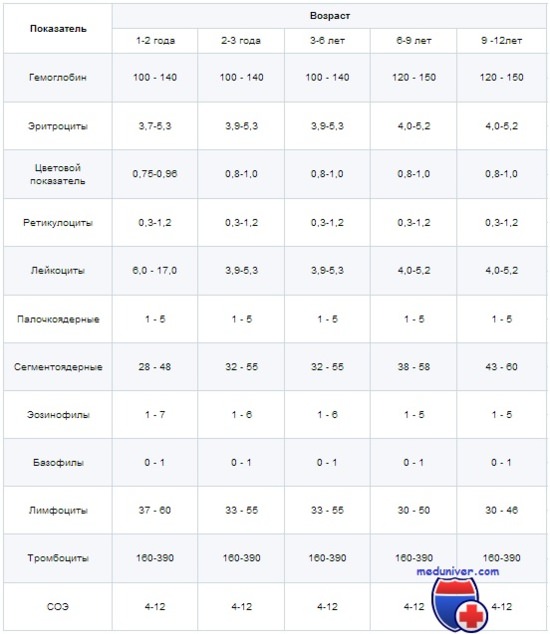
За этот период наблюдается рост количества эритроцитов и гемоглобина до показателей взрослого человека, преобразование лейкоцитарной формулы и снижение общего числа лейкоцитов. После окончания грудного периода количество гемоглобина в крови ребенка находиться на уровне 100 г/л, что вполне покрывает потребности тканей. Однако при росте изменяется соотношение массы, площади поверхности и пропорций тела, что вынуждает кровеносную систему работать эффективней и количество эритроцитов с гемоглобином неуклонно повышается.
В пред- и дошкольный период большинство детей успевают переболеть хотя бы некоторыми детскими инфекциями - вопреки возражениям родителей, это полезно для иммунной системы малыша, подобные болезни являются тренировкой защитных сил организма. Поэтому со временем количество иммунокомпетентных клеток в общем анализе крови снижается, достигая к 3-4 годам нормального уровня взрослого человека. Также этапом созревания иммунной системы является "второй физиологический перекрест лейкоцитарной формулы" - к шести-семи годам количество лимфоцитов и нейтрофилов снова уравнивается, а затем начинают преобладать сегментоядерные лимфоциты.
Несмотря на описанные особенности и высокую изменчивость показателей общего анализа крови у детей хороший педиатр должен уметь увидеть патологические изменения в картине крови для постановки верного диагноза. Здесь мы рассмотрим наиболее частые причины изменений крови у детей, которые у взрослых практически не встречаются или обнаруживаются очень редко.
Гемоглобин и эритроциты - это основная часть крови, которая ответственна за питание тканей и снабжение их кислородом, что особенно важно в условиях быстро растущего и развивающегося организма. У детей первых лет жизни "скачки" этих показателей не редкость. Повышение количества эритроцитов и гемоглобина у грудного ребенка чаще всего свидетельствует об обезвоживании, которое в этом возрасте развивается очень быстро, особенно при рвоте, диарее, высокой температуре. Постоянно высокие значения этих показателей могут натолкнуть на мысль о пороках развития сердца или почек - эритроцитоз сопровождает митральные и аортальные пороки, а также комплексные дефекты развития сердца. Высокий уровень гемоглобина и эритроцитов может возникать при стенозе почечных артерий и некоторых опухолевых заболеваний.
Снижение уровня гемоглобина или анемия встречается намного чаще. Причиной этого явления может быть использование неадаптированных смесей при питании ребенка или недостаточное поступление продуктов с железом в более старшем возрасте. Сильная анемия может быть основным симптомом некоторых наследственных заболеваний (талассемия) или последствием кровопотери.
Лейкоциты - особую проблему в расшифровке общего анализа крови ребенка составляет интерпретация полученной цифры количества лейкоцитов. Все дело в том, что этот показатель очень тонко реагирует на малейшие раздражители - от инфекционных агентов до перемены положения тела (ортостатический лейкоцитоз). Поэтому за среднюю норму берутся данные из таблицы, а к родителям предъявляют особые требования к подготовке ребенка к забору крови:
- Накануне процедуры не следует резко менять режим питания (давать новую смесь, ранее неизвестные ребенку продукты), стоит также воздержаться от жирной и высокобелковой пищи;
- Количество стрессовых для ребенка следует также резко снизить - при плаче и других сильных эмоциях у детей количество лейкоцитов увеличивается;
- При далеком расположении поликлиники или лаборатории от дома, ребенка лучше привезти туда для сдачи анализов, а не идти пешком - физическая нагрузка также может быть причиной лейкоцитоза. Как вариант - ребенка можно принести на руках.
Повышение лейкоцитов может быть симптомов гнойных и воспалительных заболеваний. Очень сильное повышение лейкоцитов (в разы выше нормы) может быть признаком онкологического заболевания - лейкоза или лимфомы. Снижение количества лейкоцитов наблюдается в случае некоторых специфических инфекций (краснухи, гепатита), при общем истощении и гиповитаминозе, некоторых аутоиммунных заболеваниях (ревматизме, красной волчанке).
Эозинофилы - особую роль в диагностике многих детских заболеваний является определение такого показателя, как эозинофилы. Эта фракция лейкоцитов участвует в "погашении" аллергического процесса и утилизации гистамина. Повышение количества эозинофилов (эозинофилия) может быть первым симптомом таких серьезных заболеваний, как бронхиальная астма, поллиноз, аллергический диатез. Эозинофилия в общем анализе крови также свидетельствует о наличии глистной и протозойной инвазии, что также более часто встречается у детей, чем у взрослых. Нередко повышенный уровень эозинофилов является поводом для полного обследования организма на предмет наличия паразитов или аллергического процесса.
Учебное видео - общий анализ крови в норме и при болезни
- Рекомендуем посетить наш раздел с интересными материалами на аналогичные тематики "Профилактика заболеваний"
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Причины инфекции у новорожденных. Определяемся
Проводится рентгенография грудной полости наряду со скринингом сепсиса, включающим полный анализ крови для выявления нейтропении и культур крови. Белки острой фазы (С-реактивный белок — СРБ) полезны, однако для их увеличения требуется 12-24 ч, поэтому один положительный результат не исключает инфекцию, однако два последовательных нормальных значения достоверно подтверждают отсутствие инфекции.
Антибиотики назначают сразу же, не дожидаясь результатов посева культуры. Антибиотики против стрептококков группы В, Listeria monocytogenes и других грамположительных микроорганизмов (обычно бензилпенициллин или амоксициллин) вводятся внутривенно в сочетании с антибиотиками против грамотрицательных бактерий (обычно аминогликозидами, например гентамицином). Если результат посева культур и ЦРП отрицательный и младенец клинически выздоравливает, через 48 ч прекращается введение антибиотиков.
Если результат посева культур положительный и если имеются какие-либо неврологические признаки, необходимо провести обследование и посев СМЖ.

Инфекции новорожденных с поздним началом (>72 ч)
Спустя 72 ч после рождения источником инфекции становится обстановка, окружающая ребёнка. Проявления инфекции обычно неспецифичные.
Клинические особенности неонатального сепсиса:
- Жар, или нестабильность температуры, или гипотермия.
- Плохое питание.
- Рвота.
- Апноэ и брадикардия.
- РДС.
- Сонливость.
- Желтушность.
- Нейтропения.
- Гипо-/гипергликемия.
- Шок.
- Раздражительность.
- Судороги.
- Вздутие живота.
При менингите у новорожденных наблюдают:
- отведение головы кзади (опистотонус);
- напряжённые или выбухающие роднички.
В неонатальном отделении или послеродовой палате имеется высокий риск инфицирования нозокомиальными инфекциями. Весь персонал должен строго придерживаться правил по эффективной обработке рук для предотвращения перекрёстного инфицирования. При интенсивной терапии другими основными источниками инфицирования являются установленные катетеры для парентерального питания или забора проб крови для анализа газового состава, трахеальные трубки, инвазивные процедуры, нарушающие защитный кожный барьер.
В данной ситуации коагулазонегативный стафилококк (Staph, epidermidis) является наиболее часто встречающимся патогеном, однако спектр микроорганизмов широкий и включает Staph, aureus, Escherichia coli, Pseudomonas species, грибы, например Candida. Цель первоначальной терапии (например, флуклоксациллином или гентамицином) — ирадикация большинства стафилококков и грамотрицательных бактерий. Если микроорганизмы устойчивы к этим антибиотикам или состояние младенца не улучшается, необходимы более мощные антибиотики (например, ванкомицин). Серийные исследования белков острой фазы (СРВ) позволяют проводить мониторинг ответа на терапию.
Менингит в неонатальном периоде встречается редко, однако уровень смертности при нём составляет 20-50%, а у трети выживших младенцев остаются серьёзные последствия. Клинические признаки аналогичны таковым при других формах неонатального сепсиса. Выбухание родничка и гиперэкстензия шеи и спины (опистотонус) являются поздними признаками.
Если подозревается менингит, назначают ампициллин или пенициллин и цефалоспорин III поколения (например, цефотаксим, проникающий в СМЖ).
Осложнения включают абсцесс мозга, вентрикулит, гидроцефалию, нарушения слуха и развития нервной системы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Цитомегаловирусная инфекция у детей — это инфекционное заболевание, которое вызвано цитомегаловирусом и поражает слюнные железы, внутренние органы, ЦНС. В детстве патология чаще возникает при трансплацентарном или интранатальном заражении. Локализованные формы проявляются сиаладенитом, гепатитом, нефритом и т. д., распространенный вариант инфекции характеризуется поражением головного мозга, легких, почек и органов ЖКТ. Диагностика предполагает идентификацию возбудителя цитологическими, гистологическими, серологическими и молекулярно-биологическими методами. Лечение цитомегаловирусной болезни проводится специфическим иммуноглобулином и противовирусными препаратами.
МКБ-10
Общие сведения
Заражение цитомегаловирусной инфекцией (ЦМВИ) наблюдается у 20%‒60% всего детского населения, но в большинстве случаев оно протекает бессимптомно. Внутриутробное инфицирование вирусом от больной матери происходит в 30-50% случаев, при этом до 18% младенцев после рождения имеют клинические симптомы. Учитывая полиморфизм клинической картины, ранняя диагностика и лечение у детей затруднены. Цитомегаловирусная инфекция представляет серьезную опасность, особенно для плода и новорожденного, у которых заболевание, как правило, вызывает необратимые осложнения.

Причины
Болезнь вызвана герпесвирусом 5 типа — Cytomegalovirus hominis. Он имеет 6 штаммов: Davis, AD 169, Kerr, C-87, Esp, Towne, причем ребенок может быть инфицирован сразу несколькими подтипами возбудителя. Цитомегаловирус (ЦМВ) имеет ДНК-геном, отличается медленной репликацией и сравнительно низкой вирулентностью. Он термолабилен, уничтожается при температуре более 56°С, но длительно сохраняет жизнеспособность в комнатных условиях.
При врожденной ЦВМИ передача вируса к плоду происходит трансплацентарно, при перинатальной инфекции — путем контакта с вагинальными выделениями матери, грудным молоком или препаратами крови. Риск заражения увеличивается, если мать с острой формой болезни не получает специфическое лечение. В постнатальном периоде ребенок чаще всего заражается от ближайших родственников и сверстников воздушно-капельным или контактно-бытовым путем.
Патогенез
Попадая в кровь, вирус реплицируется в лейкоцитах, моноцитах и макрофагах и в дальнейшем он пожизненно сохраняется в лимфоцитарных органах. Зачастую процесс выражается в виде латентной инфекции, при которой у ребенка нет симптомов, и ему не требуется лечение. Активность цитомегаловируса зависит от состояния иммунитета: при физиологической иммунной недостаточности, которая наблюдается у детей раннего возраста, риск манифестной цитомегаловирусной инфекции возрастает в разы.
Классификация
В детской инфектологии различают врожденную (внутриутробную) и приобретенную формы патологии. По течению инфекция бывает острой (до 3 месяцев), подострой (3-6 месяцев), затяжной (6-12 месяцев) и хронической (более 1 года). По клиническим признакам выделяют локализованный (сиаладенит, нефрит, гепатит, энцефалит) и генерализованный вариант. С учетом тяжести течения цитомегаловирусную болезнь делят на 3 степени:
- Легкая. Отличается незначительными патоморфологическими изменениями во внутренних органах, которые не сказываются на их функциональной активности.
- Среднетяжелая. Проявляется выраженными органическими поражениями в сочетании с клиническими симптомами и расстройством функции некоторых внутренних органов.
- Тяжелая. Манифестирует тяжелыми органическими патологиями, резко выраженной интоксикацией и генерализованным характером поражения.
Симптомы
Врожденная ЦМВИ
У пациентов с манифестной врожденной форме цитомегаловирусной болезни признаки наблюдаются с первых дней жизни. Типичный комплекс симптомов у новорожденных детей включает недоношенность и/или низкую массу тела, поражение гепатобилиарной системы (увеличение печени, желтуха, гепатиты и циррозы), лимфаденопатии и геморрагическую сыпь на коже. Если инфицирование произошло на ранних сроках беременности, ребенок рождается с аномалиями — микроцефалией, гипоплазией легких, атрезией пищевода.
Приобретенная ЦМВИ
Приобретенная цитомегаловирусная болезнь обычно протекает в субклинической или латентной форме, когда у ребенка возникают гриппоподобные симптомы, субфебрильная температура без видимой причины. После заражения инфекция может длительное время себя не проявлять и давать обострения при снижении иммунного статуса, действии неблагоприятных эндо- или экзогенных факторов.
Течение манифестной приобретенной формы напоминает инфекционный мононуклеоз. У ребенка внезапно появляется слабость, повышается температура, беспокоят недомогание, головные боли, отсутствует аппетит. Позже присоединяются сильные боли в горле, увеличиваются подчелюстные и шейные лимфоузлы. Если цитомегаловирусная инфекция проявляется сиаладенитом, наблюдается резкое увеличение и болезненность слюнных желез на фоне фебрильной лихорадки.
Генерализованная ЦМВИ
При генерализованном варианте течения инфекции у детей поражается бронхолегочная система (пневмонии, дыхательная недостаточность), ЖКТ (энтероколит, мальабсорбция), печень (желтуха, цитомегаловирусный гепатит, билиарный цирроз). Особенно опасно вовлечение в процесс нервной системы, что проявляется судорожным синдромом, парезами и параличами, задержкой психомоторного развития.
Осложнения
Поражение клеток при цитомегаловирусной болезни создает благоприятные условия для возникновения аутоиммунных поражений — системной красной волчанки, рассеянного склероза, гломерулонефрита. Иногда после малосимптомной врожденной цитомегаловирусной инфекции осложнения наблюдаются в отдаленном периоде (в возрасте ребенка 2-5 лет). В основном они проявляются неврологическими расстройствами и поражением органов чувств.
Диагностика
Цитомегаловирусная инфекция отличается многообразием клинических признаков и часто протекает под маской других патологий, что затрудняет работу детского инфекциониста. На первичном приеме, помимо стандартного физикального осмотра, врач собирает детальный акушерский анамнез, чтобы выявить факторы риска антенатального инфицирования. Диагноз ЦМВИ правомочен только при лабораторном подтверждении, для чего используют следующие методы:
Инструментальные методы подбираются соответственно форме заболевания. Для оценки структурно-функциональных особенностей печени и билиарного тракта назначают УЗИ органов брюшной полости. КТ и МРТ головного мозга информативны для выявления врожденных пороков и кальцификатов. Рентгенография ОГК необходима при симптомах дыхательных расстройств. По показаниям ребенка направляют на консультации к профильным специалистам— кардиологу, неврологу, отоларингологу.
Лечение цитомегаловирусной инфекции у детей
Препаратом выбора у новорожденных и детей первого года жизни является специфический антицитомегаловирусный иммуноглобулин, который имеет повышенную концентрацию IgG. Лечение начинают при манифестных формах заболевания и проводят по схеме: вначале вводится высокая доза препарата, а спустя 9-10 дней дозировку постепенно уменьшают, контролируя степень ответа на терапию и активность процесса.
В старшем возрасте перечень препаратов, применяемых при цитомегаловирусной инфекции, значительно расширяется. Лечение включает противовирусные средства из группы нуклеозидов и нуклеотидов (ганцикловир, валганцикловир), производные ортофосфорной кислоты (фоскарнет). При легкой и среднетяжелой формах назначают интерфероны, иммуностимуляторы.
Для купирования интоксикации показано обильное питье (при легких формах), при среднетяжелых и тяжелых клинических вариантах рекомендована инфузионная терапия. Патогенетическая терапия подбирается в соответствии с характером течения болезни и может включать пищеварительные ферменты, ингибиторы протеиназ, гемостатики. Для предупреждения вторичных бактериальных осложнений используют антибиотики (макролиды, цефалоспорины, гликопептиды).
Прогноз и профилактика
При малосимптомных приобретенных вариантах цитомегаловирусная болезнь протекает без осложнений, зачастую у ребенка выявляется только латентное носительство. Угрозу для жизни и здоровья представляют тяжелые генерализованные инфекции, которые в 50-60% случаев сопровождаются осложнениями, несмотря на проводимое лечение. Особо опасно поражение цитомегаловирусом для детей с иммунодефицитными состояниями.
Основу профилактики врожденной ЦМВИ составляет обязательное лабораторное обследование женщин на носительство цитомегаловируса, которое проводится при планировании зачатия и во время беременности. Если в семье есть пациент с цитомегаловирусной инфекцией, необходимо ограничить его общение с ребенком и обеспечить лечение. Карантинно-изоляционные мероприятия в отношении заболевших и контактных лиц не производятся.
2. Клинические рекомендации (протокол лечения) оказания медицинской помощи детям больным цитомегаловирусной инфекцией. — 2015.
Читайте также:

