Какие эфирные масла убивают стафилококки
Обновлено: 22.04.2024
Резюме. В работе была оценена антибактериальная активность эфирных масел (чайного дерева, ромашки, эвкалипта) в отношении роста золотистого стафилококка, а также альгинатных шариков с эфирными маслами.
Взаимодействие в связке между клетками и эфирными маслами измерялось с помощью оптического биосенсора. Антибактериальная активность эфирных масел с клеткой была оценена по взаимодействию в связке и соседстве. Антибактериальная активность проявилась у чайного дерева, ромашки и эвкалипта в порядке убывания по сравнению с эффектом торможения роста клетки при воздействии эфирных масел. Ассоциативная номинальная константа и соседство клетки в связке к эфирному маслу чайного дерева составили 5.0×10-13 мл/(КОЕ•s) и 5.0×105 мл/КОЕ соответственно. Соседство клетки в связке с чайным деревом было в 2 раза выше, чем у других эфирных масел. Возможно, что эффективная бактериальная активность эфирного масла чайного дерева происходит от высокой способности прилипать к клетке, которая выше, чем у других эфирных масел.
Введение
Эфирные масла известны как важные антимикробные вещества, содержащиеся в растениях, и могут также обладать антиоксидантной и противовоспалительной активностью. Эфирные масла – это сложные смеси соединений, куда входят главным образом моно терпены, сесквитерпены, а также их окисленные производные, такие как спирты, альдегиды, эфиры, кетоны, фенолы и другие. Таким образом, композиция эфирного масла – это баланс различных соединений, хотя у многих видов одна составляющая может преобладать над другой. Продукция, полученная из антимикробных растений, представляет особый интерес из-за устойчивости к антибиотикам, которую приобрели некоторые микроорганизмы. Эфирные масла, полученные из пряностей, лекарственных растений и трав, продемонстрировали свою антимикробную активность и могут быть использованы в качестве антимикробных веществ в борьбе с некоторыми патогенными бактериями. Эфирные масла и их компоненты известны своей активностью в отношении большого спектра микроорганизмов, включая грамположительные и грамотрицательные бактерии. Исследования показали, что грамотрицательные бактерии демонстрируют большую стойкость к эфирным маслам вследствие наличия липополисахаридов во внешней мембране.
Атопический дерматит является хроническим воспалительным кожным заболеванием, сопровождающимся гиперчувствительной реакцией на обычные аллергены из внешней среды. Бактериальная флора на коже пациентов, страдающих атопическим дерматитом, уникальна, и обычно среди этих бактерий присутствует золотистый стафилококк. Кроме того, известно, что пациенты, страдающие атопическим дерматитом, чаще других заболевают кератоконъюнктивитом, кератоконусом, катарактой и отслоением сетчатки.
Чайное дерево, эвкалипт и другие эфирные масла были сравнительно недавно признаны безопасными и эффективными антисептиками. В лабораторных условиях и клинических испытаниях они продемонстрировали потенциальную антибактериальную активность. Эти масла также используются в качестве терапевтического вещества при лечении атопического дерматита.
Как уже было сказано, масло чайного дерева обладает мощным антибактериальным эффектом. Было установлено в лабораторных условиях, что неразбавленное эфирное масло чайного дерева воздействует на золотистый стафилококк. Однако не совсем ясно почему именно эфирное масло чайного дерева обладает такой мощной антибактериальной активностью против золотистого стафилококка, которая намного превосходит действие других видов эфирных масел.
Поверхностные плазмонные резонансные (ППР) биосенсоры имеют большой диапазон применения, начиная от целевой характеристики, объединенного скрининга и заканчивая оптимизацией для поддержания клинических испытаний, нормативных утверждений и биофармацевтического производства. Такие биосенсоры также позволяют определять взаимодействие макромолекул в режиме реального времени без какого-либо химического изменения лигандов для генерирования сигналов. Связанные молекулы или лиганды ковалентно неподвижны на чипе сенсора, и связывающая молекула захватывается неподвижной лигандой в системе непрерывного потока. В дополнение, может быть также получен количественный анализ молекулярных взаимодействий и кинетических параметров, которые также возможно получить из биосенсорных систем.
С другой стороны, никакие исследования не сообщали об оценке антибактериальной активности эфирных масел на клетки в связывающем взаимодействии при использовании биосенсоров. Данное исследование бактериальной активности на рост золотистого стафилококка сфокусировано на оценке эфирных масел чайного дерева, ромашки и эвкалипта и альгинатных шариков с содержанием эфирных масел. Взаимодействие соединений между клетками и эфирными маслами было определено из результатов кинетических исследований соединений поверхностных плазмонных резонансных биосенсоров. Антибактериальная активность эфирных масел на клетки обсуждается в данной работе вместе с взаимодействием соединений и их соседства.
МАТЕРИАЛЫ И МЕТОДЫ
Микроорганизмы
Золотистый стафилококк был приобретен из корейской коллекции для типового культивирования. Клетки были выращены в течение 18 часов при температуре 37 градусов Цельсия в питательном бульоне
Реагенты
Были закуплены эфирные масла чайного дерева (Melaleuce Alternifolia, 99,9%), ромашки (Chamaemelum nobile, 99.9%) и эвкалипта (Eucalyptus globulus, 99.9%). Были также закуплены альгинат средней вязкости (3500cps при концентрации 2%) и хлорид кальция. Дифенол-4-4’-дитиол и другие химические вещества были использованы как реагенты без последующей очистки.
Подготовка альгинатных шариков и альгинатных шариков с содержанием эфирных масел
Альгинатные шарики были подготовлены капельным путем из раствора альгината (1%), который при помощи микрофидера был накапан в хлорид кальция при интенсивном помешивании. Подготовленные шарики были вымыты и высушены при комнатной температуре и чистые эфирные масла (400мкл) были смешаны и гомогенизированы при скорости 13500 оборотов в минуту в течение двух минут.
Антимикробный скрининг
Для определения антимикробной активности эфирных масел был использован агар, полученный методом дисковой диффузии. Суспензия золотистого стафилококка (1х108 КОЕ/мл) была распределена на твердых пластинках. Диски из фильтровальной бумаги (в диаметре 6мм) были индивидуально пропитаны 5мкл эфирных масел и помещены на инкубационные пластинки. Пластинки были оставлены при температуре 4 градуса Цельсия на 2 часа после того, как прошла инкубация при 37 градусах Цельсия в течение 24 часов. Диаметры зон ингибирования были измерены и указаны в миллиметрах. Каждый тест был проведен в трех экземплярах и повторен дважды.
Тест на торможение роста в питательном бульоне при помощи эфирных масел
Питательный бульон, используемый для теста на торможение роста клеток, состоит из пептона (5г), экстракта говядины (3г), агара (15г) и дистиллированной воды (1л). Рост золотистого стафилококка (1х108 КОЕ/мл) был остановлен в каждом питательном бульоне (100мл), к которому были добавлены чистые эфирные масла в различной концентрации. Концентрация клеток контролировалась как (1х106 КОЕ/мл), когда шарики с эфирными маслами были введены в бульон. Среда культуры поддерживалась встряхиванием при температуре 37 градусов Цельсия. Рост клеток был оценен посредством измерения всасывания среды культуры при 600нм, используя УФ /VIS спектрофотометр. Рост клеток был оценен по весу сухой клетки, определяемому из калибрирующей кривой веса сухой клетки по отношению к всасыванию при 600нм. Процент торможения роста был определен по формуле:
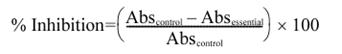
,
Анализ загрузки эфирных масел в шарики
Содержание эфирных масел в шариках было проанализировано газовым хроматографом, оснащенным FID детектором и капиллярной колонкой HP1 (внутренний диаметр 0,32мм, длина 50м, толщина пленки 0,17мкм). Вначале мы составили калибрирующие кривые эфирных масел из характерных пиковых областей для эфирных масел с различной концентрацией эфирных масел в этаноле. Шарики с эфирными маслами были растворены в этаноле в течение трех дней при помощи ультразвуковой очистки, а затем раствор была проанализирован методом газовой хроматографии. Рабочие условия для газового хроматографа были следующие: температура инжектора 290 градусов Цельсия FID температуры, температура газа-носителя гелия 250 градусов Цельсия. Температура в печи возрастала с 40 до 250 градусов Цельсия со скоростью 5 градусов в минуту, и самый высокий уровень температуры поддерживался в течение 5 минут.
Теория кинетического анализа
Постоянные величины ассоциации и диссоциации рассчитываются по кривой ППР сенсограммы, как описано в других исследованиях. Общее уравнение скорости для бинарной комплексной формулы записывается как:
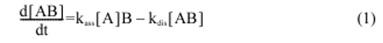
где [А] и [b] – связь лиганд аналита и поверхности соответственно,
k ass – постоянная скорости ассоциации,
k dis – постоянная скорости диссоциации в уравнении (1).
Решение уравнения для скорости образования:
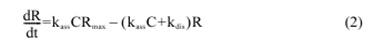
где dR/dt – скорость поверхностного комплексного образования,
R – значение величины RU, отражающей количество связи аналита к неподвижным лигандам на сенсорном чипе,
R max – значение величины RU, когда места связывания неподвижных лиганд насыщены аналитом,
С – концентрация аналита в свободном растворе.
Уравнение (2) можно переписать как:
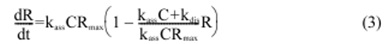
Уравнение (3) может быть выражено как интегральное уравнение (4).
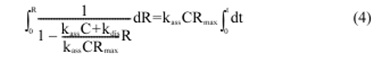
Интегральное уравнение может быть решено с вариацией R как функция от t, как показано в уравнении (5).

где k ass , k dis , Cи R max – постоянные.
Концентрация аналита С определяется посредством измерения ППР сенсограммы и R max , которая может быть получена по результатам оценки ППР сенсограммы.
Постоянные скорости k ass , k dis , определяются из результатов наилучшей кривой, подходящей к экспериментальным сенсограммам ППР. Приближение (КА) определяется как отношение k ass /k dis .
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Альгинатные шарики с эфирными маслами
Были подготовлены альгинатные шарики с эфирными маслами для повышения их эффективности и снижения ненужного распространения эфирных масел. Морфология шариков имеет сферическую форму белого цвета. Размер шариков оценивался по фотографии и был около 4мм. В таблице 1 приведено количество эфирных масел, заполненных в шарики, полученное в результате газохроматического анализа.
Таблица 1. Количество эфирного масла, загруженного в альгинатные шарики

Загруженное количество эфирных масел ромашки и эвкалипта было почти вдвое больше, чем эфирного масла чайного дерева. При этом количество эфирного масла ромашки было немного больше, чем эвкалипта.
Антимикробный диско-диффузионный анализ воздействия эфирных масел на золотистый стафилококк
Результаты антимикробного диско-дуффузионного анализа показаны на рисунке 1.
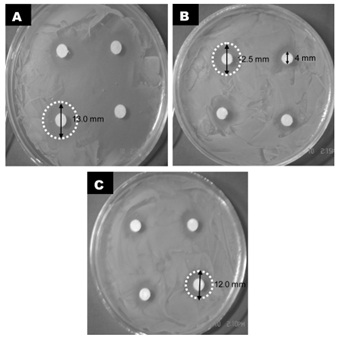
Рис.1. Фотографии гало-зон, сформированных антибактериальным эффектом эфирных масел, протестированных методом дисковой диффузии.
Показаны эфирные масла (А) Чайное дерево, (В) Ромашка, (С) Эвкалипта.
Результаты показали умеренное торможение активности клеток. Наибольший спектр был обнаружен для эфирного масла чайного дерева. Гало зоны, определенные методом антимикробной дисковой диффузии эфирных масел эвкалипта, ромашки и чайного дерева на клетки составили соответственно 12,0мм, 12,5мм и 13,0мм. Способность к торможению роста у эфирного масла чайного дерева оказалась выше, чем у остальных эфирных масел.
Торможение роста золотистого стафилококка путем впрыска эфирных масел
Вариации концентрации клеток с впрыскиванием эфирных масел в питательный бульон приведены на рисунке 2.

Рис. 2. Вариации концентрации золотистого стафилококка при впрыскивании чистых эфирных масел в 100мл питательного бульона для эфирных масел (А) Чайного дерева, (В) Ромашки, (С) Эвкалипта.
Торможение роста клеток при различном числе впрыскиваний эфирных масел было оценено по результатам, которые сравнивались с концентрацией клеток.
100% торможение роста было выявлено при впрыскивании 100мкл эвкалиптового эфирного масла в питательный бульон. Эфирное масло ромашки подавляло рост клеток при впрыскивании более 50мкл. Когда объем впрыскиваемого масла превосходил 50мкл, оказывалось большое влияние на рост клеток. Особенно значительным было влияние на подавление роста клеток со стороны эфирного масла чайного дерева уже при впрыскивании 10мкл. Процентное торможение роста клеток достигло в течение 16 часов 100% при впрыскивании в питательный бульон 10мкл эфирного масла чайного дерева.
Торм жение роста золотистого стафилококка при введении шариков с эфирными маслами
Рост клеток в питательном бульоне был исследован при введении чистых альгинатных шариков без эфирных масел. Клетки постепенно росли в питательном бульоне на протяжении 4 часов. Чистые альгинатные шарики не могли подавить рост клеток. В действительности при добавлении в питательный бульон альгинатных шариков рост клеток усилился. С увеличением введения чистых альгинатных шариков рост клеток также повышался. Было сделано предположение, что чистые альгинатные шарики возможно служат питательной средой для клеток. Рост клеток при введении альгинатных шариков с эфирными маслами в питательный бульон показан на рисунке 3.
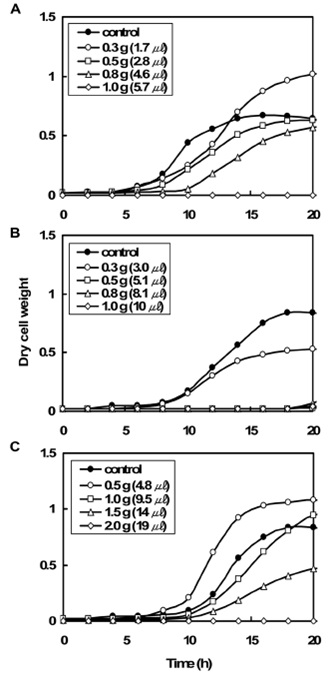
Рис.3. Вариации концентрации золотистого стафилококка при введении альгинатных шариков с эфирными маслами в 100мл питательного бульона. Эфирные масла (А) чайного дерева, (В) ромашки, (С) эвкалипта.
Каждое загруженное количество эфирных масел в шарики представлено в скобках на условных обозначениях рисунка. Эффект подавления роста не был выявлен при введении шариков с эфирным маслом эвкалипта в количестве менее 1г (рис.3С). Напротив клетки начинали хорошо расти, используя альгинатные шарики как питательную среду.
Рост клеток начинал подавляться при введении шариков, превышающих по весу 1,5г. 100% подавление роста клеток наступало после введения 2г шариков. Загруженное количество эфирного масла эвкалипта в шарики составило около 19мкл при 100% подавлении роста.
Антибактериальная активность ромашки начинала проявляться при введении 0,3г шариков (рис.3В). При введении 0,5г шариков с эфирным маслом, рост клетки подавляется постепенно после 20 часов. Рост клетки подавляется при введении шариков в количестве 0,8г с эфирным маслом ромашки. Количество эфирного масла ромашки в шариках составляет около 8мкл при 100% торможении роста.
Эффект угнетения роста клеток от шариков с эфирным маслом чайного дерева проявляется при введении шариков весом более 0,5г в раствор питательного бульона (рис.3А). 100% угнетение роста достигается при введении 1г шариков. Содержание эфирного масла чайного дерева в шариках составило около 5,7мкл при 100% угнетении роста.
Количество эфирного масла в альгинатных шариках при 100% угнетении роста клеток показано в таблице 2.
Таблица 2. Количество вводимых шариков с эфирными маслами и количество эфирных масел в шариках для 100% ингибирования роста золотистого стафилококка
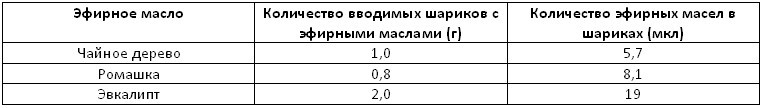
Количество эфирных масел, загружаемых в шарики при 100% подавлении роста, оказалось меньше, чем чистые эфирные масла. С другой стороны, антибактериальная активность эфирного масла, загруженного в альгинатные шарики выше, чем активность чистого эфирного масла.
Можно предположить, что клетки могут абсорбироваться на шариках, а затем абсорбированные клетки могут вступать в реакцию с эфирным маслом, загруженным на шарики. Следовательно, эффект ингибирования клетки может быть выше, чем при чистом эфирном масле, так как клетка, концентрированная на шариках, может вступать в реакцию с эфирными маслами. Если сравнивать эффект ингибирования роста клетки при воздействии эфирных масел, то высокая антибактериальная активность эфирных масел проявляется в порядке убывания по схеме Чайное дерево>Ромашка>Эвкалипт.
Связь золотистого стафилококка с лигандами эфирных масел
ППР сенсограммы, полученные экспериментальным путем и из симуляции связи золотистого стафилококка с лигандами эфирных масел, показаны на рис.4.
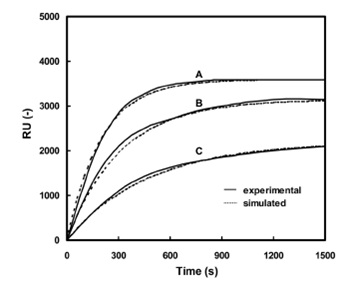
Рис.4. Экспериментальная и смоделированная ППР сенсограмма связи золотистого стафилококка с лигандами эфирных масел для эфирного масла (А) Чайного дерева, (В) Ромашки, (С) Эвкалипта.
Величина RUв ППР сенсограмме стремительно нарастает при связи клеток с лигандами эфирных масел при ранней связке, а затем достигает равновесия за менее, чем 20 минут. Смоделированные сенсограммы хорошо сочетаются с экспериментальными.
Постоянные скорости и близости при связывании клетки с лигандами эфирных масел сведены в таблицу 3.
Таблица 3. Постоянные скорости и близости при связывании золотистого стафилококка с лигандами эфирных масел

Постоянные были определены из наилучшей подстроенной кривой экспериментальных ППР сенсограмм. Кинетическая модель объясняется выше в разделе теории, который был применен для симуляции экспериментальных ППР сенсограмм. Постоянные скорости ассоциации рассчитываются по кинетической модели, полученной при ~10-13 мл/(КОЕ на секунду) к клетке (1×1010 КОЕ/мл) с лигандами эфирных масел.
Постоянная скорости ассоциации связи клетки с эфирным маслом чайного дерева была выше, чем для других эфирных масел. Близость связанной клетки с эфирным маслом чайного дерева примерно в 5 раз выше, чем для эфирного масла эвкалипта. Очевидно, что связь клеток с эфирным маслом чайного дерева намного больше, чем для других эфирных масел. В процессе связывания клеток с лигандами эфирного масла чайного дерева на только скорость ассоциации больше, но и количество связанных клеток выше, чем для других эфирных масел.
Важной характеристикой эфирных масел и их компонентов является их гидрофобность, что позволяет им разделяться в липидах бактериальных клеточных мембран и митохондрий, нарушая их структуру и делая их более проницаемыми. Затем может произойти утечка ионов и других клеток. Хотя определенное количество утечки из бактериальных клеток может оказаться толерантным без потери жизнеспособности, подавляющее большинство потерь клеточного содержания или выхода критических молекул и ионов ведет к гибели клеток.
Имеются некоторые свидетельства исследований о связи эфирного масла чайного дерева и кишечной палочки, что ведет к гибели клетки до лизиса. Гидрофобность явилась движущей силой, ведущей к взаимодействию между β-амилоидом (Аβ) и клетками. В наших результатах это означает, что гидрофобность эфирных масел играет важную роль в определении связывающих взаимодействий между эфирными маслами и клетками.
Изучено влияние эфирных масел полыни на рост и персистентные свойства стафилококков. Отобраны эфирные масла, обладающие бактерицидной активностью в отношении золотистых и эпидермальных стафилококков: Artemisia obtusiloba Ledeb. (LTS-02-07), Artemisia obtusiloba Ledeb. (LTS-02-70), Artemisia santolinifolia Turcz. ex Bess. (LTS-06-26), Artemisia glauca Pall. ex Willd. (LTS-06-44), Artemisia sieversiana Willd. (LTS-11-54). Установлено разнонаправленное действие эфирных масел полыни на персистентные свойства стафилококков, при этом максимальной способностью ингибировать факторы персистенции стафилококков обладали эфирные масла Artemisia glauca Pall. ex Willd., способностью подавлять био-пленкообразование у эпидермальных стафилококков – масло Artemisia macrocephala Jacq. ex Bess. (LTS-01-02). Полученные результаты могут служить экспериментальным обоснованием для дальнейшего изучения свойств эфирных масел полыни с целью их использования в клинической практике в качестве вспомогательного антимикробного средства.

1. Абрамзон О. М., Елагина Н. Н., Карташова О. Л. и др. Характеристика микрофлоры, выделенной при острых воспалительных заболеваниях легких и плевры // Журнал микробиологии, эпидемиологии иммунобиологии. – 2004. – №4. – С.44-47.
2. Биргер М. О. Справочник по микробиологическим и вирусологическим методам исследования. – М.: Медицина, 1982. – 464 с.
3. Бондаренко А. С., Омельчук Т. Я., Скоробогатько Т. Н. Антимикробная активность растений сем. Лилейных, лютиковых, губоцветных и сложноцветных // Фитонциды, их биологическая роль и значение для медицины и народного хозяйства. – Киев, 1967. – С. 85-88.
5. Глазева С. А., Тарасенко В. С. Клинические варианты течения рожи и характеристики возбудителей осложненных и неосложненных ее форм // Вестник Оренбургского государственного университета. – 2006. – № 13 (63). – С. 121–122.
6. Долгов В. А., Шульга И.А. Некоторые аспекты патогенеза острого и хронического среднего отита в эксперименте // Российская оториноларингология. – 2003. – № 4 (7). – С.6-7.
7. Кириллов Д. А. Лекарственная регуляция персистентных свойств микроорганизмов: Автореф. дис. … канд. мед. наук. – Оренбург, 2004. – 22 с.
8. Курлаев П. П., Чернова О. Л., Киргизова С. Б. Воздействие окситоцина, лазерного и электромагнитного излучения на персистентные свойства Staphylococcus aureus // Журнал микробиологии, эпидемиологии иммунобиологии. – 2000. – №4. – С.62-64.
9. Малицкая Е. В. Особенности течения хирургической инфекции мягких тканей второго уровня в зависимости от вида возбудителя и его биологических свойств: Автореф. дис… канд. мед. наук. – Оренбург, 2007. – 21 с.
10. Муравьев И. А., Ткачева И. И., Кравченко Э. К. Исследование стабильности эфирных масел в мазях физико-химическими методами анализа // Фармация. – 1989. – №4. – С. 54 - 55.
11. Панкрушева Т. А., Кобзарева Е. В. Разработка многокомпонентных мазей для лечения местных гнойно-воспалительных процессов // Актуальные проблемы медицины и фармации: сб. науч. тр. – Курск, 2001. – С. 264-265.
14. Kalemba D., Kunicka A. Antibacterial and antifungal-properties of essential oils // Curr Med Chem. – 2003. – Vol. 10. – P. 813-829.
15. Merrit J. H., Kadouri D. E., O`Toole G.A., Growing and analyzing static biofilms // Curr. Protoc. Microbiol. – 2005. – Vol.1. – P. 135-139.
Одним из направлений в лечении инфекционно-воспалительных заболеваний и язв является местное применение эфирных масел растений [10], которые используются в монотерапии или в составе сложных мазей при инфицированных ожогах и ранах [11]. Установлено, что, наряду с противовоспалительным и репаративным эффектом, они оказывают влияние и на микроорганизмы [14; 13; 16]. Для ряда хирургических инфекций в настоящее время показана роль персистентного потенциала бактериальных патогенов в возникновении осложнений и определении затяжного характера гнойно-воспалительного процесса [6; 10; 5]. Исследователи, занимающиеся проблемами местной антимикробной терапии гнойных заболеваний [9; 1], отмечают разнонаправленный характер воздействия различных лекарственных средств и физиотерапевтических процедур на биологические свойства микроорганизмов и значительный клинический эффект только при снижении персистентного потенциала выделяемой микрофлоры. В связи с этим актуальным является отбор наиболее эффективно подавляющих рост и снижающих персистентные свойства эфирных масел, среди которых интерес представляют масла полыней, обладающие антимикробной, противовоспалительной и анфунгальной активностью [3]. Целью работы явилось изучение влияния эфирных масел полыни на рост и персистентные свойства стафилококков.
Материалы и методы
Материалом для исследования послужили:
- эфирные масла полыней: Artemisia absinthium L., Artemisia dracunculus L., Artemisia frigida Willd., Artemisia glauca Pall. ex Willd., Artemisia macrocephala Jacq. ex Bess., Artemisia nitrosa Web. ex Stechm., Artemisia obtusiloba Ledeb., Artemisia pontica L., Artemisia santolinifolia Turcz. ex Bess., Artemisia scoparia Waldst. et Kit., Artemisia sieversiana Willd., Artemisia tanacetifolia L., полученные из свежесобранного растительного сырья методом пародистилляции в ходе экспедиционных исследований в различных регионах Южной Сибири (зав. лаб. д.х.н., профессор Ткачев А.В., Новосибирский институт органической химии им. Н.Н.Ворожцова СО РАН) и предоставленные нам под лабораторными шифрами, каждый из которых является уникальным идентификатором образца, связывающим все характеристики и спектрально-аналитические данные с видовой принадлежностью, точными географическими координатами сбора и экологической приуроченностью исследуемого вида растения;
Антибактериальную активность эфирных масел определяли по М. О. Биргеру (1982) [2]. Антилизоцимную (АЛА) и антикарнозиновую (АКрА) активности определяли по О. В. Бухарину с соавт. (1999) фотометрическим методом [4]. Образование биоплёнок (БО) оценивали по степени связывания ими кристаллического фиолетового в стерильных 96-луночных полистироловых планшетах [15]. Изучение регуляции факторов персистенции исследуемыми эфирными маслами осуществляли по Д. А. Кириллову (2004) [7].
Результаты
При изучении влияния эфирных масел полыни на рост стафилококков было установлено, что бактерицидной активностью как в отношении S.epidermidis, так и S.aureus, обладали эфирные масла Artemisia obtusiloba Ledeb. (LTS-02-07), Artemisia obtusiloba Ledeb. (LTS-02-70), Artemisia santolinifolia Turcz. ex Bess. (LTS-06-26), Artemisia glauca Pall. ex Willd. (LTS-06-44), Artemisia sieversiana Willd. (LTS-11-54); S.epidermidis - Artemisia nitrosa Web. ex Stechm. (LTS-00-25), Artemisia absinthium L. (LTS-05-03), Artemisia pontica (LTS-05-27) и Artemisia santolinifolia (LTS-11-60); S.aureus - Artemisia tanacetifolia L. (LTS-05-05), Artemisia glauca Pall. ex Willd. (LTS-05-38) (таблица 1). Количество стафилококков в контроле составляло 5*10 5 КОЕ/мл.
Антистафилококковая активность эфирных масел полыни
Эфирные масла
Рост стафилококков
(КОЕ/мл)
S.aureus
S.epidermidis
LTS-00-01 Artemisia abrotanum
LTS-00-02 Artemisia glauca Pall. ex Willd.
LTS-00-25 Artemisia nitrosa Web. ex Stechm.
LTS-00-42 Artemisia dracunculus L.
LTS-01-02 Artemisia macrocephala Jacq. ex Bess.
LTS-02-07 Artemisia obtusiloba Ledeb.
LTS-02-70 Artemisia obtusiloba Ledeb.
LTS-04-05Artemisia tanacetifolia L.
LTS-05-03 Artemisia absinthium L.
LTS-05-27 Artemisia pontica L.
Продолжение таблицы 1
LTS-05-38 Artemisia glauca Pall. ex Willd.
LTS-06-02 Artemisia glauca Pall. ex Willd.
LTS-06-24 Artemisia dracunculus L.
LTS-06-26 Artemisia santolinifolia Turcz. ex Bess.
LTS-06-44 Artemisia glauca Pall. ex Willd.
LTS-11-09 Artemisia glauca Pall. ex Willd.
LTS-11-50 Artemisia scoparia Waldst. et Kit.
LTS-11-54 Artemisia sieversiana Willd.
LTS-11-59 Artemisia frigida Willd.
LTS-11-60 Artemisia santolinifolia Turcz. ex Bess.
Кроме того, ряд изученных эфирных масел полыни обладал бактериостатическим действием, как в отношении золотистых стафилококков, - Artemisia macrocephala Jacq. ex Bess. (LTS-01-02), Artemisia pontica L. (LTS-05-27), Artemisia dracunculu L. (LTS-06-24), Artemisia frigida Willd. (LTS-11-59) и Artemisia santolinifolia Turcz. ex Bess. (LTS-11-60), так и эпидермальных, - Artemisia macrocephala Jacq. ex Bess. (LTS-01-02), Artemisia tanacetifolia L. (LTS-04-05), Artemisia glauca Pall. ex Willd. (LTS-06-02), Artemisia dracunculus L. (LTS-06-24), Artemisia scoparia Waldst. et Kit. (LTS-11-50) и Artemisia frigida Willd. (LTS-11-59).
Также необходимо отметить, что индифферентное действие в отношении золотистого стафилококка было установлено у масел Artemisia absinthium L. (LTS-05-03), Artemisia glauca Pall. ex Willd. (LTS-06-02), а у масел Artemisia obrotanum (LTS-00-01), Artemisia glauca Pall. ex Willd. (LTS-00-02), Artemisia glauca Pall. ex Willd. (LTS-05-38), Artemisia scoparia Waldst. et Kit. (LTS-06-44), Artemisia glauca Pall. ex Willd. (LTS-11-09) - в отношении эпидермального стафилококка.
На следующем этапе работы было изучено влияние эфирных масел полыни, не оказывающих бактерицидное действие на стафилококки, на их персистентные свойства, в частности, антилизоцимную, антикарнозиновую активности и способность к образованию биопленок (таблица 2).
Изменение персистентных свойств стафилококков под действием эфирных масел полыни
Эфирные масла
Свойства S.aureus
Свойства S.epidermidis
Artemisia glauca Pall. ex Willd.
Artemisia nitrosa Web. ex Stechm.
Artemisia dracunculus L.
Artemisia tanacetifolia L.
Artemisia absinthium L.
Artemisia pontica L.
Artemisia glauca Pall. ex Willd.
Artemisia glauca Pall. ex Willd.
Artemisia dracunculus L.
Продолжение таблицы 2
Artemisia scoparia Waldst. et Kit.
Artemisia glauca Pall. ex Willd.
Artemisia scoparia Waldst. et Kit.
Artemisia frigida Willd.
Artemisia santolinifolia Turcz. ex Bess.
Таким образом, в результате проведенных исследований установлены эфирные масла, обладающие бактерицидной активностью в отношении золотистых и эпидермальных стафилококков: Artemisia obtusiloba Ledeb. (LTS-02-07), Artemisia obtusiloba Ledeb. (LTS-02-70), Artemisia santolinifolia Turcz. ex Bess. (LTS-06-26), Artemisia glauca Pall. ex Willd. (LTS-06-44), Artemisia sieversiana Willd.(LTS-11-54). Показано, что максимальной способностью ингибировать факторы персистенции стафилококков (АЛА и АКрА) характеризуются эфирные масла Artemisia glauca Pall. ex Willd., причем эфирное масло Artemisia glauca Pall. ex Willd. (LTS-06-02) наиболее эффективно подавляло АЛА, а эфирное масло Artemisia glauca Pall. ex Willd. (LTS-00-02) - АКрА эпидермальных стафилококков; тогда как Artemisia glauca Pall. ex Willd. (LTS-11-09) - АЛА и АКрА золотистых стафилококков. Среди изученных эфирных масел полыни, масел, способных подавлять биопленкообразование S.aureus, выявлено не было, тогда как масло Artemisia macrocephala Jacq. ex Bess. (LTS-01-02) характеризовалось способностью эффективно (на 60 % и более) подавлять биопленкообразование эпидермальных стафилококков.
Полученные результаты могут служить экспериментальным обоснованием для дальнейшего изучения свойств у эфирных масел полыни, обладающих не только бактерицидным действием, но и эффективно ингибирующим персистентный потенциал микроорганизмов, с целью их использования в клинической практике в качестве вспомогательного антимикробного средства.
Рецензенты:
Гриценко Виктор Александрович, д.м.н., профессор, зав. лабораторией клеточного симбиоза Федерального государственного бюджетного учреждения науки Института клеточного и внутриклеточного симбиоза Уральского отделения Российской Академии наук, г. Оренбург.
Рассмотрены подходы к комплексной терапии инфекции мочевых путей с применением современных комбинированных фитопрепаратов, которые позволяют повышать эффективность антибактериальной терапии за счет преодоления резистентности возбудителя к антибиотикам, со
The article considers approaches to complex therapy of urinary tract infections, using modern combined phyto-preparations, which allow to enhance efficiency of antibacterial therapy due to overcoming the agent’s resistance to antibiotics, and reduce the course of antibiotic therapy.
Инфекция мочевых путей (ИМП; синонимы: инфекция мочевой системы, инфекция мочевыводящих путей) — собирательный термин, обозначающий инфекционно-воспалительный процесс в мочевыделительной системе без указания его локализации и характера течения. По локализации выделяют инфекцию нижних мочевых путей (цистит, уретрит) и верхних мочевых путей (пиелонефрит, абсцесс и карбункул почки, апостематозный пиелонефрит).
По характеру течения ИМП делятся на неосложненную и осложненную. Неосложненная ИМП развивается, как правило, у людей без обструктивных уропатий и структурных изменений в почках и мочевыводящих путях, в отсутствие фоновых заболеваний. Осложненные инфекции возникают у больных с обструктивными уропатиями, мочекаменной болезнью, поликистозом почек, доброкачественной гиперплазией предстательной железы (ДГПЖ), на фоне катетеризации мочевого пузыря и/или при инструментальных (инвазивных) методах исследования, а также у больных с сопутствующими заболеваниями, такими как сахарный диабет, подагра, другими метаболическими нарушениями.
По возникновению выделяют внебольничные (возникающие в амбулаторных условиях) и нозокомиальные (развивающиеся после 48 ч пребывания пациента в стационаре) ИМП. Не менее 40% всех нозокомиальных инфекций обусловлены ИМП, вызванной в большинстве случаев катетеризацией мочевого пузыря [1–3].
В зависимости от выраженности клинических проявлений ИМП часто подразделяют на афебрильную (преимущественно инфекция нижних мочевых путей), фебрильную (преимущественно инфекция верхних мочевых путей) и бессимптомную бактериурию (ББ). ББ — бактериологический диагноз, который устанавливается при исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки. По определению Американского общества инфекционных болезней (Infectious Diseases Society of America, IDSA), ББ — это изолированная бактериурия в образце мочи, полученном в условиях, исключающих контаминацию, и при отсутствии симптомов мочевой инфекции [4]. Диагноз ББ может быть установлен:
- если в двух последовательных анализах мочи у женщин без клинических признаков ИМП выделен один и тот же штамм микроорганизмов в количестве ≥ 10 5 КОЕ/мл;
- если в анализе мочи у мужчин без симптомов ИМП однократно выделен бактериальный штамм в количестве ≥ 10 5 КОЕ/мл;
- если в анализе мочи, полученном при катетеризации, как у мужчин, так и женщин, выделен бактериальный штамм в количестве ≥ 10 2 КОЕ/мл.
В структуре инфекционной заболеваемости ИМП занимает второе место, уступая лишь респираторным инфекциям. Среди взрослой популяции женщины в 30–50 раз чаще, чем мужчины, страдают от ИМП, а в течение жизни до 60% женщин сталкиваются с эпизодом ИМП. У каждой четвертой пациентки этой возрастной группы в течение года ИМП рецидивирует [5]. В пожилом и старческом возрасте частота ИМП у женщин и мужчин постепенно сравнивается, что обусловлено развивающейся практически в 100% ДГПЖ, нарушающей уродинамику. В целом ИМП, включая пиелонефрит, регистрируется существенно чаще у женщин, чем у мужчин. Распространенность ИМП в детской популяции составляет 20–22 случая на 1000 детей и в возрасте старше одного года жизни у девочек встречается в десятки раз чаще, чем у мальчиков.
В структуре внутрибольничных инфекций доля ИМП может достигать 40%.
Этиология
Основными возбудителями ИМП являются грамотрицательные бактерии из семейства Enterobacteriacеae, а из них преимущественно Escherichia coli (E. сoli). При неосложненных ИМП на долю E. сoli и других представителей семейства Enterobacteriacеae приходится до 90–95% всех случаев, тогда как при осложненных ИМП доля кишечной палочки в этиологической структуре снижается до 30–50% и значительно чаще встречаются Proteus spp., Pseudomonas spp., Klebsiella spp., грибы (преимущественно Candida albicans). Особенностью осложненных ИМП является большая доля микробных ассоциаций в этиологической структуре (табл. 1).
Лечение ИМП
Основой терапии ИМП является антибиотикотерапия. Как и при других бактериальных инфекциях, чувствительность возбудителей к антибиотикам имеет решающее значение при выборе препарата для эмпирической терапии ИМП. Лучше всего поддается лечению неосложненная ИМП.
Одними из наиболее часто используемых препаратов для лечения ИМП являются фторхинолоны (левофлоксацин, норфлоксацин, офлоксацин, пефлоксацин и др.), которые во многих международных руководствах указываются как препараты выбора в терапии ИМП. Однако в настоящее время отмечается быстрый рост резистентности уропатогенной E. coli к препаратам этой группы. Считается, что при уровне резистентности в популяции более 10% на применение препаратов вводятся ограничения. В России уровень устойчивости уропатогенной E. coli к фторхинолонам, по данным различных исследований, колеблется от 4,3% до 12,9%, составляя в среднем около 7–8% [1, 2, 6, 7].
Для лечения ИМП у беременных женщин и детей, а также у других категорий пациентов при непереносимости фторхинолонов препаратами выбора являются амоксициллин/клавуланат, цефалоспорины II–III поколений, фосфомицина трометамол, нитрофурантоин [8]. Преимуществом применения амоксициллина/клавуланата является не только его высокая активность в отношении E. coli (уровень резистентности ниже, чем к фторхинолонам), но и отсутствие тератогенного воздействия, что делает возможным его применение в I триместре беременности [9, 10].
Доказана эффективность и безопасность применения цефалоспоринов III поколения у детей и беременных женщин при лечении неосложненной и осложненной ИМП [7]. Отличительной чертой цефалоспоринов III поколения является высокая активность в отношении микроорганизмов семейства Enterobacteriaceae, устойчивость к действию бета-лактамаз, длительный период полувыведения [11].
Использование налидиксовой кислоты и нитрофурантоинов имеет определенные недостатки в связи с необходимостью применения этих препаратов 3–4 раза в сутки, а также слабой активностью нитрофурантоина в отношении Proteus spp., а налидиксовой кислоты — в отношении S. saprophyticus [12].
Длительность антибактериальной терапии зависит от особенностей ИМП. Как правило, при отсутствии факторов риска антибактериальная терапия назначается на 3–5 дней при острой инфекции нижних мочевых путей, на 10–14 дней — при инфекции верхних мочевых путей. При острой осложненной ИМП или при наличии факторов риска применяются те же антимикробные препараты, что и при неосложненной ИМП, однако длительность терапии увеличивается до 7–14 или более дней [13].
Особенностью лечения ИМП в детском возрасте является более длительная, по сравнению со взрослыми, антибактериальная терапия с обязательным курсом противорецидивного лечения.
Поэтому, несмотря на успехи в создании новых антибактериальных препаратов, лечение ИМП, особенно осложненной и рецидивирующей, остается актуальной задачей, часто требующей в своем решении назначения комбинации препаратов или их последовательной смены, длительных противорецидивных курсов. Это неизбежно приводит к повышению частоты развития нежелательных лекарственных реакций терапии, а также формирует порочный круг, т. к. частое и длительное применение антибиотиков приводит к росту популяции резистентной к ним микрофлоры.
В последние десятилетия возрождается значительный интерес к фитотерапии как компоненту комплексной терапии ИМП. Лечебные свойства растений были хорошо известны врачам древности, народная медицина практически всех народов и стран использует их для лечения различных заболеваний. Действие фитопрепаратов в рамках современных исследований представляется нам в новом свете, прежде всего, с точки зрения преодоления антибиотикорезистентности и способности разрушать микробную биопленку на слизистой оболочке мочевых путей.
В комплексной терапии ИМП применяются фитопрепараты, обладающие противовоспалительным, мочегонным, а также кровоостанавливающим действием, что важно при развитии гематурии.
Растительные препараты можно применять в качестве отдельных настоев или травяных сборов. Компоненты различных растений входят также в состав фабричных лекарственных препаратов.
Наиболее широко применяемые при ИМП лекарственные растения представлены в табл. 2, а также описаны ниже [16, 17].
Золотарник (живительная трава, сердечник) — широко применяется в народной медицине различных стран. В Германии настой золотарника рекомендуют, прежде всего, при хронических воспалительных заболеваниях почек и мочевых путей, кристаллурии и мочекаменной болезни, как мочегонное средство. Препараты травы золотарника обладают гипоазотемическим действием. Трава золотарника содержит флавоноиды, сапонины, органические кислоты и эфирное масло, способствующие разрушению мембран бактериальной клетки, каротин, аскорбиновую и никотиновую кислоты.
Хвощ полевой — обладает противовоспалительным, мочегонным и кровоостанавливающим действием. Применяется при ИМП, кристаллуриях и мочекаменной болезни. Благодаря большому содержанию соединений кремния отвары, настои и экстракты хвоща полевого обладают выраженным заживляющим и сосудоукрепляющим действием, способствуют растворению кристаллов солей в моче, ускоряют выведение свинца из организма.
Листья брусники — обладают антимикробным и мочегонным действием. Последнее связано с наличием в листьях брусники гидрохинона. Применяется в виде отвара (2 столовые ложки на 1,5 стакана воды). Назначается по 2 столовые ложки 5–6 раз в день. Также, как и толокнянка, лучше действует в щелочной среде.
Горец птичий (спорыш) — содержит гликозид авикулярин, дубильные вещества, эфирное масло, каротин, аскорбиновую кислоту. Используется как мочегонное, кровоостанавливающее и вяжущее средство. Обладает спазмолитическим действием на мочевые пути. Широко применяется в народной медицине и входит в состав различных сборов.
Петрушка огородная — богата флавоноидами и эфирными маслами. Оказывает непосредственное действие на почечные канальцы, благодаря чему достигается диуретический эффект. Обладает спазмолитическим действием на гладкую мускулатуру мочевых путей и сосудов.
Любисток лекарственный (приворотное зелье) — с медицинской целью используются в основном корни растения. Содержит эфирные масла, органические кислоты, кумарин, дубильные вещества. Обладает выраженным мочегонным и антибактериальным действием. Используется при воспалениях мочевых путей, нарушениях желудочно-кишечного тракта. Как правило, входит в состав комбинированных препаратов и сборов.
Пырей ползучий — содержит эфирные масла, сапонины, инулин, аскорбиновую кислоту, каротин. Обладает диуретическим эффектом благодаря инулину, эфирное масло обеспечивает антисептическое и противовоспалительное действие.
Клюквенный сок, морс (содержит натрия бензоат) — обладает антисептическим действием (увеличивается синтез в печени из бензоата гиппуровой кислоты, которая, выделяясь с мочой, вызывает бактериостатический эффект). Принимают по 2–4 стакана в день.
Сосна лесная — эфирное (скипидарное) масло сосны обладает выраженным бактерицидным, противовоспалительным и мочегонным действием.
При хронических и рецидивирующих инфекциях мочевых путей применяются различные сборы лекарственных трав. Они назначаются, как правило, на долгий период, с чередованием преимущественно бактерицидных и мочегонных сборов. Однако самостоятельное лечение лекарственными растениями таит в себе некоторые опасности. Компоненты многих лекарственных растений в больших дозировках могут быть потенциально ядовиты, оказывать патологическое воздействие на функционирование отдельных органов. Поэтому с точки зрения безопасности в комплексном лечении ИМП предпочтение отдается лекарственным препаратам фабричного производства, правильная дозировка которых обеспечивает высокую эффективность при соблюдении полной безопасности.
Одним из наиболее широко применяемых фитопрепаратов для лечения ИМП является Фитолизин. Фитолизин содержит экстракт смеси растений (золотарника, хвоща полевого, пырея, горца птичьего, листьев березы, любистока, пырея, петрушки, масла шалфея, мяты, сосны и апельсина, семена пажитника), благодаря чему оказывает мочегонное, противовоспалительное, спазмолитическое действие, уменьшает кристаллообразование, способствует растворению кристаллов и конкрементов и выведению их с мочой.
Препарат имеет форму пасты для приготовления суспензии, что обеспечивает легкость его дозировки и применения. Взрослым назначают внутрь по 1 чайной ложке пасты, растворенной в 1/2 стакана теплой сладкой воды, 3–4 раза в день после еды. Фитолизин может применяться в комплексном лечении ИМП вместе с антибиотиками или после их применения на этапе противорецидивной терапии. Препарат широко применяется в качестве профилактического средства при хронических воспалениях мочевых путей. Курс терапии Фитолизином составляет 2–6 недель и при необходимости может быть продлен.
Эффективность лекарственных растений в терапии ИМП доказана многовековым опытом народов мира. Современные комбинированные фитопрепараты, такие как Фитолизин, занимают важное место в комплексной терапии ИМП и позволяют повышать эффективность антибактериальной терапии за счет преодоления резистентности возбудителя к антибиотикам, сокращают курсы антибиотикотерапии, снижают частоту нежелательных лекарственных реакций их применения.
Литература
А. В. Малкоч 1 , кандидат медицинских наук
Н. Н. Филатова, кандидат медицинских наук
В обзоре представлены эффекты наиболее известных натуральных эфирных масел (мята перечная, эвкалипт, гвоздика, коричник), на основе которых созданы различные лекарственные средства. Приведены данные исследований с применением лекарственных препаратов, сод
The overview describes the effects of the most wide-spread natural essential oils (peppermint, eucalyptus, cloves, cinnamon) which are the basis for various medications. The research data involving application of medications containing essential oils, both as monotherapy, and a component of complex therapy, were given.
Исследование биологической активности и возможности использования эфирных масел в лечебных целях широко проводилось в лаборатории Крымского НИИ им. И. М. Сеченова. В ходе исследований было установлено, что эфирные масла и их компоненты легко проходят через эпителий капилляров, они свободно преодолевают плаценту. С помощью транспортных молекул-носителей, находящихся в биологических мембранах, молекулы ароматических веществ проникают через клеточные мембраны и взаимодействуют с рецепторами внутриклеточных биологических комплексов. Они взаимодействуют с ферментной, эндокринной, иммунной и другими системами [5]. Сложные смеси душистых веществ (эфирных масел) чаще всего по химическому строению относят к монотерпенам и сесквитерпенам, однако могут быть и фенольными соединениями. По физической природе они являются подвижными маслянистыми жидкостями, которые испаряются, не оставляя жирных пятен, хорошо смешиваются со спиртами и жирными маслами. Не смешиваются с водой, но способны перегоняться с водяным паром [6]. Мировой ассортимент основных эфиромасличных растений насчитывает порядка 30–40 видов, важнейшими среди них являются виды родов, в состав которых входят не только моноциклические монотерпены, но и их предшественники ациклические монотерпены: гераниол, линалоол, цитронеллол и др. [7]. В современной медицинской практике лекарственные средства на основе ЭМ применяются при лечении функциональных расстройств желудочно-кишечного тракта, воспалительных заболеваний верхних дыхательных путей, нижних мочевыводящих путей и в качестве средства коррекции функциональных расстройств центральной нервной системы.
Е. Ю. Радциг и соавт. (2009) [12] было проведено открытое сравнительное исследование по оценке эффективности препарата (масло для ингаляций), в состав которого входят многокомпонентная композиция ЭМ, как средства профилактики простудных заболеваний в организованных детских коллективах. Исследование проводилось в течение 90 дней на базе детского сада СВАО г. Москвы. В основную группу вошли дети (n = 100) в возрасте 3–7 лет, которым назначали препарат ЭМ; в группе контроля детям (n = 100) ежедневно в течение месяца проводилось промывание полости носа и носоглотки физраствором. На фоне ингаляций препаратом с ЭФ в течение первых 20 дней отмечалось менее выраженное проявление симптомов (заложенность носа, слизистые выделения из носа) в сравнении с группой контроля. В основной группе из 100 человек у 2 детей (2%) после одного дня приема препарата появилась аллергическая сыпь на коже и дети выбыли из исследования. По результатам исследования за период наблюдения оставшихся детей (n = 98) было получено: 32,6% ни разу не заболели; 51% — заболели только один раз; 15,3% — заболели дважды; 1% — трижды. На фоне приема препарата с ЭМ в качестве средства профилактики развития респираторных заболеваний у детей в организованных детских коллективах число не заболевших детей увеличилось на 34%; в 98% случаев отмечена хорошая переносимость препарата [12].
В другом открытом сравнительном исследовании Е. А. Азовой и соавт. (2012) [13] дана оценка эффективности другого препарата, в составе которого имеются натуральные ЭМ (мятное, эвкалиптовое, каепутовое, можжевеловое, гвоздичное, винтергриновое), в комплексной терапии ОРЗ. Исследование проведено на базе детской поликлиники г. Нижний Новгород. Под наблюдением находилось 45 детей, больных ОРЗ, в возрасте 3–14 лет и имевших в анамнезе рецидивирующее течение заболевания. Основная группа детей (n = 30) получала стандартную терапию в сочетании с препаратом на основе эфирных масел, контрольная группа (n = 15) — только стандартную терапию. В основной группе препарат назначался в виде пассивных ингаляций в течение 30 дней. Динамика состояния оценивалась врачом-педиатром, ЛОР-врачом, с использованием ринофарингоотоскопии, цитоскопии мазка со слизистой носа, проведения аллерготеста на переносимость эфирных масел. В фоне: клинические признаки ОРЗ с поражением верхних дыхательных путей (першение, сухость и боль в горле, ринорея, кашель), при фарингоскопии — признаки активного воспалительного процесса (гиперемия слизистой оболочки зева и пр.). Клинически положительная динамика отмечалась на 3-и сутки в основной группе, на 7-е сутки — в контрольной; на 3-и сутки улучшение риноскопической и фарингоскопической картины отмечено у всех детей (100%) в основной группе и у 20% — в контрольной. Нежелательных реакций при применении комплекса эфирных масел не отмечено, в т. ч. и у детей с отягощенным аллеpгоанамнезом. По результатам исследования сделан вывод [13]: применение комплекса эфирных масел в дополнение к стандартной терапии позволяет уменьшить длительность течения ОРЗ в 1,6 раза; возможно назначение детям разных возрастных групп; может использоваться в качестве профилактики повторных респираторных заболеваний у детей как в домашних, так и в амбулаторных условиях.
Схожие данные получены и в исследовании Л. П. Гребовой и соавт. (2013) [14], в ходе которого дана оценка эффективности препарата, содержащего аналогичную композицию эфирных масел, на заболеваемость острой респираторной вирусной инфекцией (ОРВИ) в условиях организованного детского коллектива. В исследовании приняли участие 106 детей первых классов школы г. Рязань, все школьники вакцинированы по возрасту. Всех участников разделили на 4 группы: в 1-й группе детей (n = 27) назначали препарат с эфирными маслами только в классе; во 2-й (n = 27) — только дома; в 3-й (n = 23) — и в классе, и дома; в 4-й, контрольной, группе (n = 29) — ничего не назначалось. Препарат использовался в виде пассивных ингаляций в течение 30 дней. В ходе исследования было выявлено: у детей, получавших препарат с эфирными маслами в качестве средства профилактики ОРВИ, отмечено: 1) снижение числа случаев ОРВИ в 3,1 раза; 2) более легкое течение заболевания; 3) сокращение в 3 раза количества пропущенных учебных дней по болезни [14].
Вкратце стоит остановиться на лечебных свойствах ЭМ, входящих в состав бальзама Золотая звезда. Эфирное масло гвоздики легкое, текучее, с сильным пряным запахом и жгучим вкусом. Гвоздичное масло получают из цветочных бутонов вечнозеленого гвоздичного дерева семейства миртовых. Масло гвоздики обладает сильным антисептическим, спазмолитическим, укрепляющим, стимулирующим и ветрогонным действием, поэтому его можно применять в профилактических целях во время эпидемий воздушно-капельных и кишечных инфекций [16]. Используется в качестве антисептика, благодаря своей высокой антибактериальной и противовирусной активности, при профилактике гриппа и ОРВИ во время эпидемий этих воздушно-капельных инфекций [11]. Также масло гвоздики обладает антимикотической активностью в отношении грибов вида Aspergillus [17]. Масло гвоздики является обезболивающим средством, которое можно применять при невралгиях, артрите и ревматизме, а также оно укрепляет иммунную систему и оказывает согревающее действие. Применение гвоздичного масла в комплексе с другими средствами оказывает сильное заживляющее действие при воспалении кожных покровов, попадании инфекции в раны и длительно незаживающих язвах. Препараты с маслом гвоздики устраняют воспалительные процессы в полости рта при пародонтозе и пульпите, а также при зубной невралгии [16].
Лекарственные свойства мяты перечной, многолетнего травянистого растения, известны с глубокой древности. Лекарственным сырьем является трава мяты, а также получаемое из листьев эфирное масло, обладающее выраженными антибактериальными свойствами [18]. В листьях мяты содержатся такие вещества, как каротин, гесперидин, бетаин, рамноза, глюкоза, урсоловая, мелисиновая, линолевая и олеаноловая кислоты [16, 18]. Из листьев мяты перечной получают ЭМ, которое активно применяется в терапии респираторных заболеваний [19], и ментол, который обладает легким обезболивающим и обеззараживающим действием. Ментол применяют в виде спиртовых, эфирно-спиртовых и масляных растворов наружно (для втираний) при зуде, невралгиях, мигрени, используют для смазываний, ингаляции и как капли (в нос) при воспалительных заболеваниях верхних дыхательных путей (насморк, трахеит и др.). Мятное масло применяют для ингаляций при ларингитах, для устранения мышечных болей при перенапряжении и травмах [16]. Коричное дерево или коричник — род деревьев и кустарников из семейства лавровых, из плодов и листьев которого получают коричное масло. Масло корицы обладает антисептическим, обезболивающим, противоотечным, согревающим и антидепрессантным действием; ускоряет процесс выздоровления при нервных и простудных заболеваниях, а также при некоторых расстройствах деятельности желудочно-кишечного тракта [16]. По последним данным [20] на экспериментальных моделях, коричник оказывает ингибирующее влияние на активность холинэстеразы, а также гистологически выявлено увеличение числа нейронов в гиппокампе.
Благодаря эвкалиптовому маслу бальзам Золотая звезда стимулирует чувствительные нервные окончания и незаменим при головных болях и простудных заболеваниях; масло мяты перечной обладает седативным болеутоляющим, антисептическим, спазмолитическим и другим действием; гвоздичное масло обладает выраженным анестетическим эффектом; ментоловое масло подавляет развитие отека при воспалительных заболеваниях верхних дыхательных путей; коричное масло применяется в качестве средства после ушибов, при артралгиях; камфорное масло оказывает согревающее действие (при миозитах и др.) [9–11, 16]. Бальзам Золотая звезда применяется наружно при простуде, насморке, кашле, гриппе, воспалении и боли в носоглотке. Он устраняет неприятные ощущения в носу и рекомендуется при головной боли и головокружении, а также при симптомах морской болезни. Благодаря содержащимся в нем ЭМ лекарственных растений бальзам оказывает сильное ароматерапевтическое действие, поэтому его можно применять в комплексе с другими средствами при лечении психосоматических состояний. Бальзам Золотая звезда может использоваться и при лечении различных заболеваний суставов (артрита и артроза), при радикулите, ревматизме, остеохондрозе, а также при нетяжелых травмах (ушибах и растяжениях). Препарат может применяться и при укусах насекомых для снятия кожного зуда. Противопоказаниями для применения бальзамов Золотая звезда являются непереносимость компонентов, входящих в состав бальзама, гнойничковые заболевания кожи.
Заключение
В представленном обзоре описаны эффекты наиболее известных натуральных эфирных масел (мята перечная, эвкалипт, гвоздика, коричник), на основе которых созданы различные лекарственные средства. Приведены данные ряда исследований с применением лекарственных препаратов, содержащих эфирные масла, которые свидетельствуют о том, что применение комплекса эфирных масел в дополнение к стандартной терапии позволяет уменьшить длительность и тяжесть течения острых вирусных респираторных заболеваний.
Одним из самых известных и популярных средств для профилактики и лечения простудных заболеваний в период неблагоприятной эпидемиологической обстановки по-прежнему является бальзам Золотая звезда.
Литература
О. А. Шавловская, доктор медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Читайте также:

