Какие лекарства принимать при красной волчанке
Обновлено: 15.04.2024
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Различают две формы красной волчанки (lupus erythematodes): хроническую (дискоидную) - относительно доброкачественную клиническую форму и острую (системную) - тяжело протекающую. При обеих формах могут поражаться красная кайма губ и слизистая оболочка рта. Изолированные поражения слизистой оболочки рта практически не встречаются, поэтому больные первично к стоматологу обращаются довольно редко. Заболевание чаще всего начинается в возрасте от 20 до 40 лет, женщины болеют значительно чаще мужчин.
Что провоцирует / Причины Красной волчанки:
Красная волчанка - системное заболевание невыясненной этиологии и сложного патогенеза.
Патогенез (что происходит?) во время Красной волчанки:
По современным представлениям, красная волчанка относится к ревматическим и аутоиммунным заболеваниям. Считают, что болезнь развивается в результате сенсибилизации к различным инфекционным и неинфекционным факторам. К предрасполагающим факторам относится аллергия к солнечным лучам, холоду, очагам хронической инфекции. Имеются данные о генетической предрасположенности к красной волчанке.
- Острая (системная) красная волчанка
Является тяжелым системным заболеванием. Для нее характерны высокая температура тела, боли в суставах, мышцах, адинамия, поражения внутренних органов (полисерозит, эндокардит, гломерулонефрит, полиартрит, поражение желудочнокишечного тракта и др.). В крови - лейкопения, анемия, повышенная СОЭ. Заболевание может протекать в острой, подострой или хронической форме.
В зависимости от патологии, преобладающей во время обострения, выделяют кожносуставную, почечную, неврологическую, сердечнососудистую, желудочнокишечную, печеночную и гематологическую клинические разновидности заболевания.
Течение этой формы красной волчанки характеризуется прогрессированием с постепенным вовлечением в процесс различных органов и тканей.
Симптомы Красной волчанки:
Дискоидная (хроническая) красная волчанка. Клиническая картина. Хроническая красная волчанка обычно начинается с эритемы на коже лица (чаще на носу, лбу, щеках в виде бабочки), ушных раковинах, волосистой части головы, красной кайме губ и других открытых частей тела. Может быть изолированное поражение красной каймы губ. Слизистая оболочка рта поражается редко. Заболевание у женщин встречается в 2 раза чаще, чем у мужчин. Для кожного поражения характерна триада признаков: эритема, гиперкератоз и атрофия. Течение процесса стадийное.
Первая (эритематозная) стадия характеризуется появлением 1-2 небольших слегка отечных, четко контурированных, постепенно увеличивающихся в размерах пятен. Цвет их розовый, имеются телеангиэктазии в центре. Постепенно увеличиваясь и сливаясь, очаги поражения по очертаниям напоминают бабочку, спинка которой располагается на носу, а крылья на щеках. Появление пятен иногда сопровождается жжением и покалыванием в области поражения.
Во второй стадии (гиперкератозноинфильтративной) очаги поражения инфильтрируются, превращаясь в плотную дискоидную бляшку, на поверхности которой появляются мелкие, сероватобелые плотно сидящие чешуйки. Впоследствии бляшка нередко подвергается кератинизации и приобретает сероватобелый оттенок. Бляшку окружает ободок гиперемии.
Слизистая оболочка рта также нередко поражается при дискоидной волчанке. Очаги поражения имеют вид четко отграниченных синюшнокрасных или белесоватых бляшек с запавшим, иногда эрозированным центром. Клинические формы красной волчанки с поражением слизистой оболочки рта и красной каймы губ сопровождаются жжением и болью, усиливающейся при приеме пищи и разговоре.
При хронической красной волчанке достаточно часто поражается красная кайма губ (по данным А.Л.Машкиллейсона и др., у 9 % больных).
На красной кайме губ различают 4 клинические разновидности красной волчанки: типичную; без клинически выраженной атрофии; эрозивноязвенную; глубокую.
При типичной форме на красной кайме губ образуются инфильтративные очаги овальных очертаний либо процесс может диффузно захватывать всю красную кайму. Пораженные участки багровокрасного цвета со стойко расширенными сосудами и выраженным инфильтратом. Поверхность их покрыта плотно сидящими беловатосероватыми чешуйками, при насильственном удалении которых появляются кровоточивость и значительная болезненность. В центре поражения отмечается атрофия красной каймы губ и кожи. По периферии очага имеются участки помутнения эпителия в виде наравномерно выраженных полосок белого цвета.
Патогистологически при типичной форме в эпителии определяются паракератоз, гиперкератоз, акантоз, вакуольная дистрофия базального слоя, местами выражена атрофия ткани. В собственной пластинке слизистой оболочки имеется диффузный воспалительный инфильтрат, выявляются резкое расширение кровеносных и лимфатических сосудов, разрушение коллагеновых волокон.
Форма красной волчанки без клинически выраженной атрофии характеризуется возникновением на красной кайме губ диффузной застойной гиперемии с гипер и паракератотическими чешуйками на поверхности, которые отслаиваются легче, чем при типичной форме. Гиперкератоз при данной форме выражен слабее, чем при типичной форме красной волчанки. Иногда отмечаются незначительная инфильтрация и телеангиэктазии.
Эрозивноязвенная форма красной волчанки на красной кайме губ проявляется резко выраженным воспалением; очаги яркокрасного цвета, отечны, с эрозиями и трещинами, покрыты кровянистогнойными корочками. По периферии очага поражения определяются гиперкератоз в виде чешуек и атрофия.
Больных беспокоят сильное жжение, болезненность и зуд, усиливающиеся во время еды. После заживления на месте очагов остаются атрофические рубцы.
При глубокой форме красной волчанки Капоши-Ирганга поражение на губах встречается редко. Участок поражения в виде узловатого образования выступает над поверхностью красной каймы, на поверхности его эритема и гиперкератоз.
Красная волчанка губ нередко осложняется вторичным гландулярным хейлитом.
Слизистая оболочка рта поражается при красной волчанке значительно реже, чем красная кайма губ. Процесс локализуется на слизистой оболочке губ, щек по линии смыкания зубов, реже языке, небе и других участках.
На слизистой оболочке рта различают следующие формы красной волчанки: типичную; экссудативногипе ремическую; эрозивноязвенную.
Типичная форма характеризуется очагами застойной гиперемии с инфильтрацией и гиперкератозом. В центре очага имеется атрофия, а по периферии - гиперкератоз в виде белых, прилегающих друг к другу полосок, расположенных в виде частокола.
В случае экссудативногиперемической формы вследствие сильного воспаления гиперкератоз и атрофия выражены нечетко.
При наличии травмирующего фактора экссудативногиперемическая форма довольно быстро трансформируется в эрозивноязвенную, при которой в центре очага поражения возникают болезненные эрозии или язвы. Вокруг эрозии или язвы на фоне эритемы видны радиально расходящиеся белые полоски. По периферии очага усиливаются явления гиперкератоза и иногда образуется гиперкератотический бордюр, состоящий из плотно прилежащих друг к другу полосок и точек. После заживления очага красной волчанки, как правило, остается рубцовая атрофия с древовидно расположенными рубцами и тяжами.
Течение хронической красной волчанки длительное (годы - десятилетия) с обострениями в весеннелетний период. Эрозивноязвенная форма хронической красной волчанки на красной кайме губ может озлокачествляться, в связи с чем эту разновидность относят к факультативному предраку.
Гистологическая картина поражения при хронической красной волчанке слизистой оболочки рта и губ характеризуется наличием паракератоза или паракератоза, чередующегося с гиперкератозом, акантозом и атрофией. Выявляются вакуольная дегенерация клеток базального слоя эпителия и нечеткость базальной мембраны вследствие проникновения клеток инфильтрата из стромы в эпителий. В собственной пластинке слизистой оболочки имеются массивный лимфоидноплазмоклеточный инфильтрат, расширение капилляров и застойные явления. Разрушение коллагеновых волокон особенно значительно под эпителием и вокруг мелких кровеносных сосудов. При эрозивноязвенной форме имеются дефекты эпителия, значительно выражены отек и воспаление.
Диагностика Красной волчанки:
Диагноз не вызывает затруднений, если очаги красной волчанки есть одновременно и на коже. Изолированные поражения слизистой оболочки рта или красной каймы губ могут вызывать сложности в диагностике, поэтому наряду с клиническим обследованием используют дополнительные методы исследования (гистологический, иммуноморфологический, люминесцентная диагностика). В лучах Вуда участки гиперкератоза при красной волчанке, локализованные на красной кайме губ, дают снежноголубое или снежнобелое свечение, на слизистой оболочке рта - белое или мутнобелое свечение в виде полос и точек.
Хроническую красную волчанку следует отличать от красного плоского лишая, туберкулезной волчанки и лейкоплакии. При локализации поражения на красной кайме губ его дифференцируют от актинического хейлита и абразивного преканцерозного хейлита Манганотти.
- Острая (системная) красная волчанка
Лечение Красной волчанки:
Широко применяют комплекс витаминов В2, В6, В|2 , никотиновую и аскорбиновую кислоты.
При нарушениях иммунного статуса показаны иммунокорригирующие препараты: левамизол (декарис), Тактивин, тималин и др.
- Острая (системная) красная волчанка
Лечение необходимо начинать в стационаре и как можно раньше. Курс лечения должен быть длительным и непрерывным. В активный период назначают глюкокортикоиды в больших дозах. Лечение начинают в острый период, как правило, с ударных доз - 60 мг преднизолона, постепенно доводя их до 35 мг в течение 3 мес, и до 15 мг еще через 6 мес. Дозу преднизолона снижают постепенно на Yi - уА таблетки в 2-3 нед под контролем общего состояния и лабораторных показателей. Затем индивидуально подбирают минимальную поддерживающую дозу (5-10 мг преднизолона). Для профилактики нарушения минерального обмена одновременно назначают препараты калия (хлорид калия, панангин, 15 % раствор ацетата калия).
После ликвидации острого периода системной красной волчанки проводят комбинированное лечение кортикостероидами (в поддерживающих или сниженных дозах) и аминохинолиновыми препаратами (по 1 таблетке плаквенила или делагила на ночь).
К каким докторам следует обращаться если у Вас Красная волчанка:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Красной волчанки, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Системная красная волчанка (СКВ) — это аутоиммунное мультисистемное заболевание, которое может поражать такие жизненно важные органы, как почки и головной мозг. Хотя в последние десятилетия выживаемость больных СКВ значительно улучшилась в результате использования кортикостероидов и иммуносупрессантов, современное лечение сопровождается значительными побочными эффектами. И сама болезнь, и побочные эффекты лечения приводят к кумуляции органных повреждений, что снижает и качество, и продолжительность жизни пациентов. Международная экспертная группа сформулировала рекомендации для достижения хороших результатов лечения СКВ с учетом клинического течения, накопления необратимых органных изменений и функционального статуса. Рабочая группа установила четыре всеобъемлющих принципа ведения больных СКВ, подчеркивая важность вклада пациента в процесс принятия решений, мультидисциплинарного подхода, регулярного мониторинга и корректировки терапии с целью повышения продолжительности жизни, предотвращения повреждения внутренних органов, оптимизации качества жизни путем снижения активности СКВ, минимизации проявлений сопутствующей патологии и токсичности лекарственных препаратов.
Ключевые слова: системная красная волчанка, лечение, ремиссия, активность, качество жизни.
Challenges in treating-to-target in systemic lupus erythematosus
Mok T.M.
City University of Hong Kong
North District Hospital, New Territories, Hong Kong
Systemic lupus erythematosus (SLE) is an autoimmune multi-systemic disease that can affect such vital organs as the kidneys and the brain. Although the survival rate of SLE patients has dramatically improved over the past few decades as a result of the use of corticosteroids and immunosuppressants, the current treatment is associated with significant adverse effects. Both the disease itself and the side effects from treatment are associated with cumulative organ damage, which reduces both the quality and expectancy of patients’ life. The international expert group on treat-to-target in SLE has formulated recommendations with the goals to yield superior outcomes in terms of clinical course, long-term damage and functional status. The working group established four overarching principles for managing SLE patients, emphasizing the importance of contribution of the patient in the decision making, the multidisciplinary approach, the regular monitoring and adjustment of therapy with the goals towards ensuring long-term survival, preventing organ damage, optimising health-related quality of life by controlling disease activity, minimising comorbidities and drug toxicity.
Key words: systemic lupus erythematosus, treatment, remission, activity, quality of life.
For citation: Mok T.M. Challenges in treating-to-target in systemic lupus erythematosus // RMJ. 2018. № 4(I). P. 6–9.
Введение
Системная красная волчанка (СКВ) — это системное аутоиммунное заболевание, распространенное среди азиатов несколько больше, чем в европейской популяции. СКВ затрагивает преимущественно женщин в репродуктивном возрасте и связана со значительной заболеваемостью и смертностью [1]. Это мультисистемное воспалительное заболевание, которое может поражать такие жизненно важные органы, как почки и головной мозг. Хотя в последние десятилетия выживаемость больных СКВ значительно улучшилась в результате использования кортикостероидов и иммуносупрессантов, современное лечение сопровождается значительными побочными эффектами. И сама болезнь, и побочные эффекты лечения приводят к кумуляции органных повреждений, что снижает качество и продолжительность жизни пациентов. Пациенты с СКВ также имеют повышенный стандартизированный коэффициент смертности, прежде всего за счет сердечно-сосудистой патологии и инфекционных осложнений [2].
Проблема ведения больных СКВ далека от разрешения
Несмотря на то, что СКВ по большей части имеет волнообразное течение клинической картины, у значительной доли пациентов (46–52%) имеет место постоянно высокая активность болезни [3]. Около четверти пациентов (24,5%) демонстрируют рефрактерное к проводимой терапии течение СКВ [4]. Рефрактерное течение СКВ, несмотря на современный арсенал терапии, часто проявляется симптомами изъязвления кожи (дискоидной волчанки), волчаночного нефрита и нейропсихиатрической симптоматикой. Пациенты с активным волчаночным нефритом, которые не отвечают на индукционную терапию, имеют худший долговременный прогноз по сравнению с теми, у кого имеется полностью или частично ранний положительный эффект лечения. В целом поражение внутренних органов при СКВ обусловливает неблагоприятный прогноз болезни и более высокую летальность [5].
В настоящее время единственным утвержденным биологическим препаратом для лечения активной СКВ является белимумаб. Он показан при легкой и умеренной степени активности заболевания. В связи с этим возникает насущная потребность в разработке стратегий для лучшего ведения больных СКВ и создания терапевтических подходов с более высокой клинической эффективностью и меньшим количеством побочных эффектов.
Трудности, стоящие на пути внедрения стратегии Т2Т при СКВ
Критерии Европейской антиревматической лиги (EULAR) для стратегии Т2Т при СКВ
Международная целевая группа сформулировала рекомендации с целями достижения превосходных результатов лечения СКВ с учетом клинического течения, накопления необратимых изменений и функционального статуса. Рабочая группа установила 4 всеобъемлющих принципа ведения больных СКВ, подчеркивая важность:
вклада пациента в процесс принятия решений;
мультидисциплинарного подхода;
регулярного мониторинга и корректировки терапии;
повышения продолжительности жизни, предотвращения повреждения внутренних органов, оптимизации качества жизни путем снижения активности СКВ, минимизации проявлений сопутствующей патологии и токсичности лекарственных препаратов.
Ниже представлен упрощенный вариант этих рекомендаций:
Ремиссия или как можно более низкая активность болезни, если ремиссия не может быть достигнута, являются терапевтическими мишенями, измеряемыми с помощью надежного индекса активности СКВ.
Предотвращение обострений.
Лечение больных СКВ с признаками серологической активности без явной клинической активности не рекомендуется.
Предотвращение накопления необратимых изменений в органах.
Решение проблемы факторов, влияющих на здоровье и связанных с качеством жизни больного: усталость, боль, депрессия.
Раннее распознавание и лечение волчаночного нефрита.
Как минимум 3-летняя поддерживающая иммуносупрессивная терапия волчаночного нефрита после успешного ответа на начальный курс терапии.
Использование, насколько возможно, низких доз кортикостероидов и, при возможности, их полная отмена.
Профилактика и лечение проявлений антифосфолипидного синдрома.
Применение противомалярийных препаратов у всех больных СКВ, если нет противопоказаний.
Контроль сопутствующей патологии.
Заключение
При СКВ необходимо мобилизовать усилия врачей для разработки стратегии Т2Т в целях оптимизации лечения этого заболевания. С разработкой удобных в клинической практике методик для измерения степени органоспецифических поражений, при конкретизации реалистичных и достижимых терапевтических целей, с выработкой критериев эффективности лечения поражения органов, с созданием системы строгого мониторинга пациентов с серологической активностью и созданием новых, высокоэффективных биологических агентов можно предположить, что цели профилактики обострений и органных повреждений при СКВ, а в конечном итоге — улучшение качества жизни и снижение смертности могут быть достигнуты.
Оригинал статьи: Mok T.M. Challenges in treating-to-target in systemic lupus erythematosus // Hong Kong Medical Diary. 2017. Vol. 22(10). P. 15–19. Перевод и публикация согласованы с редакцией издания. This reprint was authorized by The Federation of Medical Societies of Hong Kong. The Hong Kong Medical Diary May Issue 2017.
Статью перевел к.м.н. М.В. Головизнин
1. Mok M.Y., Li W.L. Do Asian patients have worse lupus? // Lupus. 2010. Vol. 19(12). P. 1384–1390.
2. Bernatsky S., Boivin J.F., Joseph L. et al. Mortality in systemic lupus erythematosus // Arthritis Rheum. 2006. Vol. 54(8). P. 2550–2257.
3. Conti F., Ceccarelli F., Perricone C. et al. Flare, persistently active disease, and serologically active clinically quiescent disease in systemic lupus erythematosus: a 2-year follow-up study // PLoS One. 2012. Vol. 7. P. e45934.
4. Pego-Reigosa J.M., Rua-Figueroa I., Lopez-Longo F.J. et al. Analysis of disease activity and response to treatment in a large Spanish cohort of patients with systemic lupus erythematosus // Lupus. 2015. Vol. 24. P. 720–729.
5. Bruce I.N., O’Keeffe A.G., Farewell V. et al. Factors associated with damage accrual in patients with systemic lupus erythematosus: results from the Systemic Lupus International Collaborating Clinics (SLICC) Inception Cohort // Ann Rheum Dis. 2015. Vol. 74. P. 1706–1713.
6. Atar D., Birkeland K.I., Uhlig T. ‘Treat to target’: moving targets from hypertension, hyperlipidaemia and diabetes to rheumatoid arthritis // Ann Rheum Dis. 2010. Vol. 69. P. 629–630.
7. Smolen J.S., Breedveld F.C., Burmester G.R. et al.Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force // Ann Rheum Dis. 2016. Vol. 75. P. 3–15.
8. Gibson K.L., Gipson D.S., Massengill S.A. et al. Predictors of relapse and end stage kidney disease in proliferative lupus nephritis: focus on children, adolescents, and young adults // Clin J Am Soc Nephrol. 2009. Vol. 4. P. 1962–1967.
9. Urowitz M.B., Feletar M., Bruce I.N. et al. Prolonged remission in systemic lupus erythematosus // J Rheumatol. 2005. Vol. 32. P. 1467–1472.
10. Medina-Quinones C.V., Ramos-Merino L., Ruiz-Sada P., Isenberg D. Analysis of Complete Remission in Systemic Lupus Erythematosus Patients Over a 32-Year Period // Arthritis Care Res. 2016. Vol. 68. P. 981–987.
11. Carlavilla A., Gutierrez E., Ortuño T. et al. Relapse of lupus nephritis more than 10 years after complete remission // Nephrol Dial Transplant. 2005. Vol. 20. P. 1994–1998.
12. Golder V., Kandane-Rathnayake R., Hoi A.Y. et al. Association of the lupus low disease activity state (LLDAS) with health-related quality of life in a multinational prospective study // Arthritis Res Ther. 2017. Vol. 19. P. 62.
13. Mikdashi J., Nived O. Measuring disease activity in adults with systemic lupus erythematosus: the challenges of administrative burden and responsiveness to patient concerns in clinical research // Arthritis Res Ther. 2015. Vol. 17. P. 183.
14. Romero-Diaz J., Isenberg D., Ramsey-Goldman R. Measures of adult systemic lupus erythematosus: updated version of British Isles Lupus Assessment Group (BILAG 2004), European Consensus Lupus Activity Measurements (ECLAM), Systemic Lupus Activity Measure, Revised (SLAM-R), Systemic Lupus Activity Questionnaire for Population Studies (SLAQ), Systemic Lupus Erythematosus Disease Activity Index 2000 (SLEDAI-2K), and Systemic Lupus International Collaborating Clinics/American College of Rheumatology Damage Index (SDI) // Arthritis Care Res. 2011. Vol. 63 Suppl. 11. P. S37–S46.
15. Isenberg D.A., Gordon C., Group BGBILA. From BILAG to BLIPS — disease activity assessment in lupus past, present and future // Lupus. 2000. Vol. 9. P. 651–654.
16. Steiman A.J., Gladman D.D., Ibanez D., Urowitz M.B. Prolonged serologically active clinically quiescent systemic lupus erythematosus: frequency and outcome // J Rheumatol. 2010. Vol. 37. P. 1822–1827.
17. Steiman A.J., Gladman D.D., Ibañez D., Urowitz M.B. Outcomes in patients with systemic lupus erythematosus with and without a prolonged serologically active clinically quiescent period // Arthritis Care Res. 2012. Vol. 64. P. 511–518.
18. Tseng C.E., Buyon J.P., Kim M. et al. The effect of moderate-dose corticosteroids in preventing severe flares in patients with serologically active, but clinically stable, systemic lupus erythematosus: findings of a prospective, randomized, double-blind, placebo-controlled trial // Arthritis Rheum. 2006. Vol. 54. P. 3623–3632.
19. Mok M.Y., Chan E.Y., Fong D.Y. et al. Antiphospholipid antibody profiles and their clinical associations in Chinese patients with systemic lupus erythematosus // J Rheumatol. 2005. Vol. 32. P. 622–628.
20. Mikdashi J., Handwerger B. Predictors of neuropsychiatric damage in systemic lupus erythematosus: data from the Maryland lupus cohort // Rheumatology. 2004. Vol. 43. P. 1555–1560.
Системная красная волчанка – системное воспалительное заболевание, связанное с продукцией аутоантител и иммунных комплексов к собственным тканям организма.
Преобладающий возраст развития заболевания – 20–40 лет. Преобладающий пол – женский
Гормональные влияния. Системная красная волчанка развивается в основном у женщин детородного возраста, но гормональные факторы, возможно, больше влияют на проявления заболевания, чем на его возникновение.
Генетические особенности. Роль генетических факторов подтверждает связь системной красной волчанки с наследственным дефицитом отдельных компонентов иммунной системы.
- Поражение кожи: дискоидное поражение – очаги напоминают по форме монеты с красными краями, истончением в центре и обесцвечиванием. Покраснение кожи носа и скул по типу бабочки (покраснение на щеках и в области спинки носа). Повышенная чувствительность к свету – кожные высыпания в результате необычной реакции на солнечный свет. Возможно также выпадение волос, крапивница.
- Поражение слизистых оболочек: воспаление слизистой губ, эрозии.
- Поражение суставов: боли в суставах.
- Поражение мышц: боли, мышечная слабость.
- Поражение легких – одышка, боли при дыхании.
- Поражение сердца.
- Поражение почек.
- Головная боль, напоминающая мигрень, не проходящая после приема обезболивающего, расстройства настроения.
- Общий анализ крови
- Обнаружение в крови LE-клеток
Диагностические критерии Американской ревматологической ассоциации
Диагноз системной красной волчанки считают достоверным при наличии 4 и более критериев (чувствительность – 96 %, специфичность – 96 %).
- Сыпь на скулах: фиксированное покраснение (плоское или приподнятое) на скуловых выступах, имеющее тенденцию к распространению к носогубной зоне.
- Дискоидная сыпь: красные приподнимающиеся бляшки с прилипающими кожными чешуйками.
- Фотодерматит: кожная сыпь, возникающая в результате необычной реакции на солнечный свет.
- Язвы в ротовой полости: изъязвления полости рта или носоглотки, обычно безболезненные.
- Артрит (поражение суставов). . .
- Поражение почек.
- Судороги: в отсутствие приема лекарств или метаболических нарушений (уремия, кетоацидоз, электролитный дисбаланс).
- Психоз: в отсутствие приема лекарств или электролитных нарушений.
- Гематологические нарушения: лейкопения
- Анти-ДНК: антитела к нативной ДНК в повышенном титре.
- Повышение титра антинуклеарных антител, выявленных методом непрямой иммунофлюоресценции или сходным методом в любой период болезни в отсутствие приема лекарств, вызывающих волчаночноподобный синдром.
Одни и те же симптомы могут быть признаками разных заболеваний, а болезнь может протекать не по учебнику. Не пытайтесь лечиться сами — посоветуйтесь с врачом.
Основу лечения составляют гормоны глюкокортикоиды. Наиболее высокие дозы применяются при остром течении, обострении болезни и высокой активности. Средняя доза составляет 1–1,5 мг/кг/сут. (в пересчете на преднизолон).
Начальную дозу подбирают так, чтобы снизить активность процесса, решая вопрос индивидуально. При III степени активности доза преднизолона составляет 60–40 мг, при II – 30–40 мг, при I – 15–20 мг. Если в первые два дня состояние больного не улучшилось, дозу увеличивают на 20–30 %.
Лечение волчанки гормонами в максимальной дозе проводится до достижения клинического эффекта (4–6 недель), затем дозу уменьшают не более 1/2 таблетки преднизолона в неделю. При очень высоких дозах можно начинать снижение с большей дозы – 5 мг/неделю. В течение ряда лет применяют поддерживающие дозы – 2,5–5 мг/сут.
Чем меньшая доза необходима для поддержания ремиссии, тем лучше прогноз. При длительном лечении гормонами возможны осложнения: возникновение язв пищеварительного канала, сахарного диабета, синдрома Иценко – Кушинга, нарушений психики, электролитного обмена, остеопороза, активизация хронической инфекции и др.
При неэффективности гормонов необходимо назначение цитостатических иммунодепрессантов. Часто применяется азатиоприн и циклофосфамид в дозе 1–2 мг/кг. Метотрексат 15 мг в неделю. Микофенолат мофетила 1,5–2 г/сут. Циклоспорин 2,5–4 мг/кг/сут. Курс лечения 6–8 недель, затем сохраняется поддерживающая доза в течение многих месяцев. Улучшение состояния при лечении цитостатиками наступает через 4–6 недель.
При волчанке противопоказано солнечное облучение.
В диете необходимо соблюдать низкое содержание жира, высокое содержание полиненасыщенных жирных кислот, кальция и витамина D.
Помимо классической пульс-терапии (метилпреднизолон 15–20 мг/кг массы тела в/в ежедневно в течение 3 последовательных дней), пульс-терапию назначают повторно с интервалом в несколько недель. Пульс-терапия может быть усилена циклофосфамидом 1 г внутривенно на 2-й день лечения. После проведения пульс-терапии дозу преднизолона следует снижать медленно.
Плазмаферез. В современном исполнении плазмаферез осуществляют с помощью центрифужной или мембранной технологии, с удалением за одну процедуру 40–60 мл/кг плазмы. Рекомендуемые курсы плазмафереза состоят из 3–6 процедур, проводимых последовательно или с короткими интервалами.
Плазмаферез у больных системной красной волчанкой показан как острое вмешательство при осложненной криоглобулинемии, гипервязком синдроме и тромбоцитопенической пурпуре. Плазмаферез может быть использован как дополнительное высокоэффективное средство при состояниях, непосредственно угрожающих жизни: молниеносный васкулит, полимиелорадикулоневрит, церебральная кома, геморрагический пневмонит. Оправдано подключение плазмафереза в случаях волчаночного нефрита, устойчивого к гормонам и цитотоксикам.
Среди сорбционных методов лечения различают селективное и неселективное удаление из циркуляции патологических белковых структур. К неселективным относится ГС, в основе которой лежат физико-химические свойства активированного угля. Помимо прямого удаления ЦИК, аутоантител и цитокинов, ГС стимулирует антиидиотипическую активность, фагоцитоз и повышает чувствительность клеточных рецепторов к лекарственным препаратам. В лечении больных СКВ ГС имеет те же показания, что и ПФ. Селективная сорбция осуществляется с помощью селективных иммуносорбентов (биологических или химических), способных целенаправленно удалять РФ, антитела к ДНК и ЦИК.
Экспериментальные исследования в этой области свидетельствуют о высокой эффективности иммуносорбентов у больных СКВ с высокой иммунологической активностью. Побочные проявления экстракорпоральной терапии обычно сводятся к транзиторной гиповолемии и ознобу, противопоказанием является язвенная болезнь в стадии обострения, маточное кровотечение, непереносимость гепарина.
Несмотря на подчас фантастические результаты в критических ситуациях при СКВ, ПФ и ГС, как самостоятельные методы лечения они редко находят свое место в плановой терапии. Их применение в значительной степени сдерживается развитием так называемого синдрома рикошета, возникающего непосредственно после процедуры и характеризующегося рецидивом клинической активности и резким повышением уровня антител и ЦИК. Подавление активности антителопродуцирующих b-лимфоцитов и предотвращение синдрома рикошета достигается путем последовательного, синхронного применения ПФ и ПТ МП-ЦФ. Синхронизация интенсивной терапии в виде многомесячной программы, возможно, превосходит по эффективности все известные способы лечения СКВ с неблагоприятным жизненным прогнозом.
Существует несколько методик синхронной интенсивной терапии:
- Серия плазмаферезов из 3–6 последовательных процедур с дальнейшим коротким курсом мегадоз ЦФ внутривенно;
- Начальная серия процедур ПФ (обычно 3) синхронно с внутривенным введением ЦФ 1 г и МП 3 г и в дальнейшем по одной процедуре ПФ в 1–3 мес. в течение года, синхронно с 1 г ЦФ и 1 г МП.
Вторая схема синхронной интенсивной терапии представляется более убедительной, так как обеспечивает программный контроль в течение года. Программное назначение комбинации ПФ и ПТ МП и ЦФ показано в первую очередь больным СКВ с неблагоприятным жизненным прогнозом, обусловленным началом системной красной волчанки в подростковом и молодом возрасте, быстрым развитием нефротического синдрома, быстропрогрессирующим типом нефрита, стойкой артериальной гипертензией и с развитием угрожающих жизни состояний (церебральный криз, поперечный миелит, геморрагический пневмонит, тромбоцитопения и др.).
Аутологичная трансплантация стволовых клеток предложена для лечения тяжелого течения СКВ.
Прогноз в отношении продолжительности жизни значительно снижается при наличии антифосфолипидного синдрома.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
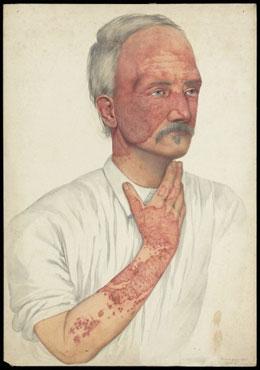
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Читайте также:

