Какие могут быть инфекции у недоношенных детей
Обновлено: 18.04.2024
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
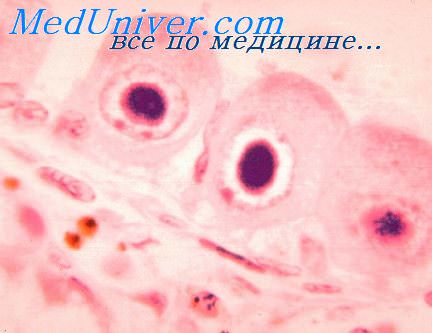
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
МКБ-10


Общие сведения

Причины
В акушерстве и гинекологии выделяют несколько факторов, которые повышают вероятность преждевременных родов. Большую значимость имеют социально-экономические причины: профессиональные вредности, проживание в экологически неблагоприятных условиях, неполноценное питание будущей матери. Медико-биологические факторы риска недоношенности подразделяются на следующие категории:
- Материнские факторы. Риск досрочных родов возрастает при осложнениях беременности (тяжелые гестозы, аномалии прикрепления плаценты), хронических соматических и острых инфекционных болезнях. Причиной недоношенности выступает иммунологическая несовместимость беременной и ребенка.
- Плодовые факторы. У многих глубоко недоношенных детей присутствуют признаки внутриутробных инфекций, задержки развития. Патологии плода могут быть проявлением врожденных аномалий, хромосомных заболеваний.
- Социально-биологические факторы. К этой группе относят возраст родителей (до 18 или старше 40 лет), наличие вредных привычек. Глубоко недоношенные дети чаще рождаются у матерей, в анамнезе у которых были спонтанные аборты, привычное невынашивание, мертворождение.
Признаки глубоко недоношенного ребенка
Внешние признаки
Новорожденные имеют внешние особенности, которые обусловлены недоразвитостью всех систем организма. У таких детей размеры головы составляют до 1/3 длины тела, мозговая часть черепа преобладает над лицевой, черепные швы открыты. Характерны мягкие и недоразвитые ушные раковины, еле заметные ареолы и соски грудных желез. Глубоко недоношенные младенцы имеют большой распластанный живот с низко расположенным пупком.
Кожа очень тонкая, морщинистая, ярко-красного или цианотичного оттенка. На лице, спине и конечностях определяется обильный зародышевый пушок. Ногти тонкие, находятся на середине дистальных фаланг пальцев. У девочек большие половые губы не прикрывают малые, виден выступающий клитор и темно-красная промежность. У мальчиков пальпируется недоразвитая мошонка, яички в ней отсутствуют.

Функциональные особенности
Поражение ЦНС проявляется угнетением функций глотания и сосания, отсутствием кашлевого рефлекса. У глубоко недоношенных детей определяются критические нарушения терморегуляции, неспособность поддерживать температуру тела. Вследствие незрелости коры головного мозга двигательная активность регулируется подкорковой деятельностью: преобладают хаотичные движения, дрожание рук, клонические судороги.
Дыхание поверхностное и аритмичное, частота дыхательных движений колеблется от 40 до 90 вдохов в минуту. Характерно недоразвитие альвеол, отсутствие сурфактанта, низкая растяжимость легочной ткани. Пульс составляет 100-180 ударов за минуту, показатели систолического артериального давления не превышают 60-70 мм рт. ст., диастолического – 20-30 мм рт. ст. При глубокой недоношенности отмечается эмбриокардия, дисфункция миокарда, аритмия.
Желудок новорожденного имеет малые размеры – не более 2 мл/кг массы тела, выработка соляной кислоты и активность пищеварительных ферментов снижена. Недоношенность сопровождается слабой и монотонной перистальтикой кишечника, угнетением синтеза иммуноглобулинов А. Транзиторная потеря веса достигает 10-14%, показатели массы тела восстанавливаются в среднем в течение 3-х недель.
Большую важность в практической неонатологии имеет супрессия иммунной системы глубоко недоношенного новорожденного. Уровня материнских антител недостаточно для надежной защиты в первом полугодии жизни, система комплемента и другие неспецифические иммунные факторы недостаточно активны. Дети склонны к быстрой генерализации инфекции и септическим состояниям.
Осложнения
Глубоко недоношенные дети составляют до 60% в статистике перинатальной смертности, в 20-30 раз чаще погибают в первые 28 дней жизни, в 10 раз чаще имеют врожденные пороки развития. Выравнивание антропометрических показателей доношенных и недоношенных детей происходит на 2-3 году жизни. Даже при успешном выхаживании младенца на первых этапах, в будущем у него сохраняется высокий риск физической и интеллектуальной неполноценности.
До 70% детей имеют проявления бронхолегочной дисплазии, практически у всех развивается респираторный дистресс-синдром. Около 60% младенцев страдают от неврологических и нейросенсорных нарушений, у 14-16% развивается ДЦП. Ретинопатия встречается у четверти новорожденных, причем впоследствии большинство из них страдает от снижения остроты зрения. Тугоухость развивается у 20% глубоко недоношенных, у 2-4% из них имеет место глухота.
Из-за недоразвития ЦНС гипоксически-ишемическая энцефалопатия у таких новорожденных имеет более серьезный прогноз. До 47% детей демонстрируют грубую задержку психомоторного развития к годовалому возрасту. Типичным осложнением глубокой недоношенности является перивентрикулярная лейкомаляция. Гипогликемия новорожденных развивается в 4 раза чаще, неонатальная гипокальциемия встречается у 89% младенцев.
Диагностика
При начале родовой деятельности у женщины на сроке 22-28 недель живорожденный ребенок автоматически считается глубоко недоношенным. Для оценки степени зрелости используется шкала по Балларду, которая учитывает состояние кожи, развитие наружных половых органов, мышечный тонус. При обследовании ребенка придерживаются принципа минимальной инвазивности, чтобы не наносить дополнительную травму. Назначаются следующие виды исследований:
- Нейросонография. Ультразвуковое исследование проводится на 1-3-й день для выявления пороков развития мозга и неврологических заболеваний. При необходимости сонография повторяется каждые 3-7 дней до стабилизации состояния. Для уточнения диагноза на 2-м месяце жизни показана МРТ головного мозга.
- Аудиологический скрининг. Исследование назначается перед выпиской из стационара для исключения или подтверждения наличия тугоухости. Данные информативны при проведении диагностики не ранее 34-й недели постконцептуального возраста.
- Офтальмологический осмотр. В 4-6 недель жизни планируется первая консультация детского офтальмолога для оценки наличия ретинопатии недоношенных. Дальнейший график осмотров подбирается с учетом выявленных отклонений.
- Лабораторные анализы. Для оценки тяжести состояния ребенка проводится общий анализ крови с лейкоцитарной формулой, анализ мочи, исследование уровня глюкозы крови. В первые дни необходим контроль газов крови, по показаниям выполняется анализ на острофазовые показатели.

Лечение глубоко недоношенных детей
Консервативная терапия
- эмпирическая антибиотикотерапия препаратами пенициллинового ряда или аминогликозидами для профилактики неонатальных инфекций;
- введение витамина К внутривенно или внутримышечно для профилактики спонтанных кровотечений;
- инъекции аналептиков для стимуляции дыхания, повышения тонуса скелетных мышц;
- инфузионная терапия для коррекции гипертонической дегидратации;
- введение сурфактанта (от одной до трех доз) для лечения синдрома дыхательных расстройств.
Вскармливание детей с ЭНМТ, которые имеют слабый глотательный рефлекс, проводится с помощью желудочного зонда. Субстратом выбора является сцеженное грудное молоко, которое при необходимости обогащается белками, углеводами, кальцием и фосфором. Объем разового кормления начинают с 0,5-1 мл, частота – до 12 раз в сутки. При тяжелом состоянии ребенка назначается парентеральное питание с постепенным переходом на энтеральное вскармливание.
Выписка глубоко недоношенных детей из стационара проводится при достижении массы тела 2000 г и общем удовлетворительном состоянии. К этому времени у младенца устанавливается нормальная частота пульса и дыхания, присутствует способность поддерживать стабильную температуру тела, налажено энтеральное питание. До выписки должны быть проведены плановые прививки и скрининговые исследования.
Реабилитация
Все дети, родившиеся глубоко недоношенными, после выписки из неонатального отделения требуют постоянного врачебного наблюдения. Для контроля динамики имеющихся нарушений назначается клинический, лабораторный и инструментальный мониторинг. Целью врачебной помощи на этом этапе является продолжение лечения, профилактика осложнений и инвалидности, консультирование родителей по особенностям ухода за ребенком.
Прогноз
Профилактика
Профилактика предполагает совершенствование медицинской помощи беременным женщинам. Необходимо своевременно выявлять пациенток из групп риска, проводить правильную подготовку к зачатию и осуществлять динамическое наблюдение в течение всей беременности. Превентивные меры включают отказ от вредных привычек, профилактические осмотры у гинеколога, выявление и лечение соматических болезней у женщин репродуктивного возраста.
3. Клинические рекомендации по оказанию медицинской помощи детям, родившимся в сроках гестации 22-27 недель/ Д.О. Иванов, О.Г. Капустина, Т.К. Мавропуло, А.И. Оболонский, Д.Н. Сурков. – 2016.
4. Недоношенные дети. Выхаживание и вскармливание недоношенных детей̆ с различной̆ массой̆ тела в родильном доме и на втором этапе выхаживания/ Губарева Г.Н., Кириенко О.С. – 2015.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Недоношенные дети – это дети, родившиеся ранее срока родов, функционально незрелые, с массой ниже 2500 г и длиной тела менее 45 см. Клинические признаки недоношенности включают непропорциональное телосложение, открытые швы черепа и малый родничок, невыраженность подкожно-жирового слоя, гиперемию кожных покровов, недоразвитие половых органов, слабость или отсутствие рефлексов, слабый крик, интенсивную и длительную желтуху и др. Выхаживание недоношенных детей подразумевает организацию специального ухода - температурного режима, влажности, уровня оксигенации, вскармливания, при необходимости – проведение интенсивной терапии.

Общие сведения
Недоношенными считаются дети, рожденные в период с 28 по 37 неделю беременности, имеющие массу тела 1000-2500 г и длину тела 35-45 см. Наиболее устойчивым критерием считается срок гестации; антропометрические показатели, в силу их значительной вариабельности, относятся к условным критериям недоношенности. Ежегодно в результате самопроизвольных преждевременных родов или искусственно индуцированного прерывания беременности на поздних сроках недоношенными появляются на свет 5-10% детей от общего числа новорожденных.
По определению ВОЗ (1974 г.), плод считается жизнеспособным при гестационном сроке более 22 недель, массе тела от 500 г, длине тела от 25 см. В отечественной неонатологии и педиатрии рождение плода ранее 28 недели гестации, имеющего массу тела менее 1000 г и длину менее 35 см расценивается как поздний выкидыш. Однако, если такой ребенок родился живым и прожил после рождения не менее 7 суток, он регистрируется как недоношенный. Уровень неонатальной смертности среди недоношенных детей намного выше такового среди доношенных младенцев, и в значительной мере зависит от качества оказания медицинской помощи в первые минуты и дни жизни ребенка.

Причины недоношенности
Все причины, приводящие к рождению недоношенных детей можно объединить в несколько групп. К первой группе относятся социально-биологические факторы, включающие слишком юный или пожилой возраст родителей (моложе 18 и старше 40 лет), вредные привычки беременной, недостаточное питание и неудовлетворительные бытовые условия, профессиональные вредности, неблагоприятный психоэмоциональный фон и др. Риск преждевременного родоразрешения и рождения недоношенных детей выше у женщин, не планировавших беременность и пренебрегающих медицинским сопровождением беременности.
К третьей группе причин, нарушающих нормальное созревание плода и обуславливающих повышенную вероятность рождения недоношенных детей, относятся различные экстрагенитальные заболевания матери: сахарный диабет, гипертоническая болезнь, пороки сердца, пиелонефрит, ревматизм и др. Часто преждевременные роды провоцируются острыми инфекционными заболеваниями, перенесенными женщиной на поздних сроках гестации.
Наконец, рождение недоношенных детей может быть связано с патологией и аномальным развитием самого плода: хромосомными и генетическими болезнями, внутриутробными инфекциями, тяжелыми пороками развития.
Классификация недоношенности
С учетом обозначенных критериев (срока гестации, массы и длины тела) выделяют 4 степени недоношенности:
I степень недоношенности – родоразрешение происходит на сроке 36-37 недель гестации; масса тела ребенка при рождении составляет 2500-2001 г, длина – 45-41 см.
II степень недоношенности - родоразрешение происходит на сроке 32-35 недель гестации; масса тела ребенка при рождении составляет 2001-2500 г, длина – 40-36 см.
III степень недоношенности - родоразрешение происходит на сроке 31-28 недель гестации; масса тела ребенка при рождении составляет 1500-1001 г, длина – 35-30 см.
Внешние признаки недоношенности
Для недоношенных детей характерен ряд клинических признаков, выраженность которых коррелирует со степенью недоношенности.
У глубоко недоношенных детей все роднички и швы черепа открыты, черепные кости податливые, мозговой череп преобладает над лицевым. Характерно недоразвитие ушных раковин, слабое развитие ногтей (ногтевые пластинки не доходят до кончиков пальцев), слабая пигментация сосков и околососковых кружков. Половые органы у недоношенных детей недоразвиты: у девочек отмечается зияние половой щели, у мальчиков – неопущение яичек в мошонку (крипторхизм).
Недоношенные дети, рожденные на сроке 33-34 недели гестации и позже, характеризуются большей зрелостью. Их внешний облик отличается розовым цветом кожных покровов, отсутствием пушка на лице и туловище, более пропорциональным телосложением (меньшей головой, более высоким расположением пупка и пр.). У недоношенных детей I-II степени сформированы изгибы ушных раковин, выражена пигментация сосков и околососковых кружков. У девочек большие половые губы практически полностью прикрывают половую щель; у мальчиков яички расположены у входа в мошонку.
Анатомо-физиологические особенности недоношенных детей
Недоношенность определяется не столько антропометрическими показателями, сколько морфофункциональной незрелостью жизненно важных органов и систем организма.
Характерными особенностями органов дыхания у недоношенных детей являются узость верхних дыхательных путей, высокое стояние диафрагмы, податливость грудной клетки, перпендикулярное расположение ребер относительно грудины. Данные морфологические особенности недоношенных детей обусловливают поверхностное, частое, ослабленное дыхание (40-70 в мин.), склонность к апноэ длительностью 5-10 секунд (апноэ недоношенных). Вследствие недоразвития эластической ткани легких, незрелости альвеол, сниженного содержания сурфактанта у недоношенных детей легко возникает синдром дыхательных расстройств (застойные пневмонии, респираторный дистресс-синдром).
Незрелость сердечно-сосудистой системы характеризуется лабильностью пульса, тахикардией 120-180 в мин., приглушенностью сердечных тонов, артериальной гипотонией (55-65/20-30 мм рт. ст.). При наличии врожденных пороков сердца (открытого Боталлова протока, открытого овального окна) могут выслушиваться шумы. Вследствие повышенной ломкости и проницаемости сосудистых стенок легко возникают кровоизлияния (подкожные, во внутренние органы, в мозг).
Морфологическими признаками незрелости ЦНС у недоношенных детей служат слабая дифференцировка серого и белого вещества, сглаженность борозд мозга, неполная миелинизация нервных волокон, обедненная васкуляризация подкорковых зон. Мышечный тонус у недоношенных детей слабый, физиологические рефлексы и двигательная активность снижены, реакция на раздражители замедлена, терморегуляция нарушена, имеется склонность как к гипо-, так и гипертермии. В первые 2-3 недели у недоношенного ребенка могут возникать преходящий нистагм и косоглазие, тремор, вздрагивания, клонус стоп.
У недоношенных детей отмечается функциональная незрелость всех отделов желудочно-кишечного тракта и низкая ферментовыделительная активность. В связи с этим недоношенные дети предрасположены к срыгиваниям, развитию метеоризма, дисбактериоза. Желтуха у недоношенных детей выражена интенсивнее и сохраняется дольше, чем у доношенных новорожденных. Вследствие незрелости ферментных систем печени, повышенной проницаемости гематоэнцефалического барьера и бурного распада эритроцитов у недоношенных детей может легко развиваться билирубиновая энцефалопатия.
Функциональная незрелость почек у недоношенных детей приводит к изменению электролитного баланса (гипокальциемии, гипомагниемии, гипернатриемии, гиперкалиемии), декомпенсированному метаболическому ацидозу, склонности к возникновению отеков и быстрому обезвоживанию при неадекватном уходе.
Деятельность эндокринной системы характеризуется задержкой становления циркадного ритма выделения гормонов, быстрым истощением желез. У недоношенных детей отмечается низкий синтез катехоламинов, часто развивается транзиторный гипотиреоз, в первые дни жизни редко проявляется половой криз (физиологический мастит, физиологический вульвовагинит у девочек).
У недоношенных детей более быстрыми темпами, чем у доношенных, развивается ранняя анемия, имеется повышенный риск развития септицемии (сепсиса) и септикопиемии (гнойного менингита, остеомиелита, язвенно-некротического энтероколита).
В течение первого года жизни нарастание массы и длины тела у недоношенных детей происходит очень интенсивно. Однако по антропометрическим показателям недоношенные дети догоняют рожденных в срок сверстников только к 2-3 годам (иногда к 5-6 годам). Отставание в психомоторном и речевом развитии у недоношенных детей зависит от степени недоношенности и сопутствующей патологии. При благоприятном сценарии развития недоношенного ребенка выравнивание происходит на 2-ом году жизни.
Дальнейшее физическое и психомоторное развитие недоношенных детей может идти наравне со сверстниками или запаздывать.
Среди недоношенных детей чаще, чем среди доношенных сверстников встречаются неврологические нарушения: астено-вегетативный синдром, гидроцефалия, судорожный синдром, вегето-сосудистая дистония, детский церебральный паралич, гиперактивность, функциональная дислалия либо дизартрия. Почти у трети недоношенных детей обнаруживается патология органа зрения – близорукость и астигматизм различной степени выраженности, глаукома, косоглазие, отслойка сетчатки, атрофия зрительного нерва. Недоношенные дети склонны к частым повторным ОРВИ, отитам, на фоне чего может развиваться тугоухость.
Женщины, родившиеся недоношенными, во взрослой жизни часто страдают нарушениями менструального цикла, признаками полового инфантилизма; у них может отмечаться угроза самопроизвольного прерывания беременности и преждевременных родов.
Особенности ухода за недоношенными детьми
Дети, рожденные недоношенными, нуждаются в организации особого ухода. Их поэтапное выхаживание осуществляется специалистами неонатологами и педиатрами сначала в родильном доме, затем в детской больнице и поликлинике. Основными составляющими ухода за недоношенными детьми являются: обеспечение оптимального температурно-влажностного режима, рациональной кислородотерапии и дозированного вскармливания. У недоношенных детей осуществляется постоянный контроль электролитного состава и КОС крови, мониторирование газового состава крови, пульса и АД.
Глубоко недоношенные дети сразу после рождения помещаются в кувезы, где с учетом состояния ребенка поддерживается постоянная температура (32-35°С), влажность (в первые дни около 90%, затем 60-50%), уровень оксигенации (около 30%). Недоношенные дети I-II степени обычно размещаются в кроватках с обогревом или в обычных кроватках в специальных боксах, где поддерживается температура воздуха 24-25°С.
Недоношенные дети, способные самостоятельно поддерживать нормальную температуру тела, достигшие массы тела 2000 г, имеющие хорошую эпителизацию пупочной ранки, могут быть выписаны домой. Второй этап выхаживания в специализированных отделениях детских стационаров показан недоношенным, не достигшим в первые 2 недели массы тела 2000 г, и детям с перинатальной патологией.
Кормление недоношенных детей следует начинать уже в первые часы жизни. Дети с отсутствующим сосательным и глотательным рефлексами получают питание через желудочный зонд; если сосательный рефлекс выражен достаточно, но масса тела менее 1800 г – ребенка вскармливают через соску; дети с массой тела свыше 1800 г могут быть приложены к груди. Кратность кормлений недоношенных детей I-II степени 7-8 раз в сутки; III и IV степени - 10 раз в сутки. Расчет питания производится по специальным формулам.
Диспансеризация недоношенных детей
После выписки дети, рожденные недоношенными, нуждаются в постоянном наблюдении педиатра в течение первого года жизни. Осмотры и антропометрия проводятся еженедельно в первый месяц, 1 раз в две недели – в первом полугодии, 1 раз в месяц - во втором полугодии. На первом месяце жизни недоношенные дети должны быть осмотрены детским хирургом, детским неврологом, детским травматологом-ортопедом, детским кардиологом, детским офтальмологом. В возрасте 1 года детям необходима консультация логопеда и детского психиатра.
С 2-недельного возраста недоношенные дети нуждаются в профилактике железодефицитной анемии и рахита. Профилактические прививки недоношенным детям выполняются по индивидуальному графику. На первом году жизни рекомендуются повторные курсы детского массажа, гимнастики, индивидуальных оздоровительных и закаливающих процедур.
Инфекции, повреждения головного мозга у недоношенных новорожденных. Особенности
У недоношенных младенцев имеется более высокий риск инфекционных осложнений, поскольку IgG в основном переносится через плаценту в последнем триместре, a IgA и IgM вообще не переносятся. Кроме того, инфекция внутри или вокруг шейки матки часто является причиной преждевременных родов и может вызвать инфицирование сразу после рождения.
Большинство инфекционных осложнений у недоношенных младенцев развиваются через несколько дней после рождения и являются нозокомиальными (внутрибольничными); они часто связаны с установленными катетерами или ИВЛ.
Инфекции у недоношенных младенцев являются основной причиной смерти и способствуют развитию бронхопульмональной (бронхолёгочной) дисплазии (БПД) — хронического заболевания лёгких, повреждению белого вещества головного мозга и последующей инвалидности.

Повреждения головного мозга у недоношенных
Кровоизлияния в головной мозг происходят в 25% случаев у младенцев с ОНВР и легко распознаются при ультразвуковом сканировании черепа. В типичных случаях они происходят в зародышевом матриксе выше хвостатого ядра, которое содержит тонкую сеть кровеносных сосудов. Большинство кровоизлияний происходит в первые 72 ч жизни.
Они наиболее типичны вследствие перинатальной асфиксии и у младенцев с тяжёлым РДС. Пневмоторакс является значительным фактором риска. Небольшие кровоизлияния, ограниченные зародышевым матриксом, не увеличивают риск церебрального паралича. Кровоизлияние может происходить в желудочках; обширные внутрижелудочковые кровоизлияния обусловливают 25-30% риск церебрального паралича.
Наиболее тяжёлым кровоизлиянием является односторонний геморрагический инфаркт с вовлечением паренхимы мозга; это часто приводит к гемиплегии.
Обширное внутрижелудочковое кровоизлияние может привести к нарушению оттока и реабсорбции спинномозговой жидкости (СМЖ), приводя к тому, что СМЖ накапливается под давлением. Эта дилатация может разрешаться спонтанно или прогрессировать до гидроцефалии, которая может вызывать расхождение швов, быстрое увеличение окружности головы и напряжённость переднего родничка.
Иногда требуется вентрикулоперитонеальное шунтирование, однако первоначальное облегчение симптомов можно обеспечить удалением СМЖ с помощью люмбарной или желудочковой пункции. Около половины младенцев с прогрессирующей постгеморрагической дилатацией желудочков страдают церебральным параличом, также имеется более высокий процент паренхиматозных инфарктов.
При наличии двусторонних множественных кист, так называемой ПВЛ, существует 80-90% риск спастической диплегии при заднем расположении. Внутрижелудочковое кровоизлияние и ПВЛ могут происходить при отсутствии патологических клинических проявлений.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

