Какие организмы относятся к прокариотам аденовирусы
Обновлено: 24.04.2024
• Хотя на теле человека или в его организме обитает много микробов, лишь небольшая их часть представляет собой патогенные бактерии
• Патогенные бактерии способны заселять ткани организма хозяина, а также размножаться и существовать в них
• Многие патогенные микроорганизмы продуцируют токсины, которые усугубляют поражение клеток организма хозяина
Организм животных содержит достаточное количество питательных веществ и обеспечивает поддержание относительно стабильных значений pH, осмотического давления и температуры. Это создает оптимальную среду для роста разнообразных прокариот. Тесные биологические взаимоотношения, существующие между двумя различными организмами, например между микробами и клетками хозяина, называются симбиотическими. В зависимости от степени выгоды или вреда, симбиоз между хозяином и микробом может быть взаимным, комменсальным паразитическим или патогенным. Эндосимбиоз рассматривался в предыдущем разделе.
Абсолютное большинство прокариот, находящихся в симбиотических отношениях с другими клетками, являются комменсальными резидентами, которые или слабо влияют на организм хозяина, или вообще не оказывают на него никакого влияния. Некоторые комменсальные обитатели оказываются полезными, и в некоторых случаях выполняют нужные функции в организме хозяина. Например, штаммы Е. coli, содержащиеся в желудочно-кишечном тракте, помогают пищеварению.
Микробы, растущие в организме, и не приносящие ему пользы называются паразиты. Некоторые из таких паразитических взаимоотношений оказываются вредными для организма хозяина. Микробы, которые причиняют вред организму хозяина, называются патогенными, и их способность заселять организм и вызывать заболевания является результатом многих факторов как со стороны организма хозяина, так и со стороны микроорганизмов. Патогенные микроорганизмы подразделяются на оппортунистические и первичные. Оппортунистические бактерии вызывают инфекции только при поражениях организма, например при тяжелых ожогах, СПИДе, и у некоторых раковых больных.
Первичные патогены вызывают заболевание нормального, здорового организма, и иногда их размножение полностью зависит от самого организма хозяина. Независимо от типа патогена, вызывающего инфекцию, микроб должен проникнуть в организм хозяина, заселить его, избежать атаки со стороны иммунной системы, и начать размножаться. Наряду с этим, первичные патогены должны подготовиться к передаче инфекции к другому хозяину.
До того как патоген вызовет повреждения в организме хозяина, он должен получить доступ к его тканям и начать размножаться. Места первичной инфекции обычно представляют собой открытые участки, например на коже или участки слизистой дыхательного, мочеполового и кишечного эпителия. На поверхности микробных клеток экспрессируются несколько разных молекул, которые связываются с рецепторами, присутствующими в тканях хозяина. Эти адгезивные молекулы представляют собой полисахариды или белки. Например, Streptococcus mutans посредством своей полисахаридной капсулы адсорбируется на поверхности зубной эмали и вызывает кариес.
Для прикрепления к клеткам тканей хозяина, многие микробы используют такие поверхностные белковые структуры, как пили. Наличие таких адгезивных органелл часто обеспечивает патогену вирулентность, и при их отсутствии микроорганизмы оказываются неспособными вызвать инфекцию; они обычно уничтожаются и выводятся из организма.
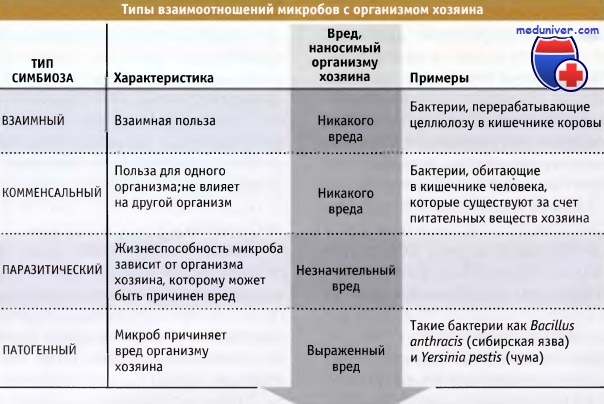
Существует несколько типов симбиотических взаимоотношений.
В зависимости от этого, симбиоз может оказаться полезным или вредным для организма хозяина.
Прикрепление микробов к тканям представляет собой тканеспецифичный процесс и зависит также от вида бактерий. Специфичность по отношению к определенным тканям обычно называют тропностыо. Например, микроб, вызывающий гоноррею, Neisseria gonorrhoeae, прочно прикрепляется к эпителию мочеполовой системы и почти не связывается с эпителиальными клетками другой локализации. К числу примеров иллюстрирующих специфичность связывания, в зависимости от вида бактерий, относится связывание с клетками почечного эпителия штамма Е. coli, вызывающего пиелонефрит. Эти штаммы обладают одной из трех разновидностей Р-ворсинок, каждая из которых специфична в отношении почечного эпителия человека, собаки или крысы.
Некоторые бактериальные патогены заселяют эпителий, вызывая инфекцию. Такая инвазия дает микробам доступ к питательным продуктам, которые поддерживают их размножение. Попадание через эпителий в кровеносные сосуды позволяет бактериям расти не только в местах первоначального заселения, но и в более отдаленных. Системные инфекции часто являются результатом проявления активности патогена, получившего доступ в кровь или лимфатическую систему, при инвазии эпителиального слоя.
Поскольку первоначальный очаг заражения редко бывает достаточно обширным, патоген должен размножиться в организме, чтобы вызвать ощутимые последствия. Ткани организма хозяина являются подходящим местом для роста бактерий. Однако в тканях существует недостаток некоторых необходимых питательных компонентов, и патогенные микроорганизмы должны быть способны более эффективно использовать имеющиеся ресурсы и в то же время противостоять атакам со стороны иммунной системы хозяина. Преимуществом обладают бактерии, способные использовать сложные источники питания, например гликоген. Патогены могут конкурировать с клетками организма хозяина за микроэлементы, например за железо.
В клетках животных есть два белка, трансферрин и лактоферрин, которые связывают и переносят железо. Таким образом в тканях организма хозяина находится очень мало свободной формы железа. Для обхода этой системы у патогенных бактерий существуют эффективные комплексы, хелатирующие железо, которые называются сидерофоры. Они помогают им накапливать железо из окружающей среды.
Патогенные бактерии продуцируют множество вирулентных факторов, которые помогают им инфицировать организм хозяина и поддерживать патологический процесс. К числу грамположительных патогенов относятся Streptococci, Staphylococci и Pneumococci, которые продуцируют ферменты, расщепляющие полисахариды клетки хозяина, что дает возможность инфекции распространяться по тканям. Clostridium является продуцентом коллагеназы, которая деполимеризует коллагеновые структуры, скрепляющие ткани хозяина, в результате чего микроб распространяется по организму. Streptococcus pyogenes распространяется по тканям благодаря действию стрептокиназы, которую продуцирует этот микроорганизм. Стрептокиназа ослабляет фибриновые структуры клеток и тканей хозяина, препятствующие распространению патогена.
Наоборот, некоторые патогены способны локализоваться (образовывать защитную оболочку вокруг своей клетки) за счет продуцирования ферментов, обеспечивающих образование фибринового сгустка. К числу хорошо известных ферментов такого типа относится коагулаза, продуцируемая Staphylococcus aureus. Микроорганизмы, продуцирующие коагулазу, покрываются фибриновой оболочкой, и считается, что она предохраняет микроб от действия защитных систем организма хозяина.
Наряду с попаданием бактерий и их размножением поражение организма хозяина усиливается под действием бактериальных токсинов. Выделяемые токсины называются экзотоксинами, и они способны повреждать ткани, расположенные далеко от места первичной инфекции. По механизму действия экзотоксины можно подразделить на три группы. Цитолитические экзотоксины, например гемолизин, действуют на цитоплазматические мембраны клеток организма хозяина и вызывают их лизис. Штаммы бактерий, обладающие гемолитическим действием, легко идентифицируются при выращивании на агаре, содержащем кровь. При выделении гемолизина происходит лизис эритроцитов, что приводит к образованию белых участков на фоне красного агара. Представителем второй группы экзотоксинов является токсин, продуцируемый Corynebacterium diphtheriae, который вызывает заболевание дифтерией.
Когда Corynebacterium попадает в среду с низким содержанием железа (что свидетельствует о попадании бактерии в организм хозяина), она начинает секретировать дифтерийный токсин, который попадает в клетки организма хозяина и вызывает остановку трансляции. К третьей группе относятся нейротоксины, включая ботулинический токсин, продуцируемый Clostridiun botulinum. Для человека это наиболее токсичный из известных токсинов. Ботулинический токсин блокирует высвобождение ацетилхолина из нервных клеток, что приводит к необратимому расслаблению мышц и к параличам.
Каждый патогенный микроорганизм использует свои детерминанты вирулентности, вызывающие то или иное инфекционное заболевание. Для микроорганизмов, продуцирующих сильные токсины, начальная степень инвазии и темпы размножения микробов не играют критической роли. Например, Clostridium tetani не относится к инвазивным микроорганизмам, поскольку продуцирует мощный токсин. Инфекция С. tetani часто приводит к смертельному исходу. В то же время Streptococcus pneumoniae не продуцирует токсин однако из-за высоких темпов размножения микроорганизма в легочной ткани инфекции оказываются смертельными. Большие количества бактерий в ткани легких ослабляют иммунную систему организма и вызывают пневмонию. Исследование механизмов вирулентности прокариот обеспечивает разработку новых терапевтических средств для борьбы с инфекционными заболеваниями.
Динамика взаимоотношений организма хозяина с патогенными микробами представляет собой бурно развивающуюся область исследований.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Бактерии. Прокариоты. Эукариоты. Различия между прокариотической и эукариотической клетками. Архебактерии. Эубактерии.
Бактерии [от греч. bakterion, уменьш. от baktron, трость, посох] — представители царства Procariotae, включающего бактерии и сине-зелёные водоросли. Бактерии крупнее вирусов, большинство из них можно изучать светооптической микроскопией. Прокариотическая клетка меньше эукариотической, ДНК в ней не окружена ядерной мембраной, а органеллы типа митохондрий и хлоропластов отсутствуют.
Клетки бактерий окружены особо организованной клеточной стенкой, имеют ограниченное число отделов (компартментов) либо вообще лишены их (рис. 2-4). Они также имеют различия в синтезе ДНК, белков и продуктов клеточной стенки (табл. 2-1). Все известные бактерии разделяют на архебактерии (то есть древние бактерии) и эубактерии (к которым относят большинство современных видов).
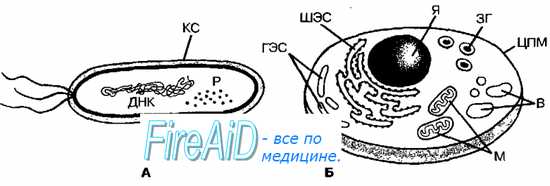
Рис. 2-4. Основные различия между прокариотической и эукариотической клетками. Бактериальная (прокариотическая) клетка (А) окружена клеточной стенкой (КС). Цитоплазма обильно насыщена рибосомами (Р). Молекула ДНК обычно расположена в центре клетки. Цитоплазма эукариотической клетки (Б) окружена цитоплазматической мембраной (ЦПМ), включает митохондрии (М), вакуоли (В), шероховатую эндоплазматическую сеть с рибосомами (ШЭС), гладкую эндоплазмати-ческую сеть (ГЭС), запасные гранулы (ЗГ) и ядро (Я).
Архебактерии
Архебактерии [от греч. arche, начало + бактерия] обитают в биотопах с экстремальными условиями. Вероятно, эти биотопы напоминают существовавшие на заре развития жизни на Земле. К архебактериям относят метанобразующие бактерии, экстремально галофильные бактерии (растут в присутствии 12-32% NaCl) и термоацидофильные бактерии (растут при 75-90 °С и низком рН).
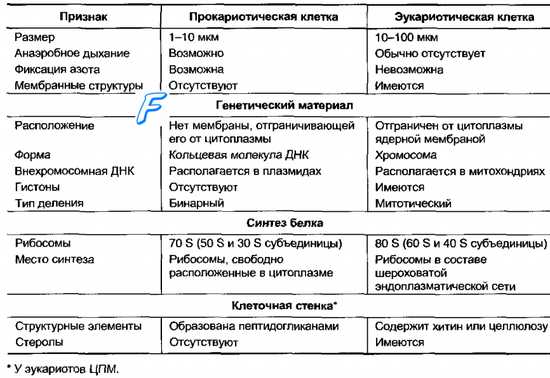
Таблица 2-1. Основные различия клеток прокариотов (эубактерий) и эукариотов
Эубактерии
Большинство эубактерий — свободноживущие сапрофиты, но среди них имеются виды, вызывающие заболевания у растений и животных. Значительная часть патогенных бактерий способна покрывать свои энергетические и метаболические потребности путём расщепления различных субстратов. Их можно выращивать на синтетических средах.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Прокариоты. Бактериология. Бактерии.
К царству прокариот относятся организмы, которых обычно называют бактериями. Это — наидревнейшая группа, появившаяся примерно 3,5 млрд. лет назад; к тому же это и мельчайшие организмы, обладающие клеточной структурой. Свойства прокариот суммированы в таблице. Как правило, прокариоты представлены одиночными клетками, хотя сине-зеленые водоросли (цианобактерии, Cyanobacteria) могут образовывать цепочки клеток, называемые нитями.
Бактерии прилипают друг к другу, терные скопления, напоминаю-винограда, однако объединившиеся клетки остаются абсолютно независимыми друг от друга. Индивидуальную бактериальную клетку можно увидеть только с помощью микроскопа, почему их и называют микроорганизмами. Наука, изучающая бактерий — бактериология — составляет важную ветвь микробиологии.
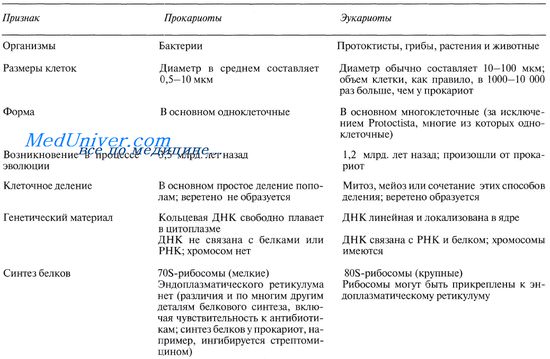
Основные различия между прокариотами и эукариотами
Бактерии различаются по своим размерам: их длина колеблется от 0,1 до 10 мкм, а диаметр в среднем составляет — 1 мкм. Таким образом, в бактериальной клетке достаточно места, чтобы поперек нее уместилось 200 молекул глобулярных белков среднего размера (5 нм в диаметре). Поскольку такие молекулы способны диффундировать примерно на расстояние 60 мкм в секунду, никаких специальных механизмов транспорта этим организмам не нужно.
Бактерий можно обнаружить повсюду: в почве, и в пыли, в воде и в воздухе, внутри и на поверхности животных и растений. Некоторые бактерии поселяются в горячих источниках с температурой 78 °С или выше. Другие способны ^ыдц^шд_очень низких температурах и даже определенные периоды замораживания во льду.
Встречаются бактерии и в глубоких расселинах на дне океана при очень высоком давлении и температуре 360 °С. С них начинаются уникальные пищевые цепи в этих областях океана.
Число бактерий невообразимо велико; установлено, что водном грамме плодородной почвы содержится 2,5 млрд. бактерий; в 1 см3 свежего молока их содержание может превышать 3 млрд. Вместе с грибами бактерии имеют жизненно важное значение для всех других организмов, поскольку, разрушая в результате своей жизнедеятельности органические вещества, они обеспечивают циркуляцию биогенных элементов в природе. Кроме того, они приобретают все более важное значение в жизни человека, и не только потому, что некоторые из них являются возбудителями различных болезней, но и потому, что в силу разнообразия протекающих в них биохимических реакций они могут использоваться во многих биотехнологических процессах.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
cGAS и виперины — редкие примеры известных противовирусных систем прокариот, унаследованных эукариотами
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Что мы знаем об иммунитете прокариот?
Что объединяет грипп [1], оспу [2], бешенство [3], краснуху [4], геморрагическую лихорадку Эбола и COVID-19? Правильно, все эти заболевания человека вызываются вирусами. Есть названия и у некоторых вирусных инфекций других многоклеточных организмов: чума собак, паралич сверчка, табачная мозаика. Однако никто не придумал имена инфекционным заболеваниям прокариот. Между тем, вирусы и им изрядно досаждают. Разумеется, и прокариоты, и эукариоты обзавелись целым арсеналом средств для борьбы с паразитами, причем о защитных системах последних, а особенно об иммунной системе человека, науке известно куда больше, и информация о принципах работы врожденного и приобретенного иммунитетов давно вошла в школьный учебник.
А что у прокариот? Любой молекулярный биолог знает системы рестрикции-модификации и CRISPR-Cas, поскольку их компоненты нашли широкое применение в лабораторной практике [5], [6]. Однако это далеко не все антивирусные приспособления прокариот, известные ученым. Долгое время поиск был сосредоточен на Escherichia coli и еще нескольких модельных бактериях, но даже в такой узкой группе микроорганизмов удалось обнаружить несколько антивирусных систем с различными механизмами действия. Настоящую революцию в поиске новых антифаговых систем произвело обнаружение защитных островков (defence islands) — участков геномов прокариот, которые кодируют компоненты защитных систем [7]. Таким образом, если какой-то ген Х находится вблизи генов уже известных защитных систем в большом количестве прокариотических геномов, можно предположить, что Х тоже кодирует какой-то белок, участвующий в борьбе с вирусами. Поскольку количество прочитанных прокариотических геномов в последнее время растет как на дрожжах, этот подход позволяет ученым ежегодно находить новые гены, вовлеченные в защиту от вирусов . Так, в одной из статей 2018 года авторы описали сразу девять новых защитных систем [8], а в 2020 году одновременно две группы сообщили об обнаружении антифаговой активности у некоторых ретронов — крайне странных генетических элементов прокариот, казавшихся ранее абсолютно бесполезными [9], [10].
Еще в 2011 году обнаружили, что в защитных островках часто находятся гены, кодирующие белки-аргонавты , и с тех пор были получены убедительные свидетельства их роли в защите клеток от фагов [7], [15]. Эта находка интересна тем, что в отличие от остальных известных нам антивирусных систем прокариот, аргонавты широко распространены и среди эукариот. Странно, что до недавнего времени белки-аргонавты были единственным подобным примером. К счастью, два недавних открытия устранили это недоразумение.
cGAS — универсальный сигнальный компонент антивирусных систем
Узнавание вирусной нуклеиновой кислоты — важнейший этап активации врожденного антивирусного иммунитета у животных. Один из рецепторов, узнающих двунитевую ДНК в цитоплазме, получил название cGAS (cyclic GMP-AMP synthase), поскольку после связывания мишени начинает синтезировать циклический динуклеотид cGAMP (циклический гуанозинмонофосфат-аденозинмонофосфат, цГАМФ) из АТФ и ГТФ. cGAMP в свою очередь запускает сигнальный каскад, который активирует синтез интерферонов, необходимых в борьбе с вирусом [17].
Ученые из Weizmann Institute of Science в Израиле проанализировали 38 167 микробных геномов и обратили внимание, что из 637 прокариотических гомологов гена cGAS 417 (65,5%) находятся в защитных островках в составе оперона из 2–4 генов (рис. 1) [18]. Предположив, что такая локализация может указывать на антифаговую активность, они решили проверить, будет ли cGAS обеспечивать иммунитет штамму E. coli, в норме не содержащему такой системы. Для этого были выбраны два оперона: один из штамма E. coli TW11681, а другой из холерного вибриона Vibrio cholerae El Tor. Оказалось, что оба оперона повысили устойчивость лабораторного штамма E. coli к некоторым бактериофагам, то есть действительно функционируют как защитная система. Ученые дали этой системе название CBASS (cyclic-oligonucleotide-based antiphage signalling system).

Рисунок 1. Опероны, кодирующие cGAS, находятся в защитных островках. Желтым показаны известные системы противофаговой защиты.
Теперь предстояло понять механизм действия CBASS. Первым делом исследователи проверили, появляется ли cGAMP в клетках с CBASS в ответ на фаговую инфекцию. Для этого они проанализировали состав клеточных лизатов методом масс-спектрометрии. Как и предполагалось, cGAMP обнаружился только в клетках, содержащих систему CBASS, и только после заражения фагом.
Интересно, что в обоих исследованных оперонах ген cGAS соседствовал с геном фосфолипазы CapV, которая активируется cGAMP’ом и расщепляет липиды клеточной мембраны. Выходит, что зараженная вирусом бактерия включает систему самоубийства.
Такое поведение — не редкость в мире прокариот: известен целый класс антифаговых систем под названием Abi (abortive infection), принцип действия которых заключается в том, что клетка, обнаружив фаговую инфекцию, совершает суицид до того, как фаг успеет размножиться. Таким образом, ценой жизни одной клетки достигается защита целой популяции.
Для доказательства функционирования CBASS по механизму абортивной инфекции клетки смешали с разными концентрациями фаговых частиц. В случае, когда на пять бактериальных клеток приходилась одна фаговая частица (multiplicity of infection, MOI = 0,2), то есть зараженной оказывалась лишь часть клеток, популяция бактерий, обладающих CBASS, успешно справлялась с инфекцией, а когда концентрация фаговых частиц вдвое превышала концентрацию бактерий (MOI = 2), то есть заражались сразу все клетки, лизис культуры произходил еще быстрее, чем в штамме без CBASS (рис. 2). Это означает, что суицидальная система CBASS в первом случае спасла популяцию от полного уничтожения, а во втором спровоцировала немедленную гибель всех клеток в культуре.

Рисунок 2а. Графики роста культуры E. coli в зависимости от наличия CBASS и фаговой инфекции

Рисунок 2б. Схема действия CBASS: в ответ на заражение cGAS продуцирует cGAMP, который включает фосфолипазу, разрушающую клеточную мембрану
Хотя ученым и удалось обнаружить новую защитную систему прокариот, многое всё еще непонятно. Во-первых, остается загадкой, что является триггером для активации cGAS. Вряд ли это двунитевая ДНК, как у эукариот, ведь у прокариот ядра нет, и отличить геномную ДНК от вирусной не так-то просто. Во-вторых, неясно, во всех ли случаях CBASS ведет себя как система абортивной инфекции. Дело в том, что вместо фосфолипазы в состав CBASS могут входить другие белки с неизвестной активностью.
Так или иначе, cGAS заслужил место в ряду белков, вовлеченных в антивирусную защиту у представителей и прокариот, и эукариот.
Виперины — универсальная защита против вирусных РНК-полимераз
Виперин — один из белков, продуцируемый клетками животных в ответ на обработку интерферонами. Известно, что виперин подавляет репликацию многих вирусов за счет продукции ddhСTP (3′-deoxy-3′4′-didehydro-CTP, 3′-дезокси-3′4′-дидегидро-ЦТФ, ддгЦТФ) — производного одного из четырех нуклеотидов, из которых РНК-полимеразы строят РНК. ddhCTP узнается вирусными РНК-полимеразами и включается в состав РНК, но из-за отсутствия 3′-концевого гидроксила фермент не может продолжить синтез. Один из вирусов, с которым борется человеческий виперин — печально известный вирус Зика , [19].
Всё те же исследователи из Израиля заметили, что некоторые гомологи виперинов у прокариот кодируются генами, находящимися в защитных островках (рис. 3) [22]. Для подтверждения их участия в борьбе с вирусами ученые помещали гены 59 представителей прокариотических виперинов в лабораторный штамм E. coli и проверяли, придают ли они устойчивость к фаговым инфекциям. Около половины исследуемых белков показали хорошие результаты в защите от целого ряда фагов, что позволило заявить об открытии новой антивирусной системы прокариот.

Рисунок 3. Прокариотические виперины локализуются в защитных островках. Желтым выделены гены известных систем противофаговой защиты.
Для выяснения механизма работы виперинов ученые вновь прибегли к масс-спектрометрическому анализу клеточных лизатов после заражения фагом Т7. На этот раз искали ddhСTP, но нашли не только его: оказалось, что разные прокариотические виперины синтезируют производные разных нуклеотидов: ЦТФ, УТФ и ГТФ (рис. 4). Забавно, что среди продуктов виперинов не обнаружили производных АТФ. Сами авторы работы предполагают, что это связано с несовершенством системы детекции.

Рисунок 4. Филогенетическое дерево виперинов. Обозначены человеческий виперин и исследованные в работе прокариотические виперины, а также их субстратная специфичность.
Чтобы проверить эффект виперинов на работу фаговой РНК-полимеразы, исследователи экспрессировали под контролем промотора фага Т7 ген зеленого флуоресцентного белка GFP в клетках E. coli, кодирующих РНК-полимеразу фага Т7, и наблюдали, что клетки флуоресцируют. Но если в таких клетках экспрессировать один из генов виперинов, GFP не синтезируется (рис. 5).

Рисунок 5. Виперины подавляют активность РНК-полимеразы Т7 in vivo. МоаА — отрицательный контроль. В присутствии виперинов снижается экспрессия гена GFP, находящегося под контролем промотора Т7-РНК-полимеразы.
Полученные данные подтверждают, что прокариотические виперины борются с вирусами по тому же принципу, что и виперины животных. Хотя правильнее будет сказать, что виперины животных работают как прокариотические: филогенетический анализ свидетельствует о том, что эукариотические виперины — лишь небольшая веточка на разветвленном дереве этого белкового семейства (рис. 4).
Микробы — это модно
Людям свойственно интересоваться прежде всего собой, и уж если не видом Homo sapiens, то хотя бы животными или на худой конец растениями. Однако во все времена находились энтузиасты, исследующие необъятный мир микробов. Может, этим энтузиастам следует заняться какими-то действительно важными проблемами? Неужели мы уже все болезни научились лечить? Только вот без любителей микробов не было бы у нас ни эндонуклеаз рестрикции для клонирования, ни термофильных ДНК-полимераз для ПЦР, ни CRISPR-Cas для редактирования геномов. Если хорошенько поискать, то у прокариот непременно найдется еще много интересного и полезного! А искать сейчас удобно как никогда: информация о новых секвенированных геномах поступает непрерывным потоком, только успевай анализировать. Исследования в области прокариотических систем защиты от фагов — отличный пример такого поиска. Открытие новых антивирусных систем, общих для бактерий, архей и эукариот, показывает, что можно узнавать что-то новое про нас с вами, изучая захватывающе разнообразный мир микробов.
Бактерии. Прокариоты. Эукариоты. Различия между прокариотической и эукариотической клетками. Архебактерии. Эубактерии.
Бактерии [от греч. bakterion, уменьш. от baktron, трость, посох] — представители царства Procariotae, включающего бактерии и сине-зелёные водоросли. Бактерии крупнее вирусов, большинство из них можно изучать светооптической микроскопией. Прокариотическая клетка меньше эукариотической, ДНК в ней не окружена ядерной мембраной, а органеллы типа митохондрий и хлоропластов отсутствуют.
Клетки бактерий окружены особо организованной клеточной стенкой, имеют ограниченное число отделов (компартментов) либо вообще лишены их (рис. 2-4). Они также имеют различия в синтезе ДНК, белков и продуктов клеточной стенки (табл. 2-1). Все известные бактерии разделяют на архебактерии (то есть древние бактерии) и эубактерии (к которым относят большинство современных видов).

Рис. 2-4. Основные различия между прокариотической и эукариотической клетками. Бактериальная (прокариотическая) клетка (А) окружена клеточной стенкой (КС). Цитоплазма обильно насыщена рибосомами (Р). Молекула ДНК обычно расположена в центре клетки. Цитоплазма эукариотической клетки (Б) окружена цитоплазматической мембраной (ЦПМ), включает митохондрии (М), вакуоли (В), шероховатую эндоплазматическую сеть с рибосомами (ШЭС), гладкую эндоплазмати-ческую сеть (ГЭС), запасные гранулы (ЗГ) и ядро (Я).
Архебактерии
Архебактерии [от греч. arche, начало + бактерия] обитают в биотопах с экстремальными условиями. Вероятно, эти биотопы напоминают существовавшие на заре развития жизни на Земле. К архебактериям относят метанобразующие бактерии, экстремально галофильные бактерии (растут в присутствии 12-32% NaCl) и термоацидофильные бактерии (растут при 75-90 °С и низком рН).

Таблица 2-1. Основные различия клеток прокариотов (эубактерий) и эукариотов
Эубактерии
Большинство эубактерий — свободноживущие сапрофиты, но среди них имеются виды, вызывающие заболевания у растений и животных. Значительная часть патогенных бактерий способна покрывать свои энергетические и метаболические потребности путём расщепления различных субстратов. Их можно выращивать на синтетических средах.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

