Какими веществами отравляется человек с поврежденными почками
Обновлено: 19.04.2024
Выделяют специфическое поражение почек при острых экзотоксикозах. Оно связано с отравлением нефротоксическими веществами: этиленглнколем, щавелевой кислотой, ртутью, хромом, свинцом, мышьяком. Токсическая нефропатия возникает при отравлении гемолитическими веществами (уксусная кислота, мышьяковистый водород, медный купорос). Нарушение функции почек развивается вслед за токсическим поражением печени (гепаторенальнын синдром).
Выделяют неспецифическое поражение почек. Оно проявляется при тяжелом отравлении различными ядами, а также при расстройстве гемодинамики (первичный токсикогеиный коллапс, ЭТШ). Большое место в структуре поражения почек занимает синдром позиционного сдавлеиия, который является осложнением коматозных состояний.
Патогенез (что происходит?) во время Токсической нефропатии:
Патогенез токсической нефропатии во многом зависит от этиологии. При отравлении этиленгликолем и щавелевой кислотой он связан с отеком нефронов. Специфическое действие солей ртути обусловлено связыванием белковых сульфгидрильных групп, что приводит к нарушению клеточного дыхания нефронов и преципитации белков. Подобный механизм действия и у других солей тяжелых металлов.
При отравлении гемолитическими ядами разрушаются эритроциты и выделяется свободный гемоглобин, который закупоривает нефроны. При синдроме позиционного сдавления нефроны поражаются свободным миоглобином. Гепаторенальный синдром обусловлен токсическим поражением почек свободными аминокислотами (лейцин, тирозин и др.).
Все указанные причины приводят к ишемии мембран клеток нефронов. Если ишемия продолжается несколько суток, возникают необратимые некробиотические изменения в клубочках и канальцах.
Симптомы Токсической нефропатии:
Клиническая картина. Выделяют три степени токсической нефропатии:
- Легкая степень характеризуется появлением в моче белка, форменных элементов крови и цилиндров.
- Средняя степень проявляется, помимо указанных симптомов, снижением диуреза, умеренным повышением мочевины, креатинина, калия и других метаболитов.
- Тяжелая степень характеризуется картиной острой почечной недостаточности (ОПН).
Острая почечная недостаточность
Выделяют инициальную, олигоанурическую, полиурическую фазы ОПН и период выздоровления.
Инициальная фаза ОПН продолжается 1-3 сут и характеризуется признаками острого отравления веществами с нефротоксическим действием. У этих больных необходим ежедневный контроль за диурезом, при его снижении проводится стимуляция 16 % раствором маинита, лазиксом (100200 мг на введение) в сочетании с эуфиллином.
Олигоанурическая фаза продолжается 7-14 дней. Это наиболее тяжело протекающая фаза ОПН. В ней наблюдается снижение диуреза (менее 500 мл/сут олигурия, менее 50 мл/сут анурия), задержка жидкости (острое водное отравление гидремия) вызывает перегрузку левого желудочка, синдром "влажных легких", что сопровождается одышкой, появлением влажных хрипов в легких. Может развиваться отек легких и мозга. В организме накапливаются шлаки и прежде всего продукты белкового обмена: креатинин, мочевина и средние молекулы их уровень уже через несколько дней повышается в 3-4 раза. Появляется слабость, заторможенность. Может быть интоксикация калием, при гиперкалиемии 811 ммоль/л наблюдается урежение ритма и даже остановка сердца. На ЭКГ регистрируется снижение амплитуды комплексов QRS, возможно развитие синоаурикулярной, атриовентрикулярной и внутрижелудочковой блокад, отмечается гиперкалиемический зубец Т высокоамплитудный с узким основанием.
В эту стадию быстро прогрессирует ацидоз рН снижается до 7,3. Метаболические сдвиги угнетают кроветворение (гемосинтетазу), нарастает анемия, тромбоцитопения, присоединяется вторичный токсический васкулит. Все это может привести к кровотечению и развитию ДВС-синдрома. Раздражение костного мозга токсическими веществами сопровождается лейкоцитозом со сдвигом лейкоцитарной формулы влево.
Полиурическая фаза. При благоприятном течении ОПН олигоанурическая фаза переходит в фазу полиурии. Повышается, а затем нарастает диурез при низком удельном весе мочи. Иногда он достигает более 35 л/сут. Это связано с нарушением реабсорбции воды и солей канальцами иефроиов. Так полиурия может привести к обезвоживанию и гипосалемии. Длительность фазы полиурии составляет 1530 дней.
Период выздоровления характеризуется постепенным повышением удельного веса мочи и нормализацией гомеостаза. Этот процесс продолжается от 6 мес до 2 лет.
Летальность при ОПН колеблется в широких пределах (от 20 до 70 %) в зависимости от этиологического фактора.
Лечение дифференцируется на оказание помощи больному в токсикогеиную и соматогенную фазы отравления. В токсикогеиную фазу лечебные мероприятия направлены на детоксикацию и предупреждение токсической нефропатии. В соматогенную фазу лечится синдром ОПН. При снижении диуреза проводят его стимуляцию маниитолом (500 мл 16 % раствора внутривенно струйно 2 раза в сутки) или лазиксом (100 мг внутривенно струйно 2 раза в сутки). Диурез усиливается при внутривенном введении эуфиллина.
В фазу олигоанурии внутривенно капельно ежедневно назначают по 500 мл 20 % раствора глюкозы с добавлением 5 мл 5 % раствора аскорбиновой кислоты и 16 ЕД инсулина для уменьшения интоксикации мочевиной и калием. С целью ликвидации ацидоза вводят 250-500 мл 4 % раствора гидрокарбоната натрия (под контролем рН сыворотки). Для восстановления уровня кальция и предупреждения геморрагии показан 1 % раствор хлорида кальция (150 мл). Рекомендуется переливание плазмы и альбумина, назначение витаминных комплексов, препаратов, улучшающих обмен веществ (актовегин, солкосерил, цитохром, цитомак). Анаболические гормоны (иеробол, ретаболил) показаны не ранее чем через неделю после отравления.
Повышение уровня мочевины до 30-40 ммоль/л и калия более 67 ммоль/л служит показанием для гемодиализа. При массивных отеках проводят ультрафильтрацию. Появление геморрагического синдрома и коллапса является противопоказанием к данным методам лечения. Можно использовать для детоксикации метод перитоиеального диализа.
В последнее время с этой же целью применяют лечебную лимфорею в количестве 1000-4000 мл. В фазу полиурии необходимо следить за электролитным балансом организма.
Лечение Токсической нефропатии:
Первый вид мероприятий - этиологическое лечение, которое носит профилактический характер и наиболее эффективно при своевременном его применении в первые часы заболевания.
Даже при тяжелом отравлении дихлорэтаном, в случае очень рано начатых мероприятий по ускоренному выведению яда из организма, клиническая картина токсической гепатопатии оказывается более благоприятной, без явлений недостаточности печени.
В случае отравления гепатотоксическими веществами оправдано сочетанное применение нескольких лечебных мероприятий по удалению этих веществ из организма: раннее промывание желудка с последующим введением в него вазелинового масла или адсорбента (активированный уголь), гемодиализа в течение 5–6 ч под контролем снижения концентрации этих препаратов в крови, перитонеального диализа в течение 1–2 сут с учетом возможности вымывания этих соединений из жирового депо сальника.
Теоретически вполне оправдано применение вместо обычного стандартного диализирующего раствора специально подготовленного стерильного масла, например интерлипида, который значительно увеличивает клиренс жирорастворимых препаратов. Рационально одновременное проведение форсированного диуреза, лучше с использованием осмотических диуретиков (сорбитол, маннитол). Хотя количество выделяемых гепатотоксических веществ с мочой невелико, применение осмотического диуреза позволяет повысить осмотичность эпителия канальцев почек до состояния функциональной гидропии, которое снижает резорбтивную функцию эпителия и в какой-то мере предохраняет его от грубых повреждений нефротоксинами или аминокислотами, выделяемыми поврежденной печенью, которые в норме дезаминируются.
К каким докторам следует обращаться если у Вас Токсическая нефропатия:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Токсической нефропатии, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Поражение почек при отравлении ртутью
Почки при отравлении ртутью:
- Поражения почек. Нефротоксичность, обусловленная воздействием ртути, может проявляться или как острый некроз канальцев, или как иммунный комплексный гломерулонефрит. Нефротический синдром бывает вторичным относительно мембранозного гломерулонефрита (МГН). Комплемент-тесты (С3, С4, СН50) нормальны. Титр антинуклеарных антигенов (AHA) и титры LE в норме. Почечные венограммы и внутривенные пиелограммы нормальны. Моча иногда содержит овальные жировые тельца, жировые и гиалиновые цилиндры.
- Этиология. Развитие МГН наблюдалось после применения зубных порошков, содержащих ртуть, которые давали детям; осветляющих кожу кремов, применяемых чернокожими африканками, и ртутно-аммиачных мазей от псориаза. Такие поражения были также описаны после профессиональной экспозиции к ртути. В случаях нефротического синдрома, обусловленного металлическими загрязнителями, целесообразно исследовать неокрашенный материал с помощью электронной микроскопии и биопсийный материал с элементарным анализом.
- Почечная функция. Почки обладают выраженной способностью концентрировать ртуть. Этот орган всегда поражается после экспозиции к ртути. Способность солей ртути (например, ее хлорида) вызывать сильное повреждение почечных канальцев убедительно удостоверена документально. Данные о том, что экспозиция человека к парам металлической ртути вызывает поражение почек, менее убедительны.
По результатам исследования с участием рабочих химических предприятий, подвергавшихся воздействию неорганической ртути, повышенные уровни ртути в моче коррелировали с чрезмерными нейропсихологическими симптомами, повышенным уровнем в моче N-ацетил-бетa-D-гликозаминидазы (лизосомный фермент, присутствующий в клетках почечных канальцев) и пониженными средними скоростями проведения по двигательным нейронам; не выявлено никакой корреляции между уровнем ртути в моче и показаниями нейроповеденческих тестов, судорожными движениями глаз или помутнением хрусталика.
- Протеинурия. Существует 2 типа протеинурии, обусловленных отравлением ртутью, — клубочковая и канальцевая. Клубочковая протеинурия характеризуется вытеканием сывороточных белков (преимущественно с высокой молекулярной массой) через поврежденные клубочки, и предполагается, что это идиосинкразический иммунно-комплексный гломерулонефрит. Канальцевая протеинурия включает разнообразные белки и ферменты.
Многие из этих маркеров — белки с низкой молекулярной массой (например, b2-микроглобулин и белок, связывающий ретинол), обычно фильтрующиеся через клубочки и затем реабсорбирующиеся в проксимальных канальцах. Другие (например, NАГ) выделяются из пораженных клеток проксимальных канальцев прямо в мочу. Канальцевая протеинурия может быть более чувствительным маркером ртутной интоксикации. Повышенные уровни NАГ могут в большей степени отражать недавнюю активность нарушенного процесса, чем острую токсичность. Повышенное содержание в моче b2-микроглобулина (b2-М) может быть более показательным для хронической токсичности, чем для острой. Кроме того, поскольку они свободно фильтруются, содержащиеся в моче b2-М более чувствительны к сывороточным концентрациям.
Концентрации b2-М в сыворотке плохо коррелируют с количественными показателями экспозиции к ртути.
- Аналитические методы. Сывороточные белки с низкой молекулярной массой определяют методом электрофореза в акриламидном геле. Экскреция b2-микроглобулина измеряют специфическим методом радиоиммуноанализа.
- NАГ (N-ацетил-бета-D-гликозаминидаза). Несмотря на повышенное содержание ртути в крови и моче, показания рутинных клинических анализов, таких как объективное обследование, анализ крови и мочи, обычно нормальны. Более чувствительными показателями токсичности могут быть оценка нейропсихологических симптомов, повышенный уровень N-ацетил-беTa-D-гликозаминидазы (NАГ) в моче, пониженная скорость проведения двигательных нейронов и выявление помутнений хрусталика при обследовании с помощью щелевой лампы.
- Лабораторные данные. Концентрация ртути в моче, превышающая 150 мкг/л, — это уровень проявления ранних неврологических симптомов у взрослых. Он может соответствовать средневзвешенной во времени концентрации за 8 ч или концентрации паров элементарной ртути, равной 50 мкг/м3. По рекомендации Агентства охраны окружающей среды (США), концентрация ртути в окружающем нас воздухе должна быть ниже 1 мкг/м3.
- Хлорид ртути. Постоянный прием слабительных средств, содержащих хлорид ртути (например, 240 мг хлорида ртути в течение 6 или более лет), может привести к появлению многих классических признаков и симптомов отравления неорганической ртутью, включая такие, как эретизм (необычная робость, потеря памяти, рассеянное внимание, снижение интеллекта) и мелкое дрожание рук или мышц лица. Кроме того, могут наблюдаться интенционный тремор, миоклонические судороги, слабость, гипорефлексия и глухота, отмечаемые как при отравлении двухвалентной, так и одновалентной ртутью.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Признаки болезни печени. Сигналы организма о нарушении работы печени
Гиппократ считал, что пессимистичный настрой человека и его раздражительность непременно связаны с застоем желчи в печени. И в некоторой степени "отец медицины" был прав. Во время злости и гнева рефлекторно задерживается отток желчи из печени и желчного пузыря. Вероятно, отсюда и корни выражения "желчный человек".
В наше время определять наличие заболеваний печени по настроению человека уже не будет ни один врач, так как существуют более явные признаки, сигнализирующие о проблемах с работой этого жизненного важного органа.
Печень выполняет огромное количество функций, среди которых главные - очищение организма от шлаков, токсинов и излишков гормонов, синтез холестерина и участие в обмене веществ. Поэтому крайне важно своевременно выявить признаки развития заболеваний печени и начать ее лечить, пока болезнь не успела нанести непоправимый вред здоровью. Вот характерные сигналы организма о нарушении работы печени:
- Боль в правом подреберье. Может быть от умеренной до интенсивной (трудно согнуться), отдавать в спину или правое плечо;
- Пожелтение склер глаз и кожи, тремор рук;
- Неприятные ощущения во рту: сухость, появление кисло-горького вкуса, тошнота;
- "Печеночные ладони". Внутренние стороны кистей (иногда подошвы) становятся ярко-красными. При надавливании бледнеют, затем красный цвет восстанавливается;
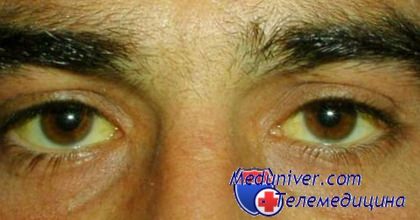
Желтуха при болезни печени - гепатите от воды
- Проблемы со сном. Он становится тревожным, прерывистым, особенно в один-три часа ночи, часто мучает бессонница;
- Язык становится ярко- красного цвета, иногда с фиолетовым оттенком, сухим, отечным, гладким;
- Запах - сладковатый, напоминающий запах свежего мяса или печени, чувствуется при дыхании и от тела больного;
- Постоянная жажда, которая не проходит даже после принятия достаточного количества жидкости;
- Поражение волос и ногтей. У мужчин волосы редеют на голове, у женщин - чаще под мышками и в лобковой области;
- Ногти становятся бледными и тусклыми, на них могут появиться бороздки, белые пятна;
- Пигментация кожи. Пятна обычно появляются на боковой поверхности щек с переходом на шею. Может темнеть кожа в подмышечных впадинах и на руках;
- Головокружение, головная боль, тахикардия;
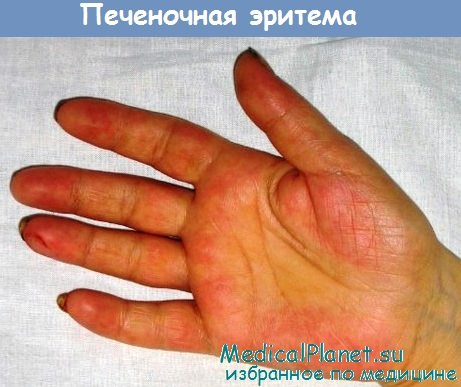
Пальмарная эритема - печеночные ладони
- Нарушение зрения, особенно в вечернее время;
- Появление аллергического дерматита, а также фурункулеза, атрофических полос (стрий) на бедрах, ягодицах, в нижней части живота;
- Кожный зуд. Чаще на отдельных местах туловища, ног и рук. Может сопровождаться сыпью. В основном имеет приступообразный, кратковременный характер;
- Появление натоптышей на мизинцах ног.
- Изменение окраса и запаха кала и мочи. Моча приобретает нездоровый коричневый оттенок, а кал меняется в цвете на светло-жёлтый или зелёный.
Чтобы избежать проблем в работе печени, не злитесь, не раздражайтесь по пустякам. А если обнаружили у себя признаки нарушения, не игнорируйте SOS-сигналы организма - пройдите обследование. Одним из самых опасных заболеваний является рак печени, которому характерно постепенное нарастание симптомов. Среди онкологических заболеваний он находится на 7-м месте по распространённости. Выявить рак печени можно по беспричинному резкому похудению и чувству тяжести под правым подреберьем. Мучают тупые боли в этой области, изжога и жажда.
При обнаружении первых симптомов неполадок в работе печени нужно, прежде всего, пересмотреть свой рацион. Исключить из рациона жирное мясо, консервы, копчености, острые блюда, алкоголь, наваристые бульоны. А также острые пряности и овощи: горчицу, хрен, чеснок, редис, поскольку они вызывают раздражение стенок желчного пузыря и, как следствие, спазмы.
Есть больше фруктов, особенно полезны для печени авокадо, свежие и запеченные яблоки, сырая и вареная свекла, зелень и мед. Пить свежевыжатые соки. Самая полезная для печени пряность - куркума. Добавляйте его по щепотке в каждое блюдо. Это поможет облегчить пищеварение, снизить уровень холестерина в крови, защитить от воздействия на печень токсичных веществ. Откажитесь от употребления сладостей, сахар тоже разрушает печень.
Для очищения печени от токсинов каждый день по утрам пейте на голодный желудок стакан теплой воды с добавлением 2 столовых ложек лимонного сока.
- Вернуться в оглавление раздела "Профилактика заболеваний"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Токсическая нефропатия — это повреждение гломерулярного аппарата и почечных канальцев, вызванное действием экзо- и эндотоксинов, гемодинамическими и метаболическими нарушениями при отравлениях. Проявляется болями в пояснице, астеническим синдромом, отечностью, олигоанурией, которая впоследствии сменяется полиурией, полиорганными нарушениями. Диагностируется при помощи общего, биохимического анализов крови и мочи, проб Реберга, Зимницкого, УЗИ и томографии почек, УЗДГ почечных сосудов, химико-токсикологических исследований. Лечение включает проведение дезинтоксикационной терапии, инфузионной коррекции нарушений метаболизма, ЗПТ.
МКБ-10
Общие сведения
Токсическая нефропатия — собирательное понятие, объединяющее ряд нефрологических заболеваний со сходным этиопатогенезом и клинической картиной. Распространенность патологии достигает 0,04%, что составляет до 20% всех регистрируемых случаев ОПН. Рост заболеваемости связан со все более широким применением химических веществ на различных производствах и в быту: по наблюдениям, ежегодно до 10 млн. человек постоянно контактирует с нефротоксичными химикатами. Кроме того, обратной стороной успехов фармацевтической отрасли стало появление новых лекарственных средств, оказывающих влияние на почки. Актуальность своевременного выявления токсической формы нефропатий обусловлена высоким уровнем смертности и тяжелыми исходами при необратимой деструкции ткани почек.

Причины
Поражение почечной паренхимы обусловлено воздействием химических веществ, оказывающих прямой или опосредованный нефротоксический эффект. В большинстве случаев ренальную дисфункцию, а в тяжелых случаях и деструкцию тканей, вызывают экзогенные производственные и бытовые яды, хотя у некоторых пациентов заболевание вызвано эндогенной интоксикацией. Специалисты в сфере урологии и нефрологии выделяют следующих группы причин, которые приводят к развитию нефропатии:
- Прием веществ с нефротоксическим эффектом. При попадании в почки ядов этой группы возникают острая гломерулопатия или тубулярный некроз, вызванный реабсорбцией большого количества токсических веществ. Непосредственным повреждающим эффектом на почечную ткань обладают соли тяжелых металлов (кадмия, свинца, ртути, золота, мышьяка, йода, висмута, хрома и др.), этиленгликоль, щавелевая и борная кислоты, бензин, фенол, толуол, орелланиновые грибные токсины, яды некоторых животных.
- Опосредованное токсическое повреждение почек. Отравления веществами с гемолитическим эффектом (уксусной кислотой, мышьяковистым водородом, медным купоросом, змеиным ядом и др.) осложняются закупоркой нефронов гемоглобином. Аналогичное повреждение вызывают массивное размозжение тканей и синдром длительного сдавления, при которых наблюдается миоглобинурия. При токсическом поражении печени ренальная паренхима вторично повреждается ксенобиотиками и эндогенными токсинами.
- Общие клинические проявления отравления. Ряд химических веществ не оказывают прямого нефротоксического эффекта, однако системные проявления, возникающие при их приеме, приводят к тяжелой ренальной дисфункции. Чаще всего токсические формы нефропатии развиваются на фоне отравлений с клиникой шока, некомпенсированного ацидоза, выраженных метаболических расстройств. Такая же ситуация возникает под влиянием эндо- и экзотоксинов патогенной и условно-патогенной микрофлоры.
Постоянное расширение ассортимента медикаментозных препаратов, в первую очередь антибактериальных и противоопухолевых средств, привело к увеличению количества случаев токсической лекарственной нефропатии. По результатам исследований, более чем у 30% пациентов неолигурическая почечная недостаточность связана с приемом фармацевтических препаратов.
Нефротоксичные медикаменты могут прямо повреждать почечные канальцы (аминогликозиды, амфотерицины, иммуноглобулины, НПВС и др.), вызывать их закупорку (сульфаниламиды, циклоспорины, производные пуриновых нуклеозидов), системно нарушать ренальную гемодинамику (β-адреноблокаторы, некоторые диуретики) или оказывать сочетанное действие. Развитие токсической ятрогенной нефропатии также возможно при проведении лучевой терапии.
Патогенез
Механизм развития токсической нефропатии определяется причинами, спровоцировавшими почечную дисфункцию. Патогенез расстройств, вызванных нефротоксинами прямого действия, основан на нарушении биохимических процессов в нефронах, эпителиоцитах проксимальных и дистальных канальцев. После фильтрации клубочками токсическое вещество попадает в канальцевую систему, где вследствие реабсорбции воды его уровень возрастает почти в 100 раз. Возникающий градиент концентрации способствует поступлению и накоплению ксенобиотика в канальцевом эпителии до определенного критического уровня.
В зависимости от типа экзотоксина в эпителиоцитах происходят процессы деструкции клеточных и митохондриальных мембран, лизосом, компонентов цитоплазмы, гладкого эндоплазматического ретикулума, рибосом и т. п. с развитием в наиболее тяжелых случаях острого тубулярного некроза. Некоторые нефротоксины за счет инициации гипериммунных процессов разрушают гломерулярный аппарат коркового слоя. Осаждение в клубочковых структурах иммунных комплексов или образование в мембранах комплексных антигенов с последующей атакой антител провоцируют начало острого гломерулонефрита или интерстициального нефрита без повреждения канальцевых эпителиоцитов. Важным фактором прямой нефротоксичности является способность некоторых веществ стимулировать образование свободных радикалов.
Патогенез опосредованного повреждения почек при закупорке канальцев основан на развитии в их клетках некротических процессов, нарушении реабсорбционной способности. Внутриренальный застой мочи сопровождается ретроградным током гломерулярного фильтрата и последующим повреждением нефронов. При нефропатиях, возникших на фоне общих отравлений, основой патоморфологических изменений обычно становится ишемия клеток и нарушение биохимических процессов за счет кислотно-щелочного и водно-электролитного дисбаланса. На начальном этапе возникает дисфункция эпителиоцитов, которая впоследствии может осложниться токсической дегенерацией и некрозом канальцевого эпителия, деструкцией гломерулярных базальных мембран, интерстициальным отеком.
Классификация
Систематизация форм токсической нефропатии проводится с учетом особенностей этиопатогенеза заболевания и тяжести симптоматики. Такой подход позволяет выработать оптимальную тактику ведения пациента, а в ряде случаев предупредить развитие необратимой деструкции тканей. С учетом этиологического фактора и механизма повреждения почек различают следующие формы заболевания:
- Токсическая специфическая нефропатия. Развивается под влиянием экзогенных и эндогенных веществ с прямыми и опосредованным нефротоксическим эффектом. Отличается быстрым развитием тканевой деструкции, которая у части пациентов является необратимой. Чаще требует раннего начала заместительной почечной терапии.
- Токсическая неспецифическая нефропатия. Осложняет течение отравлений и заболеваний с выраженным интоксикационным синдромом, при которых ведущими становятся гемодинамические и метаболические расстройства. На начальных этапах нарушения носят функциональный характер и лишь позднее начинается разрушение тканей.
При легком течении нефропатия выявляется лабораторно: в клиническом анализе мочи определяется повышенное содержание белка, лейкоцитов, эритроцитов, появляются цилиндры. Средняя степень характеризуется уменьшением количества мочи и нарушением фильтрационной функции с увеличением уровня мочевины, креатинина, калия в сыворотке крови. Для тяжелого течения характерна клиника ОПН, вплоть до наступления уремической комы.
Симптомы токсической нефропатии
Возникают тошнота, рвота, понос. Кожные покровы и видимые слизистые становятся сухими, желтушными. Нарастание почечной недостаточности сопровождается практически полным прекращением мочевыделения, усилением отечности, ее нисходящим распространением на другие отделы тела, появлением петехиальной сыпи. При тяжелых поражениях развивается мозговая симптоматика — вялость, заторможенность, оглушенность, слуховые, зрительные, тактильные галлюцинации, судорожный синдром. Признаки выраженной ренальной дисфункции обычно сохраняются в течение 7-14 суток.
На следующем этапе развития заболевания, длящемся от 10-15 до 30 дней, олигоанурия сменяется постепенным усилением диуреза. Больной выделяет за сутки от 1,8 до 5-8 л и более мочи. Сохраняются слабость, утомляемость, мучительная жажда, уменьшается масса тела. Длительность периода реконвалесценции при интоксикационной нефропатии зависит от объема и характера поражения. Обычно для восстановления функциональной состоятельности органа требуется от 6 месяцев до 2 лет.
Осложнения
В 20-70% случаев токсическая нефропатия завершается летальным исходом из-за массивной необратимой деструкции ренальной паренхимы. Снижение фильтрационной функции у пациентов с ОПН приводит к гиперкалиемии с замедлением сердечного ритма, фибрилляцией и асистолией желудочков. Нарушение работы сердца в сочетании с гипопротеинемией повышает риск развития отека легких.
Длительная уремия сопровождается усиленным выделением азотистых метаболитов через кожу, серозные и слизистые оболочки с развитием уремического перикардита, плеврита, гастрита, энтероколита, ларинготрахеита, токсическим поражением печени, костного мозга. При нарушении секреции компонентов ренин-ангиотензиновой системы возможно развитие артериальной гипертензии. Отдаленными последствиями токсического поражения почек являются хронический тубулоинтерстициальный нефрит, хроническая почечная недостаточность, новообразования органов мочевыделительного тракта.
Диагностика
Постановка диагноза токсической нефропатии обычно не представляет сложности в тех случаях, когда заболевание возникло после отравления химическим веществом. Диагностический поиск направлен на оценку характера, объема возможного повреждения тканей, определение выраженности ренальной дисфункции. Пациентам с нефропатией рекомендованы следующие лабораторно-инструментальные методы исследований:
- Общий анализ мочи. Определяются протеинурия, лейкоцитурия, микрогематурия, цилиндрурия. Относительная плотность мочи в олигоанурической фазе превышает 1030 г/л, в полиурической составляет ниже 1003 г/л. Дополнительное проведение пробы Зимницкого при полиурии выявляет снижение концентрационной функции.
- Биохимический анализ крови. До восстановления объема диуреза повышаются сывороточные уровни креатинина, мочевой кислоты, азота мочевины, калия, кальция, неорганического фосфора. Нарушение фильтрационной способности гломерул также подтверждается результатами нефрологического комплекса и пробы Реберга.
- УЗИ почек. При эхографии нефропатия токсического типа проявляется увеличением размеров почечной паренхимы за счет интерстициального и лимфостатического отека. Участки некроза имеют вид гипоэхогенных полостей или гиперэхогенных включений. УЗДГ ренальных сосудов выявляет гемодинамические нарушения.
- Томография почек. Компьютерная томография почек позволяет получить послойное изображение ренальных тканей и обнаружить даже небольшие участки деструкции. В целях безопасности при токсических поражениях исследование рекомендуется проводить без контраста или заменить его МРТ, хотя в таком случае информативность несколько снижается.
Для подтверждения токсического характера нефрологической патологии по возможности проводятся химико-токсикологические исследования, позволяющие установить химическое вещество, которое вызвало расстройство. Контрастные методы исследований (экскреторная урография, ангиография почек) применяют с осторожностью в связи с риском усугубления клинической ситуации контраст-индуцированными деструктивными процессами. Для контроля за состоянием других органов и систем проводятся биохимические пробы печени, коагулограмма, ЭКГ. Изменения общего анализа крови неспецифичны: могут выявляться анемия, умеренный лейкоцитоз, повышение СОЭ, тромбоцитопения.
Нефропатию токсического происхождения дифференцируют со вторичными нефропатиями другого генеза (контраст-индуцированной, диабетической, дисметаболической и др.), острым гломерулонефритом, ишемическим некрозом почек, травматическими повреждениями почечной паренхимы, атероэмболической болезнью. По назначению уролога-нефролога пациента консультируют токсиколог, анестезиолог-реаниматолог, невролог, терапевт, кардиолог, пульмонолог, гепатолог.
Лечение токсической нефропатии
Больных, почки которых повреждены в результате отравления экзо- или эндотоксинами, госпитализируют в палату интенсивной терапии. Основными терапевтическими задачами являются скорейшая элиминация химического вещества, коррекция метаболических расстройств, предупреждение возможных осложнений. С учетом этапа заболевания пациентам показаны:
- Дезинтоксикационная терапия. Проводится в первые часы и сутки после отравления. Для ускоренного выведения токсина проводят промывание желудка, форсированный диурез с назначением осмотических мочегонных и салуретиков, используют адсорбенты, слабительные средства, специфические антидоты. В сложных случаях эффективны плазмаферез, гемосорбция, гемофильтрация, ультрафильтрация, гемодиализ, перитонеальный диализ. Некоторым пациентам назначают переливание крови и ее компонентов.
- Инфузионная коррекция метаболических нарушений. Начинается сразу после госпитализации и продолжается в олигоанурическом периоде ОПН. Для восстановления электролитного баланса и кислотно-щелочного равновесия применяют антагонисты калия (обычно — препараты кальция), инфузию глюкозы с инсулином, ощелачивающие полиионные растворы. Возможен дальнейший прием энтеросорбентов, связывающих токсические метаболиты. При значительной ренальной дисфункции оправдано проведение ЗПТ.
При утяжелении состояния больного проводится комплексная противошоковая терапия, купируются неотложные состояния (уремическая кома, отек легких, судорожный синдром, гипертонический криз). В полиурической фазе продолжается массивная (до 5-6 л/сут) инфузионная терапия для поддержания ОЦК и физиологической концентрации метаболитов. На этапе восстановления проводится общеукрепляющее лечение и определяется тактика дальнейшего ведения пациента с учетом степени сохранности почечных функций.
Прогноз и профилактика
Токсическая нефропатия — тяжелое, прогностически неблагоприятное расстройство с высокими показателями летальности. Своевременное установление токсина, правильная оценка морфологической сохранности и функциональной состоятельности почечной паренхимы, проведение адекватной интенсивной терапии повышают шансы благоприятного исхода нефропатии. Профилактика заболевания направлена на предупреждение попадания в организм токсических веществ: ограничение времени контакта с нефротоксичными ядами, использование средств индивидуальной защиты (респираторов, защитной одежды), отказ от употребления в пищу незнакомых грибов.
Работникам предприятий с вредными условиями производства рекомендовано прохождение профилактических медосмотров для раннего выявления почечной дисфункции. Для снижения количества случаев гемодинамического и метаболического поражения почечных клеток при системных нарушениях пациентам с отравлениями рекомендован регулярный контроль функциональной состоятельности почек и адекватное купирование острого состояния. С учетом роста распространенности лекарственных нефропатий при назначении нефротоксичных лекарственных средств необходимо тщательное обследование пациента для выявления предпосылок к токсическому повреждению ренальной паренхимы.
2. Патогенез токсических нефропатий/ Гоженко А.И. // Актуальные проблемы транспортной медицины. — 2006 — № 2.
3. Клинико-морфологические изменения при токсической нефропатии, вызванной отравлением некоторыми спиртсодержащими жидкостями: Автореферат диссертации/ Морозов В.И. – 1996.
4. Механизмы хронической токсической нефропатии у рабочих химической промышленности: Автореферат диссертации/ Письменский А.В. – 2006.
Читайте также:

