Какой белок рецептор является необходимым для присоединения вич к
Обновлено: 26.04.2024
6.3. ПАТОГЕНЕЗ ВИЧ-ИНФЕКЦИИ
В связи с тем что вирусы являются патогенами внутриклеточными, ка-ждый представитель мира вирусов имеет тропность к определенному типу клеток. Тропизм вируса определяется наличием на клетке-мишени рецептора для данного вируса, а также возможностью генома вируса встроиться в геном клетки. Рецепторы для определенного вируса могут быть на клетках различ-ных типов. Рецепторную функцию выполняют различные структуры (лиган-ды): белки, липиды, углеводные компоненты белков и липидов. Эти лиганды локализованы на плазматической мембране и выполняют важнейшие функ-ции жизнеобеспечения клетки – проникновение в нее гормонов, питательных веществ, факторов роста и регуляции и т.п.
Рецепторы, независимо от их биохимического строения, имеют общую структурную характеристику, а именно, состоят из участка, расположенного вне клетки, участка, локализованного внутримембранно, и участка, погру-женного в цитоплазму.
Рецепторами для ВИЧ являются дифференцировочный антиген CD4, а также неспецифические, не зависящие от наличия CD4 компоненты. CD4 -гликопротеид с молекулярной массой 55 000, по своему строению имеющий гомологии с определенными участками иммуноглобулинов. Аналогичные гомологии имеет и белок вируса gp120, что и определяет тропность ВИЧ. Фиксация вируса через gp120 ВИЧ-1 (или gp105 в случае инфицирования ВИЧ-2) с мембранным рецептором CD4 клетки хозяина блокирует основную функцию этих иммунокомпетентных клеток - восприятие сигналов от анти-генпрезентирующих клеток. Последующая за рецепцией репликация вируса ведет к гибели клеток, выпадению функции, ими выполняемой, развитию иммунодефицита.
В организме человека имеется целый ряд иммунокомпетентных, сома-тических и ряд других клеток, имеющих рецепторы для ВИЧ (CD4+ лимфо-циты, CD8+ лимфоциты, дендритные клетки, моноциты, эозинофилы, мега-кариоциты, нейроны, микроглия, сперматозоиды), и наблюдается цитопати-ческий эффект во многих из них в случае проникновения вируса.
В 1996 году Бергер открыл корецептор для ВИЧ. Этот рецептор вместе с CD4 опосредует инфицирование СО-вариантами ВИЧ-1, адаптированных к росту в Т-хелперах, но не в макрофагах. На сегодня известно около 10 хемо-киновых рецепторов.
Таким образом, выделены белки - хемокины, блокирующие проникно-вение ВИЧ в макрофаги с антигеном CD4, и белки - корецепторы, способст-вующие инфицированию. При этом корецепторы – это рецепторы для хемо-кинов, но их использует ВИЧ в качестве рецептора, с помощью которого проникает внутрь клетки.
Проникнув в СD4+ клетки, ВИЧ сразу же начинает репликацию, при этом, чем активнее CD4+ клетки, тем выше процесс репродукции вируса. Все регуляторы, активирующие СD4+клетки, обеспечивают увеличение реплика-ции вируса. К подобным регуляторам относятся фактор некроза опухолей (ФНО), фактор, стимулирующий колонии гранулоцитов/макрофагов, интер-лейкин-6 (ИЛ-6). К негативным регуляторам, тормозящим репликацию виру-са, относятся интерферон (ИФ) и трансформирующий фактор роста.
Морфофункциональные изменения в моноцитах/макрофагах оказыва-ют разнонаправленное действие не только на Т-лимфоциты, но и естествен-ные киллеры - главные клетки противоопухолевой защиты. Активность по-следних по мере прогрессирования заболевания неуклонно снижается. Дефи-цит ИЛ-2 и γ-интерферона даже при нормальном количестве NK-клеток ве-дет к снижению функциональной активности их у больных ВИЧ-инфекцией (Ковальчук Л.В., Чередеев А.Н.,1991).
Выделено два типа CD4+клеток: Т-хелперы-1 (Th1) и Т-хелперы-2 (Th2). Тh1 продуцируют цитокины, стимулирующие клеточный иммунитет, а Тh2 – цитокины, усиливающие антителогенез. Соотношение Тh1 и Тh2 взве-шенно и конкурентно; суперэкспрессия цитокинов одного типа клеток ведет к супрессии другого. У больных ВИЧ-инфекцией идет угнетение Тh1, чем обеспечиваются и вирусная патология, и онкогенез.
Жизненный цикл ВИЧ после проникновения в организм имеет после-довательный характер: связывание вириона с поверхностью клетки, слияние мембран вириона и клетки, проникновение вируса внутрь клетки, высвобож-дение нуклеотида и геномной РНК вируса, интеграция генома вируса в геном инфицированной клетки, латентная фаза, фаза активации транскрипции с ДНК провируса и последующая транскрипция белков вируса, наработка всех компонентов вируса с формированием новых вирионов и их высвобождени-ем из клетки, влекущим за собой гибель клетки-мишени (рис.6.4.).
Рис. 6.4. Стадии проникновения ВИЧ в клетку (Ледванов М.Ю., 1997).
Судьба ДНК-транскрипта генома ВИЧ, интегрированных в хромосому пораженной клетки, может быть различна. Она определяется активностью положительных и отрицательных регуляторных генов. Если активны все по-ложительные регуляторные гены, то происходит репродукция вируса со все-ми вытекающими отсюда последствиями – идет активация инфекции.
Если активны все отрицательные регуляторные гены, синтеза компо-нентов вириона не происходит, и инфекция не развивается.
Если активны положительные регуляторные гены белков суперкапсид-ной оболочки, происходит образование этих белков, и они экспрессируются на поверхности инфицированных клеток. Такие клетки способны взаимодей-ствовать с CD4 - рецепторами клеток организма и нарушать их функции. Та-ким образом, хотя репродукции вирусов не происходит, имеют место опре-деленные проявления инфекции.
Равным образом события развиваются при активности положительных регуляторных белков капсидной оболочки. Их повреждающее действие на клетки существенно ниже, но они индуцируют образование соответствую-щих антител.
Если же активны положительные регуляторные гены только геномных белков, то в пораженных клетках образуется обратная транскриптаза, которая довольно быстро разрушается.
Сродство вирусного мембранного гликопротеида gp120 (gp105 в случае ВИЧ-2) к клеточному рецептору CD4 определяет высокую степень избира-тельного поражения клеточных структур, поэтому в патологический процесс вовлекаются, в первую очередь, и в большей степени CD4+ лимфоциты, мо-ноциты крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки, кожи, альвеолярных и интерстициальных макрофагов лег-ких, микроглия и другие клетки нервной системы, имеющие CD4 - рецепто-ры. Так же поражаются В- и О-лимфоциты, ретикулярные клетки, эпители-альные клетки кишечника, клетки Лангерганса, причем последние инфици-руются даже легче, чем CD4+ лимфоциты. Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только иммунокомпетентных клетках, возможность поражать и клетки, не имеющие этого рецептора, оп-ределяют политропность ВИЧ и полиморфизм клинической картины. Сте-пень поражения тех или иных, содержащих СD4 рецепторы, клеток зависит от плотности этих рецепторов на мембране клеток. Наиболее высока плот-ность на Т-хелперной субпопуляции лимфоцитов, что и определяет во мно-гом патогенез болезни. Но степень поражения клеток-мишеней вирусом за-висит также и от возможности репликации вируса в том или ином виде кле-ток. Очевидно, осуществляется репликация в основном в лимфоцитах с CD4+ фенотипом и моноцитах/макрофагах.
Если на CD4+ лимфоциты вирус оказывает цитопатическое действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах ВИЧ реплицируется с умеренной интенсивностью; вирионы оформляются в ок-руглые частицы еще в цитоплазме клетки и по выходе из нее не оказывают цитонекротического действия. Изучение динамики сывороточных монокинов подтверждает активное участие в патогенезе ВИЧ-инфекции моноци-тов/макрофагов, основных продуцентов фактора некроза опухолей и интер-лейкина-1b (выполняющих роль передатчика Т-лимфоцитам антигенспеци-фических сигналов, необходимых для их активации в иммунном ответе). С гиперпродукцией ФНО-a , ИЛ-1b и ИЛ-6 связывают развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. ФНО-a при этом оказывает прямое цитопатическое действие на инфицированные ВИЧ Т-хелперы. В то же время было установлено, что ВИЧ ингибирует про-дукцию ИЛ-2 и γ-ИФ, синтезируемым Т-хелперами первого типа, и не инги-бирует функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение вирус-ной оболочки с помощью белка gp41 с мембраной клетки. Помимо того, ви-русный белок gp41 обеспечивает слияние мембран соседних клеток между собой с образованием одной многоядерной клетки - синцития. При этом слияние может быть как зараженных клеток между собой, так и зараженных с незараженными. Но синцитий в основном индуцируют вирусы, выделенные от больных с клиническими проявлениям ВИЧ-инфек-ции, и не образуют выделенные от инфицированных людей, не имеющих клинических проявле-ний.
С момента интеграции генома вируса в геном клетки начинается стадия латентной инфекции. В этот период вирус находится в клетке в виде интег-рированного в геном ДНК – провируса. Раньше полагали, что в этот период отсутствуют процессы транскрипции и трансляции с вирусных генов, а по-этому и экспрессии вирусных белков, нет иммунного ответа на вирус как в виде специфических иммуноглобулинов, так и сенсибилизированных лим-фоцитов. Но последние исследования показали, что сразу после проникнове-ния вируса в клетку начинаются и трансляция, и транскрипция.
Состояние латентной инфекции без клинических признаков болезни может длиться от 2 до 11 лет. Активация длинных концевых повторов и экс-прессия генов ВИЧ, кодирующих белки вируса, знаменуют собой манифе-стацию болезни.
В расшифровке патогенеза ВИЧ-инфекции многие вопросы решены, установлены основные этапы развития процесса в клетке после инфицирова-ния ее вирусом. Выявлен ряд факторов, активирующих экспрессию генов ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфиче-ские антигены (например, вирусы группы Herpes), неспецифические антиге-ны (например, митогены типа фитогемаглютинина), цитокины (например, фактор некроза опухолей, некоторые интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы (например, монофосфат липида из саль-монелл). К активаторам экспрессии ВИЧ относятся глюкокортикостероидные гормоны, в частности, дексаметазон и гидрокортизон, ультрафиолетовое об-лучение, перекись водорода, свободные кислородные радикалы. Активирует инфекционный процесс беременность; более прогрессирующее течение ВИЧ-инфекции имеют психически неуравновешенные лица, дезадаптированные, по сравнению с людьми, имеющими уравновешенную психику.
Довольно сложен и до конца не выяснен механизм репликации вируса в инфицированной клетке. Известно, что в цитоплазме информация с вирус-ной РНК посредством обратной транскриптазы (ревертазы) переписывается на ДНК, первоначально образуется однонитевая структура; затем та же об-ратная транскриптаза обеспечивает образование второй нити, и линейная промежуточная форма ДНК-транскриптаза вируса - транспортируется в ядро, где с помощью фермента интегразы интегрирует в хромосому клетки, пре-вращаясь в провирус.
Исключительно важный этап патогенеза болезни – сборка вирусных частиц и выход нового потомства вируса из инфицированной клетки. Сборка происходит на плазматической мембране лимфоцита, куда поступают все компоненты вирусной частицы, в том числе и белки-предшественники. За-вершается процесс почкованием вирусных частиц с клеточной поверхности. Отличительной чертой ВИЧ является взрывной характер процессов актива-ции транскрипции, синтеза белков-пред-шественников, сборки вирионов и их почкования: за 5 мин одна лимфоцитарная клетка может образовать до 5000 вирусных частиц.
Ключевой вопрос патогенеза ВИЧ-инфекции – механизм иммунного повреждения. Как установлено, в составе белков gp120, главного комплекса гистосовместимости (HLA) класса II и CD4-рецепторов имеются сходные участки, что определяет перекрестное реагирование образующихся к ВИЧ антител с этими структурами. Например, происходит блокада кооперации CD4+ лимфоцитов и HLA II. Антитела к gp120 ВИЧ реагируют с CD4, обу-словливая неадекватную стимуляцию CD4+ клеток. На всех ядросодержащих клетках имеются антигены HLA I; вирус же нарушает синтез этих антигенов, участвующих в распознавании CD8+ лимфоцитами зараженных вирусом клеток, что тормозит процесс лизиса инфицированных клеток.
Взаимосвязь жизненного цикла вируса и иммунных сдвигов в началь-ной фазе ВИЧ-инфекции изучена в эксперименте при заражении SIV обезьян; полученные данные экстраполированы на человека. Как показали исследова-ния, вирус первоначально локализуется в лимфоидной системе, вирусная экспрессия определяет клинику ранней фазы болезни. Пик экспрессии вируса в клетках лимфоидной ткани предшествует накоплению его в плазме. Появ-ление вирусспецифических цитотоксических Т-лимфоцитов (CTL) совпадает со временем окончания экспрессии вируса в лимфатических узлах. Продук-ция комплементсвязывающих антител облегчает переход вируса в сеть денд-ритных клеток герминальных центров лимфатических узлов. Повреждающее действие CTL и продукция комплементсвязывающих антител оказывают ос-новное патогенное действие в результате виремии. Образование нейтрали-зующих антител обеспечивает переход острой фазы болезни в хроническую.
Иммунопатогенетически ВИЧ-инфекция проявляется дефицитом Т- и В-звеньев иммунной системы, дефицитом комплемента, фагоцитов, сниже-нием функции неспецифических факторов защиты. В результате идет фор-мирование анергии с проявлениями аллергического, аутоаллергического и иммунокомплексного патологического процесса. Уже во II стадии ВИЧ-инфекция характеризуется снижением абсолютного числа лейкоцитов за счет CD3+, CD4+, p24+ и gp120+ лимфоцитов, повышением уровня естественных киллеров (NК-клетки), нарастанием реакции торможения миграции лимфо-цитов с конкавалином А и фитогемагглютинином. Изменения гуморального звена иммунитета проявляются нарастанием IgG+ В-лимфоцитов и 4-5-кратным ростом уровня сывороточных IgE.
Для изменений В-звена иммунитета характерна активация В-лимфоцитов. Изменение их метаболизма сопровождается уменьшением вре-мени полуобмена иммуноглобулиновых рецепторов с повышением в крови концентрации клеточных рецепторов (Р-белки). Суммарная концентрация сывороточных иммуноглобулинов растет, но выявляется диспропорция уровней подклассов иммуноглобулинов. Так, содержание IgG1 и IgG3 у больных увеличивается, а концентрация IgG2 и IgG4 существенно уменьша-ется. Очевидно, повышение уровня IgG2 связано с высокой восприимчиво-стью больных к стафилококкам, пневмококкам, палочке инфлюэнцы. Не-смотря на гипергаммаглобулинемию, увеличение количества циркулирую-щих в крови В-лимфоцитов, их функциональная активность на митогены ос-таются относительно сниженными, что позволяет В-систему иммунитета у ВИЧ-больных расценивать как супрессированную. К тому же, количество В-клеток в периферической крови больных в стадии СПИДа может быть сни-жено в три и более раз.
Многочисленными исследованиями показано, что взаимодействие gp120 ВИЧ-1 с мембраной CD4+ лимфоцитов определяет не только отрица-тельные реакции инфицированных клеток, но и приводит к программирован-ной клеточной гибели - апоптозу зрелых CD4+ лимфоцитов или CD34+ ге-мопоэтических клеток-предшественников даже при отсутствии их инфици-рования вирусом.
Специфический иммунный ответ при ВИЧ-инфекции имеет ряд осо-бенностей. Локализуясь в иммуноците, вирус проникает в органы и ткани, пребывая вне доступности для иммунной системы, чем определяется перси-стенция в клетках как вируса, так и его компонентов – белков, нуклеокапси-дов, нуклеиновой кислоты. Активация инфекционного процесса ведет к гу-моральному иммунному ответу с образованием антител. Но в связи с наличи-ем в составе вирусного белка gp120, HLA класса II и CD4-рецептора лимфо-цита сходных участков образующиеся антитела перекрестно реагируют с ни-ми, чем обусловливают нарушение кооперативных взаимодействий в функ-ционировании иммунной системы. Все это определяет формирование ауто-аллергических реакций. Именно поэтому в ходе развития инфекционного процесса формируется гиперчувствительность замедленного и немедленного типов, преимущественно к антигенам ВИЧ, в частности, gр41 и gp120. Так, Л.Монтанье (1996) считает, что в патогенезе СПИДа основное место принад-лежит аутоиммунному процессу. В пользу этого говорят исследования харак-тера иммунных реакций у больных: наличие аутоантител и аллоантител к лимфоцитам, формирование аллергических реакций цитотоксического типа, накопление циркулирующих иммунных комплексов, наличие комплементо-посредованной цитотоксичности, активация антителозависимой клеточной цитотоксичности. Кроме того, при сильном антительном ответе возможность развития аутоиммунных процессов обусловлена мимикрией структуры gp120 под структуру иммуноглобулинов (Atlan H. et al.,1993). В пользу наличия ау-тоиммунных процессов в патогенезе ВИЧ-инфекции говорят и клинические проявления болезни, в частности, часто сопутствующие болезни такие ти-пичные аутоаллергические варианты патологии, как спондилоартропатии, системные ревматоидные синдромы: волчаночноподобный синдром Шегре-на, полимиозит, некротизирующий васкулит.
У половины больных развиваются манифестные формы аллергии, пре-имущественно в виде ринита, лекарственной аллергии, крапивницы, атопиче-ского дерматита, ангионевротического отека с повышением у них уровня специфических IgE к бытовым, эпидермальным, пыльцевым и пищевым ал-лергенам с положительной коррелятивной связью между общим уровнем IgE и содержанием СD8+ лимфоцитов (Ю.А.Митин, 1997).
Наряду с поражением иммунной системы в патологический процесс вовлекается и кроветворная ткань. Для заболевания характерны лейкопения, анемия, тромбоцитопения. Угнетается функциональная активность грануло-цитов. У больных ВИЧ-инфекцией в костном мозге резко снижено содержа-ние колониеобразующих единиц гранулоцитов, макрофагов, мегакариоцитов. Однако дисфункция стволовых клеток не связана с их прямым инфицирова-нием, ибо не обнаружено присутствия ВИЧ в кроветворных клетках при изу-чении методом гибридизации in situ и иммуногистохимическим исследова-нием гемопоэтических колоний, а также с помощью полимеразной цепной реакции. Пока нет однозначного мнения о причинах ингибиции пролифера-тивной активности стволовых клеток, хотя и установлено, что различные изоляты ВИЧ, воздействуя на CD34+ клетки, угнетают их функциональную активность. Также установлено, что подавление кроветворения в результате действия ВИЧ связано с усилением продукции костномозговыми моноцита-ми/макрофагами фактора некроза опухолей.
Таким образом, поражение иммунной системы при ВИЧ-инфекции но-сит системный характер, проявляясь глубокой супрессией Т- и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят законо-мерные изменения гиперчувствительности немедленного и замедленного ти-па, гуморального иммунитета и факторов неспецифической защиты, функ-циональной активности лимфоцитов и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов, циркулирующих иммунных ком-плексов. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарас-тает функциональная недостаточность СD8+ лимфоцитов, NK-клеток, ней-трофилов. Нарушение иммунного статуса клинически проявляется инфекци-онным, аллергическим, аутоиммунным и лимфопролиферативным синдро-мами иммунологической недостаточности, синдромом, свойственным болез-ни иммунных комплексов. Все это определяет в целом клинику ВИЧ-инфекции.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.

На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.

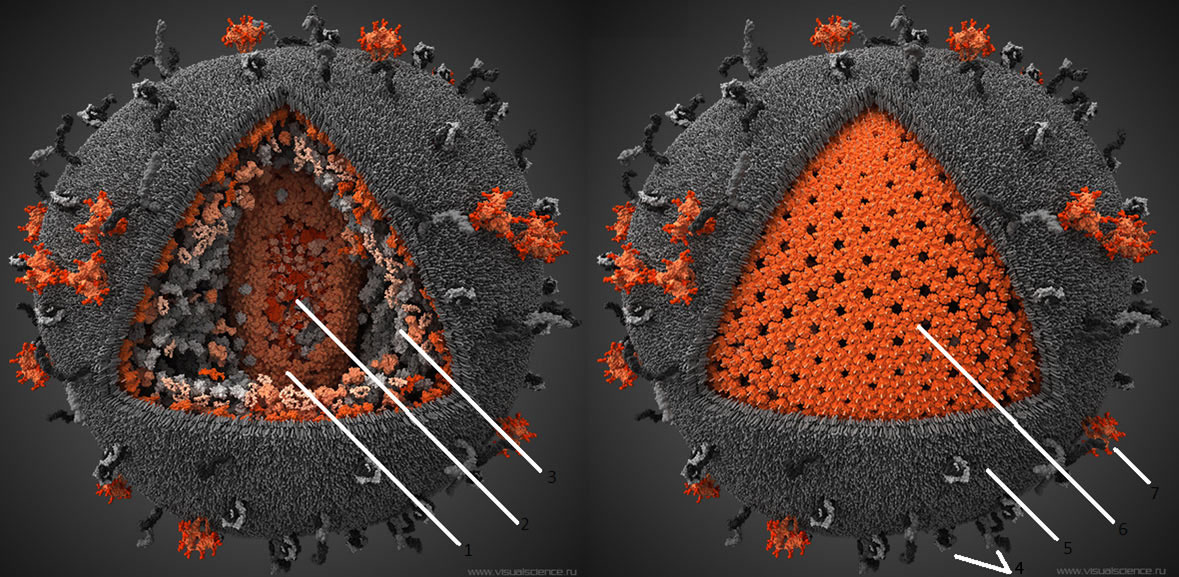
В настоящее время описаны 2 серотипа вируса: ВИЧ-1 и ВИЧ-2, различающиеся по структурным и антигенным характеристикам. Наибольшее эпидемиологическое значение имеет ВИЧ-1, который доминирует в современной пандемии и имеет наибольшее распространение на территории Российской Федерации. По данным электронной микроскопии, вирионы ВИЧ имеют округлую форму диаметром 100-120 нм. Наружная мембрана вируса построена из белков клетки хозяина и пронизана собственными белками вируса, которые обозначены как оболочечные белки.
Вирусная частица представляет собой ядро (cor), окруженное оболочкой. Ядро содержит двойную вирусную РНК, обратную транскриптазу (ревертазу), интегразу, протеазу. Различают два основных белка оболочки - трансмембранный гликопротеин с молекулярной массой 41 кД (gр41) и внешний гликопротеин - 120 кД (gр120) (табл. 1).
Таблица 1. Группы белков ВИЧ-1 и ВИЧ-2
| Группа белков | ВИЧ -1 | ВИЧ -2 |
| Белки оболочки вируса | gр160, 120, 41 кД | gp140, 105, 36 кД |
| Белки сердцевины | p55, 24, 17 кД | p56, 26, 18 кД |
| Ферменты вируса | p66, 51, 31 кД | p68 кД |
Примечание. Молекулярная масса белков выражена в килодальтонах - кД; gp - гликопротеины; р - протеины.
Нуклеоид вируса имеет округлую форму, но принимает продолговатую после отпочковывания вирусной частицы от клетки. Оболочка нуклеотида содержит протеин с молекулярной массой 24кд (р24). Между наружной оболочкой вириона и нуклеоидом существует каркас, состоящий из матриксного белка 17кд (р17).
В естественных условиях ВИЧ может сохраняться в высушенном биосубстрате в течение нескольких часов в жидкостях, содержащих большое количество вирусных частиц, таких как кровь и эякулят - в течение нескольких дней, а в замороженной сыворотке крови активность вируса сохраняется до нескольких лет.
Нагревание до температуры 56°С в течение 30 мин приводит к снижению инфекционного титра вируса в 100 раз, при 70°- 80°С вирус гибнет через 10 мин; через 1 мин инактивируется 70% этиловым спиртом, 0,5% раствором гипохлорита натрия, 1% глутаральдегидом, 6% перекисью водорода. ВИЧ относительно мало чувствителен к УФ-облучению, ионизирующей радиации.
| env | gp120 | Самый наружный белок обеспечивает связывание с клетками-мишенями. Лиганды - молекула CD4 + ; галактозилцерамиды; рецепторы для цитокинов |
| gp41 | Обеспечивает интернализацию вириона в клетку | |
| gag | р24 | Составляет оболочку ядра вируса (нуклеокапсида) |
| р17 | Составляет матриксное вещество вируса | |
| р9 | Связан с геномной РНК | |
| р7 | То же | |
| pol | р66 | Обратная транскриптаза (синтез ДНК на матрице РНК) |
| р31 | Интеграза (встраивает ДНК вируса в клеточный геном) | |
| р10 | Протеаза (расщепляет большие белковые трансляты на дифинитивные белки вируса) | |
| tat | p14 | Существенен для экспрессии белков оболочки (Env) |
| nef | p27 | Может усиливать и ингибировать репликацию ВИЧ |
| vif | p23 | Необходим для выхода новорожденных вирусов из клетки-мишени (вероятно, участвует в фолдинге белков Env) |
| vpu | p16 | Необязателен для жизненного цикла вируса; усиливает отпочковывание вируса из клетки-мишени |
Гликопротеин gр120 обусловливает присоединение ВИЧ к рецепторам СD4 клеток человека. При попадании ВИЧ в клетку под действием обратной транскриптазы синтезируется ДНК ВИЧ, встраиваемая в ДНК клетки-хозяина, которая в дальнейшем начинает продуцировать вирусные частицы.
Основа естественного иммунитета - это действие неспецифических механизмов, в большинстве своем реагирующих на повреждение тканей воспалительными реакциями. Некоторые клетки (макрофаги - МФ) и гуморальные факторы (комплемент, лизоцим) направлены на уничтожение бактерий. Другие клетки могут секретировать интерферон, действие которого в основном направлено против вирусов.
Адаптивный иммунитет основан на свойствах Т- и В-лимфоцитов избирательно отвечать на чужеродные вещества (антигены) с образованием специфической памяти и продукцией антител.
Попадая в организм человека, ВИЧ поражает различные органы и ткани, но, в первую очередь, клетки, несущие маркер СD4 + . В таблице 3 приведены основные типы клеток, поражаемых ВИЧ. В цитоплазме пораженных клеток освобождается вирусная РНК, и с помощью фермента обратной транскриптазы на основе вирусной РНК синтезируется ДНК - копия, которая встраивается в ДНК клетки хозяина (провирус). При каждом новом делении клетки все ее потомство содержит ретровирусную ДНК. В пораженной клетке начинают создаваться структурные элементы ВИЧ, из которых при помощи другого фермента - протеазы, собираются новые полноценные вирусы, в свою очередь поражающие новые клетки-мишени. С течением времени большинство зараженных клеток погибает.
Таблица 3. Типы клеток, поражаемых ВИЧ
| Тип клеток | Ткани и органы |
| Т-лимфоциты, макрофаги | Кровь |
| Клетки Лангерганса | Кожа |
| Фолликулярные дендритные клетки | Лимфоузлы |
| Альвеолярные макрофаги | Легкие |
| пителиальные клетки | Толстая кишка, почки |
| Клетки шейки матки | Шейка матки |
| Клетки олигодендроглии, астроциты | Мозг |
Уменьшение клеток, несущих рецептор СD4 + , приводит к ослаблению цитотоксической активности CD8+ Т-лимфоцитов, уничтожающих инфицированные вирусом клетки. В результате теряется контроль за проникающими в организм возбудителями бактериальных, вирусных, грибковых, протозойных и других инфекций (оппортунистических), а также за клетками злокачественных опухолей. Одновременно происходит нарушение функции В-лимфоцитов, поликлональная активация которых приводит, с одной стороны, к гипергаммаглобулинемии, а с другой - к ослаблению их способности продуцировать вируснейтрализующие антитела. Повышается количество циркулирующих иммунных комплексов, появляются антитела к лимфоцитам, что еще больше снижает число CD4 + Т-лимфоцитов. Возникают аутоиммунные процессы.
Оппортунистические инфекции, как правило, имеют эндогенное происхождение и возникают за счет активации собственной микрофлоры человека вследствие снижения напряженности иммунитета (например, эндогенная активация микобактерий туберкулеза из очагов Гона).
Цитопатическое действие ВИЧ приводит к поражению клеток крови, нервной, сердечно-сосудистой, костно-мышечной, эндокринной и других систем, что определяет развитие полиорганной недостаточности, характеризующейся разнообразием клинических проявлений и неуклонным прогрессированием ВИЧ-инфекции.

Обзор
Распространенность СПИДа в мире на 2009 год.
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система

Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
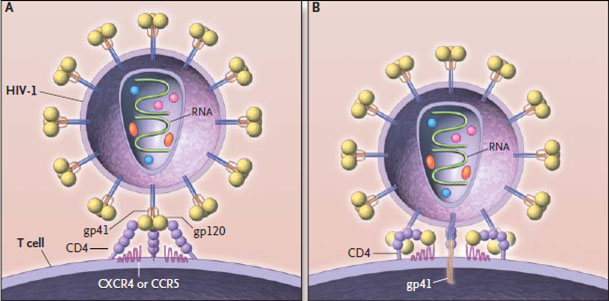
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
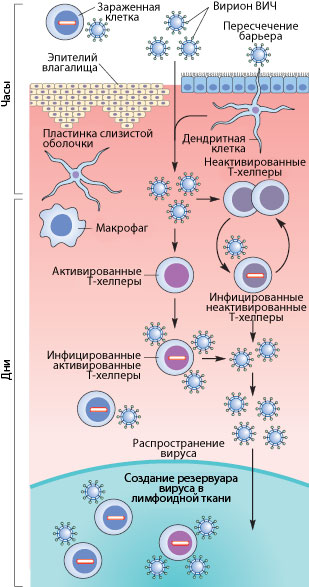
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
Читайте также:

