Какой тип дыхания характерен для менингококковой
Обновлено: 25.04.2024
Среди инфекционных болезней одной из опасных для жизни и непредсказуемых по молниеносности течения является менингококковая инфекция (МИ). Актуальность проблемы заключается в том, что при возникновении МИ требуется особый подход к организации диагностики и оказания скорой и неотложной медицинской помощи, ввиду того, что генерализованные формы МИ (наиболее часто встречающиеся в детском возрасте) при поздно начатом лечении могут приводить к смертельным исходам.
Для отечественных педиатров проблема МИ имеет особо значение, так как уровень заболеваемости среди детей всегда превышает таковую у взрослых в несколько раз, достигая 8–11 случаев на 100 тыс. населения. Более 50% от общего числа заболевших составляют дети до 5 лет (табл.1) [1]. Именно у детей высока частота развития генерализованных форм МИ. В значительной степени риск летального исхода при МИ зависит от возраста ребенка: чем он младше, тем выше вероятность неблагоприятного исхода. До 75% от числа умерших при МИ составляют дети до 2 лет, при этом доля детей первого года жизни достигает 40% (табл.2) [1].
Таблица 1
Возрастное распределение заболевших 2002–2004 годы
n=4972 (36 регионов РФ)
| 1–11 мес. | 1 г. | 2–4 г. | 5–9 л. | 10–14 л. | 15–19 л. | 20–24 л. | 25–44 л. | 45–64 л. | 65 л. + | Всего | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2002 | 0,13 | 18,8 | 12,4 | 16,9 | 10,1 | 10,4 | 9,3 | 4,8 | 8,4 | 6,9 | 1,8 | 100 |
| 2003 | – | 23,5 | 11,9 | 15,2 | 9,7 | 8,3 | 8,2 | 3,8 | 8,4 | 8,6 | 2,5 | 100 |
| 2004 | 0,2 | 1,3 | 13,2 | 15,8 | 8,13 | 5,4 | 10,4 | 4,6 | 9,8 | 8,7 | 2,4 | 100 |
| Всего | 0,1 | 21,5 | 2,4 | 15,9 | 9,3 | 8,0 | 9,2 | 4,3 | 8,8 | 8,1 | 2,3 | 100 |
Таблица 2
Возрастное распределение летальных случаев 2002–2004 годы
n=582 (36 регионов РФ)
| 1–11 мес. | 1 г. | 2–4 г. | 5–9 л. | 10–14 л. | 15–19 л. | 20–24 л. | 25–44 л. | 45–64 л. | 65 л. + | Всего | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2002 | 0,6 | 28,4 | 12,3 | 16,7 | 0,7 | 3,7 | 4,9 | 1,9 | 7,4 | 14,2 | 6,2 | 100 |
| 2003 | – | 30,4 | 12,1 | 9,2 | 3,8 | 4,6 | 5,4 | 0,4 | 10,4 | 18,3 | 5,4 | 100 |
| 2004 | 0,6 | 26,1 | 17,8 | 12,2 | 3,9 | 1,7 | 5 | 1,1 | 11,1 | 14,4 | 6,1 | 100 |
| Всего | 0,3 | 28,5 | 13,9 | 12,2 | 3,8 | 3,4 | 5,2 | 1,0 | 9,8 | 16,0 | 5,8 | 100 |
Эпидемиология
С 1962 года в ряде стран Европы и Азии, Канаде и США, а с 1968 года – и в нашей стране отмечается подъем заболеваемости МИ. Данные анализа глобальной эпидобстановки в 2005 году свидетельствуют о том, что в странах субсахарной Африки показатели заболеваемости МИ в целом колеблются от 100 до 800 случаев на 100 тыс. населения, а летальности – до 14%; предоминирует серогруппа менингококка А. На Европейском континенте наиболее высокий уровень заболеваемости МИ регистрировался в Исландии и Ирландии – 5–6,6 случаев на 100 тыс. населения, где предоминирует серогруппа В. А в странах Океании (Новая Зеландия) показатель заболеваемости МИ составил в этот период 14,5 случаев на 100 тыс. населения. В России с 1999 года в Астраханской, Пермской, Челябинской, Кемеровской, Новосибирской, Омской областях, в Хабаровском крае произошел значительный прирост МИ – на 22–40% – и составил 8,2 случая на 100 тыс. населения. В целом в 40 регионах страны в последние годы наблюдается снижение показателей заболеваемости этой инфекцией (рис. 1) [2, 3]. В общей серогрупповой характеристике по стране преобладают менингококки серогруппы А.

Рисунок 1
Территориальное распространение заболеваемости 2005 год.
n=2771 на 100000 населения
МИ характеризуется периодичностью – интервалы между отдельными подъемами заболеваемости составляют от 4 до 12–15 лет. Рост заболеваемости в эти периоды регистрируется в основном среди городского населения за счет скученности в транспорте и помещениях в холодное время года. Наиболее доказательна связь периодичности МИ с эпидемическими подъемами ОРВИ и гриппа с пиком в зимне-весенний период года.
Заболевают преимущественно дети и лица молодого возраста, чаще в закрытых коллективах.
Группой риска по развитию септических и гипертоксических форм МИ являются дети раннего возраста.
Установлена генетическая предрасположенность к заболеванию МИ и ее рецидивов у лиц, имеющих HLA антигены В12, В16, дефицит факторов комплемента С2–С8, пропердина, IgG2 и IgM [Самуэльс М., 1997]. Популяционная устойчивость к МИ, по мнению ряда исследователей, связана с локусом HLA–A1 антигена гистосовместимости.
Этиология
МИ является типичным антропонозом. Возбудитель – Neisseria meningitidis, грам-отрицательный диплококк, вырабатывающий экзо-и эндотоксин, который очень неустойчив во внешней среде.
Выделяют более 13 серотипов менингококка, при этом иммунитет – типоспецифический. По капсульным полисахаридам бактерии разделяют на серологические группы А, В, С, D43, D44, X, Y, Z, 29Е, W-135. По антигенам в мембранных протеинах различают более 20 серотипов и субтипов менингококка. По иммунотипам липополисахарида – более 11 иммунотипов. Доказана способность менингококков образовывать L-формы, которые вероятно могут обусловливать затяжные варианты менингита.
Патогенез
В развитии МИ ведущую роль играют три фактора: возбудитель, его эндотоксин и аллергизирующая субстанция. В месте входных ворот чаще всего не возникают воспалительные изменения, но при этом менингококк вегетирует, возникает менингококконосительство. Лишь в 10–15% случаев при снижении резистентности организма возможно развитие воспалительного процесса в носоглотке в виде менингококкового назофарингита. Если менингококки преодолевают местные защитные барьеры, распространение их происходит по лимфатическим путям в кровь. Менингококки в виде бактериальных эмболов заносятся в различные органы и ткани. В тех случаях, когда преодолевается гемато-энцефалический барьер, развивается гнойный менингит или менингоэнцефалит. При этом возможно проникновение возбудителя в оболочки мозга, минуя гематогенное распространение – через решетчатую кость по лимфатическим путям и влагалищам нервных волокон. Такой вариант возможен в случаях дефекта решетчатой кости или черепно-мозговой травмы. Сверхострый менингококковый сепсис развивается в результате массовой бактериемии и эндотоксинемии. При массовом распаде менингококков высвобождаемый эндотоксин воздействует на эндотелий сосудов и мембраны клеток крови, приводя к расстройству микроциркуляции [8]. В результате генерализованного повреждения эндотелия сосудов происходит закрытие дефектов тромбоцитами, агрегация которых провоцирует высвобождение тромбоксана и угнетение синтеза простациклина. Нарушаются реологические свойства крови: происходит агрегация форменных элементов, на которых фиксируется фибрин. Кроме того, важное значение имеет воздействие липида А эндотоксина на моноциты макрофаги, которые активизируясь выбрасывают ФНО-α – первичный медиатор токсических эффектов при токсическом шоке. Кроме него, в развитии септического шока колоссальную роль играют оксид азота, простагландины, факторы комплемента, гистамин, лейкотриены, фактор активации тромбоцитов и ИЛ-1, 2, 6, 8. Высвобождается избыточное количество биологически активных веществ (катехоламины, серотонин, гистамин), активизируются системы фактора Хагемана, калликреин-кининовая, свертывающая и в последующем фибринолитическая. Из печени мощно выбрасываются протромбин, калликреин и др., что в конечном счете приводит к гиперкоагуляции с образованием большого количества бактериальных тромбов в мелких сосудах (тромбогеморрагический синдром с бактериальной эмболией).
Таким образом, септический шок при МИ имеет одновременно признаки гиповолемического (недостаток объема крови), распределительного (нарушение сосудистого тонуса) и кардиогенного (недостаточность сердечного выброса) шока. Существует стадийность в его развитии.
Клинические проявления
МИ представлена разнообразными клиническими формами – от локализованных (назофарингита и менингококконосительства) до генерализованных, среди которых – молниеносные, крайне тяжелые, чаще приводящие к летальному исходу в течение нескольких часов.
Диагностировать менингококковый назофарингит на основании клинической картины, без указания на соответствующий эпиданамнез, затруднительно. До 80% всех форм МИ составляет менингококковый назофарингит. В клинической картине заболевания наиболее типичными симптомами являются заложенность носа, першение в горле, гиперемия и отечность задней стенки глотки с гипертрофией лимфоидных образований на ней, отечность боковых валиков и слизь в небольшом количестве. Гиперемия имеет синюшный оттенок. Распространено мнение о легком характере течения этой формы МИ. В зависимости от уровня лихорадки и выраженности интоксикации различают легкую, среднетяжелую и тяжелую формы болезни. При тяжелой форме доминирует гипертермический синдром, менингизм, у детей первых лет жизни – судорожный синдром. Чаще такие пациенты расцениваются как больные ОРВИ с судорожным синдромом или серозным менингитом на момент госпитализации, и только высев менингококка позволяет адекватно верифицировать диагноз и проводить этиотропную терапию [9]. Нельзя забывать о том, что нередко у детей назофарингит предшествует развитию генерализованных форм болезни, в том числе и с летальным исходом.
Носительство менингококка в коллективах достигает более 40% (в зависимости от эпидситуации). У детей первых лет жизни менингококконосительство встречается редко.
Среди генерализованных форм различают менингококцемию (может протекать в легкой, среднетяжелой, тяжелой и молниеносной формах в виде менингококкового сепсиса), менингококковый менингит, менингоэнцефалит и смешанные формы (менингококцемия + менингит).
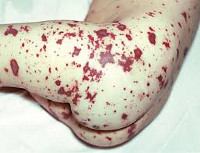
Для менингококцемии характерно острое, внезапное начало, критериями тяжести являются степень выраженности интоксикации, характер, величина, распространенность, наличие некрозов и продолжительность элементов сыпи, из которых может высеваться менингококк. При легкой форме элементы представлены розеолами, папулами, мелкими геморрагиями, которые бесследно исчезают к 3-му дню болезни. При среднетяжелой форме элементы преимущественно крупные, геморрагические, с поверхностным некрозом в центре. Сыпь более продолжительная – до 7–10 дней. Для тяжелых и септических молниеносных форм характерны обширные кровоизлияния на коже с глубокими некрозами и их отторжением, при которых могут формироваться косметические дефекты на теле. Эти формы часто сопровождаются маточными, носовыми, желудочно-кишечными кровотечениями, в том числе и на глазном дне. Отмечаются поражения сердца (эндокардит, миокардит, панкардит), суставов, легких, печени, почек, надпочечников.
На современном этапе выявлена зависимость ликворологических изменений (плеоцитоза и протеинрахии) от серогруппы. При заболевании, вызванном менингококком серогруппы С, эти показатели значительно выше, чем при МИ, вызванной менингококком В.
Среди больных МИ отдела нейроинфекций НИИ детских инфекций отмечено, что менингит развивался у лиц с дефектным преморбидным фоном со стороны ЦНС перинатального генеза [6]. Как наиболее частые неотложные состояния при менингококковом менингите в остром периоде заболевания регистрировались: отек головного мозга, внутричерепная гипертензия, инфекционно токсический шок, инфаркт мозга, субдуральный выпот, синдром неадекватной секреции антидиуретического гормона, диэнцефальная дисфункция и нейросенсорная тугоухость.
При менингоэнцефалите с первых дней болезни появляются очаговые симптомы на фоне нарушенного сознания, в виде поражения отдельных черепно-мозговых нервов, корковых и подкорковых парезов или параличей. Могут быть общие или локальные судороги. Характерны очень тяжелое течение, неблагоприятный прогноз – в исходе эпилепсия, гидроцефалия, грубая задержка психомоторного развития. Летальность высокая.
Диагностика
Верификация инфекции осуществляется бактериоскопическим (мазок и толстая капля крови, ликвор), бактериологическим (мазок слизи из носоглотки, посев крови, ликвора), серологическим (РНГА, РА, ИФА) и экспресс-методами (латекс агглютинации, ВИЭФ).
На современном этапе при менингите диагностический мониторинг включает НСГ для оценки состояния желудочков, субарахноидального пространства и цветовое доплеровское (дуплексное) картирование для дифференциации субарахноидального выпота от субдурального. Динамически оценивается ЭЭГ.
Лечебная тактика
На догоспитальном этапе при подозрении на менингококцемию (в том числе и смешанную форму МИ) терапию следует начинать немедленно, на дому, с последующей госпитализацией.
При судорожном синдроме (наряду с указанной терапией) вводят внутримышечно Реланиум из расчета 0,1 мл/кг. При отсутствии эффекта включают в терапию Дроперидол в сочетании с Ангальгином, оксибутират натрия. При дебюте менингита судорогами планово назначается длительная терапия препаратами вальпроевой кислоты (Конвулекс и др.), что снижает риск развития постменингитной эпилепсии.
Для предупреждения токсического шока вводят преднизолон (внутримышечно или внутривенно) в дозе 2 мг/кг. При выраженном менингеальном синдроме – 25% ную сернокислую магнезию (1 мл/год жизни) или Лазикс – 1–2 мг/кг внутримышечно.
Введение антибиотика в течение первого часа транспортировки не рекомендуется, а в случае длительной транспортировки стартовым препаратом является левомицетина сукцинат в разовой дозе 25 мг/кг, который вводится не более 2 суток.
Состояние больного оценивается под постоянным контролем АД, частоты пульса, дыхания, диуреза, окраски и температуры кожных покровов, нарастания количества и качества элементов экзантемы и сознания больного. При подозрении на молниеносный вариант генерализованной формы МИ госпитализация осуществляется реанимационной бригадой, которая проводит немедленные реанимационные мероприятия на дому в зависимости от степени септического шока (алгоритм действия перманентно осуществляется при транспортировке больного и продолжается в ОРИТ).
Важным в алгоритме оказания немедленной помощи при септическом шоке является нормализация гемодинамики, микроциркуляции, борьба с ацидозом и гипоксией. Противошоковый эффект достигается введением высоких доз гидрокортизона в сочетании с преднизолоном или его аналогами. Проводится инфузионная терапия, состав которой определяется показателями коллоидно-осмотического давления (альбумина 45–52 г/л и натрия 140–145 ммоль/л). Базовыми растворами являются 5% ная глюкоза, физиологический раствор или раствор Рингера. Соотношение вводимых коллоидов/кристаллоидов – 1:3. Физиологический раствор вводится с целью купирования гиповолемии, при резком падении АД – струйно, а при умеренном его снижении – внутривенно капельно. Под контролем КОС вводится 4%-ный раствор бикарбоната натрия внутривенно медленно, капельно по показателю дефицита оснований, в количестве, равном массе тела (в килограммах), умноженной на ВЕ : 2.
С учетом развития генерализованного васкулита с поражением эндотелия сосудов назначаются ангиопротекторы: Инстенон, Кавинтон, Актовегин, Весел Дуэ Ф (сулодексид).
Постоянно должна проводиться оксигенация, вплоть до ИВЛ, начиная с момента оказания помощи на дому.
После отмены левомицетина сукцината назначается пенициллин в дозе 300 тыс. ед/кг массы тела, 6 введений в сутки, а у детей до 3-месячного возраста – 500 тыс. ед/кг, 8 введений. Более комплаентным и альтернативным пенициллину препаратом является цефтриаксон (Роцефин), который вводится однократно в сутки внутривенно или внутримышечно в дозе 100–150 мг/кг массы в течение 5 дней при менингококцемии, а при менингите – до 10 дней. При тяжелом или затяжном менингите левомицетина сукцинат вводится эндолюмбально, в разовой дозе 10–15 мг.
При ДВС-синдроме назначаются при гиперкоагуляции – Трентал, реополиглюкин, коллоиды, а при гипокоагуляции – свежезаготовленная плазма, ингибиторы протеолиза. При отеке/набухании головного мозга после стабилизации центральной гемодинамики проводится постоянно дегидратационная терапия (Лазикс, Маннитол).
При клинико-ЭЭГ-мониторинге менингита с эпилептической симптоматикой проводится коррекция терапии антикольвунсантами. При неэффективности Конвулекса назначают топиромат (Топамакс).
С учетом длительности антибиотикотерапии в больших дозах, в последние годы предлагается хорошо зарекомендовавшая себя системная энзимотерапия Вобэнзимом, которая оказывает потенцирующий антибиотический, противовоспалительный, антитоксический, гепатопротективный и иммуномодулирующий эффекты, способствуя элиминации токсических субстанций, патогенных иммунных комплексов, иммунных депозитов из тканей, что укорачивает течение и уменьшает тяжесть генерализованных форм МИ [5, 6].
После выписки из стационара реконвалесценты генерализованных форм МИ находятся под диспансерным наблюдением педиатра и невропатолога, во время которого устраняются последствия болезни методами комплексной реабилитации.
При носительстве менингококка и нетяжелом назофарингите госпитализация проводится только по социально бытовым показаниям и из закрытых учреждений.
Назначаются ампициллин, левомицетин в возрастных дозировках в течение 4 дней или вводится внутримышечно Роцефин в течение 3 дней в дозе 125 мг (до 12 лет) и 250 мг у более старших. Спустя 3 дня проводится бактериологическое исследование, и при его отрицательном результате ребенок допускается в коллектив.
При длительном менингококконосительстве проводится повторный курс антибиотикотерапии в сочетании с препаратами иммунореабилитации.
С целью профилактики заболевания у лиц, контактировавших с больным МИ, проводится терапия, подобная лечению локализованных форм.
На коллектив накладывается карантин на 10 дней с момента изоляции больного, проводится наблюдение педиатра и лор-врача. В первые 5–10 дней проводится экстренная профилактика МИ вакцинами А или А+С детям старше года, подросткам и взрослым. Либо при выявлении других серогрупп менингококка в эти же сроки (не позже 7 дней от момента контакта) проводится пассивная профилактика нормальным иммуноглобулином.
После легкой формы МИ вакцинация детям согласно календарю прививок может проводиться спустя месяц после выздоровления. После тяжелых и смешанных форм МИ вакцинация (при отсутствии противопоказаний у невропатолога) может проводиться не ранее 3 месяцев после выздоровления.
Профилактика
В целях предупреждения распространения МИ необходимо проводить вакцинацию детей повышенного риска заражения в возрасте от 1,5 лет: посещающих детские дошкольные учреждения; находящихся в учреждениях с круглосуточным пребыванием (дома ребенка, детские дома); учащихся 1–2 классов общеобразовательных школ и школ–интернатов.
Менингококковая инфекция – инфекционная болезнь, совмещающая целую группу заболеваний, которые имеют разнообразные клинические проявления: от назофарингита до менингококкового сепсиса и менингита. Объединяет их то, что все они вызываются менингококками, которые переносятся воздушно-капельным путем. Менингококковая инфекция представляет опасность, так как широко распространена, скоротечна, может вызывать тяжелые осложнения и привести к летальному исходу.
МКБ-10
Общие сведения
Менингококковая инфекция – инфекционное заболевание, имеющее типичные клинические проявления в виде поражения слизистой оболочки носоглотки. Для этой болезни характерно распространение процесса, что приводит к специфической септицемии и гнойному лептоменингиту. Менингококковая инфекция распространилась по всем странам мира, в которых наблюдаются как спорадические случаи, так и эпидемические вспышки, бывают и эпидемии. Самое большое распространение менингококковая инфекция получила в странах Центральной Африки, Южной Америки, в Китае. Вспышки этого заболевания часто возникают там, где большая скученность населения сочетается с антисанитарными условиями обитания.
В нашей стране заболеваемость менингококковой инфекцией стабилизировалась и в среднем держится на уровне 5 на 100 тысяч населения. Как показывает географический анализ, есть несколько неблагополучных зон, где показатель заболеваемости более высок. Это, в первую очередь, дальневосточные области, расположенные рядом с границей Китая и Монголии. Другой регион, который дает стабильно высокий уровень заболеваемости – Мурманская и Архангельская области.

Этиология и патогенез
Возбудителем менингококковой инфекции является менингококк Neisseria meningitidis. Это грамотрицательный диплококк, не имеющий жгутиков и капсул и не образующий спор. Менингококки хорошо видны на окрашенных анилиновыми красками препаратах из чистой культуры. Они располагаются парно, как два боба, обращенных друг к другу вогнутой поверхностью. Оптимальная температура для роста менингококков – 37 °С. Во внешней среде они малоустойчивы, быстро погибают при воздействии солнечных лучей, дезинфицирующих средств, при высыхании и понижении температуры до 22 °С. Различают несколько серологических типов менингококков, основными из которых считаются четыре: А, B, C, D.
В результате воздушно-капельного механизма распространения инфекции менингококки проникают в носоглотку, полость рта, верхние дыхательные пути здоровых людей, затем гематогенным путем начинают распространяться в организме. В патогенезе менингококковой инфекции решающую роль играет комбинация процессов токсического и септического характера с присоединившимися аллергическими реакциями.
Заражение менингококковой инфекцией
Единственный источник возбудителя менингококковой инфекции - человек с клинически выраженными признаками болезни, а также носитель менингококков. Путь передачи менингококков - аспирационный. Распространение инфекции происходит при разговоре, чиханье, кашле, когда с капельками слизи возбудители попадают в окружающее больного воздушное пространство. Способствует заражению тесный контакт между людьми, особенно в закрытом помещении.
Менингококковая инфекция характеризуется некоторой сезонностью. Число заболевших в сырое и холодное время года увеличивается, достигая пика в марте-мае. Для менингококковой инфекции типичны периодические подъемы заболеваемости, имеющие интервалы в 10-15 лет. Болезнь может поражать людей практически любого возраста, но преимущественно болеют дети. Они составляют почти 70% от общего количество всех больных. Большое значение в развитии менингококковой инфекции имеет ослабленная иммунная система человека.
Классификация
Соответственно клинической классификации менингококковую инфекцию делят на локализованную и генерализованную. К локализованным формам относят менингококконосительство, острый назофарингит и изолированную менингококковую пневмонию. Генерализованные формы: острая и хроническая менингококкемия, менингококковый менингоэнцефалит, менингококковый менингит. Существуют редкие формы: менингококковый артрит или полиартрит, менингококковый эндокардит и иридоциклит. Частое распространение получили смешанные формы менингококковой инфекции.
Симптомы менингококковой инфекции
Инкубационный период при менингококковой инфекции длится от 1 до 10 дней, в среднем 2-3 дня. При менингококконосительстве чаще всего состояние здоровья не нарушается. Обычно болезнь начинается остро, однако у некоторых больных бывает продромальный период: слабость и потливость, головная боль и небольшое повышение температуры.
При менингококковом менингите может наступить расстройство сознания и психические нарушения. Возможны бред, возбуждение, галлюцинации или адинамия, заторможенность, сопор, даже кома. У детей часто возникают судороги, иногда гиперкинезы. У большинства больных отмечается угнетение или усиление периостальных и сухожильных рефлексов, а также их неравномерность, происходит поражение черепных нервов. Может развиться гнойный лабиринтит, который приводит к полной потере слуха. Реже бывает неврит зрительного нерва.
Менингококкемия представляет острый менингококковый сепсис, для которого типично острое начало, высокая лихорадка, ряд септических явлений, в том числе значительные изменения в деятельности сердечно-сосудистой системы, раннее появлением сыпи и тяжелое течение. Сыпь появляется чаще на туловище и нижних конечностях в виде розеолезных и папулезных элементов интенсивно-розового или слегка синюшного оттенка. Кроме того, на коже бывают разной величины геморрагические элементы и звездчатые красные пятна, переходящие в некроз.
При менингококкемии отмечаются кровоизлияния в конъюнктивы, склеры и слизистые оболочки носоглотки. У больных могут наблюдаться носовые, маточные, желудочные кровотечения, субарахноидальные кровоизлияния, микро- и макрогематурия. В отдельных случаях возникают артриты и полиартриты. Тяжелая менингококкемия у взрослых часто сочетается с менингитом.
Менингококковый менингоэнцефалит характеризуется судорогами и нарушением сознания уже с первых дней болезни, нередко появляются зрительные или слуховые галлюцинации. Для него типичны ранние параличи и парезы.
Осложнения
Возможны специфические осложнения в раннем и позднем течении болезни. К ним относятся:
- токсико-инфекционный шок;
- острая почечная недостаточность;
- желудочно-кишечное и маточное кровотечение;
- паренхиматозно-субарахноидальное кровоизлияние;
- острое набухание и отек головного мозга;
- церебральная гипотензия;
- отек легких;
- параличи и парезы;
- гормональная дисфункция;
- эпилепсия;
- гидроцефалия.
К неспецифическим осложнениям относят такие, как герпес, отит, пневмония, пиелонефрит и другие.
Диагноз менингококковой инфекции
Чтобы поставить правильный диагноз, необходимо изучить клиническую картину заболевания. Принимают во внимание также эпидемиологические данные, анамнез, результаты лабораторных исследований крови и цереброспинальной жидкости, взятой путем люмбальной пункции. При подозрении на менингококконосительство или менингококковый назофарингит проводят бактериологическое исследование слизи, которую собирают с задней стенки глотки. Используют также иммунологические методы.
Дифференциальный диагноз следует проводить с другими заболеваниями. Назофарингит дифференцируют с острыми вирусными инфекциями, ангиной, фарингитом. Смешанную форму менингококковой инфекции и менингококкемию сравнивают с другими инфекционными болезнями. Менингококковый менингит дифференцируют с гнойными менингитами другой этиологии.
Лечение менингококковой инфекции
При менингококковой инфекции необходима ранняя госпитализация в специализированные отделения инфекционной больницы. При развитии осложнений больных определяют в отделение реанимации. В случаях выраженной интоксикации, лихорадки назначают антибиотики. В тяжелых случаях проводят противошоковые мероприятия, дегидратационную и дезинтоксикационную, противосудорожную терапию. Назначают анальгетики, применяют кортикостероиды, оксигенотерапию, искусственную вентиляцию легких и другие средства. По показаниям используют витамины, ноотропные препараты и сердечные гликозиды. Выписка из стационара может быть произведена после исчезновения клинических симптомов, при наступлении выздоровления и отсутствии в бактериологических исследованиях слизи из зева и носа менингококков.
В большинстве случаев при своевременном лечении менингококковой инфекции прогноз благоприятен. По статистике летальные исходы возможны при таких осложнениях, как отек и набухание головного мозга, инфекционно-токсический шок. Остаточные явления встречаются у пациентов, лечение которых было начато только в поздние сроки заболевания. Могут быть функциональные нарушения нервно-психической деятельности. Пациентам, перенесшим менингококковую инфекцию показано амбулаторное наблюдение и долечивание у невролога.
Профилактика менингококковой инфекции
Важно вовремя поставить диагноз больным с разными видами менингококковой инфекции и госпитализировать их. Противоэпидемическими мерами является выявление носителей инфекции и проведение им санации носоглотки. Большое значение для профилактики имеет повышение иммунитета людей. За теми, кто был в контакте с больным, устанавливается медицинское наблюдение и проводится бактериологическое обследование. По показаниям осуществляется вакцинация комплексной полисахаридной вакциной против менингококков серологических групп А и С, иммунитет от которой сохраняется в течение 3-5 лет. Повторную иммунизацию при угрозе эпидемии можно проводить через три года.
Менингококковая инфекция — острое инфекционное заболеванние, проявляющаяся разнообразными как по характеру, так и по тяжести, клиническими проявлениями: от назофарингита (воспаление ротоглотки) и простого носительства до генерализованных форм — гнойного менингита (воспаления оболочек головного мозга), менингоэнцефалита (воспаление как оболочек мозга, так и самого мозга) и менингококкемии (тотальное поражение крови и всех систем органов).
Возбудитель Neisseria meningitides, не устойчив во внешней среде и плохо переносит внешние воздействия. К менингококковой инфекции восприимчивы только люди. Возбудитель размножается на слизистой оболочке носоглотки, в спинномозговой жидкости, может быть выделен из крови и пораженной кожи.
Менингококк обладает эндотоксином (выделяется при гибели возбудителя) и аллергизирующей субстанцией. Свойства отдельных штаммов менингококка неоднородны. Менингококки делятся на серогруппы (различающиеся по свойствам и строению клеточной стенки): N, X, Y и Z, 29Е и W135.
- Этиология
- Патогенез
- Клиника менингококка
- Диагностика
- Лечение
Этиология
Наиболее опасными являются штаммы менингококка из серогрупп А, обладающие особой агрессивностью к органам и тканям человека. Доказана способность менингококков к образованию L-форм (способ существования микроорганизма внутри клеток другого организма), которые могут быть причиной затяжного течения менингококкового менингита.
Эпидемиология
Менингококковая инфекция передается от человека к человеку воздушно-капельным путем. Источником инфекции являются больной и носители. Больной наиболее заразен в начале болезни, особенно когда имеются катаральные явления в носоглотке. Здоровые носители без острых воспалительных явлений носоглотки менее опасны, однако число их во много раз превышает число больных. В очаге инфекции число носителей значительно увеличивается, особенно среди детей с воспалительными изменениями в носоглотке. Принято считать, что частота выявления носительства превышает частоту случаев заболеваний приблизительно в 2000 раз.
Учитывая нестойкость менингококка во внешней среде, для заражения имеют значение длительность контакта, cкученность детей в помещении, особенно в спальных комнатах.
Восприимчивость к менингококку невысокая. Заражаются 10—15% проконтактировавших. Прослеживается семейная предрасположенность к менингококковой инфекции. Характерны периодические подъемы заболеваемости через 8—30 лет. Большинство крупных эпидемий были связаны с менингококком из группы А, но в последние годы подъемы заболеваемости нередко обусловлены менингококками из групп В и С. Предвестником подъема заболеваемости является увеличение восприимчивой прослойки населения за счет родившихся детей, снижения иммунитета у взрослых и нарастание числа носиттелей менингококков.
Заболеваемость растет в зимнe-веceнние период. Менингококковая инфекция встречается в любом возрасте, но 70—80% всей заболеваемости приходится на детей в возрасте до 14 лет, и особенно на детей в возрасте до 5 лет. Грудные дети первых 3 месяцев жизни болеют редко. Описаны случаи заболеваемости и в периоде новорожденности. Возможно внутриутробное заражение.
Летальность от менингококковой инфекции достаточно высока и зависит от возраста заболевшего. Дети первого года жизни и лица пожилого возраста с сопутствующими заболеваниями болеют тяжелее и умирают чаще. Большое значение в исходе заболевания имеют своевременность диагностики и правильно проведенное лечение.
В последние годы разработана схема лечения, воздействующая на все поражающие факторы менингококка, и летальность от инфекции значительно снизилась, в среднем составляет 6—10%, а в ряде клиник еще ниже — от 1,0 до 3,2%.
В развитии менингококковой инфекции играют роль три фактора: возбудитель, его эндотоксин и аллергизирующая субстанция.
Выходными воротами для менингококка являются слизистые оболочки носа и ротоглотки. В большинстве случаев в месте внедрения менингококка не возникает каких-либо изменений. Это так называемое здоровое носительство. В других случаях возникают воспалительные изменения слизистой носоглотки — менингококковый назофарингит. У части больных менингококк преодолевает местные барьеры и попадает в кровь. Это может быть бессимптомная бактериемия (в крови находится возбудитель, но человек не болеет), или возникает менингококкемия (менингококковый сепсис – заражение крови). В этих случаях менингококк с током крови заносится в различные органы и ткани: кожу, суставы, надпочечники, сосудистую оболочку глаза, почки, сердце, легкие и др. Попадая в кровь, менингококк может вызывать поражение моз¬говых оболочек и вещества мозга с развитием тяжелого гнойного менингита или менингоэнцефалита.
В развитии клинических проявлений менингококкемии и менингита наряду с самим возбудителем большую роль играет эндотоксин, высвобождающийся в большом количестве при гибели менингококков. Менингококковый эндотоксин —сильный сосудистый яд. При воздействии его на сосудистую стенку возникают различные нарушения циркуляции крови (спазм капилляров, повышение их проницаемости).
Пребывание, размножение, гибель микроорганизмов в крови ведет к большому количеству нарушений в системе свертывания крови с образованием огромного количества бактериальных тромбов в мелких сосудах, в результате этого процесса возникают обширные кровоизлияния в кожу и внутренние органы, в том числе почки, надпочечники, вещество головного мозга, сердце. Развивается острый отёк и набухание мозга. В результате этого процесса структуры головного мозга могут защемляться внутри черепа, поэтому может наступить смерть от паралича дыхательного центра и остановки дыхания.
Также может развиться гипертоксическия (молниеносная) форма обусловленная массивной интоксикацией в результате быстрого распада микробных клеток. При этом уже в первые часы болезни возникают обильная гемopрагическая сыпь на коже, массивные кровоизлияния во внутренние органы и кровотечения.
Инкубационный период длится от 2—4 до 10 дней. Течение менингококковой инфекции без лечения тяжелое и длительное — обычно до 4-6 нед. и даже до 2-3 мес. Нередко болезнь протекает волнообразно с периодами улучшения и ухудшения.
Острый назофарингит
Это наиболее частая форма болезни, составляющая до 80% от всех случаев менингококковой инфекции. Заболевание начинается остро, чаще с повышения температуры тела до 37,5—38,0° С. Ребенок жалуется на головную боль, иногда головокружение, першение в горле, боль при глотании, заложенность носа. Отмечается вялость, снижение активности, бледность. Нередко заболевание протекает при нормальной температуре тела, удовлетворительном общем состоянии и с весьма слабыми катаральными явлениями со стороны носоглотки. В периферической крови иногда отмечается умеренный лейкоцитоз. В половине случаев картина крови не меняется. Течение назофарингита благоприятное, температура тела нормализуется через 2—4 дня. Полное клиническое выздоровление наступает на 5—7-й день. Диагностировать менингококковый назофарингит на основании клинической картины весьма трудно и практически возможно только во время вспышки менингококковой инфекции в детском коллективе.
Необходимо иметь в виду, что в ряде случаев менингококковый назофарингит может быть начальным симптомом генерализованной формы болезни. Менингококкемия (менингококковая бактериемия, менингококковый сепсис) — клиническая форма менингококковой инфекции, при которой, помимо кожи, могут поражаться различные органы (суставы, глаза, селезенка, легкие, почки, надпочечники).
Болезнь начинается остро, нередко внезапно, с повышения температуры тела до высоких цифр. При этом могут быть озноб, повторная рвота, сильная головная боль, которая у детей раннего возраста проявляется пронзительным криком. В более тяжелых случаях может быть потеря сознания, у детей раннего возраста — судороги. Все клинические симптомы нарастают в течение 1—2 дней. В конце первого — начале второго дня болезни появляются высыпания на коже, характерна геморрагическая сыпь (яркая, неправильной формы, с острыми углами, в основе лежит нарушение тока крови в сосудах). Она появляется одновременно на всей коже, но обильнее бывает на ногах и ягодицах. Величина элементов сыпи колеблется от точечных до крупных кровоизлияний с некрозом в центре. На местах обширных поражений в последующем некрозы отторгаются и образуются дефекты и рубцы. В особо тяжелых случаях возможно развитие гангрены кончиков пальцев рук, стоп, ушных раковин. Нередко отмечается сочетание различных видов сыпи.
Возможно поражение суставов – артритов. Может развиваться поражение глаз и глазодвигательного аппарата. В редких случаях при менингококкемии могут быть плевриты, пиелиты, тромбофлебиты, гнойные поражения печени, сердца. Выявляется и почечная патология в виде очагового гломерулонефрита, вплоть до развития почечной недостаточности.
Изменения в периферической крови при менингококкемии характеризуются высоким лейкоцитозом, нейтрофильным сдвигом до юных форм и увеличением СОЭ.
Нередко болезнь протекает волнообразно с периодами улучшения и ухудшения. В любом периоде болезни может наступить летальный исход, в результате прекращения работы каких-либо органов и систем.
Менингококковый менингит
Болезнь начинается остро с подъема температуры тела до 39—40° С, сильного озноба. Дети старшего возраста жалуются на сильную головную боль, без строгой локализации. Ребенок стонет, хватается руками за голову, становятся резко беспокойными, вскрикивает, у него полностью расстраивается сон. Головная боль усиливается при движении, повороте головы, сильных световых и звуковых раздражителях. У некоторых больных возбуждение сменяется заторможенностью, безразличием к окружающему. Возможны болевые ощущения по ходу позвоночника и нервных стволов. Любое, даже лёгкое прикосновение к больному вызывает рез¬кое беспокойство и усиление болевых ощущений. Такие явления (гиперестезии) являются одним из ведущих симптомов гнойного менингита. Не менее характерным, иногда единственным, начальным симптомом менингита является рвота. Она появляется с первого дня и не связана с приемом пищи, у большинства больных рвота бывает многократной. У детей раннего возраста при менингококковом менингите, развиваются судороги. Менингеальные симптомы (клинические признаки воспаления оболочек мозга) отмечаются на 2—3-й день, но могут быть отчетливыми с первого дня заболевания. В результате воспалительного процесса на оболочках мозга развивается нарушение работы всех систем органов человека. Эти нарушения могут быть очень глубокими и приводить к необратимым последствиям и летальному исходу. В периферической крови находят лейкоцитоз, нейтрофильный сдвиг, повышенную СОЭ.
Большое значение для диагностики имеют изменения в спин¬номозговой жидкости, которую получают при пункции спинномозгового канала.
Менингококковый менингоэнцефалит
Встречается преимущественно у детей раннего возраста. Клинически сходно с менингококкемией и менингоитом, но в процесс так же вовлекается и вещество головного мозга. Симптомы не так ярки, а диагностика затруднена. Заболевание протекает особенно тяжело и нередко заканчивается инвалидизацией и смертью.
Менингококковый менингит и менингококкемия
У большинства больных встречается сочетанная форма менингококковой инфекции — менингит с менингококкемией. В клинической симптоматике смешанных форм могут доминировать как проявления менингита и менингоэнцефалита, так и менингококкемии.
Иммунитет
После перенесенной клинически выраженной менингококковой инфекции, так же как и после длительного носительства, в организме вырабатываются специфические антитела Титр повышаться с первых дней болезни, и достигает максимума при генерализованной форме болезни к 5-му дню. Начиная с 4-й недели болезни титры антител снижаются. Длительность их сохранения не установлена. Часто встречается бытовая иммунизация людей, связанная с распространенным носительством N. meningitidis.
В типичных случаях (встречающихся довольно редко) диагноз не представляет затруднений. Для менингококковой инфекции характерны острое начало, высокая температура тела, головная боль, рвота, гиперестезия, симптомы раздражения мозговых оболочек, геморрагическая звездчатая сыпь.
Решающее значение в диагностике менингококкового менингита имеет люмбальная пункция. Проводится бактериологическое исследование ликвора и мазков крови (толстая капля) на наличие менингококка. Распространены и зарекомендовали себя, как надежные, серологические методы исследования. Эти реакции (РПГА; ВИЭФ) высокочувствительны и позволяют улавливать незначительное содержание специфических антител и минимальную концентрацию в крови больных менингококкового токсина.
Прогноз
При своевременно начатом лечении прогноз при менингококковой инфекции благоприятный. Однако и в настоя¬щее время летальность остается высокой и составляет в среднем около 5%. Прогноз зависит от возраста ребенка и формы заболевания (чем больше и глубже поражены системы органов, тем хуже прогноз). Чем меньше возраст ребенка, тем выше летальность.
После перенесенной менингококковой инфекции длительное время сохраняются остаточные явления в виде угнетения мозговых функций, угнетении психосоматического состояния, снижении активности и развитии астении, иногда в виде легкой симптоматики, реже формируется эпилепсия и эпилептиформные расстройства сознания, снохождение, вздрагивание при засыпании и пробуждении.
При поздно начатом лечении возможны отставание в умствен¬ном развитии, глухота, частичная атрофия зрительного нерва (слепота или значительное снижение остроты зрения) и формирование гидроцефалии (нарушение оттока жидкости от головного мозга, приводящее к нарушению его работы).
Все больные с менингококковой инфекцией или с подозрением на нее подлежат обязательной немедленной госпитализации в специализированное отделение или в диагностический бокс. Лечение должно быть комплексным с учетом тяжести болезни. Основа лечения - антибиоткотерапия, проводящаяся на фоне коррекции возникающих нарушений гомеостаза организма.
Профилактика
В системе профилактических мер менингококковой инфекции ведущую роль играет вакцинопрофилактика, это видно на опыте зарубежных стран. В США, Франции, Великобритании, Германии вакцинация от менингококковой инфекции включена в национальные календари. Заболеваемость в этих странах значительно ниже чем, например, в нашей стране.
Существуют два типа вакцин, полисахаридные и конъюгированные с белками переносчиками. Полисахаридные вакцины применяются у детей старше двух лет и взрослых, конъюгированные вакцины применяются у детей с двух месяцев жизни и взрослых.
Полисахаридные:
- Вакцина менингококковая А
- Полисахаридная менингококковая А+С
- Менцевакс ACWY
Конъюгированная вакцина - Меньюгейт.
Иммунизация полисахаридрыми вакцинами приводит к быстрому подъему антител, которые сохраняются у детей в течение не менее 2-хет, а у взрослых до 10 лет, ревакцинация проводится каждые 3 года.
Конъюгированные вакцины сохраняют иммунитет в течение 10 лет и вырабатывают иммунологическую память.
Важно помнить, что в мире существуют эндемичные районы по менингококковой инфекции, так называемый менингитный пояс Африки (к югу от Сахары, протянувшемся от Сенегала на западе до Эфиопии и Египта на востоке). Высокая заболеваемость отмечается в Канаде, вспышки происходят во Франции и США. Особенно уязвимы учащиеся закрытых учебных заведений и колледжей.
Кроме вакцинации основа профилактики менингококковой инфекции – это борьба с возникающими очагами и лечение носителей.
Данная публикация подготовлена специалистами в области иммунопрофилактики, сотрудниками Кафедры инфекционных болезней у детей (Ассоциация педиатров-инфекционистов) ГБОУ ВПО РНИМУ имени Н.И. Пирогова Минздравсоцразвития России с использованием материалов Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Территориального управления Роспотребнадзора по городу Москве, данных и рекомендаций Всемирной организации здравоохранения, а также других международных организаций.
Составить индивидуальный график вакцинации или получить грамотную консультацию специалиста теперь можно не выходя из дома, потому что мы заботимся о Вас, снижая количество контактов и экономя Ваше время!
А еще мы отвечаем на интересующие вас вопросы в специальном разделе! Чаще всего это вопросы индивидуального характера в отношении вакцинации, иммунитета и тому подобного.
Что такое эмфизема легких? Причины возникновения, диагностику и методы лечения разберем в статье доктора Каретникова Дмитрия Владимировича, пульмонолога со стажем в 4 года.
Над статьей доктора Каретникова Дмитрия Владимировича работали литературный редактор Елизавета Цыганок , научный редактор Елена Лобова и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Эмфизема лёгких (Emphysema) — это болезнь, при которой количество воздуха в лёгких повышается настолько, что нарушается их анатомия: альвеолы становятся больше, а их стенки постепенно разрушаются [1] [2] .

Эмифизема встречается у 0,5–5,7 % людей старше 40 лет. Чаще всего ею болеют пожилые мужчины старше 65 лет [3] .
Причины эмфиземы лёгких
Обычно эмфизема лёгких появляется не как самостоятельная болезнь, а как сопутствующий синдром другого заболевания.
Причины развития эмфиземы могут быть как внешними, так и внутренними, иногда они сочетаются. Наиболее частой причиной развития болезни является курение табака. У курильщиков со стажем может развиться хроническая обструктивная болезнь лёгких (ХОБЛ), при которой сосуществуют эмфизема и хронический обструктивный бронхит. Однако эмфизема может быть и начальным этапом развития ХОБЛ: ею болеют 52 % курящих людей без ХОБЛ [4] .

Более редкая причина возникновения болезни — работа на вредном производстве, где на человека без необходимых мер дыхательной защиты воздействуют дымы и аэрозоли.
Эмфизема может встречаться и при других состояниях, не связанных с курением, например при ВИЧ-инфекции, гиперчувствительном (аллергическом) пневмоните или при пороках развития лёгких (нарушении закладки лёгочной ткани или недоразвитии участка лёгкого) [5] .
Причиной также могут стать вирусы: аденовирус, РС-вирус и пневмоцисты. Эти агенты снижают иммунитет, усиливают воспалительные процессы и влияют на разрастание ткани, снижают синтез коллагена и истончают альвеолярные перегородки.
Основной генетической болезнью, которая может привести к развитию эмфиземы, является дефицит фермента альфа-1-антитрипсина. Человек с дефицитом этого фермента может заболеть эмфиземой, даже если он не контактирует с дымом или аэрозолями, а при сочетании дефицита и вредных внешних факторов болезнь появляется до 40–45 лет и протекает более агрессивно.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы эмфиземы легких
Характерными признаками эмфиземы лёгких являются:
Патогенез эмфиземы легких
Важную роль в появлении эмфиземы играет плохое кровоснабжение лёгочной ткани. Она излишне растягивается, истончается и отмирает. Бронхиальная непроходимость затрудняет выдох и повышает альвеолярное давление, которое вместе с воспалением истончает альвеолы.
Не до конца ясен механизм возникновения булл. Исследователи предполагают, что болезнь развивается поэтапно: от одиночных булл до распространённой эмфиземы.
Кроме того, исследование, проведённое на животных, показывает, что существует несколько взаимосвязанных параллельных процессов, каждый из которых приводит к болезни. Однако учёные пока не выяснили, какой из них преобладает.
Концепции развития эмфиземы лёгких
Концепция сдвига протеазно-антипротеазного равновесия и разрушение внеклеточного матрикса
Все клетки нашего организма продуцируют разнообразные молекулы, часть из которых является ферментами. Некоторые из этих ферментов, протеазы, разрушают собственные ткани для последующей их перестройки. При эмфиземе они разрушают эластические волокна лёгких.
Также в организме существуют ферменты, антипротеазы, которые подавляют чрезмерную активность протеаз, если она возникает. Наиболее изученная из таких молекул — альфа-1-антитрипсин.
Сдвиг происходит, когда нарушается равновесие между активностью собственных протеаз и антипротеаз. Активность протеаз повышается, когда табачный или другой дым, аэрозоли или бактериальная инфекция повреждает лёгочную ткань. В месте повреждения появляется воспаление, куда проникают нейтрофилы, чтобы его устранить. Они расщепляют эластин, а остатки эластиновых волокон усиливают приток новых нейтрофилов и других клеток, содержащих протеазы.
Помимо сдвига активности важную роль играет дефицит альфа-1-антитрипсина. Это генетическая болезнь, причём достаточно распространённая (в среднем на 5000 – 10000 человек приходится 1 больной). При дефиците этого фермента даже слабые повреждающие факторы, не влияющие на здорового человека, например пыль или испарения, активируют протеазную систему и приводят к развитию эмфиземы.
Кроме того, дефицит альфа-1-антитрипсина часто провоцирует цирроз печени, особенно в молодом возрасте, поэтому в таком случае эмфизема лёгких обычно развивается вместе с циррозом.
Концепция оксидативного стресса и повреждения клеток лёгкого
Концепция аутоиммунного воспаления
Достаточно часто эмфизема начинает прогрессировать уже после того, как человек бросил курить. Поэтому болезнь начали связывать с хроническим самоуничтожением клеток и неспособностью организма это остановить (неэффективным фагоцитозом). Комбинация этих факторов нарушает клеточный обмен и провоцирует развитие болезни лёгких [8] .
Кроме того, в очаге поражения и плазме пациентов с эмфиземой находят большое количество Т-лимфоцитов, лимфоцитарных фолликулов и антиэластиновых антител, что также подтверждает аутоиммунную природу болезни [9] .
Классификация и стадии развития эмфиземы легких
Врачи применяют классификацию эмфиземы лёгких, основанную на местоположении поражения. В связи с этим выделяют:
- Центриацинарную (центрилобулярную) форму — поражает центр лёгочной дольки вокруг бронхиолы, которая доставляет воздух в дольку для газообмена. Этот тип эмфиземы развивается под воздействием сигаретного дыма, так как вредные компоненты оседают в основном рядом с бронхиолой. Поэтому чаще всего такая форма болезни поражает верхние отделы лёгких и болеют ею курящие пациенты (в том числе с ХОБЛ).
- Панацинарную (панлобулярную/диффузную) форму — разрушает всю дольку, обычно не затрагивая бронхиолу. Изменения происходят или в нижних отделах, или распространяются по всему объёму легких. Чаще всего этот тип эмфиземы связан с дефицитом альфа-1-антитрипсина, но встречается и у курящих пациентов без дефицита фермента.
- Парасептальную форму — поражает всю дольку, при этом в большинстве случаев страдают дольки, прилегающие к плевре. Этот тип эмфиземы может встречаться у курящих пациентов, а также у пациентов, причина болезни которых неизвестна. Если стенка дольки разрывается, воздух проникает в грудную клетку между листками плевры.
- Дистальную форму — в патологический процесс обычно вовлечены альвеолярные ходы.
- Иррегулярную (неправильную) форму — проявляется разным увеличением долек и их разрушением, сочетается с разрастанием рубцовой ткани в лёгком. Часто сопровождается пневмокониозом, туберкулёзом и саркоидозом.

Буллёзная эмфизема может быть исходом любой формы болезни, когда размер участка разрушения превышает 1 см [9] . Буллы могут достигать гигантских размеров, занимая пространство целого лёгкого, и давить на здоровую ткань [10] . Пациенты с такой формой эмфиземы обычно жалуются на выраженную одышку, возникающую при минимальной повседневной физической нагрузке, что не является специфичным симптомом.
Осложнения эмфиземы легких
Основными осложнениями эмфиземы лёгких являются:
- хроническая дыхательная недостаточность; ;
- снижение веса тела;
- лёгочное сердце.
Хроническая дыхательная недостаточность становится главным осложнением при беспрерывном прогрессировании болезни. Степень дыхательной недостаточности устанавливает врач с помощью пульсоксиметрии. Если у пациента вне обострения болезни насыщенность крови кислородом менее 90 %, врач может назначить домашнюю кислородотерапию. Обычно кислородотерапию назначают пожизненно или её отменяют после операции, устраняющей дыхательную недостаточность. При этом пациент с помощью маски или носовых канюль должен дышать воздушной смесью с повышенным содержанием кислорода, которая поступает через портативный кислородный концентратор, не менее 13 часов в сутки [11] .
Спонтанный пневмоторакс — это состояние, при котором в плевральной полости появляется воздух, а лёгкое внезапно спадается. Спонтанный пневмоторакс может возникнуть, например, при разрыве буллы или при истончении и разрыве стенки альвеолы и прилегающей к ней плевре (чаще всего при парасептальной форме эмфиземы). Это осложнение также может быть первым проявлением эмфиземы [11] .

Снижение веса. Из-за повышенной утомляемости дыхательных мышц у пациента появляется выраженная одышка, поэтому он начинает меньше заниматься спортом. Без нагрузок мышцы атрофируются и их масса уменьшается. Это создаёт порочный круг: теперь пациент задыхается при ещё меньшей активности. В условиях кислородного голодания меняется метаболизм, из-за чего уменьшается мышечная масса и вес в целом.
Лёгочное сердце — увеличение правых отделов сердца из-за повышенного давления в лёгочных сосудах. При разрушении лёгочной ткани также уменьшается количество кровеносных сосудов. Однако объём крови, проходящий единовременно через лёгкие, остаётся прежним, поэтому давление и сопротивление кровотоку растут. Первоначально лёгочное сердце — это способ организма компенсировать работу повреждённых тканей, поэтому оно протекает бессимптомно (не считая другие характерные симптомы эмфиземы). Но дальнейший застой крови по большому кругу кровообращения приводит к отёку ног и увеличению печени и селезёнки [16]. Образуется позже, чем при ХОБЛ.
Диагностика эмфиземы легких
Важными пунктами анамнеза являются курение, работа в помещениях с загрязнённым воздухом, хронические или частые острые болезни лёгких и дефицит альфа-1-антитрипсина у пациента и его родственников.
Характерными признаками при физикальном обследовании, указывающими на эмфизему, могут служить:

Важным признаком эмфиземы также является звук над лёгкими, напоминающий звук при ударе по коробке или подушке, и увеличение границ лёгких [11] . Иногда сопровождается ослабленным дыханием.
Чтобы исключить дыхательную недостаточность, проверяют количество эритроцитов в крови и сатурацию периферической крови. Если сатурация ниже 93 %, нужно провести анализ артериальной крови на содержащиеся в ней газы, чтобы уточнить характер и степень дыхательной недостаточности.
Если врач подозревает у пациента наследственный дефицит альфа-1-антитрипсина, также необходимо сдать кровь на определение его активности. Это не самое распространённое исследование, однако многие частные лаборатории его выполняют. Главным показанием для такого анализа является заболевание ХОБЛ до 40 лет или когда пациент с ХОБЛ выкуривает не менее одной пачки сигарет в день на протяжении 20 лет [11] . Если активность фермента будет снижена, генотип вируса определяет врач-генетик с помощью генотипирования.
Чтобы выявить повышение количества эритроцитов и гемоглобина, проводят общий анализ крови.
Инструментальная диагностика
Основными методами диагностики являются:

- Бодиплетизмография и исследование диффузионной способности лёгких — более точно анализируют работу лёгких и определяют объём мёртвого пространства и размер отдельной гигантской буллы. Эти исследования врач назначает перед планируемой операцией по поводу эмфиземы.

- УЗИ сердца — показывает давление в лёгочной артерии, которое появляется через несколько лет после возникновения эмфиземы лёгких.
Лечение эмфиземы легких
Эмфизема лёгких, как и ХОБЛ, — это хроническая болезнь, с которой люди живут всю жизнь, поэтому её нельзя вылечить, но можно замедлить прогрессирование, контролировать симптомы, предупреждать и лечить обострения [16] .
Пациентам с эмфиземой лёгких следует отказаться от курения, причём это относится ко всем больным, вне зависимости от типа эмфиземы и стажа курения, поскольку прекращение курения замедляет прогрессирование болезни [12] [13] .
При эмфиземе также назначают препараты, снимающие спазм и отёк бронхов, и средства, которые облегчают отход мокроты, например АЦЦ и Флуимуцил.
При обострениях хронического бронхита, который сочетается с эмфиземой, к лечению добавляют антибактериальные препараты.
Лечение эмифиземы лёгких с ХОБЛ
Если эмфизема сопровождает ХОБЛ, то больному необходимо делать ежедневные ингаляции с бронхорасширяющими препаратами. Терапия длится всю жизнь за редкими исключениями, когда возникнет потребность отменить лекарство.
Чтобы предотвратить обострение ХОБЛ, пациентам важно вовремя заметить, что количество мокроты увеличилось, а её структура изменилась со слизистой на гнойную. Каждое обострение ХОБЛ активизирует процессы разрушения лёгочной ткани и приводит к обострению эмфиземы. Стоит отметить, что лёгочная ткань не восстанавливается.
Лечение эмфиземы лёгких генетической природы
Больному назначают внутривенную заместительную терапию альфа-1-антитрипсином, если у пациента выявили комплекс следующих факторов:
- дефицит альфа-1-антитрипсина с проведённым генотипированием;
- симптомы болезни;
- снижение параметров спирометрии.
Хирургическое лечение эмфиземы лёгких
Торакальные хирурги проводят операции по лечению эмфиземы. Среди них выделяют:
- Буллэктомию — удаление буллы. После неё поджатый участок лёгкого расправляется и начинает участвовать в дыхании и газообмене, уменьшая дыхательную недостаточность.
- Операцию по уменьшению объёма лёгких — удаление верхушки лёгкого для улучшения вентиляции лёгочной ткани. Проводят при развитии эмфиземы в верхней доле лёгких, когда пациента беспокоит выраженная одышка.
- Эндоскопическую установку бронхиального клапана — способствует вентиляции лёгкого в поражённом участке и предусматривает удаление мокроты и остаточного воздуха при выдохе через эндобронхиальный клапан. Однако учёные всё ещё изучают эффективность этого метода лечения.
- Трансплантацию лёгких — рекомендуется при выраженной эмфиземе с одышкой в спокойном состоянии или при минимальной физической нагрузке, которая сохраняется несмотря на медикаментозную и реабилитационную терапию.
Чтобы назначить операцию, необходимо получить консультацию многих специалистов, в частности пульмонолога, рентгенолога, терапевта и отоларинголога.
Реабилитация при эмфиземе лёгких
Практически все пациенты с эмфиземой нуждаются в реабилитации. Она включает в себя несколько компонентов:
- физические упражнения;
- нутритивную поддержку;
- обучение пациента;
- психологическую помощь.
Регулярные физические нагрузки увеличивают общую тренированность. Пациентам с ХОБЛ рекомендуют тренироваться на беговой дорожке или велоэргометре и упражняться с лёгкими гантелями два раза в неделю. Кроме того, следует ежедневно гулять пешком столько, сколько позволяет одышка и общее состояние (средняя протяжённость около 3–4 км). Такие занятия повышают физический тонус и снижают степень одышки [11] .
Нутритивная поддержка необходима пациентам со сниженным весом и слабыми межрёберными мышцами. Их консультирует диетолог: корректирует суточный рацион и добавляет в ежедневную диету недостающие питательные вещества и витамины.
При обучении пациенту рассказывают о болезни, возможной профилактике обострений и учат правильно использовать ингаляционные препараты.
Психологическая помощь может потребоваться больным с выраженными симптомами, например длительной одышкой, поскольку такое состояние может спровоцировать депрессию.
Программу реабилитации составляют индивидуально для каждого больного.
Прогноз. Профилактика
Прогноз жизни и её качества зависит от провоцирующего фактора, который привёл к развитию эмфиземы. Например, при дефиците альфа-1-антитрипсина течение болезни и её исход зависят от генотипа белка и его уровня в крови. Наиболее неблагоприятный прогноз у пациентов с фенотипом ZZ, ZNull, NullNull [11] [14] .
Отказ от курения, стабильное течение ХОБЛ и своевременное предотвращение его обострений являются важными факторами для благоприятного прогноза жизни у пациента с эмфиземой [14] .
Профилактика эмфиземы лёгких
Для профилактики эмфиземы необходимо:
- Отказаться от курения.
- Вакцинироваться против респираторных инфекций (например, COVID-19, гриппа и пневмококковой инфекции), так как острые болезни лёгких провоцируют прогрессирование эмфиземы.
- Исключить контакт с вредными веществами, раздражающими дыхательные пути, например с пылью, испарениями и дымом. Если пациент работает на вредном производстве, рекомендуется сменить место работы [11] .
Чтобы оценить эффективность постоянного лечения и контролировать динамику течения болезни, нужно посещать врача 2–4 раза в год, даже при отсутствии симптомов. Если постоянные симптомы ярко выражены, врач усиливает терапию. Кроме того, пациент должен сообщить врачу о всех новых симптомах и обострениях, которые больной смог купировать самостоятельно. При постоянном контроле врач сможет уменьшить количество обострений, своевременно выявить осложнения болезни и устранить их [15] .
Читайте также:

