Каковы пути заражения человека малярией токсоплазмозом балантидиазом
Обновлено: 18.04.2024
Протозоозные болезни очень распространены на всей планете. Это заболевания паразитарной этиологии и практически каждый человек является окончательным звеном в развитии того или иного вида простейших паразитов. Микроорганизмы могут быть патогенными изначально, а могут активизироваться под воздействием внешних и внутренних факторов.
Все паразитарные заболевания делятся на гельминтозы (вызываются гельминтами-глистами) и протозоозы (вызываются простейшими).
Протозоозы — это группа болезней, возбудителями которых являются одноклеточные микроорганизмы, которые паразитируют в тканях и органах человеческого организма, разрушая его, с целью поддержания собственной жизнедеятельности. Передаются такие болезни половым путём и бытовым путём через общие предметы личной гигиены, пищу, воду, грязные руки.
К протозоозам относятся заболевания: малярия, лямблиоз, токсоплазмоз, криптоспоридиоз, амёбиаз, лейшманиоз, балантидиаз, пневмоцистоз, саркоцистоз, трипаносомоз, трихомоноз, хламидиоз, бабезиоз.
Течение болезни, симптомы проявления и возможный урон здоровью варьируется в каждом конкретном случае. Однако все эти инвазии требуют своевременного медикаментозного лечения.
Малярия — болотная лихорадка — острый протозооз, возбудителем которого являются плазмодии. Переносчики плазмодий — комары из рода Anopheles (большинство из них питаются кровью в ночное время). Выделяются 4 вида малярии, которые вызываются 4-мя разными видами плазмодий. Самой распространённой и опасной является тропическая малярия. Специфическая особенность — сезонность, что обусловлено наличием благоприятных условий внешней среды для развития патогенных клеток, а также для жизни основного переносчика — комара (температура воздуха от + 16 до + 30 градусов С, наличие открытых водоёмов). Заражение происходит трансмиссивным путём, то есть через укус насекомого, гемотрансмиссивным путём, то есть при выполнении инъекций одним шприцем или при переливании крови, а также вертикальным путём, то есть при беременности от матери плоду или во время родов. Течение болезни хроническо-рецидивирующее, характеризуется чередование периодов острых проявлений с периодами отсутствия симптомов. Приступы характеризуются следующими симптомами: озноб, высокая температура тела, тахикардия, судороги, повышенное потоотделение. При своевременном лечении возможно полное выздоровление, однако такое осложнение как отёк мозга может спровоцировать летальный исход.
Лямблиоз — кишечный протозооз, поражающий слизистые оболочки тонкого кишечника и желчный пузырь, отличительной особенностью лямблиоза является развитие неврологических симптомов. Возбудителем заболевания являются лямблии — жгутиковые одноклеточные паразиты. Они передаются человеку бытовым путём — через грязную воду, немытые овощи и фрукты, которые не подвергались термической обработке, то есть не обдавались кипятком после мытья под проточной водой. Жизненный цикл паразита начинается с момента попадания в человеческий организм лямблиозных цист. По достижению тонкого кишечника из каждой цисты образуется 2 паразита. Лямблиоз бывает острым и хроническим. Острая форма длится неделю, потом болезнь переходит в хроническую стадию. Болезнь не имеет специфических симптомов, что значительно затрудняет её диагностику. Острая форма проявляется жидким стулом, вздутием живота, тошнотой, высокой температурой тела, рвотой, изредка - сыпью. Клиническая картина хронической стадии характеризуется дисбактериозом, диспепсией, неврологическими проявлениями (раздражительность, эмоциональная нестабильность, выраженная бледность). Отсутствие лечения приводит к серьёзной травматизации слизистой оболочки тонкого кишечника, атрофии функции всасывающих клеток, анорексии. Большое количество токсичных продуктов жизнедеятельности лямблий пагубно влияет на работу центральной нервной системы.
Токсоплазмоз — эта форма паразитарной инвазии практически всегда протекает бессимптомно и без направленной лабораторной диагностики его выявить нельзя. Человеческий организм является промежуточным носителем возбудителя болезни. Наличие у человека ВИЧ усугубляет течение болезни и приводит к развитию энцефалита, то есть воспалительного заболевания головного мозга. Люди заражаются от кошек, либо при контакте с сырым мясом. Заражение токсоплазмозом в период вынашивания ребёнка грозит передачей паразита плоду, что провоцирует задержку внутриутробного развития, самопроизвольное прерывание беременности. Человек не является источником распространения инфекции. Общая симптоматика не выражена. Клиническая картина скрыта.
Криптоспоридиоз — протозойная инфекция, вызываемая криптоспоридиями, весь жизненный цикл которых происходит в организме человека или животного. Заболевание протекает с преимущественным поражением пищеварительного тракта. Типичные клинические проявления включают профузную водянистую диарею, тошноту, рвоту, спастические боли в животе. У лиц с иммунодефицитом, наряду с тяжёлой формой гастроэнтерита, может развиться криптоспоридиоз желчевыводящих путей и бронхо-легочная форма. Наряду с сальмонеллёзом, шигеллёзами, кампилобактериозом, ротавирусной инфекцией, лямблиозом, криптоспоридиоз является одной из наиболее частых кишечных инфекций человека.
Амёбиаз — заболевание вызываемое одноклеточными микроорганизмами, отдельные виды которых могут быть патогенными. К их числу относится дизентерийная амёба. Амёбиаз может приобретать кишечную и внекишечную формы. Переносчиками инфекции являются мухи и тараканы. Заражение происходит фекально-оральным путём — через грязные руки, употребление в пищу немытых овощей и фруктов, некипячёной воды, особенно из открытых водоёмов (ручей, река, озеро), а также и водопроводной воды. Острая форма дизентерийного амёбиаза сопровождается жидким стулом с примесями крови и слизи, болями в животе, анемией. При длительном течении болезни наблюдается истощение организма. Внекишечные формы заболевания предполагают локализацию очага размножения амёб в печени или других тканях организма, что приводит к образованию множественных абсцессов и летальному исходу при отсутствии лечения.
Лейшманиоз — трансмиссивное заболевание, переносчиком которого являются различные виды москитов. Возбудитель — лейшмания — жгутиковое простейшее, имеющее 2 формы существования: безжгутиковую - у человека и жгутиковую - у москита. В зависимости от того, какой именно формой был заражён человек, выделяют антропонозную и зоонозную формы лейшманиоза. Они различаются по интенсивности выраженности симптомов и скорости течения. Лейшманиозы поражают кожные покровы, слизистые оболочки и некоторые внутренние органы (например, селезёнку), вызывая их патологическое увеличение. Россия не является эндемичной территорией для лейшманиоза, однако имеют место диагностированные случаи инвазии при заражении людей в туристических и деловых поездках в страны Азии и Африки. К основным симптомам относят неспецифические проявления: высокая температура, озноб, повышенное потоотделение. Кроме того, кожная и кожно-слизистая формы лейшманиоза сопровождаются образованием язв на месте укуса насекомого.
Балантидиаз — источниками болезни являются цисты балантидий, которые формируются и развиваются у свиней. В связи с тем, что промежуточным звеном развития паразита является домашняя свинья, часто инфицированию подвергаются жители сельской местности, работники ферм, животноводческих предприятий. Заражение (инвазия) происходит фекально-оральным путём. Диагностика крайне затруднена, что обусловлено полным совпадением балантидиаза с энтероколитом по его проявлениям: диарея с кровяными и слизистыми примесями, боли в животе, сильное истощение организма, рвота, слабость, сухость во рту, мигрени. Эта кишечная форма болезни приводит к травмированию кишечника и изъязвлению стенок тонкого кишечника, а впоследствии и перитонита при отсутствии своевременного лечения.
Пневмоцистоз — возбудителем этого паразитарного заболевания являются пневмоцисты. Заражение происходит воздушно-капельным путём, поэтому профилактика заболевания затруднена. Вспышки заболевания в большинстве случаев ограничиваются детскими домами, отделениями для новорожденных или детскими отделениями. Носителями пневмоцист могут быть как человек так и домашнее животное. Болезнь смертельно опасна в сочетании с иммунодефицитом, особенно при отсутствии своевременного лечения. Есть определённые сложности в первичной диагностике по причине протекания заболевания в форме хронической пневмонии. Возбудитель поражает бронхи и альвеолы. К симптомам пневмоцистоза относятся следующие признаки: приступообразный кашель, одышка, потемнение носогубного треугольника (особенно у новорожденных), устойчивая температура тела 37-38 градусов С. Летальный исход наступает в 10% случаев, при повторном заражении — в 40%.
Лечение пневмоцистоза у ВИЧ- инфицированных проводится посредством химиотерапии.
Саркоцистоз — возбудители заболевания передаются человеку от свиней и крупного рогатого скота. Инвазия происходит путём употребления в пищу (при недостаточной термической обработке) мяса инвазированных свиней и коров.
Саркоцистоз может быть кишечным или мышечным. Кишечная форма сопровождается тошнотой, вздутием живота и жидким стулом. Мышечная форма протекает скрыто, сопровождается незначительной эозинофилиией.
Трипаносомоз — трансмиссивное заболевание, переносчиком которого является муха Цеце и триатомовый клоп. В зависимости от эндемичного района выделяют американский трипаносомоз (болезнь Шигаса) и африканский трипаносомоз (сонная болезнь). Кроме трансмиссивного пути передачи паразитов существует вероятность вертикального и трансплацентарного (от матери к плоду во время вынашивания ребёнка). Американский трипаносомоз ведёт к поражению центральной нервной системы и параличу, а африканский — к отёку головного мозга или воспалению мозговых оболочек. Симптомы либо не выражены, либо характеризуются повышенной температурой тела, увеличением лимфатических узлов, болями в области сердца, лихорадкой. Лечение может иметь эффект в незначительных количествах случаев при обнаружении заболевания на начальной стадии, а в последующих стадиях лечение сводится к облегчению симптомов.
Трихомоноз — человеческая болезнь, заражение происходит половым путём. Основные симптомы трихомоноза: обильные с неприятным запахом выделения, зуд наружных половых органов и внутренней поверхности бёдер, жжение и болезненность при половых актах. У мужчин болезнь протекает бессимптомно. Заболевание очень опасно при вынашивании ребёнка, может вызвать серьёзные осложнения в течении беременности и быть причиной патологии плода. Это заболевание является распространённой причиной бесплодия. Кроме того, трихомонады могут быть обнаружены при лабораторных исследованиях гнойных выделений из миндалин. При обследовании больных со стоматологическими заболеваниями также обнаруживаются трихомонады. Иногда аспирация из полости рта (вдыхание) трихомонад приводит к развитию инфекции бронхов или легочной ткани, развитию легочного трихомоноза.
Хламидиоз — хламидиии передаются от человека к человеку через половые контакты, а также с грязных рук на слизистые оболочки. Возможна передача инфекции в процессе естественных родов. Хламидии могут впадать в состояние анабиоза, что помогает им не индифицироваться иммунной системой человека. Заболевание характеризуется обильными гнойными выделениями у мужчин и у женщин, зудом, жжением, болями при мочеиспускании.
Диагностика протозоозных болезней затруднена, так как разнообразие форм проявления болезней обуславливает тот факт, что их диагностикой и лечением занимаются разные врачи или группы врачей. Все протозоозы делятся на формы (кишечные, кожные, легочные, половые и так далее) и в зависимости от преобладающих симптомов определяется раздел медицины, изучающий конкретные болезни. Изначально лечащим врачом становится терапевт или гинеколог (уролог, венеролог), дальнейшее лечение назначается им же, но для дополнительных исследований и анализов могут привлекаться другие специалисты. Что такое анализ на протозоозы пациента консультирует лечащий врач, он же даёт направление на дополнительные процедуры по выявлению инородных микроорганизмов в теле человека. Показаниями к сдаче такого анализа становится субъективное мнение врача, основанное на подробном анамнезе и осмотре пациента. Для постановки верного диагноза специалисту необходимы данные ряда исследований. Клиническая картина многих болезней не всегда ярко выражена, бывают случаи бессимптомного течения заболеваний. Чтобы восполнить недостающую информацию и скорректировать лечение в каждом конкретном случае врач может использовать методы общей диагностики, а может назначить специфические исследования для обнаружения определённого вида паразита или группы паразитов.
Профилактика — предупреждение заражения простейшими паразитами (протозоозами) включает в себя, прежде всего, постоянное соблюдение всех правил санитарии и гигиены. Исключить заражение паразитами возможно при выполнении следующих рекомендаций: соблюдение правил личной гигиены, достаточная термическая обработка мясных и рыбных продуктов; тщательное мытьё фруктов, овощей, ягод и зелени, желательно кипятком; регулярные медицинские обследования, особенно при подозрении на заражение паразитами; использование специальных мер защиты от укусов насекомых: противомоскитные сетки, специальные средства для обработки помещений и одежды; борьба с комарами, мухами и тараканами в жилых и хозяйственных помещениях; не использовать воду из открытых водоёмов без предварительного кипячения, соблюдение санитарных правил при уходе за животными.
Бабезиозы — инвазивные трансмиссивные болезни животных и человека, вызываемые простейшими рода бабезия. Болезни протекают с проявлениями лихорадки, анемии, желтухи, гемаглобинурии. Наибольшее значение имеют бабезиозы мелкого и крупного рогатого скота, а также собак, так как возможно заболевание человека. Распространены бабезиозы на всех континентах, кроме Антарктики, в пределах ареалов переносчиков — нескольких видов пастбищных клещей. В России — в основном на северо-западе и юге Европейской части и в лесостепных районах юга Сибири.
По МКБ-10 бабезиоз человека имеет код В60.0.
Возбудитель бабезиозов (более 100 видов с различной патогенностью) в основном специфичен для различных видов животных, из них Babesia divergens (Европа) вызывает бабезиоз у человека.
Возбудитель бабезиоза передаётся через укусы клещей почти всех родов семейства Ixodidae, наиболее известны как передатчики клещи родов Dermacentor, Rhipicephalus, Hyalomma. Передача происходит через слюну во время питания клеща. Естественным резервуаром возбудителей в природе служат больные бабезиозом животные. Промежуточные резервуары — мелкие грызуны. Переболевшие животные в течение 2-3 лет невосприимчивы к повторному острому заражению, но при этом остаются бессимптомными носителями и могут быть источником заражения клещей. Во многих эндемичных районах заражено большинство или всё поголовье скота. Собаки могут болеть бабезиозом ежегодно или даже по 2 раза в год.
Течение и симптомы. Продолжительность инкубационного периода при заражении Babesia divergens через клещей 10-15 суток. Бабезиоз у человека развивается на фоне пониженного иммунного статуса (пожилые или перенесшие тяжёлые операции, больные СПИДом). К симптомам относятся: лихорадка до 40 градусов С, увеличение печени и селезёнки. Случаи заболевания начали фиксировать лишь во второй половине 20-го века, описано несколько десятков случаев заболевания. высока вероятность недостаточного уровня диагностики этого заболевания у человека. У человека с нормальной иммунной системой протекает бессимптомно, несмотря на высокую степень паразитемии.
Лечение. Для тяжёлых форм бабезиоза у человека рекомендованы комбинации клиндамицина и хинина или азитромицина и атоваквона. В тяжёлых случаях необходимо переливание крови.
Профилактика. Уничтожение клещей и грызунов на пастбищах, обработка животных акарицидами. Для человека — применение противоклещевых препаратов и использование специальных противоэнцефалитных костюмов.
Все споровики – паразиты и комменсалы животных и человека. Органеллы движения у них отсутствуют. Питание споровиков осуществляется за счет поглощения пищи всей поверхностью тела. Многие споровики – внутриклеточные паразиты. Они претерпели наиболее глубокую дегенерацию. Характерны два варианта циклов развития споровиков: с половым процессом и без него. Первый вариант цикла развития включает стадии бесполого размножения, полового процесса в виде копуляции и спорогонии. Бесполое размножение осуществляется путем простого или множественного деления – шизогонии. Половому процессу предшествует образование половых клеток – мужских и женских гамет. Гаметы сливаются, а образовавшаяся зигота покрывается оболочкой, под которой происходит спорогония – множественное деление с образованием спорозоитов. Споровики с таким типом жизненного цикла обитают в тканях внутренней среды.
Второй вариант цикла развития встречается у споровиков, обитающих в полостных органах, сообщающихся с внешней средой. Он очень прост и включает стадии цисты и трофозоита.
Источники и пути заражения человека малярией.
Источником заражения являются человек, больной малярией, или паразитоноситель (человек, у которого в крови есть паразиты, но болезнь не проявляется), а переносчиком — комары из рода Анофелес. Заражается человек при укусе его инфицированным комаром, но возможны и другие пути заражении (например, при переливании крови от больного малярией, внутриутробное заражение плода от матери). Больной малярией становится заразным для комаров, когда в крови у него появятся созревшие формы плазмодиев (так называемые гамонты). При трех- и четырехдневной малярии они появляются после второго-третьего приступа, а при тропической — через 7—10 дней от начала болезни.
Факторами риска являются путешествия или проживание в регионах распространения малярии. Малярией болеют повсеместно от 45° северной до 40° южной широты (но чаще в тропиках и субтропиках) на высоте от 0 до 1800 м над уровнем моря. В странах с умеренным климатом более часто выделяют Плазмодий вивакс, реже Плазмодий малярии.
В тропиках основным возбудителем является Плазмодий фалципарум. Ежегодно в мире заболевают около 250 млн человек.
Некоторые люди обладают естественной устойчивостью к возбудителям малярии (многие представители негроидной расы). Лица с некоторыми заболеваниями крови (например, серповидно-клеточной анемией) также устойчивы к заражению, так как паразиты неспособны размножаться в измененных эритроцитах.
Стадии жизненного цикла плазмодиев.
Малярийные плазмодии относятся к классу Plasmodium и являются возбудителями малярии. В организме человека паразитируют следующие виды плазмодиев: P. vivax – возбудитель трехдневной малярии, P. malariae – возбудитель четырехдневной малярии, P. falciparum – возбудитель тропической малярии, P. ovale – возбудитель овалемалярии, близкой к трехдневной (встречается только в Центральной Африке). Первые три вида обычны в тропических и субтропических странах. Все виды плазмодиев имеют сходные черты строения и жизненного цикла, отличие имеется лишь в отдельных деталях морфологии и некоторых особенностях цикла.
Жизненный цикл типичен для споровиков и состоит из бесполого размножения (шизогонии), полового процесса и спорогонии.
Малярия – типичное антропонозное трансмиссивное заболевание. Переносчики – комары рода Anopheles (они же и окончательные хозяева). Промежуточный хозяин – только человек.
Заражение человека происходит при укусе комара, в слюне которого содержатся плазмодии на стадии спорозоита. Они проникают в кровь, с током которой оказываются в ткани печени. Здесь происходит тканевая (преэритроцитарная) шизогония. Она соответствует инкубационному периоду болезни. В клетках печени из спорозоитов развиваются тканевые шизонты, которые увеличиваются в размерах и начинают делиться шизогонией на тысячи дочерних особей. Клетки печени при этом разрушаются, и в кровь попадают паразиты на стадии мерозоита. Они внедряются в эритроциты, в которых протекает эритроцитарная шизогония. Паразит поглощает гемоглобин клеток крови, растет и размножается шизогонией. При этом каждый плазмодий дает от 8 до 24 мерозоитов. Гемоглобин состоит из неорганической железосодержащей части (гема) и белка (глобина). Пищей паразита служит глобин. Когда пораженный эритроцит лопается, паразит выходит в кровяное русло, в плазму крови попадает гем. Свободный гем – сильнейший яд. Именно его попадание в кровь вызывает страшные приступы малярийной лихорадки. Температура тела больного поднимается так высоко, что в старину заражение малярией использовали как средство лечения сифилиса (испанской чесотки): трепонема не выдерживает таких температур. Развитие плазмодиев в эритроцитах проходит четыре стадии: кольца (тро-фозоита), амебовидного шизонта, фрагментации (образования морулы) и (для части паразитов) образования гаметоцитов. При разрушении эритроцита мерозоиты попадают в плазму крови, а оттуда – в новые эритроциты. Цикл эритроцитарной шизогонии повторяется много раз. Рост трофозоита в эритроците занимает время, постоянное для каждого вида плазмодиев. Приступ лихорадки приурочен к выходу паразитов в плазму крови и повторяется каждые 3 либо 4 дня, хотя при длительно текущем заболевании чередование периодов может быть нечетким.
Из части мерозоитов в эритроцитах образуются незрелые га-монты, которые являются инвазивной стадией для комара. При укусе комаром больного человека гамонты попадают в желудок комара, где из них образуются зрелые гаметы. После оплодотворения образуется подвижная зигота (оокинета), которая проникает под эпителий желудка комара. Здесь она увеличивается в размерах, покрывается плотной оболочкой, формируется ооцис-та. Внутри нее происходит множественное деление, при котором образуется огромное количество спорозоитов. Затем оболочка ооцисты лопается, плазмодии с током крови проникают во все ткани комара. Больше всего их скапливается в его слюнных железах. Поэтому при укусе комара спорозоиты могут проникнуть в организм человека.
Таким образом, у человека плазмодий размножается только бесполым путем – шизогонией. Человек – это промежуточный хозяин для паразита. В организме комара протекает половой процесс – образование зиготы, образуется множество спорозоитов (идет спорогония). Комар – это окончательный хозяин, он же и переносчик.
Простейшие – это одноклеточные животные организмы микроскопических размеров, составляющие подцарство PROTOZOA(простейшие) царстваANIMALIA(животные).
Малярия – протозойное антропонозное заболевание, характеризующееся периодическими приступами лихорадки, увеличением размеров печени и селезенки, анемией.
Характеристика возбудителей.
Таксономическое положение. Возбудители малярии относятся к типуApicomplexa, классуSporozoa, семействуPlasmodidae, родуPlasmodium. Различают 4 вида:Plasmodiumvivax(возбудитель трехдневной малярии);Plasmodiummalarie(возбудитель четырехдневной малярии);Plasmodiumfalciparum(возбудитель тропической малярии);Plasmodiumovale(возбудитель малярии овале, напоминающей трехдневную малярию). Впервые (1880 г.) возбудителя малярии –Pl.malariaeв крови человека обнаружил А. Лаверан.
Plasmodiumvivaxоткрыт в 1890 г. В. Грасси и Р. Фелетти.,Plasmodiumfalciparumоткрыт в 1897 г. У. Уэлчем.,Plasmodiumovaleоткрыт в 1922 г. Ж. Стивенсоном.
Морфология.В зависимости от вида возбудителя и стадии его развития плазмодии могут иметь округлую, амебовидную, лентовидную, веретеновидную (нитевидную), полулунную, перстневидную форму с колебаниями размеров от 1 до 60 мкм. По Романовскому-Гимзе цитоплазма возбудителя окрашивается в голубой, ядро – рубиново-красный цвет.Культивирование малярийного паразита вне организма затруднено.Развитие малярийных плазмодиев. Малярийный плазмодий – строгий внутриклеточный паразит, имеющий 2 цикла развития со сменой хозяев:
бесполый циклсовершается в организме человека (промежуточного хозяина), называетсяшизогонией; 2)половой цикл – спорогонияпротекает в организме самки комара родаAnopheles(окончательный хозяин) и называетсяпарогонией
Шизогония протекает в виде 2-х последовательных процессов:
Тканевая шизогония протекает в клетках печени.
Инфицированный малярией комар при укусе со слюной вносит в организм человека плазмодий в виде нитевидных клеток – спорозоитов. С кровотоком спорозоиты попадают в клетки печени (и других органов и тканей), где превращаются в тканевые трофозоиты (растущие формы), шизонты (делящиеся формы), из которых образуются тканевые мерозоиты. Мерозоиты при разрушении гепатоцитов попадают в кровь. Тканевая шизогония соответствует инкубационному периоду болезни, его продолжительность 6-20- дней (зависит от вида возбудителя).
С момента выхода мерозоитов в кровь начинается эритроцитарная шизогония.Мерозоиты внедряются в эритроциты, растут, многократно делятся образуя от 6 до 24 эритроцитарных мерозоитов (в зависимости от вида возбудителя). После разрушения эритроцитов мерозоиты выходят в плазму крови. И те мерозоиты, которые не подверглись фагоцитозу, заражают новые эритроциты, и цикл эритроцитарной шизогонии повторяется.
Эритроцитарная шизогониясоответствуетострому периоду болезни.
Процесс эритроцитарной шизогонии строго цикличен. Его продолжительность у Plasmodiumvivax,Plasmodiumfalciparum,Plasmodiumovale- 48 час., уPlasmodiummalariae– 72 час.
На определенном этапе эритроцитарной шизогонии некоторые мерозоиты превращаются в предшественников половых клеток: микро- и макрогаметоциты.
Спорогония продолжается 1-3 недели.
При укусе комара с кровью больного гаметоциты попадают в желудок комара, где они созревают и оплодотворяются с образованием зиготы. Зигота превращаются в подвижную удлиненную оокинету. Оокинета внедряется в стенку желудка комара и превращается в округлую ооцисту. Ооциста увеличивается в размерах и многократно делится с образованием большого количества (до 10000) длинных тонких (1*14 мкм) спорозоитов. После созревания спорозоитов оболочка ооцисты лопается, и спорозоиты попадают в гемолимфу комара. В гемолимфе спорозоиты активно передвигаются и достигают слюнных желез, где накапливаются. При укусе комара спорозоиты из слюнных желез через ротовые органы комара попадают в кровь человека.
Эпидемиология. Источник инфекции– больной и паразитоноситель (с гаметоцитами). Механизм заражения: 1.трансмиссивный (через укус инфицированного переносчика – комара)
2. вертикальный (от матери плоду через плаценту, в процессе родов)
3. гемотрансфузионный (при переливании крови от доноров – паразитоносителей), а также через загрязненные кровью инфицированных людей шприцы, иглы и другой инструментарий при парентеральных манипуляциях. Малярия распространена повсеместно. В странах с умеренным климатом чаще встречается Plasmodiumvivax, режеPlasmodiummalariae, в тропиках основной возбудительPlasmodiumfalciparum. В Африке (тропиках и субтропиках) встречаются все виды возбудителей малярии. Эпидемиологическая ситуация по малярии в нашей стране ухудшается в основном за счет завоза этой болезни (трехдневной малярии из Таджикистана и Азербайджана, тропической, овале – из Африки). Особенно опасен приток нелегальных иммигрантов, которые не обследуются и не лечатся. В странах умеренного климата заболеваемость малярией носит сезонный характер, так как развитие паразитов малярии в организме комара возможно только при температуре выше 16 градусов, поэтому передача возбудителей здесь возможна в течение 1,5 – 3 месяцев. В условиях тропиков это происходит в течение всего года, в субтропиках – в течение 5-8 месяцев.
Клиника и патогенез. Инкубационный период – 8 – 25 дней (до 2 лет и более), зависит от вида возбудителя. Заболевание характеризуется приступообразным течением. Приступ начинается обычно в первой половине дня. Малярийный приступ (пароксизм) состоит из трех фаз:
"озноб" – больного "трясет" лихорадка, он ложится в постель и никак не может согреться. Кожные покровы бледные, холодные, шероховатые ("гусиная" кожа). Головная боль, боли в пояснице, конечностях, тошнота, иногда рвота. Озноб длится 0,5 – 3 часа и сопровождается быстрым подъемом температуры.
"Жар":температура достигает 39 - 40С и выше, усиливается головная боль, боли в пояснице, мышцах, мучительная жажда, иногда рвота, бред, нарушение сознания. Лицо красное, кожа сухая, горячая на ощупь. Тахикардия, снижение артериального давления, одышка.
Через несколько часов – фаза потоотделения: температура резко снижается до субнормальных цифр (35,5 - 36С), проливной пот, значительное облегчение, но остается слабость, сонливость.
Общая продолжительность малярийного пароксизма 6-12 часов, при тропической малярии до суток и более. После приступа – период апирексии от 48 до 72 часов в зависимости от длительности эритроцитарной шизогонии у разных видов возбудителей.
Для малярии характерна триада:
3) спленогепатомегалия ( увеличенные селезенка и печень).
Малярийные приступы – реакция организма на выход в плазму крови токсических продуктов обмена паразитов, продуктов распада эритроцитов. Чужеродные белки паразита и измененные белки разрушенных эритроцитов вызывают анафилактическую реакцию ( аллергическую реакцию первого типа). В результате повышается проницаемость капилляров, что может привести к отеку мозга. Повышается вязкость крови, капилляры закупориваются остатками эритроцитов, в результате нарушается кровообращение, что может привести к ишемии (местное малокровие) органов, тканей. В тяжелых случаях возможна смерть. Тенденцией к тяжелому злокачественному течению отличается тропическая малярия. Она является причиной смерти в 98% всех летальных случаев при малярии. Доброкачественным течением характеризуется трехдневная и ovale- малярия. Четырехдневная малярия характеризуется длительной клинической активностью (4-5 лет и более).
Иммунитет нестойкий. Лабораторная диагностика. Основной метод –микроскопический.У больного берут кровь из пальца как на фоне лихорадки, так и в период апирексии и готовят 2 препарата: мазок и толстую каплю. Оба препарата красят по Романовскому-Гимзе (предварительно фиксируя в жидком фиксаторе мазок и высушивая, без фиксации каплю). Цель этого исследования – не только обнаружение плазмодия, но и распознавание его вида. Для этого учитывают следующие признаки:
Plasmodium vivax. Юный трофозоит имеет форму кольца (голубая цитоплазма, окамляющая крупную вакуоль в центре, и рубиново-красное ядро), иногда встречается 2-3- кольца в одном эритроците. Пораженный эритроцит увеличен в размерах по сравнению с нормальным и имеет в цитоплазме кирпично-красную зернистость. Полувзрослый трофозоит имеет форму амебы с псевдоподиями. При делении шизонта образуется 12-24 мерозоитов, напоминая тутовую ягоду.
Plasmodium malariae.Юный трофозоид в виде 1 кольца в эритроците. Полувзрослый трофозоит имеет лентовидную форму. Зрелый шизонт делится на 6-12 мерозоитов. Эритроциты не деформируются.
Plasmodium ovale. Юный трофозоит в стадии кольца в количестве 2-3 в эритроците, имеет более крупное ядро, а пораженный эритроцит имеет овальную форму и часто бахромчатые края. Зернистость в пораженном эритроците крупная, менее обильная, чем при Р.vivax. Паразит делится на 6-12 мерозоитов.
Plasmodium falciparum. Юный трофозоит в виде двух-трех мелких колец в одном эритроците. Шизонт делится на 12-18 мерозоитов. Половые клетки полулунной формы (у остальных трех видов гамонты округлые). Развитие Р.vivax, Р.malariae, Р.ovaleпроисходит в циркулирующей крови, поэтому в мазках и толстых каплях крови можно обнаружить все стадии развития паразита. При тропической малярии в периферической крови можно увидеть только кольца и гаметоциты, так как развитие шизонтов происходит в капиллярах внутренних органах.
Используется также сероидентификациявозбудителя с помощью РИФ, ИФА, а также ДНК-гибридизации, позволяющей обнаружить ДНК паразитов в крови.
Применяется серодиагностика– реакция иммунофлюоресценции (РИФ), при которой антитела обнаруживаются на 2-3-ей неделе болезни в диагностический титрах 1:20 – 1:40 (иногда и до 1:160 и выше). Используют также РСК, РНГА.
Профилактиканаправлена на источник возбудителя (лечение больных и носителей), уничтожение переносчиков (комаров); защита то нападения комаров (сетки, пологи, репелленты). Разрабатывается вакцина на основе антигенов, полученных методом генной инженерии. Используется химиопрофилактика (хингамин, хинин, хлорохин).Лечение.Используется противомалярийные препараты: хинин, хлорохин, акрихин, примахин, бигумаль, хлородин, хиноцид, пириметамин, сульфаниламиды, тетрациклин.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
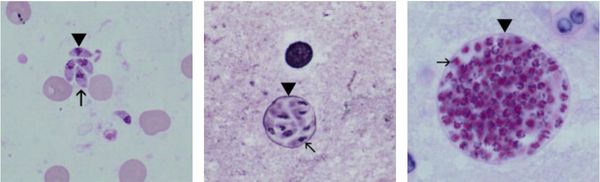
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
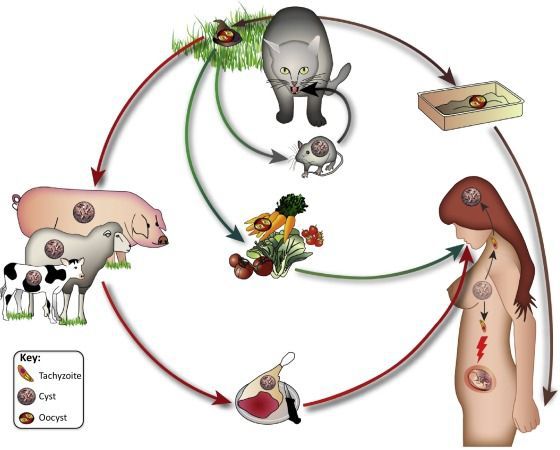
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
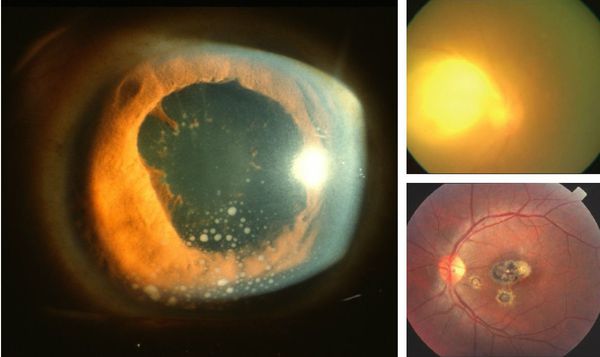
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
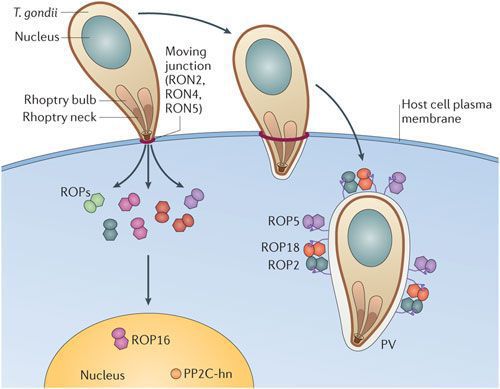
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]

Глисты — паразитические черви, которые обитают в организме человека, и вызывают гельминтоз. Заболевание имеет острое и хроническое течение, характеризуется истощением организма, системным поражением органов. В диагностике используют лабораторные методы: анализ кала на яйца глистов, посев крови, микроскопическое исследование мокроты. Для оценки состояния и тяжести поражения внутренних органов назначают УЗИ, МРТ, рентген. Лечение зависит от вида паразитических червей.
Общие сведения о гельминтах
Гельминтоз — распространенная глистная инфекция. Заболевание встречается повсеместно, с преобладанием среди регионов с влажным и теплым климатом. Возникает в любом возрастном периоде, однако в группу риска попадают дети 5‒15 лет. Это связано с познанием окружающей среды, слабым иммунитетом против глистной инвазии (заражения), недостаточно кислой средой желудка для уничтожения паразитов. Гельминты поражают разные органы, но основная среда их обитания — кишечник.
Возбудитель проникает в организм через слизистые оболочки и кожу, при заглатывании личинок и яиц паразитов с водой, пищевыми продуктами. Из проглоченных зрелых яиц в желудочно-кишечном тракте выходят личинки, которые через слизистую оболочку кишечника попадают в кровь, и циркулируют по всему организму, поражая печень, почки, желчный пузырь, сердце, бронхи, легкие. При откашливании и заглатывании слюны паразиты через ротовую полость вновь попадают в кишечник, где в течение 70‒75 дней растут, превращаются в половозрелую особь.
От момента заражения до формирования зрелой особи проходит 2‒3 месяца. Это время соответствует ранней кишечной стадии. На этапе поздней стадии в организме уже паразитируют взрослые особи. Они живут в кишечнике около года и откладывают яйца, которые выходят вместе с калом.
Причины глистов
Заражение происходит при употреблении пищи и воды, в которой содержатся яйца паразитических червей с созревшими личинками, контакте с загрязненной фекалиями землей. Глисты передаются от человека к человеку через посуду, игрушки, одежду и обувь, предметы обихода и туалета.
Количество заболеваний увеличивается из-за недостаточного соблюдения правил гигиены после прогулки, употребления немытых овощей и фруктов, грязной воды, недостаточной термической обработки мяса или рыбы. Возможно также самозаражение глистами.
Справка! Яйца глистов приносят домашние животные, которые бывают на улице, на лапах и шерсти.
Виды глистов
По способу существования во внешней среде гельминтозы разделяют на три группы:
геогельминтозы — развиваются в почве без участия промежуточного хозяина;
биогельминтозы — обязательное условие для существования это два и более организма;
контактные гельминтозы — передаются от человека к человеку контактно-бытовым путем.
Известно около 400 возбудителей, из них в организме человека паразитирует несколько видов:
Нематоды (круглые черви): аскариды, острицы, трихинеллы. Вызывают аскаридоз, некатороз, энтеробиоз, анкилостомидоз.
Цестоды (лентецы, ленточные черви): бычий и свиной цепень, широкий лентец, эхинококк. Возубидети эхинококкоза, гименолепидоза, цистицеркоза, тениоза.
Трематоды (сосальщики): печеночная и кошачья двуустки. Возбудители описторхоза, фасциолеза, клонорхоза.
Колючеголовые (скребни): скребень-великан провоцирует акантоцефалез.
В зависимости от места паразитирования возбудителя гельминтозы разделяют на кишечные и внекишечные — паразитируют в печени, почках, сосудах, желчном пузыре.
Симптомы глистов
Клинические проявления гельминтоза разнообразны, и зависят от вида, количества гельминтов и органа, в котором они паразитируют, возраста, состояния иммунной системы. Заболевание имеет острое течение — от двух недель до двух месяцев, и хроническое — до нескольких лет.
В остром периоде преобладают признаки интоксикации и аллергии:
кожный зуд и сыпь,
Специфическое проявление гельминтоза — бруксизм (скрежет зубами). При заражении паразитическими червями может возникать раздражение области ануса, инфекции наружных половых органов.
В хроническую фазу на первый план выходят органоспецифические поражения. Наиболее частый клинический синдром — расстройство пищеварения:
боль в нижней части живота,
непереносимость некоторых продуктов,
При наличии глистов в печени, желчном пузыре возникают кисты, механическая желтуха, гепатит. Круглые гельминты провоцируют бронхит, сердечную недостаточность, миокардит (воспаление мышечной оболочки сердца).
При инвазии нервной системы человек становится раздражительным, снижается концентрация внимания, трудно переносит умеренные физические нагрузки, появляется бессонница.
На фоне гельминтоза снижается иммунная защита, возникают грибковые и гнойничковые поражения кожи, кариес, утяжеляется течение аллергии и других сопутствующих заболеваний.
Осложнения при глистах
При отсутствии своевременного и адекватного лечения личинки паразитируют в организме, поражая кровеносные сосуды, печень, почки, кишечник, легкие, бронхи, что негативно сказывается на их функциональности, общем состоянии.
Продукты жизнедеятельности личинок токсичные для человеческого организма. При их скоплении развиваются местные аллергические реакции, крапивница, бронхиальная астма, атопический дерматит.
Гельминты используют белки, витамины, микро- и макроэлементы организма человека, что влечет риск отставания в физическом, умственном и психическом развитии ребенка. Такой вид паразитических червей, как анкилостомы и власоглавы поглощают кровь человека, вызывая анемию. Паразиты угнетают иммунную систему, снижают его сопротивляемость к инфекциям, из-за чего часто возникают простудные и инфекционные заболевания.
Справка! Наличие в организме глистов уменьшает эффективность профилактических вакцин.
При массовом заражении возрастает риск развития дисбактериоза, частичной закупорки просвета кишечника и желчных протоков, что в итоге может спровоцировать приступ аппендицита, кишечную непроходимость, холецистит (воспаление желчного пузыря).
Диагностика глистов
При подозрении на гельминтоз пациента должен осмотреть гастроэнтеролог, инфекционист, паразитолог, терапевт или педиатр. При ощупывании увеличена печень, селезенка, лимфатические узлы. Определить наличие паразитов в организме можно по результатам общего анализа крови — превышена норма лейкоцитов и эозинофилов, повышена скорость оседания эритроцитов.
Более точная диагностика гельминтоза возможна спустя три месяца после заражения, когда глисты становятся половозрелыми. Для первичной диагностики и мониторинга лечения заболевания используют лабораторные методы:
соскоб на выявление яиц остриц из области анального отверстия,
исследование кала на яйца гельминтов,
копрограмму (расширенный анализ кала для оценки функциональной деятельности ЖКТ).
Биологическим материалом для исследования могут быть рвотные массы, мокрота, моча, биоптат кожи (забор кусочка кожи), содержимое двенадцатиперстной кишки.
При кишечных гельминтозах информативны аллергические пробы. Для выявления поражения внутренних органов используют инструментальные методы диагностики:
КТ внутренних органов;
колоноскопию (осмотр толстого кишечника зондом с камерой);
гастроскопию и эзофагоскопию (осмотр внутренних органов желудочно-кишечного тракта с помощью эндоскопического прибора).
Выявить глисты у человека достаточно сложно, так как кладка яиц происходит нерегулярно. Чтобы обнаружить яйца важно попасть в период зрелости. Антитела в крови присутствуют только первые два месяца, после чего исчезают из кровотока, и сосредотачиваются в кишечной стенке. Диагностику также затрудняет разнообразие клинической картины. Поэтому, часто врач вынужден принимать решение о назначении противоглистного лечения на основании косвенных признаков гельминтоза.
Лечение глистов
Для лечения глистной инвазии используют противогельминтные средства. Выбор препарата и продолжительность курса определяет врач с учетом типа паразитических червей и симптоматики. Обычно назначают противонематодозные, противотрематодозные, противоцестодозные или средства широкого спектра действия.
Симптомы со стороны бронхолегочной системы купируют с помощью глюкокортикостероидов, антигистаминных, спазмолитических препаратов. Для восстановления микрофлоры кишечника принимают пробиотики, для улучшения процесса пищеварения — ферментные средства. Кисту или абсцесс в печени удаляют хирургическим способом.
Через две недели и потом через месяц после завершения терапии сдают анализ кала на яйца гельминтов трехкратно. Пациенты из группы риска нуждаются в периодическом паразитологическом обследовании.
Справка! При заражении одного из членов семьи, лечат только тех, у кого есть косвенные признаки.
Профилактика глистов
Избежать глистного заражения возможно, если соблюдать санитарно-гигиенические мероприятия:
мыть руки перед едой, после улицы и туалета;
вести здоровый образ жизни;
тщательно промывать овощи, фрукты и ягоды;
употреблять только кипяченую или фильтрованную воду;
раз в 10–14 дней использовать моющие средства для влажной уборки пола;
правильно обрабатывать пищевые продукты.
Специфическую медикаментозную профилактику противогельминтными препаратами широкого спектра действия рекомендовано проводить всем два раза в год — весной и осенью. В дегельминтизации нуждаются также домашние питомцы.
Читайте также:

