Каналикулярный путь распространения инфекции это
Обновлено: 15.04.2024
Пути инфицирования позвоночника. Классификация инфекций позвоночника
а) Вопросы лучевой диагностики с позиций анатомии. Возбудители инфекционных заболеваний могут проникать в органы и ткани человека различными путями, в т.ч. путем прямого контакта, лимфогенным путем, гематогенным путем или с током спинномозговой жидкости Контактный путь, как говорит само его название, предполагает прямое соприкосновение кости или мягких тканей с источником инфекции с развитием абсцесса мягких тканей или остеомиелита.
Если вести речь о позвоночнике, то такой путь инфицирования можно видеть, например, при развитии спондилита в области глубокого пролежня. Инфекционное поражение межпозвонкового диска может распространяться на окружающие паравертебральные мягкие ткани и приводить к формированию абсцессов поясничных мышц. Контактный путь также является механизмом развития эпидуральных абсцессов, расположенных краниальней или каудальней уровня поражения межпозвонкового диска. Этот путь инфицирования имеет место и при развитии интрамедуллярных абсцессов спинного мозга, при которых возбудитель проникает в спинной мозг через эпителиальный ход и дефект в задних элементах позвонка.
Лимфогенный путь имеет ограниченное значение, поскольку при инфекционных поражениях позвоночника намного чаще мы видим контактный или гематогенный пути инфицирования. Лимфогенный путь может быть актуален, например, при поражении забрюшинных лимфоузлов при первичных злокачественных новообразованиях брюшной полости и таза.
б) Гематогенный путь инфицирования. Гематогенный путь является одним из самых главных механизмов развития инфекционных поражений костей аксиального скелета. При этом вопрос о том, какой именно гематогенный путь (артериальный или венозный) имеет большее значение, остается спорным. Артериальный путь распространения инфекции в отношении позвоночника традиционно считается более актуальным. В телах позвонков существуют области, с физиологической точки зрения очень похожие на метафизы длинных трубчатых костей. Области эти расположены вблизи передней продольной связки и характеризуются наличием разветвленной сети конечных артериол, которая делает их восприимчивыми к развитию инфекционного процесса.
Дистальные сосуды в этих областях характеризуются отсутствием сети анастомозов и медленным кровотоком, тромбоз их ведет к аваскулярному некрозу кости. Сегментарные артерии обычно кровоснабжают тела двух смежных позвонков и расположенный между ними диск, в связи с чем и картина инфекционного поражения позвоночника бывает достаточно типична. Венозный путь инфицирования традиционно реализуется через сплетение Батсона, представляющее собой продольно ориентированную сеть бесклапанных вен, расположенных параллельно позвоночному столбу. Вены эти располагаются за пределами брюшной или плевральных полостей. Сплетение Батсона сообщается с различными другими венозными системами, в т. ч. с полой веной, системой воротной вены, системой непарной вены, межреберными венами, легочными и почечными венами.
Направление тока крови в сплетении меняется в зависимости от градиента давления в грудной и брюшной полостях. Аналогичную функцию на уровне шейного отдела позвоночника выполняет глоточно-позвоночное сплетение. Непрерывность ликворных пространств полости черепа и дурального мешка обеспечивает возможность прямого распространения возбудителей инфекций или метастазов опухолей стоком ликвора. Внутричерепные новообразования таким образом могут давать отсевы с развитием метастазов в шейном, грудном или поясничном отделах дурального мешка. Точно также новообразования, расположенные в самых дистальных отделах дурального мешка, могут метастазировать с током ликвора в полость черепа.
(Слева) На схеме сагиттального среза показаны признаки инфекционного поражения поясничного межпозвонкового диска с распространением процесса на тела позвонков с развитием спондилита, деструкцией замыкательных пластинок и отеком костного мозга. Отражено формирование дорзального и вентрального абсцессов.
(Справа) Сагиттальный срез, Т1-ВИ FS с КУ, пациент со спондилодисцитом: контрастное усиление сигнала тел L5 и S1 позвонков и межпозвонкового диска, флегмонозные изменения превертебральных и эпидуральных тканей. (Слева) Аксиальный срез, Т1-ВИ с КУ, пациент со спондилодисцитом: распространение инфекционного процесса в превертебральные ткани, поясничные мышцы и дорзальные мышцы позвоночника. Флегмона проникает в вентральный отдел эпидурального пространства и вызывает сдавление дурального мешка.
(Справа) Аксиальный срез, Т2-ВИ FS: распространение воспалительного процесса в превертебральное пространство, на поясничные мышцы и дорзальные мышцы позвоночника. (Слева) Аксиальный срез, Т1-ВИ с КУ: случай диссеминированного кокцидиомикоза с диффузным поражением костной и мягких тканей, распространением процесса в паравертебральные ткани и легкое.
(Справа) Сагиттальный срез, Т2-ВИ: пациенте кокцидиомикозом: массивные паравертебральные абсцессы. Дуральный мешок в спинномозговом канале деформирован за счет пора -жения межпозвонкового диска и тел позвонков.
в) Патологическая лучевая анатомия. Варианты инфекционного поражения позвоночника можно разделить на инфекцию межтелового пространства/остеомиелит позвонков, субдуральную эмпиему, менингит, интрамедуллярный абсцесс спинного мозга и септический артрит/поражение дугоотростчатых суставов. Инфекция межтелового пространства характеризуется типичной картиной снижения интенсивности сигнала в Т1 -режиме в области соответствующего межпозвонкового диска, распространяющейся на смежные замыкательные пластинки. Типичной характеристикой является неровность контура замыкательных пластинок. В Т2-режиме характерна гиперинтенсивность сигнала межпозвонкового диска, не повторяющая анатомию диска и распространяющаяся на смежные тела позвонков. При контрастировании наблюдается неравномерное усиление сигнала межпозвонкового диска и диффузное усиление, распространяющееся на пораженные тела позвонков.
Важным аспектом инфекционного поражения позвоночника является распространение процесса на паравертебральные ткани, признаки чего будут видны в режимах подавления сигнала жировой ткани, постконтрастныхЛ -ВИ, на которых мы ищем признаки контрастного усиления сигнала паравертебральных тканей и поясничных мышц, или Т2-ВИ, характеризующихся усилением Т2-сигнала соответствующих анатомических образований. В протоколе исследования важно описать не только уровень поражения, но также признаки нестабильности или изменения анатомии позвоночника, если таковые имеют место, признаки распространения инфекционного процесса на паравертебральные ткани, эпидуральное пространство и поясничные мышцы.
г) Эпидуральный абсцесс и менингит. Изолированные эпидуральные абсцессы могут возникать и в отсутствии сопутствующей инфекции межпозвонкового диска, а также могут быть связаны с постоянной катетеризацией эпидурального пространства или перенесенным стабилизирующим вмешательством на позвоночнике. Изредка эпидуральный абсцесс может быть следствием гематогенного заноса инфекции. Менингит обычно проявляется на постконтрастных Т1 -ВИ как линейное усиление сигнала вдоль мягкой мозговой оболочки спинного мозга или корешков конского хвоста. При грибковых инфекциях наблюдается узелковый характер усиления сигнала, что напоминает картину метастатического поражения. Субдуральная эмпиема позвоночника встречается редко и может развиваться при тяжелом течении инфекционного процесса межпозвонкового диска с его распространением на эпидуральное пространство. Эмпиема является результатом в первую очередь прямого распространения процесса через твердую мозговую оболочку в субдуральное пространство.
Интрамедуллярные абсцессы спинного мозга встречаются редко и могут возникать как вследствие гематогенного, так и прямого распространения инфекции. У взрослых более типичным механизмом является контактный путь, у детей-также контактный путь через функционирующий эпителиальный ход. Септический артрит/поражение дугоотростчатых суставов может развиваться как вследствие гематогенного, так и контактного распространения инфекции. Ранние стадии инфекционного поражения могут характеризоваться лишь некоторым усилением интенсивности Т2-сигнала субхондральных участков суставных отростков в сочетании с выпотом в полость суставов.
д) Особенности течения инфекционного процесса у взрослых и детей. В силу анатомических особенностей пути распространения инфекции у взрослых и детей отличаются друг от друга. У взрослых в первую очередь поражаются замыкательные пластинки, затем процесс распространяется на межпозвонковый диск, смежные участки тел позвонков, паравертебральные ткани и эпидуральное пространство. У детей через толщу ростковой зоны проходят сосуды, за счет которых первичный очаг инфекционного поражения развивается в межпозвонковом диске с последующим вторичным распространением в тело позвонка. Наиболее частой локализацией инфекции межпозвонкового диска является поясничный отдел позвоночника, за которым следует грудной и шейный отделы. Факторы риска развития инфекции многочисленны и включают возраст старше 50 лет, сахарный диабет, ревматоидный артрит, СПИД, прием глюкокортикоидов, инородные тела мочевыводящих путей, перенесенную травму позвоночника и параплегию. Наиболее распространенной этиологической причиной инфекции является Staphylococcus aureus.
У лиц, употребляющих внутривенные наркотики, возбудителем могут бактерии рода Pseudomonas. Для пациентов с серповидноклеточной анемией классикой считаются поражения, вызванные бактериями рода Salmonella, однако и у них наиболее распространенными остаются стафилококковые поражения.
е) Классификация. Классификация инфекционных поражений костей подразделяет эти поражения на четыре анатомических типа заболевания и три вида ответа организма-хозяина и включает, таким образом, 12 клинических стадий заболевания. Четыре анатомических типа: (1) ранний гематогенный или медуллярный остеомиелит, (2) поверхностный остеомиелит (контактное инфицирование), (3) локальная или полнослойная секвестрация и (4) диффузный остеомиелит. Классификация ответа организма: (А) нормальный физиологический ответ, (В) локальный или системный патологический ответ и (С) лечение остеомиелита будет более тяжелым, чем лечение собственно инфекции.
Классификация туберкулеза позвоночника Mehta (2001) подразделяет заболевания на четыре группы: (1) стабильное поражение передней колонны без кифотической деформации, при котором показан передний дебридмент и костная пластика опорным трансплантатом, (2) тотальное поражение с кифотической деформацией и нестабильностью, показана задняя стабилизация и передняя костная пластика опорным костным трансплантатом, (3) пациенты высокого риска трансторакальных вмешательств, которым показана задняя декомпрессия и стабилизация, (4) изолированные задние поражения, при которых показана задняя декомпрессия.
ж) Клинические вопросы. Инфекционные поражения позвоночника составляют 2-5% всех остеомиелитов. Наиболее распространенным симптомом является боль в спине. Болевой синдром прогрессирует, развиваясь постепенно, он становится постоянным, не уменьшаясь даже в состоянии покоя. Температурная реакция вариабельна и присутствует в
Интрамедуллярные абсцессы оканчиваются фатально в 8% случаев, более, чем у 70% этих пациентов остается стойкий неврологический дефицит. Более, чем у 90% пациентов отмечается повышение СОЭ. Также повышается и уровень С-реактивного белка. Бактериологическое исследование крови оказывается положительным у 25-60% пациентов с остеомиелитом позвоночника.
Показания к хирургической санации очага и спондилодезу при инфекционном поражении позвоночника включают необходимость забора материала для бактериологического исследования, дренирование абсцесса, сохраняющийся неврологический дефицит, деформацию и нестабильность позвоночника, и неэффективность консервативного лечения. Первой линий терапии при условии отсутствия острого или прогрессирующего неврологического дефицита остается продленная внутривенная антибактериальная терапия. Курс внутривенной терапии антибиотиками обычно продолжается 6 недель, по завершении антибактериальная терапия может быть продолжена перорально. Может быть показана наружная иммобилизация позвоночника. Рецидивы инфекции проявляются рецидивирующими эпизодами бактериемии, формированием паравертебральных абсцессов и хронических функционирующих свищей. Наиболее распространенным и благоприятным исходом консервативного лечения является формирование спонтанного костного блока пораженных позвонков.
(Слева) На схеме сагиттального среза показаны эпителиальный ход, соединяющий поверхность кожи с конусом спинного мозга, абсцесс конуса спинного мозга и распространенный отек спинного мозга.
(Справа) Сагиттальный срез, Т2-ВИ: пациент с абсцессом шейного отдела спинного мозга и стрептококковым эндокардитом отмечается диффузное расширение спинного мозга с формированием на уровне С4-С6 в его толще кольцевидной зоны низкоинтенсивного сигнала (капсула абсцесса). (Слева) Сагиттальный срез, Т1-ВИ с КУ и подавлением сигнала жировой ткани: распространенная субдуральная эмпиема с периферическим контрастным усилением сигнала на протяжении всего шейного отдела позвоночника и распространением вдоль поверхности ската.
(Справа) Случай септического артрита дугоотростчатого сустава. Аксиальный срез, Т1-ВИ с КУ на уровне L4-L5: распространение инфекционного процесса на правый дугоотростчатый сустав с диффузным усилением сигнала суставных отростков и поражением околосуставных мягких тканей. (Слева) Аксиальный срез Т1-ВИ с КУ: признаки прямого распространения инфекционного процесса (аневризма аорты на фоне грибкового поражения) от аорты в тело позвонка с формированием зоны деструкции и развитием спондилита. Инфекция также напрямую распространяется на поясничную мышцу.
(Справа) Аксиальный срез с КУ: признаки прямого распространения инфекционного процесса (аневризма аорты на фоне грибкового поражения) от аорты в тело позвонка и на левую поясничную мышцу.
з) Дифференциальный диагноз. Первичным методом диагностики эпидуральных абсцессов является МРТ, чувствительность которой в отношении диагностики инфекционного поражения эпидурального пространства аналогична КТ-миелографии, однако она в то же время позволяет исключить другую патологию, например, грыжу диска, кисту, опухоль и инфаркт спинного мозга. МР-картина эпидурального абсцесса включает мягкотканное образование эпидурального пространства с конусовидными краями, оттесняющее дуральный мешок и спинной мозг. В Т1 -режиме абсцесс характеризуется изоинтенсивностью сигнала, в Т2-режиме — усилением сигнала.
Для полноценного трактования наблюдаемых изменений как признаков эпидурального абсцесса необходимо исследование с контрастированием. Картина контрастного усиления при эпидуральном абсцессе включает: (1) диффузное и гомогенное усиление, (2) неоднородное усиление и (3) тонкий ободок периферического усиления сигнала. Контрастирование является очень полезным дополнительным инструментом исследования, позволяющим оценить протяженность поражения в случаях, когда стандартные режимы МР-томографии оказываются недостаточно информативными. Контрастное усиление сигнала свидетельствует об активности инфекционного процесса и позволяет рационально ограничить зону интереса для последующей игольной биопсии или хирургического вмешательства. Эффективное медикаментозное лечение должно приводить к прогрессирующему снижению выраженности контрастного усиления сигнала паравертебральных мягких тканей, дисков и тел позвонков. На ранних стадиях развития инфекционного процесса, когда межпозвонковые диски еще интактны, только с использованием МРТ инфекционный процесс сложно дифференцировать с опухолевым поражением, дегенеративными изменениями замыкательных пластинок I типа или компрессионным переломом.
Для окончательного определения природы наблюдаемых изменений необходимо исследование в динамике.
Boden et al. предположили, что признаком инфекции позвоночника в послеоперационном периоде будеттриада из контрастного усиления сигнала межпозвонкового диска, контрастного усиления сигнала фиброзного кольца и контрастного усиления сигнала костного мозга позвонков в сочетании с соответствующими лабораторными изменениями, например, увеличением СОЭ. Однако бывают пациенты с неосложненным течением послеоперационного периода и признаками контрастного усиления сигнала фиброзного кольца (в зоне вмешательства), межпозвонкового диска и замыкательных пластинок и без признаков инфекционного поражения. В послеоперационном периоде в норме контрастное усиление сигнала межпозвонкового диска обычно определяется в виде тонких полос, параллельных смежным замыкательным пластинкам, а усиление сигнала костного мозга тел позвонков связано с дегенеративными изменениями замыкательных пластинок I типа.
Подобную МР-картину следует отличать от аморфного усиления сигнала межпозвонкового диска при инфекционном поражении.
и) Список использованной литературы:
1. Duarte RM et al: Spinal infection: state of the art and management algorithm. Eur Spine J. 22(12):2787-99, 2013
2. Malghem J et al: Necrotizing fasciitis: Contribution and limitations of diagnostic imaging. Joint Bone Spine. 80(2): 146-54, 2013
3. Go JL et al: Spine infections. Neuroimaging Clin N Am. 22(4):755-72, 2012
4. DeSanto J et al: Spine infection/inflammation. Radiol Clin North Am. 49(1):105-27,2011
5. Celik AD et al: Spondylodiscitis due to an emergent fungal pathogen: Blastoschizomyces capitatus, a case report and review of the literature. Rheumatol Int. 29(10):1237-41,2009
6. Hong SH et al: MR imaging assessment of the spine: infection or an imitation? Radiographics. 29(2):599-612, 2009
7. Karikari IO et al: Management of a spontaneous spinal epidural abscess: a single-center 10-year experience. Neurosurgery. 65(5):919-23; discussion 923-4, 2009
8. Mylona E et al: Pyogenic vertebral osteomyelitis: a systematic review of clinical characteristics. Semin Arthritis Rheum. 39(1): 10-7, 2009
9. Petruzzi N et al: Recent trends in soft-tissue infection imaging. Semin Nucl Med. 39(2): 115-23, 2009
10. Posacioglu H et al: Rupture of a nonaneurysmal abdominal aorta due to spondylitis. Tex Heart Inst J. 36(1):65-8, 2009
11. Sobottke R et al: Treatment of spondylodiscitis in human immunodeficiency virus-infected patients: a comparison of conservative and operative therapy. Spine (Phila Pa 1976). 34(13):E452-8, 2009
12. Thwaites G et al: British Infection Society guidelines for the diagnosis and treatment of tuberculosis of the central nervous system in adults and children. J Infect. 59(3):167-87, 2009
13. Dai LY et al: Anterior instrumentation for the treatment of pyogenic vertebral osteomyelitis of thoracic and lumbar spine. EurSpineJ. 17(8):1027-34, 2008
14. Mehta JS et al: Tuberculosis of the thoracic spine. A classification based on the selection of surgical strategies. J Bone Joint Surg Br. 83(6):859-63, 2001
15. Mader JT et al: Staging and staging application in osteomyelitis. Clin Infect Dis. 25(6):1303-9, 1997
16. Boden SD et al: Postoperative diskitis: distinguishing early MR imaging findings from normal postoperative disk space changes. Radiology. 184(3):765-71, 1992
8.3. ПУТИ РАСПРОСТРАНЕНИЯ ИНФЕКЦИИ
В зарубежной и отечественной литературе описано пять основных пу-тей проникновения возбудителей инфекции в организм плода (Анкирская А.С., 1985; Радзинский В. Е, 1992; Кира Е.Ф., 1996; Левицкая С. К., 1991):
1) восходящий (через шейку матки и оболочки плодного яйца);
2) трансплацентарный, или гематогенный (через плацентарный барьер к плоду);
3) нисходящий (из воспалительно измененных придатков матки, аппен-дикса);
4) интранатальный (при прохождении плода через инфицированные ро-довые пути матери);
Антенатально инфекционный агент попадает к плоду гематогенно (трансплацентарно) или через инфицированные околоплодные воды. Чаще при антенатальном заражении возбудители поступают в организм плода ге-матогенно. Вначале они с кровью матери поступают в плаценту, где возмож-но размножение возбудителя и последующее развитие воспалительного про-цесса (плацентита). Преодолев маточно-плацентарный барьер, возбудитель проникает к плоду и может привести к развитию генерализованной инфекции с поражением печени, легких, почек, головного мозга и других органов (Ан-кирская А.С., 1989; Айламазян Э.К., 1995; Есаулова Н.Е., 1996; Сидельникова В.М., 1996; Сидорова И.С., 1999; Михайлов А.В., Лаврова Д.Б., Коляченко Е.С., 2003). Следует отметить, что распространение возбудителей может происходить и по вартонову студню пуповины, чему способствует внесосу-дистый ток жидкости от плаценты к плоду (Mindel A., 1995).
Околоплодные воды могут быть инфицированы восходящим (из влага-лища) и нисходящим (из маточных труб) путём, а также самим плодом, ин-фицированным гематогенно и выделяющим возбудителя с калом и мочой с последующим инфицированием околоплодных вод. При синдроме инфици-рования амниона может произойти преждевременный разрыв околоплодных оболочек с последующим развитием эндометрита, инфекционных осложне-ний новорожденного (Анкирская А.С., 1985). Учитывая ведущую роль трансплацентарного (гематогенного) инфицирования при антенатальной ВУИ, важно отметить, что состояние барьерной функции плаценты в значи-тельной мере определяет возможность развития инфекции и количество по-павшего к плоду инфекционного агента. Известно, что фетоплацентарная не-достаточность резко увеличивает риск развития генерализованной ВУИ при наличии хронического очага или остром заболевании у беременной.
Гематогенный путь передачи инфекции характерен для цитомегалови-русной, энтеровирусной инфекции, вируса простого герпеса, ветряной оспы, а также наблюдается при листериозе, микоплазмозе, некоторой бактериаль-ной инфекции и приводит к тяжёлым диссеминированным поражениям фе-топлацентарной системы, жизненно важных органов плода (мозга, печени, лёгких) (Девис П. А., 1987; Лозовская Л. С., 1995; Самохин П. А., 1987; Си-макова М. Г., 1995).
Восходящий путь инфицирования характерен для условно - патогенной микрофлоры, грибковой инфекции, а также наблюдается при хламидиозе, микоплазмозе, листериозе, других инфекциях. При восходящем пути инфи-цирования микроорганизмы проникают через плодные оболочки в около-плодные воды, где происходит размножение возбудителя. При этом плод оказывается в инфицированной среде. Заражение внутренних полостей плода происходит при заглатывании и аспирации инфицированных вод (Гуртовой Б. Л., Анкирская А. С., 1994; Цинзерлинг А. В., 1986).
Нисходящий путь инфицирования менее характерен для ВУИ, хотя его риск высок при персистенции возбудителей в эндометрии и маточных трубах (хламидии, микоплазмы, уреаплазмы) (Радзинский В. Е., 1996; Тареева Т. Г., 1994).
Интранатальный путь инфицирования (заражение плода во время родов путём аспирации или заглатывания содержимого родовых путей матери) наиболее характерен для бактериальной инфекции (стрептококк группы В, E.сoli, стафиллококк, Proteus, клебсиелла, анаэробная флора), но возможен и для вирусной (ВПГ, ЦМВ) инфекции, грибов рода Кандида. Причем передача инфекции возможна как при наличии симптомов поражения в области шейки матки и вульвы, так и при бессимптомном выделении возбудителя (Адаске-вич В. П., 1996; Барашнев Ю. И., 1994; Кудашев Н. И., 1991; Carmack M. A., 1993).
Таким образом, при наличии у беременной урогенитальной инфекции внутриутробное инфицирование плода и новорожденного может произойти любым из вышеперечисленных путей.
«. В андрологии встречаются такие ненормальные явления, которые, будучи часто признаваемы за маловажные страдания, влекут за собой тяжелые, а иногда и гибельные последствия. Эти маловажные по внешности и многозначащие по существу
В настоящее время оказание специализированной помощи детям мужского пола, а также кардинальное изменение подхода к профилактике репродуктивной недостаточности представляют собой едва ли не самые актуальные проблемы в практике педиатрической медицинской науки.
Многие нарушения репродуктивной функции корнями уходят в детство, что и послужило одним из главных аргументов в пользу выделения детских разделов науки о поле — детской гинекологии и детской урологии-андрологии.
Детская и подростковая андрология — отрасль медицины, рассматривающая вопросы эмбриогенеза, клинической анатомии, морфологии, физиологии и патологии репродуктивной системы, половых органов и функционально связанных с ней органов и систем в процессе их онтогенетического развития с момента формирования зиготы и до наступления репродуктивного периода онтогенеза, а также способы и методы профилактики, диагностики и лечения анатомических и функциональных расстройств, включая социальную и репродуктивную реабилитацию.
Наиболее распространенные причины мужского бесплодия: крипторхизм, варикоцеле, эпидидимит (Б. Джарбусынов, 1991; 1992) — устранимы. Лишь некоторые секреторные (орхит) и экскреторные (аплазия яичек или семявыносящих путей) нарушения неизлечимы или прогноз их лечения крайне сомнителен, но они составляют абсолютное меньшинство среди причин бесплодия. Вместе с тем наш опыт показывает, что при качественном, своевременном и полном устранении факторов патогенеза, в частности при орхите, удается в значительной мере восстановить репродуктивную функцию.
В связи с этим особенно важное значение в решении проблемы мужского бесплодия приобретает разработка способов ранней диагностики и профилактики этих нарушений.
В России сложился стереотип, согласно которому заболевания ОРС считаются хирургической патологией, а это, в свою очередь, привело к тому, что огромное число больных, не имеющих по тем или иным причинам показаний к оперативному вмешательству, не получают сегодня адекватной врачебной помощи.
До выделения детской урологии-андрологии в самостоятельную область знания носители заболеваний, представляющих собой факторы риска репродуктивных расстройств, находились в точке пересечения профессиональных интересов детских хирургов, урологов, эндокринологов, сексологов, психологов, психиатров, дерматовенерологов и ряда других смежных специалистов. Тактика лечения таких заболеваний, как крипторхизм, левостороннее варикоцеле, кисты придатков яичек, воспалительные заболевания яичек и/или придатков яичек, заболевания крайней плоти, задержка полового развития, у врачей-специалистов часто диаметрально противоположна. Разнообразие клинических форм иногда не укладывается в принятые классификации, что затрудняет подчас определение способа лечения.
В отношении синдрома отечной и гиперемированной мошонки педиатры, напротив, занимают выжидательную позицию, избирая симптоматическую, стратегически не выверенную терапию. Чаще всего врачи, назначающие препараты в разных сочетаниях, не учитывают всех факторов патогенеза и морфогенеза воспаления — в этом случае терапия оказывается не направлена на ликвидацию отдаленных последствий воспалительной реакции.
В отношении воспалительных заболеваний крайней плоти и головки полового члена, представляющих собой статистически достаточно значимую группу (от 17 до 22%), также не разработано единого стратегического подхода к лечению. Способы купирования воспаления варьируют довольно широко — от парентерального применения антибиотиков до изматывающих пациента и приводящих к формированию в отдаленном периоде рубцовых осложнений ванночек с КМnO4.
Это объясняется отсутствием единой классификации заболеваний воспалительного генеза. Именно появление новой отрасли медицинского знания позволяет объединить и структурировать опыт поколений врачей различных клинических школ и специальностей, а значит, и добиться оптимизации конечного результата лечения.
Чаще всего у детей регистрируются проявления синехий крайней плоти. Распространенное мнение о том, что это состояние должно устраняться до года, в раннем детском возрасте, или — другая крайность — не требует лечения вовсе, в 2004 г. также были опровергнуты (С. С. Садчиков, Д. И. Тарусин). Было показано, что после 6 лет сохранение синехиальных спаек неизбежно ведет к хроническому воспалению препуция и формированию рубцовых изменений в нем. Не останавливаясь на специфических профилактических мероприятиях, коснемся лишь проявлений активной воспалительной альтерации в области препуциального мешка и головки полового члена.
Из воспалительных заболеваний ОРС вторым по распространенности является воспаление яичка и его придатка. Орхиты, наблюдаемые у детей и подростков, бывают острыми и хроническими. Механизм инфицирования при острых орхитах, как правило, гематогенный или каналикулярный. Гематогенный путь инфицирования может развиться при любом очаге местной инфекции, септикопиемии либо как осложнение инфекционных заболеваний, в частности бруцеллеза, эпидемического паротита и др. Изредка встречаются идиопатические орхиты, когда возбудитель или причина возникновения воспаления не может быть установлена современными средствами диагностики. У детей следует также иметь в виду вероятность возникновения травматического орхита. При каналикулярном распространении инфекция проникает в различные участки мочеотводящей и семявыносящей системы, как правило, путем ретроградного заброса инфицированной мочи в устья семявыбрасывающих протоков при недостаточности их клапанного аппарата и эктопии устьев.
Острые орхиты могут возникать при нарушениях кровообращения в яичке и травмах. На раннем этапе травматические и конгестивные орхиты являются асептическими, но в дальнейшем создаются условия для присоединения вторичной инфекции. Опасность присоединения инфекции и соответственно риск развития трансформации асептического орхита в септическое поражение паренхимы яичка возникают у подростков — носителей инфекций, передающихся половым путем (ИППП), или с хроническим воспалением мочевой системы в виде инфекции нижних мочевыводящих путей.
Яичко при остром орхите обычно увеличивается, не утрачивая обычной формы, и становиться болезненным. Это общий признак для орхитов любой этиологии.
Хронические орхиты могут быть первичными и вторичными. Вторичный орхит является непосредственным продолжением острого неспецифического и характеризуется в основном прогрессирующим фиброзом. Если поражено одно яичко, то в совокупности ни сперматогенез, ни гормоногенез значительно не страдают. Двустороннее поражение у детей влечет за собой расстройство как генеративной, так и эндокринной функций.
Первичные хронические орхиты у детей не наблюдаются.
Нужно подчеркнуть, что нозологическая принадлежность орхита не всегда обусловливает один и тот же характер воспалительных изменений. Острые орхиты, как правило, проходят бесследно, но возможны и такие исходы, как нагноение (крайне редко) и фиброз. Не исключено распространение инфекционного процесса по ходу семенного канатика с поражением клетчатки таза (пельвита), фуникулита, вагинита, перитонита и др. К осложнениям этого заболевания относятся и орхоэпидидимиты, возникающие в результате каналикулярного распространения инфекционного агента в паренхиму придатка яичка.
Основными заболеваниями придатка яичка как у детей и подростков, так и у взрослых считаются воспалительные процессы — эпидидимиты и эпидидимоорхиты. В последние годы с повсеместным внедрением ультразвукового исследования на аппаратах высокого разрешения стали чаще появляться упоминания о кистах придатка яичка (истинные кисты, сперматоцеле). Однако помимо острых заболеваний и кистозных образований, существуют еще и пороки развития органа, аномалии расположения, фиксации, кровоснабжения и т. д. Наши исследования органов мошонки у более чем 3000 детей и подростков в возрасте от 0 до 18 лет показывают, что на самом деле доля патологии придатка яичка значительно выше, чем принято считать на основании официально приводимых данных.
Острый эпидидимит — клинический синдром, включающий боль, отек, гиперемию области соответствующей половины мошонки вследствие воспаления придатка яичка. Его следует дифференцировать с хроническим эпидидимитом, при котором боль в придатке и в самом яичке сохраняется долго, но отек обычно не развивается.
До недавнего времени считалось, что большинство случаев заболевания у молодых пациентов носят абактериальный характер и возникают в результате рефлюкса стерильной мочи в семявыносящий проток во время форсированного выдавливания мочи через закрытый наружный сфинктер уретры. Graves и Engel (1950) даже смоделировали данное состояние на собаках, подтвердив эту теорию. Однако впоследствии многократно было продемонстрировано, что при рефлюксе стерильной мочи ни пиурия, ни уретрит развиваться не могут, вместе с тем данные симптомы присутствуют у большинства молодых пациентов с эпидидимитом.
В литературе нам не удалось найти однозначный ответ на вопрос о том, у какой части детей и подростков при воспалении придатка яичка имеют место проявления сочетанного воспаления собственно мочевых путей.
Причинными агентами развития эпидидимита у детей (как правило, при наличии обструкции мочевых путей) являются общие мочевые патогены, среди которых доминируют энтеробактерии. У подростков старше 15 лет эпидидимит может быть связан с ИППП (чаще Chlamydia trachomatis и Neisseria gonorrhoeae), вызывающими развитие уретритов.
Описаны случаи развития истинного неинфекционного эпидидимита при лечении аритмии амиодароном. Причем часть наблюдений относится к подросткам старшего возраста, получающим длительную антиаритмическую терапию. Заболевание связано с селективным накоплением препарата в придатке яичка. В настоящее время нельзя говорить о том, что антиаритмики являются единственными фармакологическими агентами, раздражающими придаток яичка. Это заболевание не поддается лечению антибиотиками, не связано с воспалением уретры или мочевого пузыря, в него вовлекается только головка придатка яичка; заболевание регрессирует с уменьшением дозы амиодарона.
Классификация хронического эпидидимита (J. Nickel, 2002) выделяет три формы заболевания: воспалительный, обструктивный, болевой (эпидидимоалгия). Все три вида эпидидимита могут иметь место у детей и подростков. Так, альтеративный генез заболевания является наиболее распространенным у детей и юношей. Обструкция часто возникает при выполнении операций Бергманна и Винкельманна, в результате чего формируется клиническая картина хронического обструктивного эпидидимита. Суть патоморфоза заключается в формировании кистозных трансформаций в теле придатка яичка. Идиопатическая эпидидимоалгия, как правило, оказывается связана с кистозными трансформациями привесков придатка яичка.
Лечение острого эпидидимита включает назначение антибактериальных препаратов широкого спектра действия до получения результатов культурального исследования и определения чувствительности микрофлоры к антибиотикам, после чего лечение может быть скорректировано.
У детей, как правило, оказывается достаточно 7–10-дневного курса, но у подростков, компрометированных по ИППП, при присоединении дополнительной кокковой или палочковой флоры, эпидидимиты оказываются резистентными к краткосрочной монотерапии антибиотиками. Лечение эпидидимита предлагается проводить с учетом возраста больных и полового статуса. Если возраст пациента не предполагает или исключает проявления гетеросексуальной или иной половой активности (до 10–11 лет), необходимости в исследовании на носительство ИППП не возникает. В этом случае достаточно монотерапии с применением макролидов последнего поколения (кларитромицин — клабакс, клеримед, клацид; азитромицин — азитрокс, азитрал, сумамед; джозамицин — вильпрафен). Если пациент старше 15 лет и у него имеется уретрит и предполагается наличие ИППП, предпочтительнее использовать препараты цефалоспоринового ряда в сочетании с фторхинолонами.
Особое внимание при выявлении воспалительных поражений органов мошонки необходимо уделять двум факторам: обязательному выяснению статуса пациента в отношении с партнером (для подростков) и факту использования презервативов при половых контактах. Современные данные показывают, что соотношение защищенный/незащищенный секс при половом контакте составляет для российских подростков 3/1. Не менее важным является мотивация пациента подросткового возраста на исследование крови на антитела к ВИЧ-инфекции, с соответствующим дотестовым консультированием. Важно мотивировать подростка и на исследование его партнера на предмет носительства ИППП, а при ее выявлении — на ВИЧ-инфекцию.
Ограничение двигательной активности пациента позволяет предупредить механический фактор дессиминации инфекции за пределы придатка яичка или восходящим путем по ходу семенного канатика. Пациенту назначают постельный режим и иммобилизацию мошонки, что улучшает лимфоотток и снимает ощущение давления. В силу выраженности болевого синдрома лечение включает регулярное применение нестероидных противовоспалительных средств (ибупрофен, индометацин, диклофенак, нимесулид).
Вместе с тем нами было доказано, что при наличии синдрома острой и гиперемированной мошонки у детей младшей возрастной группы целесообразно купировать воспаление и отек в максимально короткие сроки. Доказано, что возникающая в результате отека компрессия тестикулярной ткани в достаточно ригидной белочной оболочке яичка является фактором развития ишемии. Яичко представляет собой орган, крайне чувствительный к ишемизации даже в течение очень короткого промежутка времени. Так, доказано, что при полной блокаде тестикулярного кровотока, продолжающейся более 5 ч, изменения сперматогенного эпителия и базальной мембраны характеризуются как критичные и необратимые. Даже после купирования ишемии неизбежно наступает гиалиноз мембран извитых семенных канальцев.
Особое внимание нужно обратить на факторы патогенеза, которые вступают в действие уже после того, как воспаление было купировано. В основе формирования гистологической картины тестикулярной атрофии лежит избыточное развитие соединительной ткани интерстиция — гиперпродукции коллагена. Фактором, инициирующим пуск процесса гиперпродукции, является перекисное окисление липидов. Предусмотрев в терапевтическом плане ингибиторы коллагена (например, высокие дозы витамина С) и антиоксиданты (аевит, ксидифон), мы достигаем нивелирования отсроченных по времени патоморфозов тестикулярной ткани, которые в конечном счете и проводят к выключению тестикула из процессов герминативной активности.
Литература
- Abdul Gaffoor P. M. Gonococcal tysonitis//Postgrad Med J. 1986. Sep; 62(731): 869–870; 110.
- Albertini J. G., Holck D. E., Farley M. F. Zoon’s balanitis treated with Erbium: YAG laser ablation//Lasers Surg Med. 2002; 30(2): 123–126; 21.
- Bargman H. Pseudoepitheliomatous, keratotic, and micaceous balanitis//Cutis. 1985. Jan; 35(1): 77–79; 121.
- Datta C., Dutta S. K., Chaudhuri A. Histopathological and immunological studies in a cohort of balanitis xerotica obliterans//Indian Med Assoc. 1993. Jun; 91(6): 146–148; 71.
- Delavierre D. Ann Urol (Paris) 2003; 37 (6): 322–338.
- Furuya R., Takahashi S., Furuya S. et al.//J Urol. 2004; 171 (4): 1550–1553.
- Schlossberg D. (ed). Current Therapy of Infectious Diseases. (Deck A. J., Shapiro R. H., Berger R. E. Epididymo-orchitis). St. Louis, Mosby, 2000; 217–219.
- Kalamkarian A. A., Mandel’ Ash, Getling Z. M. The morphological changes in the skin of the prepuce in patients with xerotic balanoposthitis//Vestn Dermatol Venerol. 1990; (4): 4–8; 91.
- Nickel J. C., Siemens D. R., Nickel K. R., Downey J. J Urol. 2002; 167 (4): 1701–1704.
- Walsh P. C. (ed). Campbell’s Urology. 8th Edition. Saunders, Philadelphia. 2002; 1.
М. Г. Омаров, кандидат медицинских наук
Д. И. Тарусин, доктор медицинских наук
А. Г. Румянцев
С. А. Горкин
НПЦ детской андрологии, Москва
Саркоидоз. Туберкулез. Признаки туберкулеза легких.
При саркоидозе легкие, как правило, вовлекаются в патологический процесс в виде слабо выраженного альвеолита, гранулематоза и фиброза легочной ткани. При саркоидозе могут возникать мозаичные стенозы бронхов (в тех случаях, когда гранулемы расположены в стенках бронхов), очаговые ателектазы, зоны иррегулярной эмфиземы, очаги обызвествления в гранулемах, участки пневмосклероза и фибринозного плеврита. Иногда в центре гранулем можно определить фибриноидное набухание и коагуляционный, но не казеозный некроз.
Туберкулез. Признаки туберкулеза легких.
При диагностике туберкулеза важное значение имеет цитологическое исследование мокроты или бронхиального секрета, при котором цитобактериоскопически можно обнаружить кислотоустойчивые микобактерии.
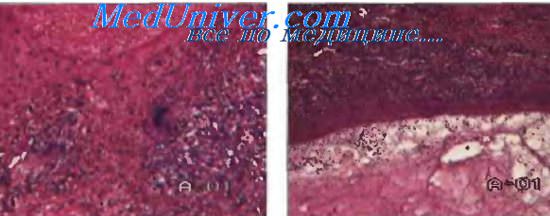
Морфологической основой туберкулеза является туберкулезная гранулема (узелок, бугорок), в центре которой очаг казеозного некроза, окруженный эпителиоидными клетками, гигантскими многоядерными клетками Пирогова-Лангханса, лимфоцитами, плазматическими клетками, макрофагами.
При затухании первичного туберкулеза на месте первичного очага возникает петрифицированный, а в дальнейшем оссифициронный очаг Гона.
Генерализация процесса может происходить гематогенным или лимфогенным путем, за счет роста первичного очага с возникновением лобарной казеозной пневмонии и/или первичной легочной каверны; принимая хроническое течение, развивается первичная легочная чахотка с наличием казеозного бронхаденита, что отличает ее от вторичного фиброзно-кавернозного туберкулеза.
У ослабленных больных может возникнуть смешанная форма прогрессирования - одновременный рост первичного очага, казеозныи бронхаденит и многочисленные туберкулезные отсевы в других органах. При длительной стероидной терапии возникает лекарственный туберкулез как проявление эндогенной инфекции. Хроническое течение первичного туберкулеза характеризуется чередованием вспышек и затиханий с поражением лимфоузлов (аденогенная форма). При гематогенном (послепервичном) туберкулезе выделяют три разновидности генерализованный гематогенный; гематогенный туберкулез с преимущественным поражением легких; гематогенный с преимущественно внелегочным поражением. При второй форме гематогенного туберкулеза развивается острый или хронический милиарный туберкулез (или гематогенно-диссеминированный туберкулез легких), который встречается только у взрослых.
Для такого туберкулеза характерны кортикоплевральные очаги в легких, продуктивная тканевая реакция, пневмосклероз, эмфизема, легочное сердце и внелегочный очаг туберкулеза.
Вторичный (рвинфекционный) туберкулез возникает у взрослых, перенесший первичный. Для такого туберкулеза характерны легочная локализация, контактное и каналикулярное (по бронхиальному дереву) распространение, смена клиникоморфологических форм, которые одновременно являются фазами туберкулеза. Выделяют восемь форм вторичного туберкулеза: очаговый, фиброзно-очаговый, инфильтративный, туберкулома, казеозная пневмония, острый кавернозный, фибозно-кавернозныи цирротический. При остром очаговом туберкулезе в 1-2-м сегментах, как правило, правого легкого обнаруживают один или два очага реинфекта Абрикосова. Начальные явления вторичного туберкулеза представлены специфическим зндо-, мезо- и панбронхитом внутридолькового бронха с лобулярной творожистой бронхопневмонией с образованием по периферии зпителиоидноклеточных гранулем.
При своевременном лечении эти очаги инкапсулируются и петрифицируются, оссификации их никогда не происходит. Такие очаги реинфекта называют очагами Ашоффа-Пуля. При новой вспышке инфекции вокруг этих очагов возникает казеозная пневмония, которая впоследствии инкапсулируется, не выходя за пределы 1-2-го сегментов. Эта фаза носит название фиброзно-очагового туберкулеза. Инфильтративный туберкулез развивается при прогрессировании острого очагового или обострении фиброзно-очагового. При этом экссудация может выходить за пределы дольки и даже сегмента. При захвате дольки следует говорить о лобите. Перифокальное воспаление преобладает над казеозными изменениями.
Туберкулома - своеобразная форма эволюции инфильтративного туберкулеза (очаг творожистого некроза в капсуле диаметром 2-5 см) в 1 -2-м сегментах, чаще правого легкого. Туберкулому следует прежде всего дифференцировать с периферическим раком легкого.
Казеозная пневмония возникает при прогрессировании инфильтративного или в терминальный период любой другой формы туберкулеза, при этом некроз преобладает над перифокальными изменениями. Распространенность - от ацинозного оча-I га до захвата всей доли.
Острый кавернозный туберкулез характеризуется быстрым образованием полости распада и каверны на месте инфильтрата или туберкуломы. Появление каверны чревато бронхогенным обсеменением легких. Каверны в 1 -2-м сегментах обычно овальной или округлой формы.
Фиброзно-кавернозный туберкулез (хроническая легочная чахотка) возникает в тех случаях, когда кавернозный туберкулез принимает хроническое течение. Процесс чаще выражен в одном правом легком и постепенно спускается в нижние отделы контактным путем или интраканаликулярно и может переходить на другое легкое. Более старые изменения локализуются в верхних отделах, а очаги казеозной пневмонии - в нижних.
Цирротический туберкулез - вариант фиброзно-кавернозного с разрастанием фиброзной ткани вокруг каверн. На местах заживших каверн остаются линейные рубцы, возникает деформация легочной ткани, развиваются плевральные спайки и очаг гиалиноза. Появляются многочисленные бронхоэктазы.
Осложнения туберкулеза многочисленны. При первичном часто развивается менингит, плеврит, перикардит, перитонит. При вторичном характерно развитие кровотечения из каверн, прорыв их содержимого в плевральную полость с развитием пневмоторакса и эмпиемы плевры.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Источники инфекций. Распространение инфекционных болезней
Источники инфекции. Инфекционный процесс может быть вызван как представителями нормальной микрофлоры организма хозяина (эндогенные инфекции), так и микроорганизмами извне (экзогенные инфекции).
Условно-патогенные бактерии нормальной микрофлоры кишечника становятся источниками инфекции только при определённых условиях (например, при перфорации кишечника). Энтеробактерии и неспорообразующие анаэробы (например, Bacteroides fragilis) вызывают внутрибрюшинные абсцессы. При попадании в лёгкие содержимого желудочного и ротоглотки, в котором присутствуют представители нормальной микрофлоры (факультативные и облигатные анаэробы), развивается пневмония или абсцесс лёгкого.
Обитающий на слизистой оболочке передних отделов носовых ходов Staphylococcus aureus может вызвать раневую инфекцию после хирургического вмешательства. Нейтропенический сепсис (бактериемия) возникает, когда бактериям удаётся преодолеть внутренние защитные механизмы слизистой оболочки кишечника или при снижении функции нейтрофилов во время химиотерапевтического лечения лейкемии. Различные изменения в организме хозяина повышают риск развития заболеваний: хирургическое вмешательство и катетеризация сосудов способствуют развитию инфекций, вызываемых представителями нормальной микрофлоры; применение иммунодепрессантов увеличивает риск возникновения оппортунистических инфекций, вызываемых возбудителями с низкой вирулентностью.
Источником экзогенных инфекций могут стать различные животные (зоонозныс инфекции). В этом случае заражение происходит контактно-бытовым и пищевым путями. Кроме того, инфекции могут быть вызваны микроорганизмами, обитающими в окружающей среде (например, Legionella или Clostridium).
Изменение условий окружающей среды ведёт к выраженному повышению риска заражения. Так, распространению зоонозных инфекций способствовало активное развитие сельского хозяйства и земледелия. Например, скармливание крупному рогатому скоту белков животного происхождения привело к возникновению эпидемии губчатой энцефалопатии, которая затем распространилась среди людей (вариантная болезнь Крейцфельдта—Якоба).
Развитие птицеводства способствовало распространению сальмонеллёза (факторы передачи — пух и перо домашней птицы), а механизация пищевой промышленности — повышению риска перекрёстной контаминации. Избежать подобных проблем позволяет совершенствование методов ведения сельского хозяйства и соблюдение санитарно-гигиенических норм.
Недостаточный контроль систем вентиляции в зданиях приводит к возникновению заболеваний, вызываемых Legionella pneumophila.
Сложный жизненный цикл некоторых микроорганизмов помогает им выжить в неблагоприятных условиях и способствует их распространению. Например, возбудители, выделяющиеся из организма хозяина с экскрементами, как правило, передаются посредством фекально-орального механизма. Многие возбудители часть своего жизненного цикла проводят в организме переносчика, и в этом случае заражение происходит во время укуса. Иногда в качестве промежуточного хозяина паразиты могут использовать не животных, а человека (например, при эхинококкозе).

Выживание и распространение возбудителей инфекций
Каждый микроорганизм по-своему приспосабливается к условиям окружающей среды. Так, бактерии способны долгое время выживать в неблагоприятных условиях в виде спор — покоящихся клеток со сниженным метаболизмом, снабжённых твёрдой многослойной оболочкой. Яйца гельминтов также снабжены твёрдой оболочкой, помогающей им выживать в окружающей среде. Распространению возбудителей способствует их длительное персистирование в организме хозяина, который в этом случае становится резервуаром инфекции.
Микроорганизмы, выделяющиеся в окружающую среду при чихании, могут долгое время находиться в воздухе в составе микроскопических капель (5 мкм). Инфекционный процесс возникает при их попадании в лёгкие здорового человека (воздушно-капельный путь передачи). Этим способом происходит распространение как возбудителей респираторных заболеваний (вирусы гриппа и др.), так и микроорганизмов, поражающих другие органы (например, Neisseria meningitides).
Возбудителей желудочно-кишечных расстройств (Salmonella) можно обнаружить в воде и пище (алиментарный путь передачи). Такое распространение инфекции наблюдают при токсоплазмозе и цистицеркозе, поражающих различные органы.
Через неповреждённый кожный покров проникают Leptospira, Treponema и Schistosoma. Передача ВИЧ происходит во время инъекций и переливаний крови (при нарушении кожного барьера). Представители нормальной микрофлоры кожного покрова (Staphylococcus epidermidis) могут проникать в организм через венозный катетер. Переносчиками некоторых инфекций служат насекомые, питающиеся кровью (например, малярию переносят самки комара рода Anopheles).
При половом контакте происходит передача микроорганизмов, не способных к жизни вне организма человека (например, Neisseria gonorrhoeae или Treponema pallidum). При этом заражению способствуют изъязвления слизистой оболочки половых органов.
Факторы распространения инфекций
Улучшение социальной обстановки и условий окружающей среды способствует снижению риска заражения и распространения инфекционных болезней. Например, соблюдение санитарно-гигиенических норм ведёт к уменьшению риска возникновения диареи, а улучшение жилищных условий препятствует распространению туберкулёза. Кроме того, полноценное питание уменьшает восприимчивость человека к инфекционным заболеваниям.
Однако как ни парадоксально, с увеличением уровня жизни возрастает и смертность от некоторых инфекционных заболеваний. Тяжесть осложнений инфекционного процесса прямо пропорциональна возрасту пациента, например при паралитическом полиомиелите или ветряной оспе.
Просвещение населения и распространение инфекций. Существует большое количество программ медицинского просвещения населения, охватывающих такие проблемы, как половое воспитание, рекомендации для беременных, соблюдение правил личной гигиены (гигиенические нормы при приёме пищи, рекомендации для путешественников и др.), использование одноразовых игл и шприцев.
Безопасность пищевых продуктов и распространение инфекций. В Европейском союзе существуют общепринятые стандарты безопасности пищевых продуктов. Контроль за их соблюдением осуществляют специалисты по вопросам гигиены окружающей среды, а также представители Министерства окружающей среды, продовольствия и сельского хозяйства. Пастеризация молока помогает снизить риск возникновения заболеваний, вызываемых Mycobacterium bovis и бактериями рода Campylobacter.
Борьба с переносчиками инфекций. Борьбе с переносчиками инфекций придают огромное значение в регионах, где промежуточными хозяевами возбудителей могут быть насекомые. Лица, посещающие тропические страны, могут существенно снизить риск развития заболевания, приняв меры, предотвращающие нападение и укусы насекомых. Попытки контролировать популяции насекомых с помощью инсектицидов могут быть неудачными вследствие наличия резистентности к этим препаратам.
Профилактика инфекционных заболеваний
Для профилактики некоторых заболеваний (например, дифтерия, менингококковая инфекция) применяют лекарственные препараты. Цель — уничтожение возбудителей заболевания в организме носителя для предупреждения развития острого состояния или распространения инфекции.
Например, для профилактики менингококковой инфекции применяют рифампицин или ципрофлоксацин, приём изониазида рекомендован пациентам с риском обострения туберкулёза при снижении иммунитета.
Значение эпидемиологии в распространении инфекций
Значение организации здравоохранения в распространении инфекционных заболеваний
В большинстве стран существует департамент здравоохранения, занимающийся изучением, профилактикой и лечением инфекционных заболеваний. Обязанности департамента:
• контроль за инфекционной заболеваемостью;
• эпидемиологическое обследование в очаге инфекционного заболевания;
• контроль за вакцинопрофилактикой;
• научные эпидемиологические исследования и обучение медицинского персонала.
Для предотвращения вспышек зоонозных инфекционных заболеваний необходимо тесное сотрудничество между учреждениями (министерствами) пищевой и сельскохозяйственной промышленности и органами санитарно-эпидемиологического надзора. В некоторых странах функции всех этих организаций выполняет одна из них, например Департамент здравоохранения в Великобритании и СДС — Центр по контролю и предупреждению распространения заболеваний — в США. Кроме того, в ведении этих организаций находится решение проблемы биологического терроризма. При этом особую важность приобретает быстрое определение вида возбудителя и своевременное оповещение населения о применении биологического оружия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Вернуться в раздел "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

