Кератит при цитомегаловирусе лечение
Обновлено: 18.04.2024
Кератиты занимают весомое место в структуре глазной заболеваемости детей раннего возраста. В современных условиях на первое место в этиологии воспалительных заболеваний глаз выходят вирусы, активность которых проявляется при снижении иммунитета. По данным офтальмологического отделения ДРКБ Республики Татарстан, в этиологической структуре кератитов у детей 35,7% составляют кератиты вирусной этиологии (в их числе 25,0% – герпетические кератиты, 10,7% – кератиты ЦМВИ-этиологии).
Следует отметить, что клиническая картина герпетических кератитов хорошо изучена на современном этапе и описана практически во всех руководствах по офтальмологии. Что касается кератитов ЦМВИ-этиологии, сведения о них практически отсутствуют в офтальмологической литературе.
Возбудителем ЦМВИ является вирус герпеса 5 типа [6]. Для цитомегаловируса характерны такие свойства, как медленная репродукция, сравнительно низкая вирулентность, слабая чувствительность к интерферонам, выраженная цитопатическая активность по отношению к поражаемым клеткам. С его биологическими особенностями связана способность к длительной персистенции в организме человека и реактивации при иммунодепрессивных состояниях.
Многочисленными исследованиями, проведёнными в разных странах мира, показано широкое распространение ЦМВ среди населения. Большинство взрослых людей (65-70 %) в течение жизни инфицируются этим вирусом, о чём свидетельствует наличие у них специфических сывороточных антител [5, 7-9].
Литературные данные свидетельствуют о том, что ЦМВИ характеризуется разнообразными клиническими проявлениями, среди которых отсутствуют патогномоничные для данной инфекции признаки [4].
Типичным для ЦМВИ-поражением глаз принято считать хориоретиниты. Клиника их хорошо изучена в настоящее время. Они встречаются преимущественно у ВИЧ-инфицированных пациентов и при классическом течении не требуют вирусологического подтверждения [1, 2].
В работе практического врача существуют трудности диагностики ЦМВИ-поражения переднего отрезка глаза, которые обусловлены своеобразием патогенеза данной патологии и отсутствием патогномоничной клиники.
Клиническое наблюдение. Ребёнок 3 лет. С декабря 2013 по декабрь 2014 гг. многократно находился на стационарном лечении в офтальмологическом отделении ДРКБ. При первой госпитализации был поражён только правый глаз, клиническая картина была достаточно типичной для аденовирусного кератита, в связи с чем ребёнок получал терапию, рекомендованную для данного заболевания (подробные сведения о локальном статусе, проведённых исследованиях и их результатах, схемах лечения представлены ниже в табл.).
Через месяц девочка была вновь госпитализирована. Признаки воспаления определены на двух глазах, причём на правом глазу картина напоминала метагерпетический кератит с округлым обширным инфильтратом в центре роговицы, слева – мелкоточечные инфильтраты по всей её поверхности. Процесс был расценен как герпетический, в связи с чем проведено лечение по соответствующей схеме. С клиническим улучшением ребёнок выписан из стационара. Однако через месяц вновь госпитализирован с ухудшением состояния и появлением кратерообразного изъязвления роговицы на правом глазу и глубокого округлого инфильтрата роговицы на левом глазу. На фоне активной противовирусной и противогерпетической терапии отмечалось волнообразное течение процесса без существенной положительной динамики. Ребёнок обследован инфекционистом, выявлена ЦМВИ с высокими титрами специфических антител классов IgM и IgG. Проведён курс противовирусной терапии с системным назначением иммуноглобулина человека антицитомегаловирусного и ганцикловира в течение 21 дня. После проведённой терапии активность процесса была купирована, титры антител к ЦМВИ снизились до субнормальных цифр.
Со стороны роговицы процесс завершился образованием грубого васкуляризированного помутнения в оптической зоне, в связи с чем через 2 месяца после достижения ремиссии ребёнок получил 5 субконъюнктивальных введений аллопланта для регенерации (с интервалом в 1 мес.) и 2 сеанса лазеркоагуляции новообразованных сосудов роговицы.
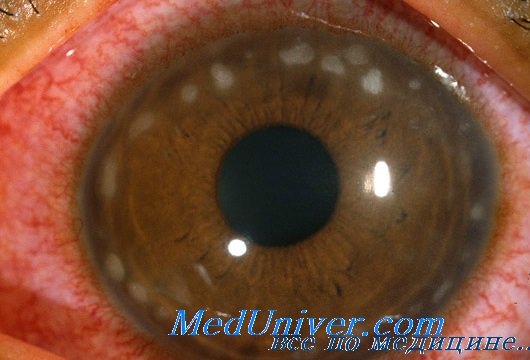
В настоящее время локальный статус следующий: visus OD – 0,04, с корр. sph+1,0=0,1; OS – 0,05, с корр. sph+1,0=0,1. Оба глаза спокойные, на роговицах обоих глаз в оптической зоне нежные полупрозрачные помутнения с единичными тонкими новообразованными сосудами. Глубжележащие отделы не изменены. Зрачки обоих глаз расширяются мидриатиками. Глазное дно без патологии.
Выводы. Приведённый клинический случай показал, что существуют определённые трудности диагностики и лечения кератитов ЦМВИ-этиологии у детей, которые обусловлены отсутствием характерной клинической картины, маскируются под проявления других кератитов вирусной этиологии. Лечение кератитов ЦМВИ-этиологии не приносит положительных результатов и требует системного назначения специфических антицитомегаловирусных иммуноглобуллинов в сочетании с ганцикловиром и коррекции иммунного статуса ребёнка.
Поражение глаз при цитомегаловирусной инфекции (ЦМВ)
Цитомегаловирус человека является членом семейства герпесвирусов, содержит ДНК, покрыт липидсодержащей оболочкой, размножается медленно внутриклеточно. При этом пораженные клетки увеличиваются в размерах и содержат крупные внутриядерные включения, что отразилось в названии вируса. От других герпесвирусов отличается сравнительно низкой вирулентностью, резким подавлением клеточного иммунитета, меньшей чувствительностью к аналогам нуклеозидов. Культивируется только в культуре человеческих фибробластов, давая цитопатический эффект лишь через 30—50 дней. Известно три его штамма: Davis, AD-169, Kerr.
Источником ЦМВ инфекции являются люди, зараженные цитоме-галовирусом, количество которых в возрасте после 50 лет составляет более 75-90%. Цитомегаловирус содержится в грудном молоке, слюне, крови, фекалиях, моче, семенной жидкости, в секрете шейки матки. Заражение происходит внутриутробно в 0,3-2,4% случаев, в родовом канале, при грудном вскармливании, через слюну, контактным путем, в том числе половым, при переливании крови, пересадке органов.
Цитомегаловирус проникает в организм трансплацентарно, через слизистые оболочки или поврежденную кожу. В здоровом организме он персистирует пожизненно в виде латентной бессимптомной инфекции, лишь изредка возникает мононуклеоз-ная форма заболевания. При заражении же лица с ослабленным Т-клеточным иммунитетом или его ослаблении у зараженного происходит реактивация вируса с появлением клинически выраженных форм болезни. Иммунодефицит развивается при СПИДе, у реципиентов аллотрансплантатов, больных, принимающих иммунодепрессанты и цитостатики, и в других случаях.
Цитомегаловирусная инфекция у лиц с иммунодефицитом начинается с продолжительной лихорадки, слабости, анорексии, ночных потов, миалгии, артралгии. Часто развивается пневмония, гепатит, поражается желудочно-кишечный тракт с возникновением язв в пищеводе, желудке, тонкой и толстой кишке, ретинит. Развивается лейкопения с появлением атипичных мононуклеаров, тромбоцитопения, нарушаются функции печени.
Частота хориоретинита у новорожденных с генерализованной цитомегаловирусной инфекцией может достигать 30%. Врожденная ЦМВ-инфекция может быть асимптомной или же проявляться различными поражениями глаз: дакриоциститом, дактриоаденитом, конъюнктивитом, помутнением роговицы, кератомаляцией, склеритом, катарактой, хориоретинитом, периваскулярным экссудатом сетчатки, ретинальными кровоизлияниями, атрофией зрительного нерва, врожденными дефектами зрительного нерва, а в некоторых случаях и полной гибелью глаза.
Развивающиеся при ретините атрофия и рубцевание сетчатой оболочки могут привести к ее отслойке, вызывая внезапную и полную потерю зрения. Цитомегаловирусный ретинит часто является проявлением генерализованной формы инфекции и требует полного обследования больного с определением наличия вирусемии методом ПЦР. Цитомегаловирус может обнаруживаться в слезной жидкости у больных хориоретинитом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекции вызванные цитомегаловирусом: диагностика, лечение, профилактика
Вирусы герпеса — большие, покрытые оболочкой, двунитевые ДНК-вирусы (120—200 нм). Геном содержит 120—240 тыс. пар нуклеотидов, кодирующих более 35 белков. Оболочка состоит из гликопротеинов и Fc-рецепторов. Инфекция персистирует у человека на протяжении всей жизни, переходя в латентную форму после острой стадии и периодически рецидивируя (особенно при снижении иммунитета у человека).
Классификация герпес-вирусов
Все вирусы герпеса разделяют на:
• а-герпес-вирусы — быстрорастущие цитолитические вирусы, вызывающие латентную инфекцию и поражающие нейроны (вирусы простого и опоясывающего герпеса);
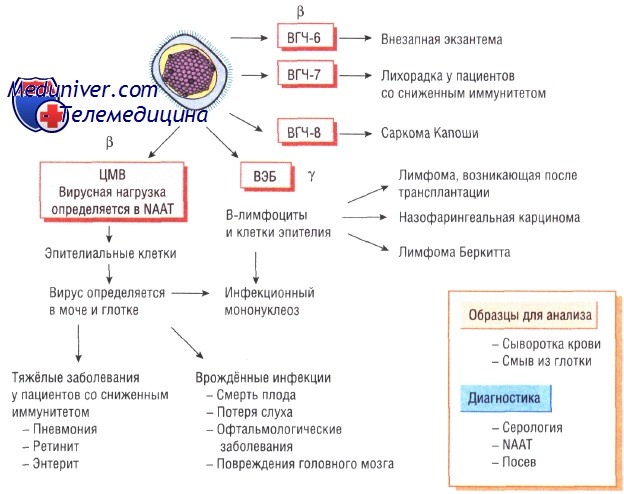
• бета-герпес-вирусы — медленно растущие вирусы, вызывающие латентные инфекции секреторных желёз и почек (цитомегаловирус);
• у-герпес-вирусы — вирусы, вызывающие латентный инфекционный процесс в лимфоидной ткани (вирус Эпштейна—Барр).
Недавно обнаруженные вирусы герпеса человека типа 6 и 7 (ВГЧ-6 и ВГЧ-7) относят к у-герпес-вирусам, так как они вызывают латентные инфекции лимфатических узлов и имеют генетические сходства именно с этой группой вирусов герпеса. ВГЧ-8, ассоциированный с саркомой Капоши, сходен с вирусом Эпштейна—Барр. Все вирусы герпеса, за исключением вируса простого герпеса типа 1 и 2, различны по антигенной структуре.
Инфекции вызванные цитомегаловирусом
По своей структуре цитомегаловирус похож на все остальные вирусы герпеса. Обычно он персистирует в организме на протяжении всей жизни. Его обнаруживают в моче и слюне человека. Примерно 50% населения Великобритании инфицированы ВГЧ-5.
Эпидемиология и патогенез цитомегаловирусной инфекции. Механизм передачи инфекции — вертикальный или контактный (от человека к человеку). Чем ниже социально-экономические условия, тем раньше происходит инфицирование. Возможен вертикальный механизм передачи инфекции. Кроме того, заражение может произойти при переливании крови или пересадке органов; в этом случае инфекции свойственно очень тяжёлое течение.
Клинические признаки инфекции вызванной цитомегаловирусом. Врождённая инфекция обычно протекает в тяжёлой форме. В начальном периоде выраженные симптомы заболевания отсутствуют. В дальнейшем возникает прогрессирующая глухота, задержка развития. При заражении после рождения заболевание протекает в лёгкой форме. У пациентов со сниженным иммунитетом (ВИЧ-инфекция, состояние после трансплантации органов) может развиться тяжёлая пневмония, ретинит, поражение кишечника, причём вирусная инфекция может быть приобретённой (от пересаженного органа) или собственной (латентная форма).
Диагностика инфекции вызванной цитомегаловирусом. Врождённую инфекцию диагностируют при проведении анализа мочи через 3 нед после рождения. У взрослых цитомегаловирус может быть культивирован либо определён молекулярно-генетическим методом в образцах мочи и крови. Исследование вирусной нагрузки имеет большое значение для диагностики тяжёлого течения инфекции и назначения своевременного лечения.
Лечение и профилактика инфекции вызванной цитомегаловирусом. При тяжёлой инфекции, угрожающей жизни пациента, а также при риске потери зрения лечение проводят ганцикловиром в комплексе с иммуноглобулином (при развитии пневмонии). Эфир ганцикловира, валганцикловир принимают внутрь, назначают в начале лечения и в качестве поддерживающей терапии. Ещё более токсичные альтернативные препараты (фоскарнет и цидофовир) ингибируют цепочечную ДНК-полимеразу. Важная мера профилактики заболевания — тщательный подбор донорских органов для пересадки и крови для переливания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение цитомегаловирусной инфекции - препараты
Подход к лечению ЦМВ-инфекции существенно отличается у реципиентов после аллогенной трансплантации костного мозга (ТКМ) и у больных, подвергающихся химиотерапии (в том числе высокодозной после трансплантации аутологичных стволовых клеток). Больным первой группы необходимо упреждающее лечение, поскольку, несмотря на наличие препаратов, эффективно ингибирующих репликацию вируса, лечение уже развившихся висцеральных поражений эффективно не более чем в половине случаев.
Больным, получающим стандартную химиотерапию, специфическое лечение проводят только при установленном или высоковероятном висцеральном поражении.
Методы контроля ЦМВ-инфекции у реципиентов аллогенного костного мозга зависят от ЦМВ-статуса пары донор — реципиент. При серонегативности как донора, так и реципиента самым надежным способом профилактики ЦМВ-инфекции является использование для трансфузий препаратов крови от серонегативных доноров или лейкодеплеция с помощью фильтров последнего поколения, предназначенных для фильтрации в банках крови. При любом другом сочетании ЦМВ-статусов главные инструменты контроля — еженедельный мониторинг ЦМВ-виремии (методом ПЦР или выявлением антигенемии рр65) и упреждающее лечение ганцикловиром при позитивном результате.
Для начала терапии больных высокого риска (реципиенты неродственной или неполностью совместимой трансплантации, лечение РТПХ антитимоцитарным глобулином) достаточно однократного позитивного анализа. В то же время у больных низкого риска при невысокой вирусной нагрузке назначение специфической терапии можно отложить до повторного позитивного анализа, выполненного с интервалом 3— 5 дней. Этот подход проверен многими исследователями, в том числе нами. Доказано, что такой подход эффективнее и дешевле, чем профилактическое использование высоких доз иммуноглобулина и ацикловира, которое было популярно в конце 80-х — начале 90-х годов.

Ганцикловир (1,3-дигидрокси-пропоксиметил-гуанин) сам по себе не является активным противовирусным агентом, необходимо его фосфорилирование вирусной тимидинкиназой. В форме трифосфата ганцикловир ингибирует вирусную ДНК-полимеразу. Сродство ганцикловира к тимидинкиназам человека значительно меньше, поэтому его токсичность для человеческих клеток относительно невелика.
Доза ганцикловира для курса индукции составляет 10 мг/кг в сутки на два введения. Курс индукции продолжается 2—3 нед, после чего назначают поддерживающую дозу — 5 мг/кг в сутки на одно введение ежедневно или 5—6 раз в неделю. Длительность курса поддерживающей терапии определяют индивидуально. При упреждающем лечении реактивации ЦМВ после аллогенной ТКМ при достижении негативной реакции на антигене-мию или виремию поддерживающее лечение можно не проводить, в то время как при органном поражении (пневмония, ЦМВ-колит) лечение должно быть продолжено до купирования симптомов и негативизации результатов вирусологических исследований, а при ЦМВ-ретините терапия может быть пожизненной.
При длительном профилактическом или упреждающем применении ганцикловира в раннем посттрансплантационном периоде высока частота поздних ЦМВ-пневмоний. Таким пациентам необходимо продолжать мониторинг ЦМВ-виремии или антигенемии и после 100-го дня после трансплантации [11]. Примерно у 20 % больных, леченных ганцикловиром в указанной дозе, развивается гранулоцитопения менее 1000 в 1 м\ во всех случаях обратимая (быстрее под влиянием G-CSF), с медианой длительности 12 дней. Резистентность ЦМВ к ганцикловиру является редкостью.
Отличным от ганцикловира по механизму действия (прямое ингибирование ДНК-полимеразы) является натрия фосфоноформат (фоскарнет, фоскавир), который может быть эффективен при резистентности данного штамма вируса к ганцикловиру. Индукционная доза натрия фосфоноформата 90 мг/кг каждые 12 ч. Продолжительность курса лечения составляет 14 дней, затем проводят поддерживающую терапию в половинной дозе. Побочными реакциями являются нарушение функции почек, гипомагнезиемия, гипокальциемия и изъязвление слизистых оболочек наружных половых органов.
Необходимо отметить коммерчески доступный специфический антицитомегаловирусный иммуноглобулин. Убедительных доказательств его эффективности в лечении вызванных ЦМВ болезней нет. С учетом его дороговизны, а также наличия препаратов, оказывающих специфическое противовирусное действие, дальнейшее применение этого препарата вряд ли оправдано.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

