Кишечная палочка деление клетки
Обновлено: 24.04.2024
Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
Своё название бактерии получили в честь немецкого педиатра Т. Эшериха, впервые выделившего Escherichia coli из содержимого кишечника детей. Род образуют подвижные (перитрихи) прямые палочковидные бактерии размером 1,1-1,5x2,0-6,0 мкм. В мазках они располагаются одиночно или парами. У большинства штаммов существуют капсулы или микрокапсулы.
Температурный оптимум для роста эшерихий 37 °С. Эшерихии ферментируют углеводы с образованием кислоты или кислоты и газа, оксидаза-отрицательны и каталаза-положительны.
Эшерихии входят в состав микрофлоры толстой кишки теплокровных, пресмыкающихся, рыб и насекомых. Эшерихии — основная аэробная микрофлора кишечника, вызывающая, однако, обширную группу заболеваний человека, известных как эшерихиозы.
Эшерихиозы характеризуются не только клиническим полиморфизмом, но и создают особую эпидемиологическую ситуацию. Основное медицинское значение имеет кишечная палочка (Escherichia coli). Кишечные палочки рассматривают как санитарно-показательные микроорганизмы (СПМ) при анализе воды и пищевых продуктов.

Кишечная палочка. Escherichia coli
В настоящее время среди прочих энтеробактерии кишечная палочка — основной возбудитель эшерихиозов у человека.
Морфология кишечной палочки. Культуральные свойства кишечной палочки
Кишечная палочка имеют типичную для энтеробактерий форму и представлены короткими подвижными палочками с закруглёнными концами.
• На плотных средах бактерии образуют плоские выпуклые мутные S-колонии с ровными или слегка волнистыми краями (3-5 мм в диаметре) либо сухие плоские R-колонии с неровными краями.
• В жидких средах растут диффузно, вызывая помутнение среды и образование осадка (реже формируют поверхностную плёнку или пристеночное кольцо).
• На средах Хисса кишечная палочка может образовывать газ. На селективно-дифференциальных средах колонии принимают цвет, соответствующий окраске среды. На агаре Эндо лактоза-положительные эшерихии образуют фукс и ново-красные колонии с металлическим блеском, лактоза-отрицательные — бледно-розовые или бесцветные с тёмным центром. На среде Левина бактерии формируют тёмно-синие колонии с металлическим блеском, а лактоза-отрицательные — бесцветные, на среде Плоскирева — соответственно красные с жёлтым оттенком или бесцветные. На КА могут давать полный гемолиз.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
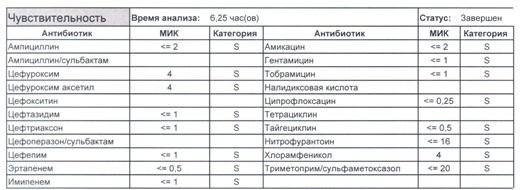
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
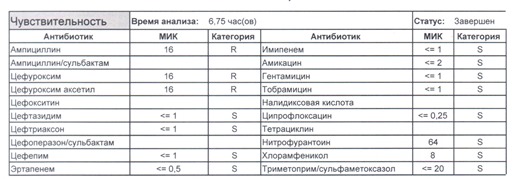
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
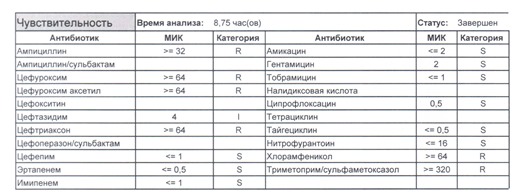
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
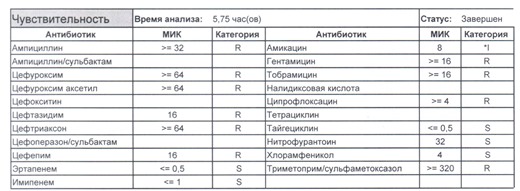
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения
• На заключительной стадии деления клеточная оболочка сжимается и разрушается или участвует в синтезе септы с последующим автолизом, образуя две отдельных клетки
• Процесс деления у бактерий контролируется гомологом тубулина, белком FtsZ, который образует кольцевую структуру в месте деления
• Вместе с FtsZ, в месте деления образуется набор, состоящий примерно из 8 белков, участвующих в делении
• Место деления клетки определяется двумя системами отрицательной регуляции: блокирующим эффектом нуклеоида и системой Min
Большинство клеток эукариот делятся точно посередине, образуя две одинаковые дочерние клетки. Деление скоординировано с завершением репликации ДНК и сегрегацией хромосом. Обычно деление происходит по завершению периода роста, во время которого масса клеток удваивается. После сегрегации хромосом наступает цитокинез, в результате которого клетка разделяется на две. Во время цитокинеза все слои клеточной мембраны локально принимают кольцеобразную форму. Как показано на рисунке ниже, цитокинез осуществляется, по крайней мере, двумя различными путями.
У грамотрицательных микроорганизмов, таких как Е. coli, деление происходит при сокращении слоев существующей оболочки, с последующим разрывом образующейся перемычки. У других бактерий, например у грамположительных В. subtilis, новообразованные кольцевые структуры материала клеточной стенки растут внутрь клетки, образуя перегородку. Когда образование перегородки завершилось, между сестринскими клетками образуется двойная мембрана, но клетки остаются связанными друг с другом. Разделение клеток представляет собой самостоятельное событие, которое включает в себя автолиз материала перегородки. В зависимости от условий роста, автолиз перегородки может происходить достаточно медленно и сопровождаться возникновением длинных цепей связанных между собой клеток.
Ключевой белок деления, FtsZ, представляет собой гомолог тубулина эукариот, белка, входящего в состав цитоскелета и формирующего микротрубочки. Подобно тубулину, этот белок является ГТФазой и в присутствии ГТФ полимеризуется с образованием линейных прото-филаментов, in vitro формирующих пучки и плоские структуры. Кольцевая структура белка FtsZ крайне динамична, и in vivo постоянно подвергается переформированию (с полупериодом
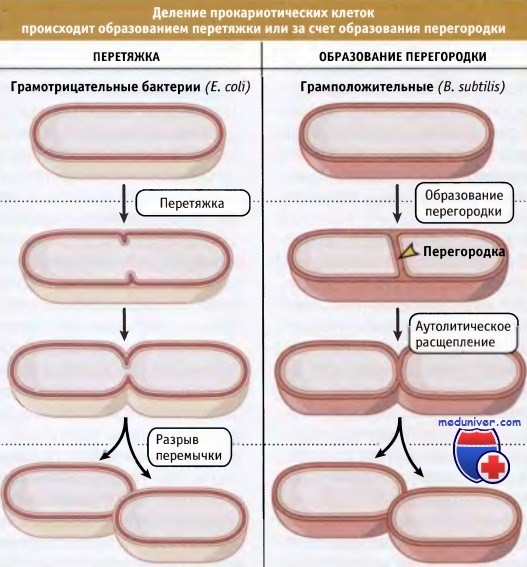
У прокариот деление происходит либо путем образования перетяжки, либо с помощью перегородки.
Для простоты, капсульный слой клеточной оболочки не показан.
В Z-кольце с белком FtsZ непосредственно взаимодействует белок FtsA, функция которого, вероятно, состоит в стабилизации кольца. Белок FtsA напоминает актин клеток эукариот, однако обладает дополнительным доменом, функции которого неизвестны. Этот белок образует димеры, но, по-видимому, не полимеризуется. Хотя он не участвует в формировании Z-кольца, клетки двойного мутанта, дефектного по белкам FtsA и ZipA, не способны образовывать кольцевые структуры. Таким образом, функции белков FtsA и ZipA частично перекрываются, и, по крайней мере, один из них необходим для стабилизации Z-кольца. Также показано, что белок ZipA непосредственно взаимодействует с FtsZ и, в отличие от последнего и FtsA, представляет собой трансмембранный белок. Поэтому ZipA может обеспечивать сопряжение Z-кольца с клеточной мембраной.
Остальные белки деления представляют собой трансмембранные белки. Функции белков FtsL и FtsQ неизвестны. Белок FtsW, вероятно, поставляет предшественники для белка FtsI, который является ферментом, участвующим в синтезе перегородки. Последний обладает способностью связывать пенициллин и взаимодействует с аппаратом синтеза клеточной стенки, функционирующим при делении. Белки FtsK и FtsN необходимы для деления клеток Е. coli, однако у B. subtilis гомолог белка FtsK (SpoIIIE) не участвует в делении, а гомолог белка FtsN у этих клеток отсутствует.
Между двумя хорошо изученными микроорганизмами, Е. coli и В. subtilis, существуют интересные различия в процессе сборки белков деления. Так, у E. coli этот процесс носит почти линейный характер, в то время как у В. subtilis сборка белков на Z-кольцевой структуре является взаимозависимой. Эти различия, вероятно, отражают различную организацию клеточной оболочки у грамотрицательных и грамположительных микроорганизмов. Пока мы мало знаем о том, каким образом полностью собранный аппарат деления влияет на цитокинез, и выяснение этих вопросов представляет собой обширное поле деятельности для исследователей.
Деление контролируется, главным образом, на уровне образования кольца FtsZ. Предполагают, что положение сайта деления, и, вероятно, протекание этого процесса во времени находятся под контролем двух факторов: блокирования нуклеоидом и системы Min. Оба этих фактора обеспечивают наступление деления только после завершения репликации ДНК, а также одинаковую величину образующихся клеток.
Фактор блокирования нуклеоидом исследован недостаточно. Он проявляется в том, что из-за своего объема нуклеоид может предотвращать деление. Поэтому деление клетки происходит только после завершения раунда репликации ДНК и расхождения сестринских хромосом с образованием отдельных нуклеоидов. При блокировании процессов репликации или сегрегации, присутствие нуклеоида в середине клетки предотвращает образование перегородки. В принципе отрицательный эффект нуклеоида может объясняться просто отсутствием в этой области исключением из его состава белка FtsZ. При этом белок не накапливается до критической концентрации, необходимой для его полимеризации.
Значимость фактора блокирования нуклеоидом для клетки представляет собой потенциальную проблему, которая заключается в том, что полюса клетки (по крайней мере у палочковидных бактерий) не защищены нуклеоидом, и поэтому возможно наступление аберрантного полярного деления. Для предупреждения этого, у многих бактерий присутствуют белки, входящие в систему Min, которая препятствует делению на полюсах.Название этой системы происходит от названия мини-клеток, образуемых мини-мутантами, для которых характерно деление на полюсах.
Ключевой эффектор системы Min представляет собой ингибитор клеточного деления, который называется MinC. Этот белок обладает способностью ингибировать образование Z-кольца, вероятно, непосредственно ингибируя полимеризацию FtsZ. Активность MinC находится под контролем белка MinD. Вероятно, этот белок контролирует внутриклеточную локализацию MinC по двум различным механизмам. Один из них состоит в том, что MinD транспортирует MinC на периферию клетки (ближе к цитоплазматической мембране) туда, где происходит сборка кольцевой структуры FtsZ. Второй механизм заключается в том, что MinD ограничивает активность MinC полюсами клетки, тем самым предотвращая наступление полярного деления, но способствуя делению клетки по средней линии.
У многих палочковидных бактерий система MiniCD используется для контроля за местонахождением сайта деления. Эта система хорошо охарактеризована у бактерий Е. coli и В. subtilis. Интересно, что у двух этих микроорганизмов существуют совершенно разные механизмы, посредством которых MinD ограничивает эффект MinC на полюса клетки. У В. subtilis используется простой механизм, при котором полярный якорный белок DivIVA транспортирует комплекс MinCD к полюсам клетки и в течение всего клеточного цикла удерживает его там в статичном положении. Как показано на рисунке ниже, DivIVA и MinD локализуются у полюсов вновь образованной клетки, и присутствие ингибитора MiniC предотвращает формирование FtsZ-кольца у полюсов.
По-видимому, после завершения репликации ДНК, в середине клетки создается новый потенциальный сайт деления. Концентрация ингибитора MiniC у полюсов позволяет провести сборку FtsZ-кольца в середине клетки и обеспечивает мобилизацию других белков деления. В этот момент аппарат деления, вероятно, становится нечувствительным к ингибирующему действию MinC Затем белки DivIVA и MinD перемещаются на середину клетки. Поэтому, когда при делении образуется новая пара клеточных полюсов, DivIVA встраивается в новые полюса и образует новую область проявления ингибирующего эффекта MinCD. Когда произошло сокращение оболочки, наступает разборка FtsZ-кольца, однако DivIVA и MinCD остаются на вновь образованных полюсах, тем самым предотвращая деление на этих полярных сайтах.
Таким образом, транспортировка DivIVA к сайту деления и затем его удержание на полюсах клетки являются ключевыми событиями этого механизма.
Интересно, что белок DivIVA локализуется на сайтах деления, когда он экспрессируется в эукариотических клетках (делящиеся дрожжи). Эта позволяет предполагать, что DivIVA может узнавать топологические характеристики, например кривизну мембраны, а не специфические белковые мишени.
В противоположность этому, в клетках Е. coli существует динамическая система MinCD, которая на какое-то время собирает комплекс у одного полюса. Затем он разбирается и собирается вновь у противоположного полюса. Так повторяется много раз. Этим процессом управляет кольцо белка MinE, которое, в свою очередь, каждый раз перемещается к тому или иному полюсу, смещая MinCD и обеспечивая ему возможность собраться у противоположного полюса. Изменение локализации MinCD от одного полюса к другому происходит с частотой порядка десятков секунд. Как показано на рисунке ниже, MinD поочередно накапливается на периферии мембраны с каждой стороны кольца MinE. Быстрое изменение локализации MinD не позволяет кольцу FtsZ собраться на полюсах.
Присутствие MinE в центральной области исключает проявление там ингибирующего эффекта MinD и дает возможность собраться в этом месте кольцу FtsZ. Остается невыясненным, почему для контроля MinCD и установления полюсов у Е. coli выработался такой энергетически невыгодный механизм.
MinD относится к интересной группе белков, обладающих общей функцией связывания нуклеотидов, которая также включает белок разделения хромосом, ParA. Близкий к ParA белок, Soj, также проявляет динамические свойства. Вероятно, общей для этих белков является их способность связывать и гидролизовать нуклеотиды и контролировать реакции полимеризации и деполимеризации. Это напоминает механизм контроля динамической нестабильности актиновых филаментов и микротрубочек у эукариот . Поэтому эти белки относятся еще к одному классу белков цитоскелета бактерий, обладающих широкими функциями, которые особенно связаны с вопросами морфогенеза на разных стадях клеточного цикла.
Недавно у грамположительных бактерий был идентифицирован белок, участвующий в блокировании клеточного деления нуклеоидом. Это Noc, представляющий собой белок, неспецифически связывающийся с ДНК, который локализован в нуклеоиде. Он также является ингибитором клеточного деления. Если не нарушена репликация хромосом, то мутанты noc растут нормальным образом. При этом в noc- клетках деление происходит с участием нуклеоида, а клетки дикого типа не делятся. Как показано на рисунке ниже, Noc и система MiniCD определяют местоположение кольца FtsZ в середине клетки. В клетках дикого типа, DivIVA запускает процесс полимеризации белка MinD, который распространяется от полюсов к середине клетки вдоль мембраны.
Белок MinC, связанный с белком MinD, предотвращает накопление FtsZ или полимеризацию поблизости от полюсов клетки. Предполагается, что белок Noc связывается с нуклеоидом и ингибирует накопление FtsZ или проявление его активности поблизости от нуклеоида. В клетках noc-, система Min предотвращает сборку кольца FtsZ, исключая область середины клетки, и клетки растут нормально. Однако у min- клеток Noc ингибирует сборку FtsZ только вокруг нуклеоида, и FtsZ образует кольцевую структуру в середине клетки и на полюсах, где нет нуклеоида. У клеток с отсутствующими топологическими ингибиторами (двойные мутанты min-noc-) сборке FtsZ ничего не препятствует, и по всей клетке образуются многочисленные вкрапления, состоящие из этого белка. Их образование приводит к утрате клеткой способности к делению. У грамотрицательных бактерий Noc отсутствует, однако у Е. coli обнаружен белок, контролирующий систему блокирования деления нуклеоидом по механизму, аналогичному Noc.
Сбока белков деления в клетке Е. coli.
Белки FtsZ образуют кольцевую структуру, к которой в указанном порядке присоединяются остальные белки.
Порядок присоединения белков установлен методами молекулярной генетики. Отрицательная пространственная регуляция клеточного деления
за счет блокирующего эффекта нуклеоида. Локализация ключевых белков в сайте деления на разных стадиях клеточного цикла, начиная со новообразованных клеток и заканчивая делением,
в результате которого образуются две дочерних клетки.
На срезах показаны половины каждой клетки, но целые кольцевые структуры FtsZ и MinC.
Для простоты нуклеоиды не показаны. Модель пространственного контроля аппарата клеточного деления у грамположительной бактерии В. subtilis.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021


Микроорганизмы в пищевых продуктах присутствуют всегда. Патогенные микроорганизмы могут быть уничтожены благодаря обработке продуктов. Они могут стремительно размножаться из-за неправильной транспортировки, хранения, приготовления, или подачи. Увеличение количества этих микроорганизмов может привести не только к порче пищи, но и вызвать серьёзное отравление. Распространённый представитель пищевых патогенных бактерий - кишечная палочка. Кишечная палочка является частью микрофлоры кишечника человека и животных.
Некоторые виды кишечных палочек - патогенные для человека, то есть способны вызвать заболевание.
Бактерии группы кишечной палочки - универсальный показатель качества пищевых продуктов. Наличие кишечной палочки - показатель фекального загрязнения, особенно воды.
К сожалению, по внешнему виду, запаху или вкусу мы не сможем сказать, загрязнена ли пища кишечной палочкой (E. coli).
Кишечной палочкой могут быть обсеменены многие продукты, включая говядину, зелень, готовые к употреблению салаты, фрукты, сырое молоко и сырое тесто, нарезки колбас, сыров , особенно в условиях рынка, где не всегда обрабатывается аппарат для нарезки, мясорубки для приготовления фарша. Кишечная палочка активно размножается во время гниения продуктов.
Механизм передачи возбудителя фокально-оральный. Заражение происходит через пищу, воду, грязные руки.
Эта бактерия способна вырабатывать токсины (25 типов) и в зависимости от типа токсина, вырабатываемого кишечной палочкой, она обладают определенным действием.
Например, энтеротоксигенные E.coli имеют высокомолекулярный термолабильный токсин, который действует аналогично холерному, вызывая холероподобную диарею (гастроэнтериты у детей младшего возраста, диарею путешественников и др.).
Энтероинвазивные кишечные палочки вызывают профузную диарею с примесью крови и большим количеством лейкоцитов (аналогично дизентерие).
Энтеропатогенные E.coli вызыают водянистую диарею и выраженное обезвоживание.
Энтерогеморрагические кишечные палочки вызывают диарею с примесью крови.
Симптомы

Симптомы пищевого отравления отравления кишечной палочкой: боль в животе, тошнота, рвота, диарея более 20 раз в сутки, возможно с кровью. Температура тела обычно повышается незначительно или остаётся в норме.
Кишечная палочка является наиболее распространенным патогеном, вызывающим менингит у новорождённых детей. Он имеет высокие показатели заболеваемости и смертности во всем мире.
В группе риска

-Взрослые в возрасте 65 лет и старше
-Дети младше 5 лет
-Люди с ослабленной иммунной системой, в том числе беременные
-Люди, которые путешествуют в определенные страны
Профилактика

Чтобы защитить себя от инфекций, вызванных кишечной палочкой, а также от других болезней пищевого происхождения, соблюдайте основные правила безопасности:
-Мойте руки, посуду и кухонные поверхности горячей мыльной водой до и после приготовления или приема пищи.
- Используйте отдельные разделочные доски для сырых продуктов и готовых
-Тщательно мойте фрукты и овощи, испотльзуйте щетку для овощей.
-Держите сырые продукты, особенно мясо и птицу, отдельно от готовых к употреблению продуктов.
- Охлаждайте или замораживайте скоропортящиеся продукты как можно быстрее.

Студент медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 08.10.2019
- Reading time: 1 минут чтения
Ученые выяснили, как кишечные палочки защищаются от антибиотиков. Результаты не радуют.
Бактерии начинают и выигрывают
Многие больные страдают от повторяющихся инфекций мочевыводящих путей, несмотря на антибиотикотерапию. Дело в том, что возбудители научились защищаться от антибиотиков.

Кишечные палочки, вызывающие инфекции мочевыводящих путей в 61% случаев, обладают способностью проникать в мочевыделительную систему из кишечника. Во время антибиотикотерапии они меняют свои свойства, становясь шаровидными и неправильными L-формами без клеточных стенок.
Антибиотики пенициллин, амоксициллин, фосфомицин и другие убивают бактерии, блокируя клеточные стенки во время деления клетки. На измененные формы препараты не действуют.
В течение шести месяцев исследователи исследовали 360 образцов мочи больных, страдающих от повторных инфекций мочевыводящих путей. В моче 46% пациентов были обнаружены кишечные палочки сферической неправильной формы без клеточных стенок.
На момент трансформации кишечные палочки теряют активность, и симптомы инфекции исчезают. Больные считают, что выздоровели, но через некоторое время снова обретают клеточную стенку и палочкообразную форму. Симптомы инфекции возникают снова.
От временной потери клеточной стенки микробы только выигрывают. Таким образом, кишечные палочки избегают атаки иммунных клеток, которые теряют способность их распознавать.
Ученым придется изобретать новые лекарства
Поэтому назначение антибиотиков должно сопровождаться посевами мочи на чувствительность. Только так можно подобрать препарат, оказывающий максимальное лечебное действие.
Пока еще больным удается подобрать антибиотики, уничтожающие микроорганизмы, но такая возможность может скоро кануть в Лету.
Читайте также:

