Кишечная палочка это анаэроб
Обновлено: 17.04.2024
СТАЙЛАБ предлагает тест-системы для определения кишечной палочки (E. coli) в пробах продуктов и окружающей среды микробиологическими методами, с помощью ПЦР в реальном времени, а также методом латекс-агглютинации.
Кишечная палочка (Escherichia coli) – это факультативно-анаэробная грамотрицательная подвижная палочковидная бактерия, входящая в состав нормальной микрофлоры кишечника большинства теплокровных животных, в том числе, и человека. Существует множество серотипов кишечной палочки, большинство из которых безвредно или даже полезно для носителя. Бактерии, входящие в состав микрофлоры, препятствуют размножению других бактерий, в том числе, патогенных. Кроме того, кишечная палочка вырабатывает витамин К. Однако некоторые серотипы E. coli могут вызывать тяжелые заболевания. Морфологически безвредные и патогенные кишечные палочки не различаются, потому для определения патогенности микроорганизма необходимо проанализировать его антигены.
Бактерии кишечной палочки могут относиться к различным серогруппам: обладать различными антигенами. Серогруппа – это группа бактерий, обладающих общим антигеном; она может включать более одного серотипа, вида или рода. Для E. coli наиболее известными являются серогруппы энтеропатогенной кишечной палочки O26, O55, O86, O111, O114, O119, O125, O126, O127, O128, O142 и O158. К этим же группам могут относиться и другие типы патогенной кишечной палочки. Например, у DAEC выявлены серогруппы O86, O127, O142 и O158.
Выделяют шесть типов патогенных кишечных палочек.
- Энтерогеморрагическая кишечная палочка (EHEC, используются также сокращения STEC – от «шигатоксин-продуцирующая E. coli и VTEC – «веротоксин-продуцирующая E.Coli). Эти бактерии вырабатывают два токсина, которые называют веротоксинами, или шигаподобными (шигеллоподобными) токсинами. EHEC вызывает заболевания, по симптоматике сходные с дизентерией и сопровождающиеся геморрагической диареей. В тяжелых случаях может развиваться гемолитико-уремический синдром (ГУС). К EHEC относятся серотипы кишечной палочки O104:H4, O157:H7 и некоторые другие.
- Энтеротоксигенная кишечная палочка (ETEC) вырабатывает термолабильный и термостабильный токсины, последний из которых похож на токсин холерного вибриона. Для заболеваний, вызываемых этой бактерией, характерна водянистая диарея, повышенная температура и, в некоторых случаях, тошнота.
- Энтероинвазивная кишечная палочка (EIEC) вызывает заболевания, похожие на бактериальную дизентерию. Эти бактерии проникают в клетки эпителия кишечника и размножаются в них.
- Энтеропатогенная кишечная палочка (EPEC) чаще вызывает диарею у детей, чем у взрослых. Механизм ее действия отличается от ETEC и EIEC: эти бактерии прикрепляются к клеткам эпителия кишечника, но не проникают в них. Заболевания, вызванные EPEC, могут продолжаться до 2 недель.
- Энтероагрегативная кишечная палочка (EAEC) также вызывает заболевания, в основном, у детей. Бактерии прикрепляются к эпителию кишечника и выделяют токсины.
- Диффузно-адгезивная кишечная палочка (DAEC) вызывает легкую диарею у детей, особенно возрастом до 2х лет. Однако этот микроорганизм обнаруживали и у здоровых детей, а также у здоровых взрослых.
Кишечная палочка способна вызывать не только энтериты и токсикоинфекции, но и менингиты новорожденных, респираторные инфекции, инфекции мочевыводящих путей и бактериемию – общее поражение организма, вызванное бактериями, проникшими в кровь.
E. coli относится к наиболее изученным организмам. Геном одного из штаммов этих бактерий был полностью секвенирован в 1997 году. Кишечную палочку используют в генетических и микробиологических экспериментах, а также при изучении видообразования. Кроме того, с помощью этих бактерий синтезируют различные белки, в частности, аналог инсулина человека, некоторые ферменты и др. Их применяют также для получения вакцин. Ведутся исследования по использованию кишечной палочки для получения топлива.
Для определения кишечной палочки в пробах используют как микробиологические методы (селективные среды, тест-подложки), так и определение ДНК с помощью ПЦР. В качестве экспресс-тестов применяют простой и быстрый метод латекс-агглютинации.
Знакомьтесь с героиней нашего сегодняшнего повествования – синегнойной палочкой или Pseudomonas aeruginosa (P.aeruginosa).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач-клинический фармаколог Трубачева Е.С.
Знакомьтесь с героиней нашего сегодняшнего повествования – синегнойной палочкой или Pseudomonas aeruginosa (P.aeruginosa).
.jpg)
И, воспользовавшись ситуацией, мы поговорим о микробиологической безопасности лечебных учреждений, ведь именно этот возбудитель до сих является одним из лидеров внутрибольничных инфекций, особенно в условиях реанимационных, хирургических, онкологических и ожоговых отделений, и, казалось бы, эта проблема не решаемая. О том, как победить этого зверя-убийцу и не разорится, мы сегодня и поговорим.
Микробиологические аспекты
Pseudomonas aeruginosa – это аэробная грамотрицательная палочка, с одним или двумя полярно расположенными жгутиками, которая может расти и размножаться и в анаэробных условиях.
Это один из немногих возбудителей, который угадывается в прямом смысле носом – инфицированная рана издает совершенно неповторимое амбрэ, которое не перепутаешь ни с чем, если услышал хотя бы один раз. Причем больной обнаруживается в прямом смысле по запаху от двери не то, что палаты, а от входа в лечебное отделение. Для тех, кто пока ни разу не сталкивался, – он слышится как запах сладкой карамели с аммиаком, вызывающий отчетливые рвотные позывы (хотя последнее строго индивидуально). Некоторые ощущают его как аромат жасмина в аммиаке. Запах очень специфический и способен играть серьезную диагностическую роль, а уж если к нему в дополнение идут сине-зеленые повязки, и это не вылитый ранее флакон зеленки, то перед вами на 99,9% рана, инфицированная P.aeruginosa. Согласитесь, это важно, особенно в условиях как недостатка микробиологических лабораторий, так и широкого распространения возбудителя в стационарах.
Дикая почвенная синегнойка, являющаяся родоначальницей всех внутрибольничных форм, будет выглядеть следующим образом. Как вы можете видеть, убить ее можно абсолютно всем с применением обычных терапевтических дозировок. (картинка 1)
В природе синегнойная палочка обитает в почве и воде, при этом она непривередлива в плане питательных веществ (в дистиллированной воде растет и размножается до 2,5 месяцев, хотя и снижает свою активность в десять раз). Поэтому идеальной средой ее обитания будет та локализация в организме, где темно, тепло и сыро, а именно – раны, нижние дыхательные пути, мочевыводящие пути и все те полости, в которые можно установить катетеры. Конечно, самостоятельно палочка туда не заползет, у нее нет ножек, зато мы – медицинский персонал, не соблюдая правила обработки рук и имея единственного больного в отделении, к концу смены обсеменим всех, особенно если в ординаторских и сестринских используются общие, а не одноразовые бумажные, полотенца.
P.aeruginosa очень любит, когда вокруг нее тепло (30 – 37 0 С), темно и сыро. Соответственно, самое чистое время года с точки зрения риска принести дикую уличную палочку в стационар – это зима. И если зимой в вашем на 100% чистом стационаре с внутренним микробиологическим контролем вдруг пациент, простите, завонял – ищите любителя-огородника с рассадой на подоконнике. Достаточно такому садоводу-огороднику один раз по приходу на работу не отмыть правильно руки и пойти на перевязку – больной с синегнойной (или ацинетобактерной, а то и вообще микст) инфекцией на ровном месте будет обеспечен. А если все остальные так же правильно не помыли руки или вытерлись общим полотенцем – чистый стационар очень быстро станет стационаром с синегнойкой.
Синегнойная палочка является активным пленкообразователем. В этом процессе участвует вырабатываемая микробом внеклеточная слизь, покрывающая саму клетку тонким слоем. Процесс пленкообразования условного возбудителя наглядно показан на данном видео. Как мы обсуждали ранее, микробы – это не статичные существа, которые всю жизнь питаются и размножаются, они способны вести достаточно бурную социальную жизнь, и синегнойная биопленка тому наглядный пример, поэтому о ней стоит поговорить поподробнее. Когда палочка прикрепляется к поверхности, она тут же образует монослой из микроколоний, покрытых экзополисахаридом. Затем бактерии образуют множество пилей, которыми скрепляются в том числе и друг с другом и вся структура образует полисахаридную матрицу. Когда биопленка созреет (это занимает в среднем неделю), то она становится эластичной и упругой, напоминая резину или силиконовую стельку, и точно так же обеспечивает защиту включенных в нее микроорганизмов от воздействий антибиотиков, антисептиков, дезенфектантов и иммунных клеток организма хозяина. При этом внутри самой биопленки бактерии активно обмениваются факторами вирулентности и антибиотикорезистентности и отшнуровывающиеся в последующем от пленки новые палочки будут обладать всем набором факторов защиты, характерным для материнской биопленки. Так выглядит один из способов получения вооруженной до зубов внутрибольничной микрофлоры, которая убивает пациентов и которую фактически невозможно убить в пациентах в виду как недоступности для действующих агентов (биопленка), так и в виду наличия механизмов антибиотикорезистентности, вплоть до металло-бета-лактамаз, разрушающих все до одного существующих антибиотика и большое число антисептиков и дезенфектантов.
Почему же P.aeruginosa так полюбила больницы? Да потому что здесь, в отличие от дикой среды обитания, для нее созданы идеальные условия, как в плане климата и питательных веществ, так и в плане окружения – зверю практически не требуется бороться за свое выживание с другой микрофлорой, фактически всегда за счет своих свойств синегнойка получает селективное преимущество перед другими возбудителями, которых успешно травят антисептиками, антибиотиками, заключительной дезинфекцией и УФ-излучением, оставляя сегодняшней героине расчищенную от конкурентов территорию.
Где же в стационаре создаются условия для размножения и распространения инфекции? Для этого необходимо знать следующие свойства P.aeruginosa:
Таким образом, исходя из вышесказанного, любимыми местами обитания в стационарах являются все то, что создает оптимальную для обитания теплую и влажную среду, а именно:
- краны, раковины, кафель и стыки между ними у раковин и моек, сан. узлы, тряпочные общие полотенца ординаторских и сестринских
- медицинское оборудование, создающее теплую и влажную среду (аппараты ИВЛ, наркозные аппараты, аппараты для проведения диализа, испарители всех типов)
- кондиционеры открытого типа, хотя и за сплит-системами необходим постоянный уход и дезинфекция
- посуда для сдачи анализов
- руки мед. персонала
- общие, а не одноразовые полотенца
То есть любимыми отделениями для обитания в стационаре будут ожоговые и хирургические (практически все, а не только гнойная хирургия и травматология), отделения реанимации и интенсивной терапии и хирургический блок. Особняком стоят пульмонологические отделения с пациентами с муковисцидозом и онкологические стационары. При этом синегнойка может оказаться совершенно в любом отделении, переехав туда на руках медицинского персонала и разбежавшись по больным уже через тамошнее общее полотенце. Поэтому первый и главный шаг на пути борьбы с распространением синегнойной инфекции – это наши руки, точнее, правильная их обработка. После КАЖДОГО пациента. И не протирание полотенчиком на обходе, а полноценное мытье, после которого хотя бы самому себе можно сказать, что уж ты-то точно сделал все, что было возможно.
Клинические аспекты
Какие пациенты более всего чувствительны к P.aeruginosa и когда вообще ждать именно ее:
Какую патологию чаще всего вызывает (а лучше сказать, осложняет) P.aeruginosa
То есть почти любая область поражения и это говорит нам о крайней необходимости микробиологической диагностики, так как почти точно такой же набор может вызвать нозокомиальный золотистый стафилококк или ацинетобактер.
Эпидемиологические аспекты
Как уже выше было неоднократно сказано – P.aeruginosa умеет поражать практически все, до чего сможет добраться, а уж убивать, да в своих нозокомиальных формах, когда из биопленок вылупились и распространились супермутанты, тем более. Вопрос в том, что делать, ведь ситуация кажется безнадежной. Но это не так.
Вылечить больных мы, конечно, можем, но только в том случае, если перед нами дикая и непуганая P.aeruginosa с улицы. Если случилось так, что в вашем стационаре она живет годами и смогла инфицировать пациента (а сама она не может, ее надо донести на чьих-то медицинских руках или до пациента, или до аппарата, который используется у этого пациента), то тут фармакология почти бессильна, так как внутрибольничные палочки умеют разрушать все до одного антибиотика, имеющегося на рынке, а новых уже лет 10 не было, и неизвестно когда будут, если вообще будут. Поэтому единственным барьером встает эпидемиологический надзор. Причем синегнойку, в отличие от фекальной микрофлоры, из стационара выбить можно полностью, так как в норме она не является элементом нормальной микрофлоры человека, как та же кишечная палочка, клебсиелла или энтерококки, то есть в людях в норме она не живет.
Почему в этой статье нет антибиотикограмм устойчивых форм? Ответ до банальности прост – автор долгое время проработала в стационаре, свободном от синегнойки. Это достижимо, и от P.aeruginosa можно освободится даже в самом запущенном случае, что не будет стоить колоссальных денег, при том, что в перспективе высвобождаются действительно серьезные средства, которые ежегодно тратятся на тушение пожара антибиотиками, что в случае внутрибольничных инфекций равноценно тушению бензином. Для достижения полного антисинегнойного эффекта необходимо:
- Правильно мыть руки после каждого пациента
- Менять перчатки после каждого пациента (вместе с мытьем рук)
- Прекратить практику использования общих полотенец и полотенец на обходе
- Ввести тотальный микробиологический мониторинг
- Если есть эпидемиолог, с него требовать доступ к антисептикам и дезенфектантам нескольких видов, а также постоянное наличие одноразовых расходных материалов (это его вопрос, как он будет с начальством договариваться, но все одноразовое обязано быть одноразовым и в достаточных количествах – так как отодрать синегнойную пленку обычными методами, как вы видели, фактически нереально)
- В идеале всю группу антисинегнойных препаратов необходимо вывести из общебольничного оборота и назначать только специально обученным клиническим фармакологом. Таким образом, удастся снизить антимикробную нагрузку на внутрибольничную флору, уменьшить ее селективность и снизить вероятность селекции нозокомиальных штаммов самой P.aeruginosa
В заключении хотелось бы отметить еще раз – данная статья не про то, как победить синегнойку голыми руками антибиотиками. Этого еще пока никому не удавалось, так как проблема не в одном больном с диким возбудителем. От антибиотиков в этом деле зависит процента два в лучшем случае (приблизительно столько диких форм к вам может прийти за год). Проблема носит глубокий системный характер, и без усилий по освобождению всего стационара от P.aeruginosa, использование только и исключительно антибиотиков на каждый случай, особенно внутрибольничного инфицирования, будет сизифовым трудом с соответствующим печальным результатом.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
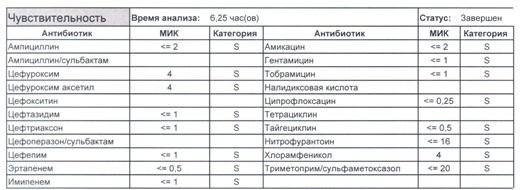
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
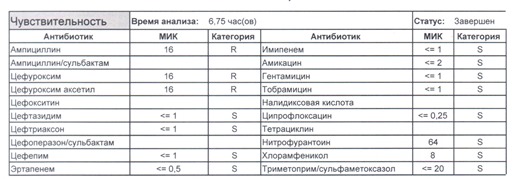
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
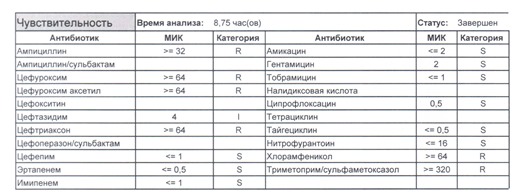
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
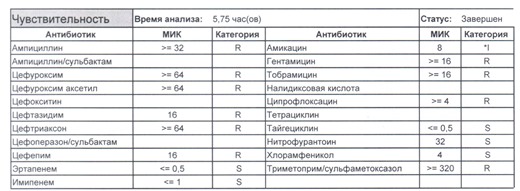
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения

Кишечная палочка представляет собой тип бактерий, который в больших количествах является опасным для человеческого организма. Данная бактерия имеет палочковидную форму. При этом данная бактерия считается нормальной для человеческого тела. Она располагается в желудочно-кишечном тракте.
Существует очень большое количество таких бактерий, которое превышает 100. Они объединены в 4 отдельных типа, которые отличаются между собой по особенностям жизнедеятельности и своему уровню патогенности. Морфологическая разница между теми, которые являются патогенными, и теми, которые таковыми не являются, на отсутствует.
Общая информация
Данные бактерии являются очень устойчивыми к воздействию окружающей среды, а также могут долгое время быть в почве, фекалиях и воде, что также может быть фактором риска при определенных обстоятельствах. Они могут быть также в пищевых продуктах и молоке. Они при этом также не имеют высокого уровня устойчивости, если на них воздействуют при помощи антисептических средств и не имеют устойчивости к кипячению, так что при термической обработке кишечная палочка погибает. Более того, даже прямое воздействие солнечных лучей способно убить такие палочки менее чем за минуту, что очень важно.
Часть кишечных палочек имеет возможность для передвижения при помощи специальных жгутиков. В некоторых ситуациях это не представляется возможным, ведь не все виды палочек имеют возможность к такого рода передвижению, что имеет принципиальное значение для обеспечения достаточно высокой скорости передвижения, достаточной для комфортного существования в среде.
В кишечнике человека
В нормальной ситуации кишечника есть возможность отследить наличие таких бактерий в количестве 1% от общего количества. Именно такая концентрация считается нормальной, что имеет принципиальное значение для поддержания хорошего состояния человеческого организма. Кишечник имеет определенное количество кислорода, который является для него вредным. Такие бактерии помогут его забирать, что очень важно для нормального функционирования человеческого тела.
Именно кишечные палочки ответственны за то, чтобы вырабатывать полезные для человека витамины группы В. Они также вырабатывают муравьиную кислоту, уксусную и даже молочную. Они оказывают влияние на всасывание кальция, билирубина, а также железа и прочих полезных веществ. Благодаря кишечным палочкам есть возможность также перерабатывать определенные составы, что очень важно.

Энтеробактерии (лат. enterobacteriaceae) — семейство грамотрицательных (как и другие протеобактерии) палочкообразные (бациллы), споронеобразующие бактерии, длиной 1-5 мкм, со жгутиками для передвижения. Эти бактерии — факультативные анаэробы, расщепляют углеводы с образованием муравьиной кислоты и других конечных продуктов формиатного брожения. Некоторые из них могут разлагать лактозу.
Множество представителей семейства являются частью микрофлоры кишечника человека и животных. Они представляют большое число нормальной микрофлоры человеческого организма и значительное количество патогенных микробов: сальмонелла, кишечная палочка, чумная палочка и др. Энтеробактерии определяют в различных отделах желудочно-кишечного тракта здорового человека: в тощей кишке – от 0 до 103 КОЕ/мл, в подвздошной — от 10 2 до 10 6 КОЕ/мл. В норме в составе факультативной микрофлоры кишечника они не должны превышать количество 10 4 КОЕ/г.
Другая часть этих бактерий обнаруживается в воде и почве или паразитирует на различных растениях и животных. Хорошо изучена кишечная палочка — модельный организм, используемый в молекулярной биологии и генетике, в связи с изученностью её генетики и биохимии.
Энтеробактерии в воде и почве месяцами остаются жизнеспособными, но за несколько минут гибнут от дезинфектантов и при очень высоких температурах через 1 час.
Эти бактерии вырабатывают сахаролитические, протеолитические и др. ферменты, определение которых имеет таксонометрическое значение. Образуют индол, а глюкозу, лактозу, маннит ферментируют до кислоты и газа.
Факторами патогенности являются:
- эндотоксин, который освобождается после разрушения микробных клеток и адгезины,
- цитотоксин,
- экзотоксин.
Бактерии могут проникать в макрофаги и размножаться в них. Патологический процесс усугубляется на фоне снижения активности фагоцитоза, падения барьерной функции тканей. Снижение в кишечнике полезной нормофлоры и нарушение колонизационной и защитной функции может приводить к проникновению в лимфу и кровь. Коли-бактериозы возникают при снижении количества полезной микрофлоры кишечника и иммунитета. После перенесённого заболевания невосприимчивость не формируется.
Какие заболевания вызывают энтеробактерии?

энтреробактерии e.coli
Группа энтеробактерий включающая: сальмонеллы, шигеллы, эшерихии, клебсиеллы, собственно энтеробактер, серрации, протей, морганеллы, провиденции и иерсинии в норме обитают в желудочно-кишечном тракте человека, но при снижении защитных свойств слизистой кишечника, могут вызывать инфекции желудочно-кишечного тракта или других органов.
Энтеробактерии — представители родов citrobacier, ewardsiella, enterobacter, escherichia, hafnia, klebsiella, proteus, providencia, salmonella, serratia, yersinia вызывают инфекции мочеполовой системы (в том числе циститы, пиелонефриты, цервициты и т.п.). До 80% бактерий, обнаруживаемых в моче — энтеробактерии.
Энтеробактерии становятся причиной различных заболеваний человека. Условно – патогенные бактерии вызывают гнойно-воспалительные процессы различной локализации: как эндогенные процессы — развиваются инфекции мочевыводящих путей (уретрит, цистит, пиелонефрит), половой системы (вагинит, трихомиоз, цервицит), дыхательных путей (пневмония), желудочно-кишечного тракта (холециститы, сальмонеллез, дизентерия, чума) и другие, так называемые коли-бактериозы, а как экзогенные – нагноение ран. Разные формы ОКЗ – острых кишечных заболеваний обусловлены патогенным действием различных энтеробактерий и чем агрессивнее токсины бактерий, тем тяжелее состояние, особенно у маленьких детей.
Escherichia coli – кишечная палочка в норме определяется в желудочно-кишечном тракте и синтезирует секреторные иммуноглобулины и колицины. Они тормозят рост некоторых патогенных энтеробактерий и препятствуют проникновению их в слизистую оболочку стенки кишечника. E. сoli участвует синтезе витамина К (свертываемость). Некоторые патогенные штаммы кишечной палочки могут поражать слизистую кишечника, что проявляется кровавым водянистым поносом или диареей путешественников.
У детей диарея, вызываемая патогенной энтерогеморрагической кишечной палочкой, может осложняться гемолитико-уремическим синдромом и почечной недостаточностью. Эта бактерия может поражать кровь, желчный пузырь, легкие, мочевыводящие пути и кожу. У новорожденных детей, особенно недоношенных, кишечная палочка может стать патогенным возбудителем бактериемии и менингита.
Инфекции, обусловленные клебсиеллами (Klebsiella), энтеробактериями (Enterobacteriaceae) и серрациями (Serratia), обычно встречаются в больницах, чаще при снижении способности бороться против инфекций. Эти бактерии также часто поражают мочевыводящие, половые органы. Пневмония, вызванная клебсиеллами, наиболее распространена у больных сахарным диабетом и у злоупотребляющих алкоголем и имеет часто тяжелое течение.
Симптоматика инфекций, вызываемых энтеробактериями.
Симптомы инфекционного заболевания могут быть различны, в зависимости от места развития воспалительного процесса, однако все больные жалуются на общую слабость, повышение температуры, проявления интоксикации и боли в месте заболевшего органа. Для определения патогенных энтеробактерий обязательно нужно сдать анализы – кровь, мочу, мокроту, мазки или кал, в зависимости от локализации воспалительного процесса, пройти до обследование, для выявления функциональных нарушений.
Важно соблюдать правила личной гигиены, следить за качеством, чистотой овощей-фруктов, питаться, учитывая индивидуальные особенности, избегать контакта с инфекционными больными и поддерживать свой иммунитет в норме.
Как быстро восстановиться после инфекции?
Восстановление и сохранение достаточного количества полезной нормофлоры кишечника – лакто- и бифидобактерий, способствует защите слизистой кишечника от проникновения патогенных бактерий и их токсинов в кровь и лимфу, выведению токсинов, созданию среды, в которой патогенные микроорганизмы не могут продолжать свою жизнедеятельность и выводятся из организма человека. Важно, что продукты жизнедеятельности полезных бактерий помогают иммунитету сохранять активность в борьбе с вредными бактериями.
Синбиотический биокомплекс Нормофлорины – содержащий живые активные лакто- и бифидобактерии и их метаболиты с противовоспалительным, антисептическим, иммуногенным и питательным действием на слизистые за многие годы зарекомендовал себя, как активный помощник и борец против патогенных бактерий для малышей и взрослых, беременных и больных с различными заболеваниями. Достаточно быстро при употреблении Нормофлоринов снимается интоксикация и восстанавливается функция кишечника, общее самочувствие.
Рекомендуется: как можно раньше начать принимать Нормофлорины в возрастных дозировках – Л – за 10-15 мин до еды утром (+ обед при запорах), Д – обед или вечер за 20 мин до еды, Б – на ночь или в микроклизме. Длительность приема 3-4 недели, до полного восстановления функции кишечника и улучшения общего самочувствия. Желательно 10-14 дней натощак принимать сорбенты – для выведения токсинов – зостерин или пекто, они уменьшают гнилостные, бродильные процессы, повышенное газообразование, улучшают работу кишечника.
Важно закрепить эффект восстановления микрофлоры, улучшить работу поджелудочной железы, печени, кишечника, иммунитет – для этого хорошо далее в течение месяца использовать функциональное питание – Гармония жизни. В её составе также содержатся живые полезные лакто- и бифидобактерии, их метаболиты и пектин. Вкусно, полезно и эффективно!
Читайте также:

