Кишечная палочка это продуцент
Обновлено: 18.04.2024
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Писанов Р. В., Монахова Е. В., Алексеева Л. П., Маркина О. В., Гончарова Л. А.
Ген zonula occludens toxin (zot) Vibrio cholerae, амплифицированный с помощью ПЦР, клонирован в составе векторной плазмиды pQE30 по сайтам BamHI-HindIII. Экспрессия гена происходит под контролем Т5-промотора. Штамм Escherichia coli M15[pREP4]pZot69, содержащий рекомбинантную плазмиду , является активным продуцентом белка 6His-Zot, который обладает биологической активностью на модели культур клеток, вызывая разрушение межклеточных плотных контактов в монослое. Продукт присутствует в клетках кишечной палочки в виде телец включения. Штамм-продуцент может быть использован для получения препаратов Zot в целях изучения его значимости как фактора вирулентности холерных вибрионов , как агента, повышающего проницаемость кишечника для некоторых лекарственных препаратов, и как адъюванта при иммунизации.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Писанов Р. В., Монахова Е. В., Алексеева Л. П., Маркина О. В., Гончарова Л. А.
Конструирование рекомбинантного штамма Escherichia coli продуцента основной субъединицы токсин-корегулируемых пилей адгезии TcpA Vibrio cholerae биовара Эль Тор
Разработка методического подхода к созданию рекомбинантного штамма-продуцента субъединицы В холерного токсина
An Escherichia coli Strain - Producer of the Zot-toxin of Vibrio cholerae
Vibrio cholerae zonula occludens toxin (zot) amplified with the PCR procedure, was cloned as part of pQE30 vector plasmid at BamHI-HindIII sites. The expression of the gene was controlled by T5 promoter. Eschericia coli strain M15 [pREP4] pZct69 containing the recombinant plasmid , is an active producer of 6His-Zot protein which manifests a biologic activity on the model of cellular cultures causing destructive injuries in the inter-cellular tight junctions of the monolayers. The product is found within the colibacillus cells as inclusion corpuscles. The producer strain may be used to obtain Zot preparations in order to study its significance as one of the cholera vibrio virulence factors and as an agent facilitating intestinal penetrability for certain medical drugs, as well as an immunization adjuvant.
Р.В.Писанов, Е.В.Монахова, Л.П.Алексеева, О.В.Маркина, Л.А.Гончарова ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ ZOT-ТОКСИНА VIBRIO CHOLERAE
Ростовский-на-Дону научно-исследовательский противочумный институт
Ген zonula occludens toxin (zot) Vibrio cholerae, амплифицированный с помощью ПЦР, клонирован в составе векторной плазмиды pQE30 по сайтам BamHI-HindIII. Экспрессия гена происходит под контролем Т5-промотора. Штамм Escherichia coli M15[pREP4]pZot69, содержащий рекомбинантную плазмиду, является активным продуцентом белка 6His-Zot, который обладает биологической активностью на модели культур клеток, вызывая разрушение межклеточных плотных контактов в монослое. Продукт присутствует в клетках кишечной палочки в виде телец включения. Штамм-продуцент может быть использован для получения препаратов Zot в целях изучения его значимости как фактора вирулентности холерных вибрионов, как агента, повышающего проницаемость кишечника для некоторых лекарственных препаратов, и как адъюванта при иммунизации.
Ключевые слова: zonula occludens toxin, холерный вибрион, клонирование генов, рекомбинантная плазмида
Zonula occludens toxin относят к числу дополнительных факторов вирулентности холерных вибрионов [7]. Кодирующий его ген zot вместе с генами cep, orfU, ace и ctxAB входит в состав коровой области генома умеренного филаментозного фага СТХф, интегрированного в хромосому Vibrio cholerae и способного к горизонтальной передаче перечисленных генов от штамма к штамму [13]. Zot представляет собой белок с двойной функцией, являясь одновременно необходимой составляющей фагового морфогенеза [6, 13] и аналогом эукариотического модулятора межклеточных плотных контактов (tight junctions, tj) зонулина [7]. Оба белка имеют общий рецептор и механизм действия, состоящий в разрушении tj за счет полимеризации клеточного актина, что приводит к усилению проницаемости тканей и может обеспечивать более свободный доступ других токсинов, в том числе холерогена, к клеточной мембране [8, 9].
Установлено, что первичный продукт гена zot представляет собой белок с молекулярной массой (ММ) 45 кДа, который подвергается процессингу предположительно за счет специфических протеаз, синтезируемых холерными вибрионами, в результате чего образуются две молекулы. Первая из них (N-терминальная часть исходной формы размером 33 кДа) остается связанной с клеточной поверхностью и, скорее всего, является одной из субъединиц капсида СТХф, тогда как вторая (С-терминальный фрагмент размером ~12 кДа) секретируется в просвет кишечника и обусловливает биологическое действие токсина [7].
Вместе с тем роль Zot как в патогенезе типичной холеры, так и в качестве самостоятельного фактора вирулентности нехолерогенных штаммов холерных вибрионов, содержащих неполный (ActxAB) СТХ-элемент [4], в том числе выделяемых от больных острой диареей на территории России и пограничных государств [2], изучена далеко не достаточно.
В последнее десятилетие Zot также широко исследуется в качестве агента, повышающего проницаемость кишечника и других тканей для лекарственных препаратов, обычно оказывающих терапевтическое действие только при парентеральном вве-
дении. Например, у крыс с экспериментальным диабетом пероральное введение инсулина совместно с Zot приводило к снижению содержания глюкозы в сыворотке крови до такого уровня, который наблюдался после парентерального введения гормона [9]; аналогичные данные получены и на приматах [7, 14]. Результаты этих экспериментов обнадеживают в плане возможности замены в недалеком будущем парентерального использования целого ряда терапевтических средств на пероральное [7]. Интересны и экспериментальные данные о применении Zot в качестве адъюванта при интраназальной иммунизации мышей различными белками [10, 12]. В частности, иммунизация мышей столбнячным анатоксином с добавлением Zot обеспечивала полную защиту против столбнячного токсина [11].
Дальнейшие исследования в указанных направлениях требуют наличия очищенных препаратов Zot. Получение их из штаммов V. cholerae представляется малоэффективным и сопряжено с рядом трудностей. Поэтому одним из перспективных решений данной задачи является клонирование гена zot в составе плазмидных векторов и создание продуцентов на основе лабораторных штаммов E. coli.
Материалы и методы
Донором ДНК для амплификации гена zot служил штамм V. cholerae О1 569В классического биовара.
В качестве хозяина для трансформации рекомбинантных плазмид использовали штаммы E. coli Jm103 (thi, strA, endA, sbcB15, hsdR4, A(lac-proAB), [F’, traD36, proAB, lacIqZ AM15]) (Pharmacia) и M15[pREP4] (NaIS, StrS, RifS, Thi-, Lac-, Ara+, Gal+, Mtl-, F-, RecA+, Uvr+, Lon+) (QIAGEN). В качестве вектора для клонирования использовали плазмиду pQE30 (QiAGEN).
Для культивирования штамма E. coli Jm103 использовали жидкую и агаризованную среду LB, для M15[pREP4] к средам добавляли 25 мг/мл канами-цина, а для соответствующих рекомбинантов - дополнительно 50 мкг/мл ампициллина и 0,5 % глюкозы. В качестве индуктора использовали изопропил-ß-D-тиогалактозид (ИПТГ) в конечной концентрации 1 мМ.
Хромосомную и плазмидную ДНК выделяли из клеток холерных вибрионов и кишечной палочки в соответствии с общепринятыми методами [1].
ДНК плазмиды и амплификатов гена zot расщепляли эндонуклеазами рестрикции BamHI и HindIII (Fermentas UAB) в течение 3-4 ч в соответствующем каждому ферменту буфере. Линейную форму плазмиды и амплификаты после рестрикции очищали в 0,7 % агарозном геле и лигировали с использованием ДНК-лигазы Т4 (Fermentas UAB) согласно рекомендациям изготовителя. Лигазной смесью трансформировали компетентные клетки E. coli Jm103, приготовленные с помощью обработки хлористым кальцием [1]. Трансформанты высевали на агар LВ, содержащий 50 мкг/мл ампициллина и 0,5 % глюкозы. Посевы культивировали при 37 °С в течение ночи. Отбирали ампициллинрезистентные колонии и определяли присутствие zot с помощью праймеров для детекции гена. Из позитивных клонов выделяли плаз-мидную ДНК, подтверждали наличие в ней вставки гена zot рестрикцией BamHI и HindIII с последующим электрофорезом в агарозном геле.
Рекомбинантной плазмидой трансформировали компетентные клетки E. coli M15[pREP4]; полученные рекомбинантные клоны проверяли на присутствие гена zot и плазмиды, как описано выше.
Для определения способности рекомбинантов к
продукции Zot их выращивали в жидкой среде LB, содержащей 50 мкг/мл ампициллина (без глюкозы) в течение 3-4 ч и индуцировали 1 мМ ИПТГ в течение 1, 2, 3 и 4 ч при 37 °С с шуттелированием при 150 об/мин. Контролем служил штамм, содержащий векторную плазмиду pQE30 без вставки. Клетки осаждали центрифугированием, лизировали в буфере, содержащем 65 мМ трис-НС1 (pH 6,8), 1 % SDS и 10 мМ 2-меркаптоэтанола, при температуре 96 °С в течение 10 мин. Лизат подвергали электрофорезу в 10 % полиакриламидном геле (ПААГ) с SDS и окрашивали гель Coomassi Blue R250.
Для определения локализации искомого продукта осадки клеток ресуспендировали в 50 мМ Na-фосфатном буфере (pH 8,0), содержащем 1 мМ фе-нилметилсульфонилфторида (PMSF) и 2 мг/мл ли-зоцима, инкубировали на льду в течение 30 мин, добавляли тритон X-100 до 1 % и ДНКазу до 5 мкг/мл, продолжали инкубацию на льду в течение 10 мин, затем замораживали в жидком азоте. После размораживания разделяли растворимую и нерастворимую фракции центрифугированием, добавляли к обеим лизис-буфер, прогревали при 100 °С в течение 10 мин и исследовали в электрофорезе. Процентное содержание Zot по отношению к суммарным клеточным белкам определяли с помощью программы Quantity One.
Для получения препарата-сырца Zot нерастворимую фракцию клеток рекомбинантного штамма, выращенного с индукцией ИПТГ, растворяли в 8 М мочевине, разбавляли равным объемом 10 мМ трис-HCl (рН 8,0), осветляли центрифугированием и подвергали многоступенчатому диализу с постепенным снижением концентрации мочевины в диализном буфере. Содержание общего белка в полученном таким образом препарате определяли методом Лоури.
Для оценки биологической активности Zot использовали культуры клеток эпителия тонкого кишечника человека СаСо2 и фибробластов мышей L-929 из Российской коллекции клеточных культур (Санкт-Петербург). Клетки культивировали соответственно в среде DMEM (Sigma) с 10 % сыворотки плода коровы в течение 5-7 сут и RPMI-1640 (Sigma) с 1 % сыворотки плода коровы в течение 12 сут (до образования плотного монослоя). Испытуемый препарат в разведениях 1:10 - 1:1600 вносили в 96-луночные планшеты с плотным клеточным монослоем и инкубировали в ССЬ-инкубаторе (Sanjo) при 37 °С. Морфологическое изучение культуры проводили в течение 2 дней с помощью инвертированного микроскопа (Reichert). Для фотографирования клетки фиксировали формалином и окрашивали по Романовскому-Гимза.
Результаты и обсуждение
На основе анализа нуклеотидной последовательности гена VC1458 (AE0038852) нами были сконструированы праймеры для ПЦР -синтеза гена zot (AF220606, AF414369, AF542088, AF542089):
и обратный -5'-AAATAAGCTTTCAAAATATACTATTTAGTC-3'.
Поскольку амплификат необходимо было
встроить в плазмидный вектор pQE30 в ориентации, обеспечивающей направление транскрипции под контролем Т5-промотора, на 5'-конце каждого праймера внесен сайт рестрикции для эндонуклеазы, образующей липкие концы: BamHI для прямого праймера и HindIII - для обратного (в приведенных последовательностях выделены жирным шрифтом и подчеркнуты) в соответствии с порядком расположения сайтов рестрикции в полилинкере векторной плазмиды.
В результате трансформации компетентных клеток E. coli Jm103 лигазной смесью получены клоны, несущие рекомбинантную плазмиду, обозначенную pZot69 (рис. 1). Гидролиз этой плазмиды BamHI и HindIII с последующим электрофорезом в агарозном геле подтвердил наличие вставки размером 1,2 т.п.н. Рекомбинантные клоны штамма E. coli Jm103pZot69, однако, не выдерживали длительного хранения на питательных средах даже в присутствии глюкозы и требовали частых пересевов, вероятно, в связи с недостаточно эффективной репрессией Т5-промотора и токсичностью Zot для E. coli. С целью создания более жизнеспособного продуцента мы транформировали pZot69 в штамм M15[pREP4], содержащий низкокопийную плазмиду pREP4, обеспечивающую дополнительную ре-
Рис. 1. Схема плазмиды pZot69
прессию Т5-промотора за счет конститутивной экспрессии входящего в ее состав гена lacI. Действительно, трансформанты оказались более жизнеспособными по сравнению с таковыми Jm103pZot69.
После SDS-электрофореза лизатов клеток E. coli M15[pREP4]pZot69, выращенных с индукцией, в 10 % ПААГ выявлена белковая линия с ММ ~46 кДа, которая отсутствовала как в лизате клеток, выращенных без индукции, так и у контрольного штамма, содержащего векторную плазмиду (рис. 2А). Увеличение времени индукции от 1 до 4 ч не привело к повышению/снижению количества продукта, которое составляло, по данным программы Quantity One, приблизительно 6-7 % суммарных клеточных белков. Эти данные свидетельствуют о способности рекомбинантного штамма к активной экспрессии клонированного гена в присутствии ИПТГ.
Для определения локализации рекомбинантного Zot электрофорезу были подвергнуты также растворимая и нерастворимая фракции клеток (рис. 2Б). Как видно из рисунка, белок с ММ ~46 кДа был выявлен в нерастворимой фракции (тельцах включения), где его содержание составляло —18—21 % суммарных клеточных белков.
Как было показано выше, рекомбинантный белок Zot, продуцируемый штаммом кишечной палочки, имел ММ —46 кДа, соответствующую рассчитанному значению для 6His-Zot, т.е. он не подвергался протеолитическому процессингу. Тем не менее, из литературных данных известно, что гиб-
Рис. 2. SDS-электрофорез в 10 % ПААГ:
А - лизатов клеток рекомбинантных штаммов E. coli M15[pREP4], содержащих плазмиды pZot69 (дорожки 1, 2) и pQE30 (3, 4), выращенных без индукции (1, 3) и с индукцией ИПТГ (2, 4);
Б - нерастворимой (1, 3) и растворимой (2, 4) фракций выращенных с индукцией ИПТГ клеток E. coli M15[pREP4], содержащих плазмиды pQE30 (1, 2) и pZot69 (3, 4).
Рекомбинантный белок 6His-Zot указан стрелкой
Рис. 3. Действие препарата-сырца 6His-Zot
на культуры клеток CaCo2 (слева) и L-929 (справа).
Верхний ряд - контроль, нижний - разрушение tj под действием Zot
Таким образом, гибридный рекомбинантный белок Zot несмотря на отсутствие процессинга и присутствие в его молекуле дополнительных аминокислотных остатков обладает описанной для него биологической активностью - способностью вызывать разрушение tj в культурах клеток.
Использование рекомбинантного штамма E. coli M15[pREP4]pZot69 (КМ 193) в качестве про-
Преимуществом предлагаемого продуцента по сравнению с холерными вибрионами является также то, что его культивирование не требует соблюдения режима работы с возбудителями особо опасных инфекций.
1. Манниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии: Молекулярное клонирование / Пер. с англ. - М.: Мир, 1984. - 2. Монахова Е.В., Писанов Р.В., Михась Н.К. и др. // Журн. микробиол. - 2004. - № 2. -
R.V.Pisanov, E.V.Monakhova, L.P.Alekseyeva, O.V.Markina, L.A.Goncharova
An Escherichia coli Strain - Producer of the Zot-toxin of Vibrio cholerae
Rostov-on-Don Anti-Plague Research Institute
Vibrio cholerae zonula occludens toxin (zot) amplified with the PCR procedure, was cloned as part of pQE30 vector plasmid at BamHI-Hindlll sites. The expression of the gene was controlled by T5 promoter. Eschericia coli strain M15 [pREP4] pZct69 containing the recombinant plasmid, is an active producer of 6His-Zot protein which manifests a biologic activity on the model of cellular cultures causing destructive injuries in the inter-cellular tight junctions of the monolayers. The product is found within the colibacillus cells as inclusion corpuscles. The producer strain may be used to obtain Zot preparations in order to study its significance as one of the cholera vibrio virulence factors and as an agent facilitating intestinal penetrability for certain medical drugs, as well as an immunization adjuvant.
Key words: zonula occludens toxin, cholera vibrio, genetic cloning, recombinant plasmid.
Ускоренная подготовка к ЕГЭ с репетиторами Учи.Дома. Записывайтесь на бесплатное занятие!

-->

Задание 18 № 22762
Установите соответствие между организмами и функциональными группами в экосистемах: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
Б) горох посевной
В) гриб спорынья
Г) бактерия сенная палочка
Запишите в таблицу выбранные цифры под соответствующими буквами.
1) продуцент: Б) горох посевной; Д) железобактерии
2) консумент: В) гриб спорынья (ПАРАЗИТ ЗЛАКОВЫХ); Е) чёрный хорь;
3) редуцент: А) гриб опёнок; Г) бактерия сенная палочка
Продуценты (автотрофные организмы или автотрофы) — организмы, способные синтезировать органические вещества из неорганических. Это, в основном, зелёные растения (синтезируют органические вещества из неорганических в процессе фотосинтеза), однако некоторые виды бактерий-хемотрофов способны на чисто химический синтез органики и без солнечного света. Продуценты являются первым звеном пищевой цепи.
Хемоавтотрофы – для синтеза органических веществ используют химическую энергию. Это серобактерии и железобактерии, получающие энергию при окислении соединений серы и железа (хемосинтез).
Консументы (от лат. consumo — потребляю) — организмы, питающиеся готовым органических веществом (животные, большинство микроорганизмов, в том числе паразитические; частично насекомоядные растения), т. е. поддерживающие свое существование с помощью преобразования вещества, произведенного продуцентами.
Редуценты (от лат. reducens — возвращающий, восстанавливающий) — организмы, главным образом грибы и бактерии, разлагающие мертвое органическое вещество и превращающие их в неорганические вещества, которые в состоянии усваивать другие организмы — продуценты.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
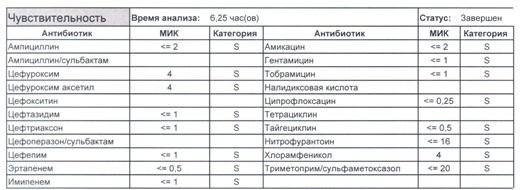
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
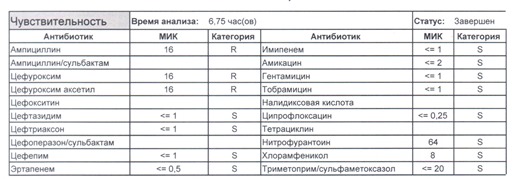
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
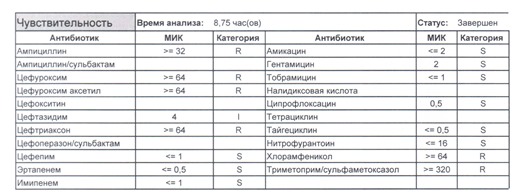
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
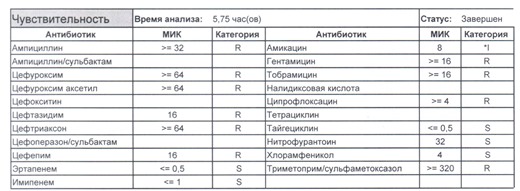
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения
Ускоренная подготовка к ЕГЭ с репетиторами Учи.Дома. Записывайтесь на бесплатное занятие!

-->

Задание 18 № 22762
Установите соответствие между организмами и функциональными группами в экосистемах: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
Б) горох посевной
В) гриб спорынья
Г) бактерия сенная палочка
Запишите в таблицу выбранные цифры под соответствующими буквами.
1) продуцент: Б) горох посевной; Д) железобактерии
2) консумент: В) гриб спорынья (ПАРАЗИТ ЗЛАКОВЫХ); Е) чёрный хорь;
3) редуцент: А) гриб опёнок; Г) бактерия сенная палочка
Продуценты (автотрофные организмы или автотрофы) — организмы, способные синтезировать органические вещества из неорганических. Это, в основном, зелёные растения (синтезируют органические вещества из неорганических в процессе фотосинтеза), однако некоторые виды бактерий-хемотрофов способны на чисто химический синтез органики и без солнечного света. Продуценты являются первым звеном пищевой цепи.
Хемоавтотрофы – для синтеза органических веществ используют химическую энергию. Это серобактерии и железобактерии, получающие энергию при окислении соединений серы и железа (хемосинтез).
Консументы (от лат. consumo — потребляю) — организмы, питающиеся готовым органических веществом (животные, большинство микроорганизмов, в том числе паразитические; частично насекомоядные растения), т. е. поддерживающие свое существование с помощью преобразования вещества, произведенного продуцентами.
Редуценты (от лат. reducens — возвращающий, восстанавливающий) — организмы, главным образом грибы и бактерии, разлагающие мертвое органическое вещество и превращающие их в неорганические вещества, которые в состоянии усваивать другие организмы — продуценты.
.jpg)
В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых – как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Morganella spp. и Proteus spp.
Особо выдающихся представителей семейства Enterobacteriaceae мы уже разбирали в отдельных статьях, а именно представительницу рода Esherichia – кишечную палочку E.coli, а также одну из представительниц клебсиелл – Klebsiella pneumonia. В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых – как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Микробиологические аспекты
Основными клинически значимыми представителями родов семейства Enterobacteriaceae, вызывающими заболевания у человека, являются:
Естественно совсем уж экзотику мы рассматривать не станем, но по наиболее часто встречающимся представителям обязательно пробежимся.
Клинические аспекты
Почему данное семейство так актуально? Наверное, потому, что почти ни одна нозология не обходится без его представителей. В самом широком смысле семейство Enterobacteriaceae является причиной следующих заболеваний:
- со стороны нервной системы: менингит, энцефалит, множественный неврит;
- со стороны мочевыводящих путей –пиелит, пиелонефрит, цистит;
- со стороны желудочно-кишечного тракта – аппендицит, холецистит, панкреатит, которые со своей стороны могут осложниться перитонитом;
- пневмонии, в основном связанные с медицинскими вмешательствами;
- со стороны ЛОР-органов: отиты, назофарингиты;
- со стороны глаз – конъюнктивиты;
- сепсис, как исход всех вышеуказанных состояний, чаще всего уже носящий полимикробный характер.
Как мы видим, наши знакомые отметились практически везде. Но надо обязательно помнить, что выявление вышеуказанных представителей у здоровых людей из респираторного тракта, урогенитального и уж тем более желудочно-кишечного ни в коем случае не говорит о том, что человек чем-то болен, так как в большинстве своем эти микробы являются представителями нормальной микрофлоры, а не все люди умеют мыть руки, особенно летом.
Когда можно думать о наличии бактериальной патологии? Во-первых, когда имеется четкая клиника, во-вторых, когда микробы выделены из стерильных в норме сред, таких как кровь и ликвор, брюшная или плевральная полость, точнее, экссудат оттуда и, в-третьих, когда микроорганизмы выделены в клинически значимых концентрациях (тут в помощь будет ваша бак. лаборатория).
Стоит отметить еще один немаловажный момент – не все представители семейства Enterobacteriaceae умеют жить вне организма человека, и поэтому не размножаются во внешней среде, а потому обнаружение оных на пищевых продуктах и всевозможных поверхностях в лечебных учреждениях говорит о фекальном загрязнении, проще говоря, о неумении обрабатывать руки после посещения туалетной комнаты. Одним из таких микробов-детекторов является кишечная палочка, и стоит ее поймать даже не на руках персонала, а, например, на компьютерной мышке, как дальше можно уже ничего не искать, а начинать очередной этап избиения младенцев, пардон, обучения правилам асептики и антисептики, в частности, обработки рук.
Но давайте перейдем к частностям – и первым микроорганизмом, который будем сегодня рассматривать, станет:
Morganella spp.
Зверюшка названа так в честь своего первооткрывателя Гарри Р. Моргана.
Начнем традиционно с микробиологических аспектов
Семейство морганелл включает единственный вид M. morganii, включающий два подвида M. morganii и M. sibonii, которые различаются только ферментацией трегалозы.
Морганеллы являются представителями нормальной микрофлоры как человека, так и животных, а потому могут присутствовать в качестве сапрофитов в окружающей (внебольничной!) среде.
Морганеллы имеют довольно сложные отношения с антибактериальными препаратами и обладают природной резистентностью к:
- пенициллинам,
- цефалоспоринам 1 и 2 поколения,
- макролидам, .
Проявляют высокую чувствительность к:
- аминогликозидам, ,
- цефалоспоринам 3 и 4-го поколения,
- карбопенемам,
- фторхинолонам
Клинические аспекты
Как говорилось выше, морганеллы являются частью нормальной микрофлоры человека, крайне редко вызывая инфекционные заболевания. Чаще всего они являются возбудителями осложненных инфекций мочевыводящих путей.
Факторами риска развития инфекции являются:
- пожилой возраст,
- иммунодефициты любой этиологии,
- длительное лечение в стационаре,
- установленные мочевые катетеры.
В качестве механизмов резистентности морганеллы способны продуцировать бета-лактамазы, чем и объясняется их природная устойчивость к пенициллинам и цефалоспоринам 1-2 поколений. При нерациональном использовании антибиотиков они начинают вырабатывать бета-лактамазы расширенного спектра и факторы устойчивости к фторхинолонам, которыми довольно бодро делятся с соседями по семейству Enterobacteriaceae. Отдельно стоит отметить способность отдельных штаммов морганелл к резистентности к имипенему.
Какие заболевания вызывают чаще всего:
- инфекции мочевыводящих путей,
- сепсис, чаще всего уросепсис полимикробной этиологии,
- хирургические инфекции, связанные с оказанием медицинской помощи (они же нозокомиальные),
- редко, но вызывают септические артриты,
- крайне редко вызывают менингиты, эндофтальмиты, перикардиты,
- неонатальный сепсис и хориоамнионит.
Терапевтические аспекты
Антибактериальная терапия будет полностью зависеть от результата из микробиологической лаборатории. Повторимся еще раз, микроб изначально умеет вырабатывать бета-лактамазы, а потому в случае развития осложненных инфекции мочевыводящих путей, которые чаще всего уже не связанны с кишечной палочкой, препаратами выбора становятся карбопенемы (имипенем, если штамм к нему чувствителен, или меропенем), дозирование которых проводится с учетом клиренса креатинина. Длительность лечения должна быть не менее 7 дней. В качестве альтернативы можно использовать цефалоспорин 4-го поколения Цефипим каждые 8 часов или фторхинолоны.
Аминогликозиды, несмотря на чувствительность к оным, при лечении заболеваний мочевыводящих путей лучше не применять в виду их нефро- и отоксичности, и по этой же причине их невозможно будет использовать около трех месяцев после проведенной терапии, например, в лечении синегнойной инфекции. Цефалоспорины третьего поколения тоже применять не стоит, так как морганеллы довольно быстро обзаводятся бета-лактамазами расширенного спектра, которые, как мы помним, эту генерацию препаратов быстро инактивируют.
Proteus spp.
Микробиологические аспекты
Протей долгое время был практически родным отцом морганеллы, так как последняя рассматривалась как один из видов рода протей. Этот род примечателен тем, что занимает почетное второе место по выявляемости после кишечной палочки в семействе Enterobacteriaceae.
В данный момент представителями рода протей являются P. mirabilis, вызывающий порядка 90% инфекционных заболеваний, а также P. vulgaris и P. penneri.
Клинические аспекты
Протеи выступают возбудителями порядка 10% неосложненных инфекций мочевыводящих путей, с чем могут быть связаны неудачи в лечении последних с использованием аминопенициллинов.
Как и все клинически значимые возбудители семейства Enterobacteriaceae, протей является возбудителем нозокомиальных инфекций, таких как пневмония, вплоть до сепсиса. Кроме того выступает возбудителем интраабдоминальных, а также хирургических инфекций кожи и мягких тканей, сепсиса, связанного с медицинскими вмешательствами как последствий нозокомиальной пневмонии в результате недостаточной дезинфекции, например, бронхоскопов.
Таким образом, мы видим, что, как и в предыдущем случае, проще правильно помыть руки и обработать инструменты, чем лечить это все с учетом природной и приобретенной резистентности.
Терапевтические аспекты
Как и в случае с морганеллой, нам просто необходим результат микробиологического исследования с определением чувствительности по МПК возбудителя либо результаты микробиологического мониторинга, которые помогут предположить зверей в случае неудачи ранее проводимого лечения.
В случае ампициллин-чувствительного P.mirabilis именно ампициллин может выступать препаратом первой линии. Кроме того, возможно использование цефуроксима и фторхинолонов. Обязательным аспектом лечения является его длительность. В случае неосложненных инфекций мочевыводящих путей (цистита) – не менее 3 дней, пиелонефрита – 10-14 дней, осложненных инфекций – 10-21 день. Сепсис является состоянием, требующим индивидуального подхода, но лечим не менее 14 дней.
На этом на сегодня мы закончим, но повторим одну базовую и, чего уж, наиважнейшую истину: в лечении инфекций, связанных с любым представителем семейства Enterobacteriaceae, самым главным будет являться профилактика. А именно правильное и тщательное мытье рук. Обеспечим мытье рук, не будет большинства проблем с инфекциями, вызванными указанным семейством.
Читайте также:

