Кишечная палочка имеет митохондрии
Обновлено: 18.04.2024
Внутреннюю организацию клетки животных и растений можно сравнить с коммуной, где все равны и каждый выполняет одну, очень специфическую роль, создавая сбалансированный ансамбль. И вот только одна структура, митохондрия, может похвастаться множественностью внутриклеточных функций, которые определяют ее уникальность и обособленность, граничащие с некоторой самодостаточностью.
Эту структуру открыли в середине XIX века, и в течение 150 лет почти все считали, что ее единственная функция — быть энергетической машиной клетки. Грубо говоря, организм получает питательные вещества, которые после определенной деградации доходят до митохондрии и дальше происходит окислительная деградация питательных веществ, сопряженная с запасанием энергии в виде богатой энергией фосфорной связи в молекуле АТФ. Организм повсеместно использует энергию АТФ, расходуя ее на проведение нервного сигнала, мышечное сокращение, образование тепла, синтез нужных клеточных компонентов, уничтожение ненужных веществ и пр. В сутки в организме человека генерируется АТФ, весом равная весу самого человека, и в основном это заслуга митохондрий. До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует.
До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует
Постулат доминирующей в клетке энергетической функции митохондрии как-то оставлял в тени уже давно высказанную и всеми поддерживаемую теорию бактериального происхождения митохондрий. В простой трактовке она выглядит так: около 600 млн лет назад в клетку т. н. гетеротрофов внедряется бактерия, которая умеет утилизировать кислород. Есть точка зрения, что появление внутри клетки нового типа бактерий было вызвано постоянным увеличением в атмосфере Земли кислорода, начавшим поступать из мирового океана в атмосферу около 2,4 млрд лет назад. Высокая окислительная способность кислорода представляла опасность для внутриклеточных органических и неорганических элементов, и появляются бактерии, уничтожающие кислород в присутствии ионов водорода с образованием воды. Таким образом внутри клетки содержание кислорода уменьшается, а с ним и уменьшается вероятность нежелательного окисления клеточных компонентов, что, наверно, полезно для клетки.
Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики
Есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий
Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка

Американские биологи заставили кишечную палочку поселиться внутри клеток дрожжей и выполнять функции сломанных митохондрий. Результаты эксперимента, который имитирует ранние этапы эволюции митохондрий, описаны в статье, опубликованной в журнале Proceedings of the National Academy of Sciences.
Еще в начале XX века ученые заметили, что митохондрии (и хлоропласты растений) удивительно похожи на бактерий, а в 1970-х годах Линн Маргулис и ее последователи свели сведения об этом в теорию эндосимбиоза. Согласно ей, все митохондрии были раньше свободноживущими бактериями, способными очень эффективно перерабатывать углеводы при помощи кислорода, а потом попали внутрь предковой эукариотической клетки. По каким-то причинам они не были переварены, как это обычно происходит, а остались целы. Клетка-хозяин предоставила им укрытие, стала снабжать разными необходимыми веществами, а симбионты, в свою очередь, стали снабжать клетку энергией.
С того момента бывшая свободноживущая бактерия сильно видоизменилась и настолько приспособилась к жизни внутри клетки, что теперь считается ее частью. Например, в митохондриях осталась лишь короткая ДНК с самым базовым набором генов, тогда как большая их часть исчезла за ненадобностью или переехала жить в ядерный геном. Поскольку симбиоз случился довольно давно — больше полутора миллиардов лет назад, — разобраться в ранних этапах со-настройки предков эукариот и их митохондрий времена довольно сложно. В основном это делается при помощи реконструкции на основе современных митохондрий.
После того, как организмы были подготовлены ко встрече друг с другом, их посадили вместе, и дальше, чтобы отобрать варианты с удачным симбиозом, начали растить на среде, для переработки которой дрожжам бы понадобилась помощь кишечных палочек. Оказалось, что дрожжи без митохондриальной ДНК не выживают в таких условиях, а дрожжи с выключенным cox2 геном образуют очень маленькое число колоний. По идее, эти колонии могли выжить за счет бактерий, которые их окружали, и не формировать эндосимбиоз. Чтобы учесть такой вариант, исследователи пересадили эти колонии на среду, в которой не могут расти отдельно ни дрожжи, ни кишечные палочки (без тиамина и без альтернативных источников энергии). Оказалось, что в таких условиях не выжил никто.
Авторы статьи считают, что подобная синтетическая модель эндосимбиоза позволит лучше разобраться в том, как происходила коэволюция митохондрии и эукариотической клетки, в том числе — как уменьшался бактериальный геном (свободноживущая бактерия обычно имеет несколько тысяч разных генов, тогда как в геноме митохондрии их не больше ста). Например, они попробовали убрать из него еще один важный ген и оказалось, что химеры с такими кишечными палочками тоже вполне жизнеспособны.

Рис. 1. Почвенный грибок Rhizopus microsposus. Грибок держится за субстрат при помощи ризоидов, от основания которых отходят три коричневатых спорангиофора. На спорангиофорах находятся серо-синие спорангии сферической формы, заполненные округлыми спорангиоспорами (спорами бесполого размножения). Фото с сайта adelaide.edu.au
Бактерии-эндосимбионты часто приносят своим хозяевам немалую пользу. В недавней статье, опубликованной в журнале Current Biology, описан еще один любопытный пример таких взаимоотношений. Ученые выяснили, что у почвенного грибка Rhizopus microsposus есть эндосимбиотическая бактерия Ralstonia pickettii. В серии экспериментов они показали, что именно благодаря этой бактерии споры грибка способны уклоняться от поглощения как почвенными амебами, так и иммунными клетками человека. По отдельности и споры, и бактериальные клетки оказываются практически беззащитными перед фагоцитами. Впрочем, молекулярно-биологические основы этого союза пока установить не удалось.
Вообще, эндосимбиотические бактерии — штука во многих отношениях полезная. Так, бактерии, живущие в клубеньках бобовых растений, фиксируют атмосферный азот и обеспечивают своих хозяев легкоусвояемыми соединениями азота. А бактерии, входящие в состав кишечной микрофлоры, осуществляют биосинтез витамина K и некоторых витаминов группы B, участвуют в метаболизме желчных кислот и стеринов, а также нейтрализуют антибиотики (G. Clarke et al., 2014. Minireview: Gut microbiota: the neglected endocrine organ). Подобные примеры можно приводить очень долго — тем более, что их список постоянно пополняется. В недавней статье, опубликованной в журнале Current Biology, показано, что почвенный грибок Rhizopus microsposus защищается от питающихся его спорами амеб благодаря эндосимбиотической бактерии.
Обычно грибок Rhizopus microsposus из порядка мукоровых (Mucorales) обитает в почве. Однако некоторые представители мукоровых (R. microsporus в том числе) могут вызывать у людей с ослабленным иммунитетом заболевание, известное как мукормикоз. При мукормикозе могут поражаться разные ткани и органы, нередко болезнь приводит к летальному исходу. Инфицирование происходит при попадании в организм иммунологически инертных спор, находящихся в покоящемся состоянии.
Прорастание спор начинается с активации метаболизма и набухания, а метаболически активные споры иммунная система уже может распознать. Дело в том, что на поверхности набухающей споры появляются особые молекулы, которые внутри организма человека не встречаются. Их появление служит однозначным сигналом для иммунной системы (такие молекулы называют MAMPs — microbe-associated molecular patterns). Самая первая и неспецифичная реакция иммунной системы, которую может вызвать пробравшийся в организм патогенный микроб (да и просто что-то инородное), — захват подозрительной частицы иммунными клетками и ее дальнейшее расщепление в ходе фагоцитоза. Фагоцитировать в той или иной степени способны многие иммунные клетки, но в кровотоке этим занимаются преимущественно нейтрофилы, а в тканях — макрофаги. Собственно, и споры грибов, наряду с множеством мелких чужеродных частиц, постоянно попадающих в организм человека, оседают на слизистых, где в норме быстро подвергаются фагоцитозу и уничтожаются. Однако набухающие споры плесневого грибка Rhizopus microsposus каким-то образом ухитряются уклоняться от фагоцитоза.
Для проверки этой гипотезы ученые поместили набухающие споры R. microsposus в раствор культуральной среды на некоторое время, а затем налили эту среду на клетки J774A.1 и оценили их способность фагоцитировать покоящиеся споры R. microsposus. Оказалось, что эта среда не только предотвратила поглощение спор R. microsposus, но, похоже, заблокировала фагоцитоз как таковой, потому что макрофаги оказались неспособны поглощать и дрожжевые клетки. Что же за загадочное вещество (или смесь веществ) выделяют прорастающие споры R. microsposus?
Здесь нужно отметить, что эти вещества может выделять не сам грибок, а эндосимбиотические бактерии, живущие внутри его клеток. Среди грибов наличие эндосимбиотических бактерий далеко не редкость. Авторы исследования выяснили, что у штамма R. microsposus, с которым они работали, действительно есть внутриклеточный компаньон. Им оказалась бактерия Ralstonia picketii. Ранее ее находили в образцах воды и почвы, однако иногда она присутствует на необработанном медицинском оборудовании. Ученым удалось ясно визуализировать клетки бактерии внутри гиф и спор гриба, причем после обработки антибиотиком ципрофлоксацином бактериальные клетки исчезали (рис. 2).

Рис. 2. Клетки бактерии R. picketii в гифах R. microsposus. Бактериальные клетки окрашены красителем SYTO9. После обработки ципрофлоксацином клетки бактерии погибают, поэтому в гифах они не выявляются. Изображение из обсуждаемой статьи в Current Biology

Рис. 3. Амебоидные клетки D. discoideum до и после добавления среды, в которой были выдержаны прорастающие споры R. microsposus с эндосимбиотической бактерией. Черные стрелки указывают на крупные вакуоли, появившиеся в амебах под действием среды, желтыми звездочками отмечены формирующиеся выпячивания цитоплазмы. Изображение из обсуждаемой статьи в Current Biology
Тут следует сделать небольшое отступление и отметить, что в цитоплазме любой клетки, неважно, способна ли она к фагоцитозу или нет, постоянно происходит перемещение мембранных пузырьков — везикул. Везикулы снуют по клетке в разных направлениях с помощью транспортных белков, которые, как по рельсам, тащат их по микротрубочкам. Часть везикул несут к поверхности клетки белки, предназначенные для выделения во внешнюю среду. Перед тем, как загрузиться в везикулы, эти белки проходят сложный процессинг в эндоплазматическом ретикулуме и аппарате Гольджи, причем между эндоплазматическим ретикулумом и аппаратом Гольджи белки путешествуют тоже в составе везикул. После того как везикула с грузом успешно достигла поверхности клетки, она сливается с клеточной мембраной, высвобождая свое содержимое наружу. Однако, если везикулы будут только сливаться с мембраной клетки, то очень быстро она раздуется до непомерных размеров, поэтому вскоре после слияния и высвобождения груза везикулы отпочковываются внутрь клетки и возвращаются обратно. Если клетка захватывает что-то извне, например, фагоцитирует спору гриба, то участок ее мембраны вворачивается внутрь и отпочковывается в цитоплазму, образуя так называемую эндосому (так называют мембранные пузырьки, отпочковывающиеся от клеточной мембраны, когда клетка захватывает что-то извне; если произошел фагоцитоз, то эндосому принято называть фагосомой). Далее с эндосомой сливаются лизосомы — мембранные органеллы, содержащие ферменты, которые расщепляют содержимое эндосомы. Вся эта запутанная система внутриклеточных везикул и мембранных органелл получила название эндомембранной системы, а фагоцитоз можно рассматривать как частный пример ее функционирования.
Вернемся к нашему грибку. Дальнейшие эксперименты показали, что прорастающие споры R. microsposus не только препятствуют фагоцитозу, но и снижают способность амебы к уничтожению захваченных бактерий. Под действием среды, в которой находились прорастающие споры R. microsporus, амебы в половине случаев не могли убить фагоцитированную клетку гриба, и бактерия, заключенная в мембранный пузырек, могла остаться живой.
Итак, можно сказать, что союз грибка R. microsposus и бактерии R. picketii приводит к тому, что прорастающие споры, содержащие клетки эндосимбионта, нарушают фагоцитоз и созревание фагосом, включая уничтожение захваченного в составе фагосомы микроорганизма.
Любопытно, что R. picketii вызывает существенные изменения в организации стенки споры грибка R. microsposus: стенки спор, не содержащих бактерии, содержат больше хитина, белка и полисахарида маннана. Вполне возможно, что изменение химического состава стенки споры в присутствии R. picketii отрицательно сказывается на ее доступности для фагоцитоза, но пока это не выяснено.
Не секрет, что на нашем теле и слизистых обитает множество микроорганизмов, грибков и вирусов. По примерным подсчетам, их общее число даже превышает общее количество всех клеток нашего тела и составляет порядка 1014-15. В кишечнике человека, например, количество бактерий измеряется килограммами и по примерным оценкам составляет около 1–3 кг [1].
Такое взаимовыгодное сожительство биологи называют симбиозом. Пока мы здоровы, а наша иммунная система функционирует без перебоев, эти микроорганизмы не причиняют неудобств, а многие из них выполняют полезные функции. Однако стрессовые факторы, болезни, прием лекарств и многие другие обстоятельства превращают наших добрых соседей во врагов, которые могут стать причиной инфекций: острых и хронических [1,2].
Одним из таких типичных представителей условно-патогенной флоры является кишечная палочка, E. coli, которая может вызвать расстройства кишечника и инфекции мочеполового тракта [3,4]. О ней мы и поговорим сегодня.
Что такое E.coli
Кишечная палочка является обычным представителем нормальной флоры толстого кишечника. Она может жить как в условиях отсутствия кислорода, так при его наличии. Специалисты называют такие бактерии облигатными анаэробами. Благодаря этому качеству кишечная палочка может выживать в окружающей среде и становиться источником заражения.
Наиболее многочисленными представителями кишечной микрофлоры являются строгие анаэробы, для которых кислород смертельно ядовит. Они составляют около 80–90% от всего количества микроорганизмов. К ним относятся представители пропионобактерий, эубактерий, анаэробных лактобактерий, вейлонелл, несколько видов кокков, бактероидов, кампилобактер, псевдомонад и др.
10–20% микробиоты толстого кишечника составляют кишечные палочки, клостридии, стафилококки, цитробактер, коринебактерии, вирусы, бактериофагов, грибки рода Кандида и Аспергиллов, одноклеточные простейшие, а также многие другие виды микроорганизмов [1].
Какие полезные функции выполняют эшерихии?
- пищеварение: разлагает хитин, целлюлозу, клетчатку, низкомолекулярные остатки жирных кислот;
- поддержание местного иммунитета, защита кишечника от патогенных бактерий;
- стимуляция перистальтики, продвижения кишечного содержимого, формирование каловых масс;
- участие в обмене компонентов желчи и других биологически активных веществ (таурина, глицина, эстрогенов, холестерина, глутатиона и др.) и их обратном всасывании;
- активация пристеночного пищеварения;
- стимуляция местного иммунитета;
- активация или торможение всасывания железа, витаминов группы Д;
- синтез витаминов группы В и К;
- детоксикация различных соединений и др. [1,2]
Почему кишечные палочки становятся возбудителями заболеваний?
Поскольку все представители нормальной микрофлоры обитают в просвете кишечника или в пристеночном пространстве, они активно контактируют между собой. В норме они не проникают внутрь клеточной оболочки слизистой кишечника.
При таком тесном контакте нельзя исключить обмен участками ДНК между бактериями. Это обычный способ взаимодействия, благодаря которому микробы могут быстро приспосабливаться к меняющимся условиям окружающей среды. До тех пор, пока кишечные палочки не приобретают генетические элементы, кодирующие факторы заразности и токсичности, они остаются нашими добрыми соседями.
Симптомы
Перечислим признаки наиболее частых заболеваний, которые могут быть вызваны патогенными штаммами Escherichia coli.
Диарея путешественников
Причиной расстройства кишечника являются штаммы E. coli O157:H7. Заражение происходит через немытые овощи, фрукты, полусырое мясо, непастеризованное молоко, из-за глотка воды из подозрительного источника. В отличие от других возбудителей инфекции, кишечная палочка может вызвать заболевание, даже если концентрация микробов была незначительной.
Как проявляется диарея путешественников:
- болезнь начинается через три-четыре дня после контакта с бактериями (или после приезда в другую страну);
- диарея: от легкой и водянистой до тяжелой и кровавой;
- спазмы в животе, боль или болезненность при пальпации;
- тошнота и рвота.
Здоровые взрослые обычно выздоравливают от заражения кишечной палочкой O157:H7 самостоятельно в течение недели. Маленькие дети и пожилые люди, а также люди с хроническими болезнями органов пищеварения переносят болезнь тяжелее и могут подвергнуться риску развития опасной для жизни формы почечной недостаточности. Если состояние ухудшается, обезвоживание достигает высокой степени, повышается температура, выделения приобретают кровавый оттенок — необходимо обратиться к врачу [5].
Инфекции мочевыводящих путей
Несмотря на близость к прямой кишке и потенциальный риск заражения, слизистые мочевыводящих путей защищены от проникновения микробов из кишечника благодаря местным факторам защиты, нисходящему току мочи и слабокислой среде, которая токсична для большинства представителей кишечной микрофлоры.
Но существуют штаммы Escherichia coli, которые приспособились к этим условиям и научились выживать и размножаться в непривычной среде. В этом им помогают шипики и жгутики, набор ферментов и токсинов, которые облегчают прикрепление к слизистым оболочкам, проникновение внутрь клеток и создание вокруг колоний специфического защитного окружения. До 75% всех уретритов и циститов бывают вызваны уропатогенными подвидами кишечных палочек.
- расстройством мочеиспускания: оно становится частым, болезненным, ощущается жжение, резь при выделении мочи;
- моча приобретает мутноватый цвет, меняется ее запах;
- число походов в туалет увеличивается, моча выделяется малыми порциями, возможно ночное мочеиспускание.
Реже встречается повышение температуры, недержание мочи или чувство неполного опорожнения, а также появление крови в моче [3].
Лечение инфекций, вызванных кишечной палочкой
Терапию инфекционных заболеваний должен проводить специалист. С этими симптомами можно обратиться к терапевту, инфекционисту, гастроэнтерологу, урологу. Лечением, которое направлено на причину болезни, является назначение антибиотиков и антибактериальных препаратов. Эти средства нельзя принимать самостоятельно без назначения специалиста.
Для уменьшения симптомов заболеваний могут также назначать:
- растворы для восполнения потери жидкости при сильной диарее и рвоте;
- диету с ограничением сложных для переваривания продуктов;
- спазмолитики при сильных болях в животе;
- безрецептурные препараты для облегчения боли и спазма при циститах и уретритах [3,5].
В каких случаях специалисты могут назначать растительные безрецептурные препараты для уменьшения боли и спазма? Например, в комплексе с антибактериальной терапией. Одним из средств, которые облегчают состояние при цистите*, является паста Фитолизин®, в ее состав входят сгущенный экстракт смеси из девяти растительных компонентов, а также четыре эфирных масла в качестве вспомогательных веществ. Пасту для приготовления суспензии нужно просто растворить в теплой подслащенной воде — и средство готово к применению. По инструкции одну чайную ложку пасты разводят в половине стакана теплой сладкой воды, принимают 3-4 раза в день после еды,. Период лечения может составить от 2 недель до 1.5 месяцев. Легкость в приготовлении позволяет проводить лечение в любых условиях: дома, на работе, в командировке, в отпуске [6].
Конечно, если причиной дискомфорта стал цистит или уретрит, то самолечение недопустимо. Полноценное лечение должен назначить специалист после обследования и осмотра пациента.
Профилактика инфекций, вызванных E.coli
К сожалению, никакая вакцина или профилактическое средство не могут защитить вас от болезни, вызванной кишечной палочкой, хотя исследователи изучают потенциальные возможности для их разработки.
Чтобы снизить вероятность заражения кишечной палочкой, соблюдайте следующие меры:
- Не пейте воду из подозрительных источников.
- Не глотайте воду в бассейне.
- Мойте фрукты и овощи перед тем, как их съесть.
- Не употребляйте непрожаренное мясо в пищу.
- Пейте пастеризованные напитки.
- Тщательно мойте посуду, разделочные доски, столешницы, если они соприкасаются с сырым мясом, грязными овощами или зеленью.
- Мойте руки после посещения туалета, контакта с животными или прикосновения к предметам, которые могут быть загрязнены, и следите за тем, чтобы дети обязательно выполняли эти правила [5].
Для профилактики инфекций нижних мочевыводящих путей, вызванных кишечной палочкой, есть свои методы профилактики:
- Пейте больше воды — не менее 1,5л в сутки.
- Подмывайтесь и мочитесь до и после полового контакта.
- Женщинам нужно подмываться спереди назад, чтобы микрофлора из области заднего прохода не попадала в уретру.
- Носите белье из натуральных тканей и меняйте его при малейшем загрязнении.
Специфическим методом профилактики цистита, вызванного эшерихиями, можно считать длительный курсовый прием лизатов уропатогенных штаммов E.coli. Также существуют хирургические методы лечения, которые уменьшают частоту рецидивов хронического цистита [3].
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
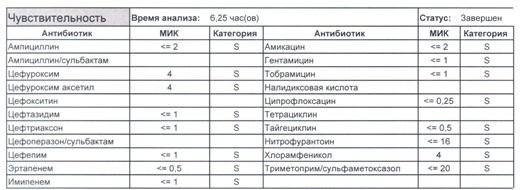
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
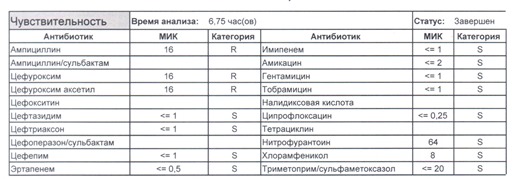
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
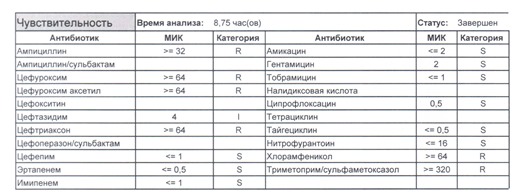
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
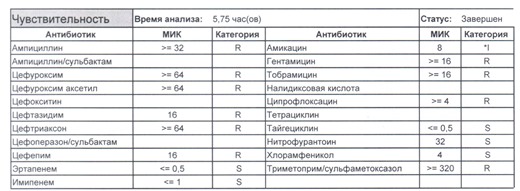
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения
Читайте также:

