Кишечная палочка при няк
Обновлено: 25.04.2024
Неспецифический язвенный колит и кишечные инфекции. Дифференциация НЯК
Неспецифический язвенный колит (НЯК) представляет собой хроническое воспалительное заболевание кишечника, этиология и патогенез которого до настоящего времени остаются неясными. В последние годы число случаев НЯК увеличилось, преимущественно среди лиц молодого возраста.
Существуют известные трудности в дифференциальной диагностике острого (молниеносного) течения НЯК и пищевых токсикоинфекций, а также хронического рецидивирующего течения НЯК и дизентерии.
Сложность диагностики наблюдается чаще всего в дебюте заболевания. Особенно трудной она бывает при острой тяжелой форме НЯК. Заболевание характеризуется высокой температурой, ознобами, болями в области живота, жидким стулом (иногда водянистым) и довольно быстро появляющейся примесью крови в испражнениях.
Под нашим наблюдением находились 18 пациентов (женщин в возрасте от 18 до 40 лет), госпитализированных с диагнозом пищевой токсикоинфекций, у которых был выявлен НЯК. В анамнезе у 11 пациенток отмечалась дисфункция кишечника на протяжении последних 2—3 лег, но за медицинской помощью обращались лишь 2 пациентки. Последним было назначено симптоматическое лечение, а рентгенологические исследования и колоноскопия не проводились.
Все пациентки поступили в отделение на 2—4-й день болезни: у 4 из них состояние было тяжелым, у 14 — среднетяжелым; температура тела у 13 была в пределах 38—39 °С, у 5 — выше 39 °С. Длительность лихорадки во всех наблюдениях — от 7 до 25 дней, и в большинстве случаев температура нормализовалась подвлиянием специфической терапии (сульфосалазин).
Тошнота наблюдалась у 7 больных, рвота — у 3, диарея — у всех. У 4 больных стул в первые 3 дня болезни был до 10 раз в сутки, у 14 — более 10 раз; примесь слизи в испражнениях отмечалась у 3, примесь крови — у 17 больных в первые 10 дней наблюдения. Боль в области живота не была ведущим симптомом и чаще всего возникала при пальпации по ходу толстой кишки. Живот, как правило, был умеренно вздут. У 3 больных пальпация живота сопровождалась "шумом плеска".
Особенно трудно дифференцировать прогрессирующую форму НЯК от острой дизентерии. При обоих заболеваниях возможно острое начало с кровянистой диареей, тенезмами, лихорадкой и другими сходными симптомами. Однако в последующем начинают преобладать симптомы, нехарактерные для дизентерии: тяжелое течение с гектической лихорадкой, анемия, тахикардия, псевдополипоз, массивные кишечные кровотечения, перфорация кишечника, увеличение печени и селезенки. При бактериологических исследованиях канала ши-геллы не выявляются.
Не меньшую сложность представляет дифференциальный диагноз между НЯК и хронической дизентерией (в стадии обострения). По мнению В.К.Карнаухова (1963), правильной диагностике в этих случаях помогает следующее:
• отсутствие в анамнезе больных НЯК указаний на перенесенную в прошлом дизентерию;
• постепенное начало болезни с появлением ректальных кровотечений и слизисто-гнойных выделений из заднего прохода;
• необычная кровоточивость слизистой оболочки прямой кишки;
• частота артралгий и кожных поражений;
• связь обострения НЯК с интеркуррентными инфекциями и стрессовыми ситуациями;
• неэффективность антибиотикотерапии;
• отсутствие шигелл в испражнениях.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
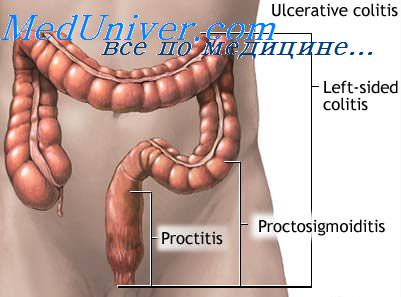
В англоязычном варианте МКБ-10 мукозный проктоколит описывается как левосторонний колит (left hemicolitis or Left-sided colitis) - зона поражения включает в себя прямую, сигмовидную и нисходящую часть поперечно-ободочной кишки до селезеночного угла включительно.
Левосторонний колит является наиболее частой по локализации формой неспецифического язвенного колита.
Неспецифический язвенный колит (НЯК) - это хроническое рецидивирующее воспалительное заболевание кишечника неустановленной этиологии, которое характеризуется наличием диффузного воспалительного процесса в слизистой оболочке толстой кишки.
Примечание 1. Из данной подрубрики исключено:
- Язвенный (хронический) проктит - K51.2;
- Язвенный (хронический) ректосигмоидит - K51.3;
- Язвенный (хронический) энтероколит - K51.0;
- Другие язвенные колиты - K51.8.
Примечание 2. Термин "неспецифический язвенный колит", отражающий не только клиническую сущность заболевания, но и идиопатический характер воспаления слизистой оболочки кишки, применяют только в отечественной литературе. В иностранной литературе для обозначения данного заболевания используют термин "язвенный колит". Вместе с тем, следует отметить, что язвенный характер поражения слизистой оболочки толстой кишки, подчеркнутый в названии заболевания, не является обязательным условием для постановки подобного диагноза.
Классификация
С целью правильной клинической интерпретации и разработки оптимальной программы лечения конкретного пациента, каждый клинический случай заболевания следует оценивать по локализации и протяженности воспалительного процесса в толстой кишке, характеру течения и тяжести обострения заболевания.
Классификация неспецифического язвенного колита по распространенности поражения:
4. Тотальный колит.
Обычно заболевание начинается с поражения прямой кишки (дистальный колит), затем воспалительный процесс распространяется по восходящей на остальные отделы толстой кишки. Примерно в 80% случаев воспалительный процесс поражает толстую кишку только до селезеночного изгиба (левосторонний колит). У остальных больных поражение распространяется на поперечно-ободочную, а затем и на восходящую кишку (субтотальный или тотальный колит).
Для оценки тяжести атаки заболевания наиболее проста и удобна в практической деятельности клинициста классификация по Трулав и Виттс (1955). Данная классификация позволяет различать выраженность обострения по степени тяжести, что определяет различие лечебных подходов в каждом конкретном случае.
| Симптомы | Легкий | Среднетяжелый | Тяжелый |
| Частота стула в сутки | ≤ 4 | 4-6 | >6 |
| Примесь крови в стуле | Незначительная | Умеренная | Значительная |
| Лихорадка | Отсутствует | Субфебрильная | Фебрильная |
| Тахикардия | Отсутствует | ≤ 90 в минуту | >90 в минуту |
| Уровень гемоглобина | >110 г/л | 90-100 г/л | |
| СОЭ | ≤ 30 | 30-35 | >35 мм/ч |
| Лейкоцитоз | Незначительный | Умеренный | Выраженный со сдвигом формулы |
| Похудание | Отсутствует | Незначительное | Значительное |
| Симптомы мальабсорбции | Отсутствуют | Незначительные | Выраженные |
Существует определенная корреляция между распространенностью воспалительного процесса в толстой кишке и тяжестью обострения заболевания. Например, тяжелые атаки возникают почти в половине случаев при тотальном колите и значительно реже при левостороннем.
1. Рецидивирующее течение. Клинически рецидивирующая форма протекает с чередованием различных по продолжительности периодов атак заболевания и фаз ремиссии. О часто-рецидивирующей форме НЯК свидетельствуют повторные обострения заболевания (2 раза в год или чаще) и короткие периоды ремиссии.
2. Непрерывное течение (обострение два раза в год и чаще), при котором не удается достичь клинической и эндоскопической ремиссии в течение длительного времени. Диагностируют примерно у каждого десятого пациента.
3. Фульминантая форма - наиболее часто встречается при клинической манифестации заболевания; характерно тяжелое течение и развитие осложнений.
В Российской Федерации выделяют следующие формы заболевания:
1. По течению: молниеносное, острое, хроническое рецидивирующее (повторные обострения), непрерывное, рецидивирующее (обострение более 6 месяцев при условии адекватного лечения).
2. По протяженности процесса: дистальная (прямая и сигмовидная кишка), левосторонняя (до селезеночного изгиба), субтотальная (до печеночного изгиба), тотальная (панколит) формы.
3. По степени тяжести: легкая, среднетяжелая, тяжелая формы.
4. По активности процесса: минимальная, умеренная, максимальная.
5. По фазам заболевания: обострение, ремиссия.
Этиология и патогенез
Этиология неизвестна. В генезе заболевания обсуждают роль различных инфекционных факторов. Возможно, речь идет о так называемых "детских инфекциях", в частности паротите. Вероятно, воздействие различных микроорганизмов. В частности в качестве триггера, который приводит к извращенному иммунному ответу организма, может выступать воздействие патогенной микрофлоры кишечника. Протективными факторами являются курение и аппендэктомия, выполненная в связи с острым аппендицитом в молодом возрасте. Предполагается, что язвенный колит может возникать вследствие взаимодействия генетических факторов и факторов окружающей среды (пищевые продукты, психоэмоциональная нагрузка, прием неселективных НПВП и прочее), которое вызывает срыв регуляторных механизмов, сдерживающих иммунные реакции на неизвестные кишечные бактерии.
В патогенезе воспалительных заболеваний кишечника доказана ведущая роль аутоиммунного компонента, однако конкретные антигены, инициирующие иммунный ответ, не идентифицированы. Этот фактор отличает воспалительные заболевания кишечника и в частности НЯК от прочих заболеваний пищеварительного тракта, при которых четко установлено наличие специфического антигена, вызывающего развитие иммунной аутоагрессии (аутоиммунные гепатиты, хеликобактерный гастрит и т.д.). Поскольку при анализе выявляется частая внутрисемейная заболеваемость, важное значение в настоящее время придают генетической предрасположенности. Воспалительные реакции при НЯК в основном связаны с избыточным количеством цитокинов макрофагального происхождения (фактора некроза опухоли) и дефицитом некоторых противовоспалительных цитокинов.
Эпидемиология
Признак распространенности: Редко
Левосторонний колит является наиболее частой по локализации формой неспецифического язвенного колита (до 80%).
Клиническая картина
Клинические критерии диагностики
диарея, слизистые выделения из прямой кишки, тенезмы, постепенное начало, лихорадка, вздутие живота, боль в левой половине живота, потеря веса, отеки ног, запор, гематохезия
Cимптомы, течение
Классические признаки левостороннего (мукозного) колита:
- боль, локализующаяся в левой половине живота;
- кровь и слизь в стуле;
- диарея.
При левостороннем колите часто встречается изолированное поражение селезеночного изгиба толстой кишки - ангулит (некоторые авторы описывают данное проявление как "синдром левого подреберья"). Для ангулита характерны сильные боли в левом подреберье, которые зачастую иррадиируют в спину и левую половину грудной клетки. Боль сопровождается ощущением распирания и давления в левом верхнем квадранте живота.
В некоторых случаях возможно появление рефлекторной боли в области сердца, сердцебиений, что заставляет проводить дифференциальную диагностику с коронарной болезнью.
Вследствие локализации болей, их иррадиации и интенсивности пациентам с ангулитом нередко выставляется ошибочный диагноз хронического панкреатита.
Проявления тяжелой формы ангулита:
- стул чаще 8 раз в сутки с кровью, слизью, нередко с гноем;
- температура тела выше 38 о С;
- тахикардия (не менее 90 уд./мин.);
- боли в животе;
- отсутствие аппетита;
- вздутие живота;
- снижение массы тела более чем на 10%;
- дегидратация;
- отеки ног;
- выраженная анемия;
- увеличение СОЭ (более 30 мм/ч.);
- гипоальбуминемия;
- гипонатриемия;
- гипохлоремия;
- гипокалиемия;
- гипергаммаглобулинемия.
Диагностика
Во многих случаях у пациентов с воспалительными заболеваниями кишечника отмечается наличие длительного периода с момента появления первых симптомов заболевания до момента установления правильного диагноза. Это может быть обусловлено многообразием клинических проявлений заболевания, необходимостью проведения сложной дифференциальной диагностики и такой субъективной причиной, как недостаточное знание врачами клинической картины заболевания.
При физикальном обследовании больных НЯК необходимо комплексное и планомерное исследование всех органов и систем организма. Физикальное обследование органов брюшной полости обязательно должно включать пальцевое исследование толстой кишки (высокий риск появления колоректальной карциномы).
2. УЗИ применяют при НЯК для динамического изучения выраженности воспалительных изменений в разных участках толстой кишки и контроля эффективности лечения (показателями эффективности служат уменьшение толщины воспалительно измененной стенки кишки, увеличение диаметра кишечного просвета).
Лабораторная диагностика
Лабораторная диагностика при левостроннем колите соответсвует таковой при неспецифическом язвенном колите (см. также "Язвенный колит неуточненный" - K51.9). Однако, при левостороннем колите повышается диагностическая ценность обнаружения pANCA pANCA - антинейтрофильные перинуклеарные IgG-антитела - аутоантитела к компонентам цитоплазмы нейтрофилов
.
Дифференциальный диагноз
Заболевание, вызванное энтерогеморрагическими штаммами кишечной палочки, имеет острое течение, которое сопровождается тяжелой водной диареей (выделения из кишечника могут иметь примесь крови) и выраженными абдоминальными болями. При эндоскопическом исследовании толстой кишки выявляют неспецифичные геморрагические изменения различной степени выраженности. Таким образом, микробиологические методы исследования играют решающую роль.
При дифференциальной диагностике необходимо исключить амёбную дизентерию, симптомы которой (диарея, гематохезия, признаки интоксикации) очень похожи на выраженную атаку НЯК. Картина изменений слизистой оболочки при амёбной дизентерии также напоминает таковую у больных НЯК и включает поверхностные язвы и воспалительные полипы. Для постановки правильного диагноза требуется проведение исследования на наличие трофозоитов (вегетативных форм амёб) в кале или определение соответствующих антител в сыворотке крови иммунологическими методами.
У больных с иммунодефицитными состояниями (ВИЧ-инфицированные; принимающие глюкокортикоидную или цитостатическую терапию) затруднена дифференциальная диагностика НЯК с различными оппортунистическими инфекциями (цитомегаловирусная, грибковая инфекции, которые протекают с тяжелыми воспалительными поражениями дистальных отделов толстой кишки). Дифференциация проводится на основе всего комплекса клинических и микробиологических данных.
Течение тяжелых форм антибиотикоассоциированного колита сопровождается выраженной диареей, возможно наличие гематохезии, лихорадки, симптомов интоксикации. Эндоскопическое исследование кишечника на фоне воспалительных изменений слизистой оболочки не позволяет выявить характерные псевдомембраны, поэтому его результаты не могут однозначно свидетельствовать в пользу правильного диагноза. Ведущую роль имеют изучение анамнеза заболевания (связь с проводимой или предшествующей антибиотикотерапией) и результаты исследования кала на токсин С. difficile.
Лимфоцитарный и коллагеновый колиты клинически характеризуются обильной водной диареей (до 4-6 л в сутки). При постановке диагноза (помимо особенностей клинической картины и отсутствия визуально определяемых изменений слизистой оболочки кишечника) ведущее значение имеет гистологическое изучение биопсийного материала. При лимфоцитарном колите обнаруживается значительное число межэпителиальных лимфоцитов. При коллагеновом колите выявляется субэпителиальное гомогенное отложение коллагеновых волокон.
Дифференциальная диагностика НЯК с болезнью Крона (БК) имеет важное значение. Это обусловлено наличием различных лечебных подходов при этих двух заболеваниях и разной частотой возникновения осложнений. Так, при длительном течении НЯК существует высокая вероятность развития колоректального рака, а при БК - возникновения лимфом. При НЯК методом кардинального излечения заболевания выступает колэктомия , при БК воспалительный процесс поражает все отделы пищеварительного тракта.
При дифференциальной диагностике н еобходимо оценивать всю сумму клинических и параклинических критериев. В 10-15% всех случаев воспалительных заболеваний кишечника невозможно провести достоверное разграничение НЯК и БК. В этой ситуации данные клинические случаи выделяют в группу недифференцированного колита (см. "Неинфекционный гастроэнтерит и колит неуточненный" - K52.9).
Дифференциальная диагностика неспецифического язвенного колита и болезни Крона (Дамианов И., 2006)
Определение
Определение ВЗК дано в соответствии с консенсусом ЕССО, рекомендациями Британского общества гастроэнтерологов [1, 2, 3].
Язвенный колит – хроническое заболевание, приводящее к протяженному воспалению слизистой оболочки толстой кишки без гранулем при биопсии, поражающее прямую кишку и, в различной степени толстую кишку, характеризующуюся ремитирующим течением с периодами обострений. Также характерным являются системные и внекишечные проявления.
Болезнь Крона - мультисистемное заболевание со специфической клинической картиной, характеризующееся фокальным, асимметричным, трансмуральным гранулематозным воспалением, которое поражает, прежде всего, желудочно-кишечный тракт (ЖКТ); но может проявляться также системными и внекишечными осложнениями.
Неклассифицированное ВЗК – термин, используемый для мониторирования случаев затрудненного дифференциального диагноза между язвенным колитом и болезнью Крона или других колитов, с учетом данных анамнеза, эндоскопического и гистопатологического исследования нескольких биоптатов, а также радиологического обследования.
Недифференцированный колит – термин, используемый морфологами для описания перехлеста признаков язвенного колита и болезни Крона в образцах после колэктомии. Наличие такового служит прогностическим фактором риска хирургического вмешательства.
ФНО – фактор некроза опухоли.6. Категория пациентов: взрослые больные с воспалительными заболеваниями кишечника (язвенный колит, болезнь Крона).
Пользователи протокола: врачи-терапевты и гастроэнтерологи стационарного и амбулаторного звена, врачи общей практики поликлиники
Классификация
Классификация в зависимости от возраста, в котором развилось заболевание, имеет прогностическое значение. У молодых пациентов с ЯК, как правило, более агрессивное течение и чаще применяются иммуномодуляторы. В то время как у пациентов, у которых ЯК диагностирован позже в жизни (A3), болезнь протекает мягче, с меньшей необходимостью в хирургии [1].
2. По локализации (Монреальская классификация ВЗК) [4]
Язвенный колит:
- E1 проктит
- E2 левосторонний колит
- E3 тотальный колит (панколит)
Болезнь Крона:
- L1 терминальный илеит
- L2 толстая кишка
- L3 илеоколит
Язвенный колит. В соответствии с Консенсусом ЕССО и Монреальской классификацией, течение язвенного колита делится на ремиссию и активную фазу заболевания (таблица 1). Ремиссия определяется как полное отсутствие клинических симптомов (т.е. частоты стула ≤3/день без кровотечения) и нормальная слизистая оболочка при эндоскопии с отсутствием острого воспалительного инфильтрата по данным гистологии.
| Ремиссия | Активный ЯК | ||
| S0 | S1 | S2 | S3 |
| Частота стула/день | |||
Для определения тяжести (выраженности активности) язвенного колита используется модифицированная классификация Truelove и Witts. Критерии, приведенные в таблице 2 легко применять в амбулаторных условиях, они позволяют определять показания для госпитализации и интенсивного лечения, а также мониторировать результат. Эти критерии рекомендованы для идентификации тяжелого колита Американской Коллегией Гастроэнтерологов (The American College of Gastroenterology (ACG) [5], Ассоциацией Колопроктологии Великобритании и Ирландии (Association of Coloproctology of Great Britain and Ireland (ACPGBI) [6], а также ЕССO [1].
| Слабая активность | Умеренная активность | Выраженная активность | |
| Частота кровянистого стула /день | 4 и более | >6 | |
| Пульс | ≤90 уд/мин | >90 уд/мин | |
| Температура | ≤37,8 ºС | >37,8 ºС | |
| Гемоглобин | >11,5 г/дл | ≥10,5 г/дл | |
| СОЭ | ≤30 мм/час | >30 мм/час | |
| СРБ | Норма | ≤30 мг/л | >30 мг/л |
При проведении клинических исследований для определения активности ЯК чаще используется индекс Мейо (Mayo Clinic disease activity index) [7] – таблица 3.
| Индекс Мейо | 0 | 1 | 2 | 3 |
| Частота стула | Норма | 1-2/день>нормы | 3-4/день>нормы | ≥5/день |
| Ректальное кровотечение | Нет | Примесь | Присутствует | В значительном количестве |
| Слизистая | Норма | Эритема, обеднение сосудистого рисунка, ранимость | Выраженная эритема, отсутствие сосудистого рисунка, эрозии, ранимость | Спонтанные кровотечения, язвы |
| Общая врачебная оценка | Нет симптомов колита, пациент чувствует себя хорошо, по данным РСС – 0 баллов | Незначительные симптомы колита (0 или 1 балл), функциональная оценка 0 или 1, РСС - 0 или 1 балл) | Признаки умеренной активности (симптомы колита, кровотечения, функциональная оценка и эндоскопически – 1 или 2 балла) | Тяжелая степень с высокой вероятностью назначения глюкокортикоидов и, госпитализации. Частота стула, ректальное кровотечение, самочувствие пациента и по данным РСС – 2 или 3 балла |
Болезнь Крона. В большинстве стран и клинических исследований для оценки клинической активности (тяжести) БК используется индекс активности БК (Crohn’s Disease Activity Index (CDAI), индекс Беста).
При расчете учитываются только клинические (но не эндоскопические) критерии. Максимальное количество баллов - 600 (таблица 4). CDAI<150 баллов расценивается как ремиссия БК, индекс >150 баллов – как активная болезнь с разделением на низкую (150-200 баллов), умеренную (200-450) и высокую активность (более 450 баллов) [8].
В настоящее время для оценки активности язвенного колита и болезни Крона наметилась тенденция использовать уровень СРБ>10 мг/л в дополнение к клиническим критериям активности. К примеру, уровень СРБ 45 мг/л на 3 день после поступления в стационар при частоте стула 3-8 раз в день - это прогностический признак высокого риска колэктомии [1].
- Со стороны верхнего отдела желудочно-кишечного тракта: афтозный / язвенный стоматит, глоссит, гингивит, эзофагит;
- Со стороны кожи, подкожно-жировой клетчатки: узловатая эритема, гангренозная пиодермия, язвы нижних конечностей, анальный зуд, дерматит, абсцессы, флегмона;
- Со стороны органа зрения: ирит, эписклерит, кератит, конъюнктивит, блефарит, увеит;
- Со стороны печени и желчевыводящих путей: первичный склерозирующий холангит, холангиокарцинома, перихолангит, жировой гепатоз, хронический гепатит;
При наличии сопутствующего язвенному колиту первичного склерозирующего холангита (ПСХ) повышается риск развития колоректального рака [1].
Диагностика
3. показатели функции печени – аспартатаминотрансфераза, аланинаминотрансфераза, γ-глутамилтранспептидаза, щелочная фосфатаза;
6. илеоколоноскопия или ректосигмоскопия с множественной биопсией (не менее 2 кусочков из 5 участков, включая дистальный отдел подвздошной кишки и прямую кишку);
7. эзофагогастродуоденоскопия с биопсией;
Следует учитывать опасность эндоскопических и рентгенологических манипуляций у больных в острой фазе заболевания из-за вероятности перфорации кишечника.
3. обзорная рентгенография в условиях естественной контрастности (при подозрении на токсическую дилатацию толстого кишечника);
– микробиологическое исследование на наличие токсина Clostridium difficile (для выявления инфекции в 90% случаев требуется минимум 4 образца кала), шигеллы, сальмонеллы, иерсинии, дизентерийной амебы, гельминтов, паразитов;
13. исследование на цитомегаловирус, вирус герпеса и Эбштейн-Барр показано в случае тяжелого или резистентного течения заболевания; реактивация этого вируса часто наблюдается у пациентов, получающих иммуносупрессивную терапию;
Перечень обследований, которые необходимо провести до плановой госпитализации (минимальный перечень):
1) Жалобы: частый, водянистый стул, наличие крови и/или слизи в стуле, ночные дефекации, чувство неполного опорожнения кишечника, боли и урчание в животе, снижение массы тела, боли в суставах, изменения на коже (гангренозная пиодермия, узловатая эритема), свищи, лихорадка, тахикардия, повышенная утомляемость, отеки.
Анамнез: продолжительность диареи более 4 недель, рецидивирующий характер описанных жалоб, наличие ВЗК у близких родственников; активное табакокурение (протективный фактор для ЯК и фактор риска для БК), аппендэктомия в анемнезе (протективный фактор для ЯК). Неселективные нестероидные противовоспалительные препараты увеличивают риск обострения язвенного колита. При сборе анамнеза заболевания необходимо уточнить связь возникновения симптомов с недавними путешествиями, приемом антибактериальных или нестероидных противовоспалительных препаратов, перенесенной кишечной инфекцией, сменой полового партнера, аппендэктомией.
2) Физикальное обследование: диарея, боли в правой подвздошной области и напряжение передней брюшной стенки, опухолевидное образование в брюшной полости, перианальные осложнения, лихорадка, тахикардия, бледность кожных покровов, периферические отеки, внекишечные проявления, внутренние свищи, потеря массы тела.
3) Лабораторные исследования.
- Маркеры острой фазы: ускорение СОЭ, лейкоцитоз, повышение СРБ, гипопротеинемия, гипоальбуминемия, увеличение альфа 2-глобулинов.
- Серологические маркеры: perinuclear anti-neutrophil cytoplasmic antibodies (pANCA) позитивны у 65% больных ЯК, anti-Saccharomyces cerevisiae antibodies (ASCA) позитивные при БК.
1. Эндоскопические методы исследования. Эндоскопическое исследование верхних и нижних отделов ЖКТ проводится для подтверждения диагноза ВЗК, оценки локализации и распространенности патологического процесса и получения образцов ткани для морфологического анализа с целью дифференциальной диагностики между ЯК и БК, выявления дисплазии или злокачественного образования.
При ЯК выявляется непрерывное (сплошное) воспаление слизистой толстой кишки, почти всегда начинающееся в прямой кишке, примерно в 50% случаев распространяющееся проксимально. Терминальный отдел подвздошной кишки вовлекается редко (рефлюкс-илеит).
Видеокапсульная эндоскопия (ВКЭ) с момента ее одобрения Управлением по продовольствию и медикаментам (США) в 2001 года стала инновационным инструментом для исследования патологий тонкой кишки, в том числе, при болезни Крона. До проведения ВКЭ рекомендуется выполнять эндоскопическое обследование верхних и нижних отделов ЖКТ.
Видеокапсульная эндоскопия является неинвазивной и считается безопасной процедурой, так как эндоскопические капсулы, как правило, выводится из организма с калом в течение 24-48 ч [9]. Однако, если задержка капсулы происходит, это может помочь определить основную причину желудочно-кишечной патологии и потребовать хирургического вмешательства
3. Гистологическое: нарушение архитектоники крипт, крипт-абсцессы, трансмуральное воспаление слизистой, отек и инфильтрация лимфоидными и плазматическими клетками подслизистого слоя, гиперплазия лимфоидных фолликулов и пейеровых бляшек, гранулемы. При прогрессировании заболевания нагноение, изъязвление лимфоидных фолликулов, распространение инфильтрации на все слои кишечной стенки, гиалиновое перерождение гранулем.
4. Ультразвуковое исследование: классическим УЗ-признаком воспалительных изменений стенки кишечника, выявляемых при поперечном сечении, служит обнаружение конфигурации в виде кольца – так называемый симптом мишени. Этот феномен коррелирует с выраженностью изменений кишечной стенки. В продольном сечении наблюдается ее протяженное анэхогенное утолщение. Отмечается также сужение просвета пораженного участка кишки, ослабление или исчезновение его перистальтики. Метод УЗ-диагностики не несет лучевую нагрузку, не требует введения контрастного вещества, следовательно, безопасен у беременных, незаменим для исследования камней почек и желчного пузыря, наличие которых может быть осложнением БК, достаточно чувствителен для выявления абсцессов, особенно у худощавых пациентов.
5. Магнитно-резонансная томография. Данный метод может быть полезен для дифференцировки воспалительных и фиброзных стриктур. Характеризуется высокой чувствительностью для определения абсцессов, внутренних свищей и перианальных осложнений.
МР-холангиопанкреатография – первоочередной метод исследования для диагностики склерозирующего холангита. МРТ не сопряжена с воздействием ионизирующего излучения, что весьма важно, учитывая возраст пациентов и необходимость многократной визуализации.
5) Показания для консультации специалистов: окулист (для исключения поражения органа зрения), ревматолог (при вовлеченности в аутоиммунный процесс суставов), хирург (при подозрении на острую токсическую дилатацию толстой кишки, при отсутствии положительной динамики от консервативной терапии), онколог (при появлении признаков дисплазии, рака).
Аннотация научной статьи по клинической медицине, автор научной работы — Симаненков Владимир Ильич, Суворов Александр Николаевич, Соловьева Ольга Ивановна
Похожие темы научных работ по клинической медицине , автор научной работы — Симаненков Владимир Ильич, Суворов Александр Николаевич, Соловьева Ольга Ивановна
Коррекция дисбиотических нарушений при заболеваниях желудочно-кишечного тракта и печени биологически активными добавками с пробиотическим действием
Новый жидкий симбиотический биокомплекс в алгоритме восстановления микробиоценоза при хеликобактер-ассоциированных заболеваниях
Potentialities of probiotic therapy at ulcerative colitis
Changes in thestructure of intestinal microflora is a comorbidal condition at ulcerative colitis . Decrease in activity of intestine normal microflorae and increase in quantity of its conditionally-pathogenic representatives create conditions for maintenance of immunopathologic processes in a mucous membrane of a gut. The influence of probiotic therapy on current ulcerative colitis is investigated. Probiotic Laminolact has been added to standard therapy by mesalasin of 23 patients with ulcerative colitis . The activity of the basic disease, the condition of intestinal microbiota prior to the beginning of therapy, in 2 and 6 months of supervision were estimated. Data were compared with the results of inspection of 24 patients of the control group who received therapy only by mesalasin. As a result of the research carried out it is established that the combination of standard therapy by preparations 5-ASA with a probiotic allows to achieve the maintenance of medication-induced remission of disease.
В. И. Симаненков1, А. Н. Суворов1, О. И. Соловьева1
возможности ПРОБИОТИЧЕСКОЙ ТЕРАПИИ ПРИ НЕСПЕЦИФИЧЕСКОМ ЯЗВЕННОМ КОЛИТЕ
1Санкт-Петербургская медицинская академия последипломного образования 2Институт экспериментальной медицины РАМН, Санкт-Петербург
Повышение эффективности терапии неспецифического язвенного колита (НЯК) и увеличение продолжительности фазы его ремиссии являются одной из актуальных задач современной гастроэнтерологии. Традиционная базисная терапия не позволяет полностью решить поставленные задачи. Кроме того, применение средств, направленных на подавление различных звеньев иммунитета, обладает рядом хорошо известных побочных эффектов [1, 2]. Учитывая роль кишечной микрофлоры в формировании иммунного ответа в слизистых оболочках, особенности строения и функционировании мукозоассоциированной лимфоидной ткани, следует считать актуальным изучение возможности повышения эффективности лечения НЯК посредством коррекции микробиоценоза [1, 3].
Нарушение качественно-количественного состава кишечной микрофлоры является облигатным коморбидным состоянием при НЯК [2, 4]. Описаны механизмы, посредством которых изменения в микробиоценозе способны утяжелять течение основного заболевания, создавая условия для прерывания ремиссии. К ним относятся влияние бактериальных эндотоксинов и продуктов метаболизма микроорганизмов, микробная сенсибилизация, нарушение синтеза секреторного иммуноглобулина А, стимуляция образования провос-палительных цитокинов [3, 5, 6].
Прекращение всасывания и утилизации ЛЖК колоноцитами при наличии воспалительных изменений в слизистой оболочке толстой кишки приводит к накоплению этих соединений в просвете толстой кишки, что способствует подавлению симбионтной флоры. Таким образом, формируется порочный круг, когда иммунно-воспалительные процессы в слизистой оболочке толстой кишки и нарушения в микробиоценозе поддерживают существование друг друга [3, 7].
Изменения в составе кишечной микрофлоры способствуют появлению антител к бактериальным антигенам, перекрестно реагирующим с эпителиальными клетками толстой и тонкой кишки [1, 4]. Токсины бактерий и продукты их метаболизма нарушают функцию толстой кишки, подавляют регенерацию эпителия и увеличивают антигенную нагрузку на иммунную систему, ассоциированную с кишечником [1].
Участие кишечной микрофлоры в патогенезе язвенного колита (извращение иммунного ответа, нарушение трофики колоноцитов вследствие нарушения взаимоотношений между просветной микрофлорой и иммунной системой) послужили основанием для экспериментального изучения возможности применения пробиотических препаратов при данном заболевании [3, 8, 9].
© В. И. Симаненков, А. Н. Суворов, О. И. Соловьева, 2009
Материалы и методы исследования. Пациенты с неспецифическим язвенным колитом средней тяжести (47 человек) методом случайных чисел были рандомизированы на две группы.
Первая группа пациентов (24 человека) получала терапию синбиотиком ламинолакт (в состав ламинолакта входят Enterococcus faecium Ь-3 в титре 106-7 КОЕ/г, пектин, соевый аминокислотный гидролизат, морская капуста в качестве источника микроэлементов) в дозе 3 драже 3 раза в день в течение 1 месяца на фоне базисной терапии месалазином в суточной дозе 2400 мг.
Во второй группе пациентов (23 человека) — контрольной — проводилась базисная терапия месалазином в суточной дозе 2400 мг.
По исходным данным (половой состав, возрастной состав, длительность заболевания, активность заболевания) группы были сравнимы.
Программа обследования всех больных включала следующие разделы:
• Клинико-лабораторный (определение степени активности язвенного колита). Для оценки тяжести течения и динамики клинических проявлений НЯК применялся индекс клинической активности по D. Rachmilewitz (1989 г.).
• Микробиологический (исследование кишечной микрофлоры). Материалом для исследования на дисбиоз кишечника служили испражнения, взятые из последней порции кишечного содержимого, полученного утром в день исследования. Посев производился на стандартные среды в аэробных и анаэробных условиях. Анализ характера роста микроорганизмов на селективных средах позволил провести идентификацию основных представителей флоры (бактероиды, фузобак-терии, лактобактерии, бифидобактерии, эубактерии, пептострептококки и др.) до рода. Их видовую идентификацию проводили по биохимическим признакам. Для определения степени выявленных дисбиотических изменений пользовались классификацией Г Г Кузнецовой (1972 г.).
• Статистическая обработка полученных данных ^ТАТ^ТГСА 5.5).
Контрольные исследования проводились через 2 месяца после основного курса
терапии и через 6 месяцев после лечения.
результаты и их обсуждение
1. Состояние кишечного микробиоценоза в зависимости от проводимой терапии
При исследовании кишечной микрофлоры у всех пациентов выявлены дисбио-тические изменения, которые в большинстве случаев были представлены дисбиозом II и III степени. Так, дисбиоз I степени выявлен у 4 пациентов общей группы (9,7 %), дисбиоз II степени — у 15 (31,9 %), дисбиоз III степени — у 23 (49,6 %) и дисбиоз IV степени — у 5 пациентов с НЯК (10,7 %).
Дисбиотические изменения в подавляющей части случаев сопровождались снижением количества бифидо- и лактобактерий, лактозопозитивной кишечной палочки. Отмечалось увеличение количества представителей условно-патогенной флоры, а в ряде
случаев — повышение титров протея, стафилококка, грибов. У обследованных пациентов лишь в единичных случаях наблюдался рост гемолитической кишечной палочки, клебсиелы. Роста золотистого стафилококка получено не было (рис. 1). Практически у всех пациентов с язвенным колитом наблюдалось изменение соотношения анаэробной и аэробной флоры в сторону увеличения последней.
Достоверных различий между исследуемыми группами по выраженности дисбиоти-ческих изменений до лечения выявлено не было. Динамика выраженности дисбиотических изменений в исследуемых группах представлена на рис. 2.
] Норма — min lg КОЕ
] Норма — max lgKOE
3 Средний lgKOE при НЯК
Рис. 1. Состав кишечной микрофлоры у пациентов с НЯК (по оси ординат — ^ КОЕ)
Через 6 месяцев
П IV степень В III степень ЕЭ II степень И I степень □ Норма
Рис. 2. Динамика выраженности дисбиотических изменений в исследуемых группах (Л — группа, получавшая ламинолакт в сочетании с месалазином, К — контрольная группа). В процентах выражена доля пациентов, имеющих ту или иную степень дисбиоза, от общего количества наблюдавшихся
Из рисунка видно, что через 2 месяца после завершения основного курса терапии в обеих группах наблюдения произошло перераспределение показателей дисбиотических изменений в сторону уменьшения степени дисбиоза. Так, на этом этапе исследования в обеих группах у подавляющего большинства пациентов либо отсутствовали дисбио-тические изменения, либо выявлялся дисбиоз I степени. Ни у одного больного не было обнаружено дисбиоза тяжелее II степени. Достоверных различий между группами на этом этапе отмечено не было.
Распределение дисбиотических изменений по степеням в сравниваемых группах через 6 месяцев после окончания курса основной терапии представлено на рис. 3. На диаграммах видно, что при контрольном исследовании через 6 месяцев состояние кишечной микрофлоры у подавляющего большинства пациентов, получавших синбиотическую терапию, нормальное или характеризуется дисбиозом I степени, в отличие от пациентов контрольной группы.
2. Динамика активности язвенного колита в условиях различных схем терапии, применявшихся в исследовании
Как отмечалось выше, динамика активности язвенного колита у наблюдавшихся пациентов оценивалась по изменению индексов клинической (ИКА) и эндоскопической (ИЭА) активности по D. Rachmilewitz. Динамику этих показателей в группах наблюдения до лечения и при контрольных исследованиях иллюстрируют рис. 4, 5.
На диаграмме видно, что через 2 месяца после окончания основного курса терапии в обеих группах наблюдения произошло достоверное уменьшение индекса клинической активности НЯК. Спустя 6 месяцев в группе пациентов, получавших ламинолакт, индекс
Нормальная флора, 13 %
Дисбиоз IV степени 0%
Нормальная флора, 33,3 %
Дисбиоз ІП степени 0%
Рис. 3. Распределение степеней дисбиоза (в % от общего числа наблюдавшихся) в группах сравнения через 6 месяцев после окончания основного курса терапии
До лечения Через 2 месяца Через 6 месяцев
Рис. 4. Динамика индекса клинической активности (в баллах) НЯК в зависимости от группы наблюдения (*р < 0,05)
Рис. 5. Динамика индекса эндоскопической активности (в баллах) НЯК в зависимости от группы наблюдения (*p < 0,05)
практически не изменился по сравнению с предыдущим исследованием. В контрольной же группе ИКА достоверно увеличился в сравнении с предыдущим показателем, хотя и не достиг исходной цифры.
Динамика индекса эндоскопической активности аналогична изменениям индекса клинической активности.
Для всех хронических воспалительных заболеваний кишечника характерны нарушения регуляции иммунной системы слизистой оболочки [1, 5]. Особенность мукозоас-социированной лимфоидной ткани толстой кишки (GALT) состоит в ее взаимодействии с очень большим количеством антигенов [1, 3]. В этих условиях основными функциями GALT-системы являются, с одной стороны, обеспечение толерантности по отношению к антигенам, а с другой — выработка высокоселективного и высокоспецифичного
До лечения Через 2 месяца Через 6 месяцев
иммунного ответа. В условиях нарушения барьерной функции эпителия из просвета кишечника в организм проникают бактерии, токсины (в том числе и бактериальные), антигены. Антигенная и токсическая нагрузка на GALT-систему значительно увеличивается в условиях дисбиоза, что в условиях нарушения равновесия между популяциями Тх1-и Тх2-лимфоцитами приводит к развитию иммунопатологических реакций [1, 2, 6].
Кроме того, хорошо известны тесные симбиотические отношения колоноцитов и представителей нормофлоры кишечника, основанные на трофоэнергетических взаимодействиях. Микрофлора кишечника создает для эпителия толстой кишки как энергетическую, так и сырьевую базу синтетической деятельности (летучие жирные кислоты, лактат). Муцин, являющийся одним из компонентов слизи, является одним из источников питания нормофлоры кишки [7]. Наличие кишечного дисбиоза способствует появлению антител к бактериальным клеткам, перекрестно реагирующих с эпителиальными клетками толстой и тонкой кишки.
Анализ современной литературы, посвященной вопросам пробиотической терапии, показал возможность ее успешного применения при лечении язвенного колита. В экспериментальных работах было продемонстрировано, что применение пробиотиков способно как предотвращать развитие колита, так и уменьшать активность воспалительных процессов в толстой кишке. У моделей с экспериментальным колитом на фоне пробиотической терапии было отмечено значительное улучшение барьерной функции слизистой оболочки толстой кишки, что оценивалось по уменьшению количества циркулирующих антител к эндотоксинами и уменьшению проницаемости кишечной стенки 9.
Было показано, что пробиотики способны улучшать иммунологический барьер слизистой оболочки толстой кишки преимущественно за счет увеличения синтеза секреторного IgA. Особенно важной в отношении язвенного колита является способность пробиотических препаратов снижать продукцию интерлейкина-4, являющегося маркером иммунологической реакции Тх2-типа, гиперактивация которой имеется при этом заболевании [8, 13]. Использование пробиотиков на основе бифидобактерий и лактобацилл позволяло снизить уровень экспрессии провоспалительных цитокинов TNF-a и IL-8 [10].
С целью нормализации микрофлоры кишечника у наблюдавшихся пациентов с НЯК был использован синбиотик ламинолакт. В составе ламинолакта помимо комплекса пре-биотиков содержится пробиотик Enterococcus faecium L-3. Одним из определяющих качеств для использования этого микроорганизма в нашем исследовании явилась его способность подавлять рост условно-патогенной флоры, избыток которой наблюдается в микробном пейзаже пациентов с НЯК, и стимулировать восстановление нормальной микрофлоры, в первую очередь уровня содержания бифидобактерий. Антагонистическое действие осуществляется за счет продукции бактериоцинов (в геноме этого штамма содержатся гены двух бактериоцинов — энтероцинов А и В), конкуренции за рецепторы адгезии и питательные вещества, нормализации иммунной реактивности слизистой оболочки [14].
Состояние кишечного микробиоценоза при оценке через 2 месяца наблюдения значительно улучшилось в обеих группах пациентов независимо от предпринятой тактики
лечения. Очевидно, основным фактором в данном случае явилось значительное снижение степени активности НЯК и стабилизация состояния слизистой оболочки толстой кишки, что способствовало улучшению состояния микрофлоры. При контрольном обследовании через 6 месяцев было выявлено, что состояние кишечного микробиоценоза в группе, получавшей синбиотическую терапию, было достоверно лучшим, чем в контрольной группе, что сочеталось и с достоверно более низкими показателями активности основного заболевания.
1. Адлер Г. Болезнь Крона и язвенный колит / Пер. с нем. А. А. Шептулина. М., 2001. 500 с.
2. Белоусова Е. А. Язвенный колит и болезнь Крона. Тверь, 2002. 128 с.
3. JewellD. P., Mortensen N. J., SteinhartA. H. e. a. Challenges in Inflammatory Bowel Disease. Oxford, 2006. 400 p.
4. Парфенов А. И. Энтерология. М., 2002. 744 с.
5. Ардатская М. Д., Дубинин А. В., Минушкин О. Н. Дисбактериоз кишечника: современные аспекты изучения проблемы, принципы диагностики и лечения // Терапевтич. архив. 2001. № 2. С. 67-72.
6. Наврузов С. Н., Даутов Ф. А., Якубова Н. Р. Микрофлора кишечника при неспецифическом язвенном колите // Врачебн. дело. 1990. № 8. С. 23-29.
7. Дубинин А. В., Бабин В. Н., Раевский П. М. Трофические и регуляторные связи макроорганизма и кишечной микрофлоры // Клинич. медицина. 1991. № 7. С. 24-28.
8. Campieri M., Gionchetti P. Probiotics in inflammatory bowel disease: new insight to pathogenesis or a possible therapeutic alternative // Gastroenterol. 1998. Vol. 116. P. 1246-1260.
9. Kennedy R. J., Kirk S. J., Gardiner K. R. e. a. Probiotic therapy stabilises the gut mucosal barrier in the IL-10 knockout mouses model of colitis // Br. J. Surg. 2000. Vol. 87. P. 689.
10. Mallon P., McKay D., Kirk S., Gardiner K. Probiotics for induction of remission in ulcerative colitis // Cochrane Database Syst. Rev. 2007. Is. 4. Art. No: CD005573. DOI: 10.1002/14651858.CD005573. pub2.
11. Rembacken B. J., Snelling A. M., Hawkey P. M. e. a. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial // Lancet. 1999. Vol. 354. P. 635-639.
12. Shanahan F. Probiotics in inflammatory bowel disease // Gut. 2001. № 48. P. 609-611.
13. Dugas B., Mercenier A., Lenoir-Wijnkoop I. e. a. Immunity and probiotics // Immunol. Today. 1999. Vol. 20. P. 387-390.
14. Суворов А. Н., Захаренко С. М., Алехина Г. Г. Энтерококки как пробиотики выбора // Пробиотики нового поколения: Сб. статей. СПб., 2003. С. 32-40.
Инфекционный колит – это полиэтиологическая группа воспалительных заболеваний толстого кишечника, которые возникают вследствие активизации условно-патогенной кишечной флоры или попадания патогенных микроорганизмов из внешней среды. Проявляются поносом со слизью, иногда с кровью и неприятным запахом, болями в животе, симптомами общей интоксикации и обезвоживания. Диагностируются на основании клинических данных, посевов кала, общего анализа крови. При необходимости проводят ректороманоскопию и колоноскопию. Лечение инфекционного колита консервативное, включает антибиотикотерапию, противопаразитарные препараты, дезинтоксикацию, борьбу с обезвоживанием).
МКБ-10
Общие сведения
Инфекционный колит – это острое (реже - хроническое) заболевание толстого кишечника, которое вызывается разными видами бактерий, простейшими, иногда паразитами и некоторыми вирусами, сопровождается общей интоксикацией, обезвоживанием; в процесс часто вовлекаются другие отделы желудочно-кишечного тракта. Распространено повсеместно: считается, что не существует людей, которые хотя бы раз в жизни не сталкивались с проявлениями острого инфекционного колита. Проблема становится более актуальной в теплый период года.
Заболевание больше распространено в странах с жарким климатом, на тех территориях, где затруднен доступ к питьевой воде, не развиты коммуникации. Наиболее опасные регионы – страны Африки, Юго-Восточной и Средней Азии. Мужчины и женщины болеют одинаково, несколько чаще инфекционный колит диагностируют у детей раннего возраста. Лечением занимаются врачи-инфекционисты. Пациенты могут попадать в отделение проктологии, если заболевание ошибочно принимают за неспецифический инфекционный колит или другие болезни толстого кишечника.

Причины
Основной причиной возникновения инфекционного колита являются разного рода бактерии. Чаще всего заболевание вызывают шигеллы (возбудители дизентерии), кишечная палочка, сальмонеллы, клостридии, иерсинии, брюшнотифозная палочка, кампилобактерии, протей, стафилококки. Симптомы инфекционного колита наблюдаются при аденовирусной, энтеровирусной инфекции, иногда при заболеваниях, вызванных ротавирусом. Также причиной возникновения колита могут стать амебы, лямблии, некоторые другие виды паразитов.
Инфекционный колит иногда развивается как осложнение туберкулеза или сифилиса. У ослабленных пациентов с угнетенным иммунитетом заболевание могут вызывать грибки (кандида, актиномицеты). Грибковый инфекционный колит является одним из маркеров СПИДа, также он возникает у онкологических больных, принимающих химиотерапию, или у лиц, которые длительное время лечатся стероидными гормонами. При дисбактериозе, спровоцированном антибиотикотерапией или химиопрепаратами, инфекционный колит могут вызвать условно патогенные бактерии, например, клостридии.
Патогенез
При инфекционном колите в толстом кишечнике возникают воспалительные изменения, нарушается моторика, усиливается выделение жидкости эндотелиальными клетками и нарушается обратное всасывание воды, повышается проницательность стенок кишечника для различных токсинов, которые вызывают общую интоксикацию организма.
Классификация
С учетом морфологических изменений различают следующие формы инфекционного колита: катаральную, фиброзную, катарально-геморрагическую, флегмонозную, флегмонозно-гангренозную и некротическую. Процесс может довольно быстро прогрессировать и переходить из одной формы в другую, а может приостановиться на одном этапе развития. Кроме того, форма зависит от вида возбудителя. Катаральные формы характерны для вирусных заболеваний, катарально-геморрагическая типична для дизентерии. Клостридии часто вызывают некротический и флегмонозно-гангренозный инфекционный колит.
Симптомы инфекционного колита
Клинические проявления заболевания во многом зависят от его причины. Общими для всех форм являются острое или подострое начало, понос с выделением большого количества слизи, боли в животе, часто спазматического характера, повышение температуры тела, ухудшение общего самочувствия, слабость, сухость слизистых, обложенный белым налетом язык. Если в процесс вовлекается тонкий кишечник (развивается энтероколит), количество каловых масс увеличивается, усиливаются процессы потери жидкости и усугубляются симптомы обезвоживания. В случае поражения и желудка (гастроэнтероколит) заболевание может начинаться с рвоты.
При дизентерии чаще поражается сигмовидная кишка. Заболевание проявляется поносом с небольшим количеством каловых масс, дефекацией 3-20 раз в сутки и больше. В кале выявляют слизь и кровь, в тяжелых случаях при дефекации выделяются только небольшие слизистые сгустки с прожилками крови (ректальный плевок). Пациенты жалуются на резкие боли в животе, у них повышается температура тела до высоких цифр, выражены явления общей интоксикации, иногда до спутанности или потери сознания.
Похожую клинику имеет амебиаз. Этот вид инфекционного колита развивается менее остро, в процесс вовлечена слепая, восходящая ободочная кишка или весь толстый кишечник. Кал с большим количеством слизи, перемешанной с кровью, напоминает малиновое желе. Симптомы интоксикации не очень выражены, заболевание может приобретать хронический или рецидивирующий характер.
Инфекционный колит, вызванный сальмонеллами, проявляется поносом цвета болотной тины с неприятным запахом. Каловые массы жидкие, так как поражен и тонкий кишечник. У пациентов поднимается температура, тяжелый инфекционный колит может осложняться сепсисом и септицемией.
Псевдомембранозный колит, обусловленный клостридиями, возникает на фоне антибиотикотерапии, химиотерапии или при тяжелом дисбиозе. Проявляется лихорадкой, схваткообразными болями в животе, обильным поносом с гнилостным запахом. Псевдомембранозный инфекционный колит часто рецидивирует, может осложняться некрозом кишечника.
Диагностика
Главное значение в диагностике инфекционного колита имеют лабораторные анализы. Для выяснения этиологии заболевания проводят вирусологические, паразитологические бактериологические исследования кала. Реже исследуют сыворотку крови для выявления антител к тому или иному возбудителю. Посев крови на стерильность могут проводить при подозрении на септические осложнения. В общем анализе крови при бактериальном инфекционном колите можно выявить лейкоцитоз со сдвигом формулы влево, повышение СОЭ. При вирусном колите повышается уровень лимфоцитов, а при паразитарном – преимущественно эозинофилов.
Эндоскопические исследования имеют вспомогательный характер, так как картина морфологических изменений не является специфической, и данный вид диагностики проводится с целью дифференцирования от других заболеваний толстого кишечника. Ректороманоскопию проктологи или инфекционисты выполняют при бактериальной дизентерии, псевдомембранозном инфекционном колите. УЗИ органов брюшной полости показано при подозрении на осложнения. Дифференцируют инфекционный колит с болезнью Крона, дивертикулитом, дивертикулярной болезнью, дисбиозом. Также очень важно различать между собой разные виды инфекционного колита, так как от причины зависит специфическая терапия.
Лечение инфекционного колита
Важным направлением лечения инфекционного колита является регидратация. При незначительной и средней степени потери жидкости, отсутствии рвоты применяют пероральные солевые растворы. Если состояние больного тяжелое, проводят инфузионную регидратацию и дезинтоксикационную терапию. При инфекционном колите рекомендуют принимать пробиотики и ферментные препараты (панкреатин).
Прогноз и профилактика
Прогноз при инфекционном колите довольно благоприятный, так как на сегодняшний день известны эффективные методы этиотропной терапии данного заболевания. Ухудшается прогноз при тяжелых формах инфекционного колита, вызванного клостридиями, сальмонеллами, грибками, а также у ослабленных пациентов с онкопатологией, у больных СПИДом. Более тяжело инфекционный колит переносят дети. Из профилактических мероприятий главным является гигиена. Следует тщательно контролировать чистоту и срок годности пищевых продуктов, особенно тех, которые употребляются без термической обработки, а также качество употребляемой воды.
Читайте также:

