Кишечная палочка в генной инженерии
Обновлено: 25.04.2024
Синтез целых геномов — раздел синтетической биологии, которая ставит своей задачей создание организмов с заданными свойствами при помощи современных методов генной инженерии.
Вообще-то, принципы синтетической биологии давно используются и в области индустриальной микробиологии для создания микробов — сверхпродуцентов ценных молекул, и в экологии (например, для создания биосенсоров), и в других областях биологии. Отличие синтетической биологии скорее в том, что это междисциплинарное направление, объединяющее несколько крупных проектов, таких как создание вычислительных устройств на основе живых систем или создание организмов с дизайнерскими геномами, синтезированными de novo.
Как это делается
Наиболее популярный и дешевый амидофосфитный метод синтеза ДНК-цепочек на твердофазном носителе позволяет провести не более 100-200 циклов последовательного присоединения нуклеотидов, причем вероятность ошибочного присоединения с каждым циклом увеличивается. Таким образом, на выходе можно получить короткие одноцепочечные молекулы ДНК (олигонуклеотиды), состоящие максимум из 200 звеньев.
Альтернативой этому методу может стать ферментативный синтез с использованием терминальной дезоксинуклеотидил трансферазы (TdT). Этот фермент работает как ДНК-полимераза, удлиняя цепочку за счет присоединения новых нуклеотидов, но для синтеза ему не нужна матрица. Ферментативный подход может увеличить точность синтеза, но, судя по всему, не длину готового продукта. Пока что максимальная длина цепочки, полученной таким образом, составила 150 нуклеотидов. Кроме того, для коммерческого использования технология пока недоступна.
Несмотря на ограничение по длине, такая продуктивность синтеза до недавних пор устраивала большинство пользователей. Короткие цепочки ДНК используются во множестве биологических приложений — в качестве затравок для полимеразной цепной реакции, в качестве зондов для детекции последовательностей, подавления экспрессии генов и мутагенеза. Тем не менее, появление синтетической биологии привело к росту конкуренции на рынке синтеза, в результате чего цены заметно упали. Заказать синтез целого гена длиной в несколько сотен или тысяч нуклеотидов теперь может позволить себе большинство исследовательских лабораторий.
Чтобы синтезировать даже единственный ген, на старте придется иметь дело с большим количеством коротких олигонуклеотидов. На этапе дизайна эксперимента последовательность ДНК разбивают так, чтобы последовательности этих олигонуклеотидов перекрывались друг с другом. Дальше олигонуклеотиды смешивают по несколько штук и объединяют при помощи полимеразной цепной реакции. Этот метод тоже был изобретен еще в конце 80-х и так сильно подстегнул развитие молекулярной биологии, что за его разработку вручили Нобелевскую премию.
В реакции, состоящей из множества циклов последовательного разделения и отжига цепочек друг на друга, используется термостабильная ДНК-полимераза, которая достраивает вторую цепь ДНК на одноцепочечной матрице. В результате короткие перекрывающиеся кусочки можно не только сшить друг с другом, но и многократно копировать.

Обзор
Герой февраля: кишечная палочка Escherichia coli
Автор
Редакторы
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas

Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Клетки с относительно тонкой клеточной стенкой, не окрашивающиеся красителем генцианом фиолетовым (окраской бактерий по методу датского микробиолога Кристиана Грама).
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
Кстати, Джошуа Ледерберг был некоторое время мужем Эстер Ледерберг, первооткрывательницы бактериофага лямбда [3].
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
Благодарность

Несмотря на существование очевидных преград и трудностей, которые подчас встают на пути развития и внедрения продуктов генной инженерии (ГИ), XXI век уже невозможно представить без плодов этой важной и многообразной технологии в арсенале современного биолога. Наиболее часто используемым организмом в ГИ являются бактерии.
Что такое ГИ и зачем она нам нужна? Почему бактерии так популярны у генных инженеров? В каком виде проще всего внести нужный ген в бактерию? С какими трудностями можно столкнуться, работая с этими организмами? Что произошло раньше: создание первой генноинженерной бактерии или открытие структуры ДНК и генома? Об этом и многом другом читайте под катом.
0. Краткий ликбез по биологии
В данном пункте приведено краткое описание так называемой Центральной догмы молекулярной биологии. Если вы обладаете базовыми знаниями в молекулярной биологии, то смело переходите к пункту 1.

Центральная догма молекулярной биологии в одной картинке
Итак, начнём. Вся информация о всех стадиях развития и свойствах любого организма, будь то прокариоты (бактерии), археи или эукариоты (все остальные одно- и многоклеточные), закодирована в геномной ДНК, которая представляет собой комплекс двух комплементарных друг другу полинуклиотидных цепей, образующих двойную спираль (комплементарные нуклеотиды ДНК: A-T и G-C). Хромосомы эукариот представляют собой линейные двухцепочечные молекулы ДНК, а хромосомы прокариот закольцованы. Зачастую гены составляют лишь небольшую часть всего генома (у человека — около 1,5%).

Две комплементарные друг другу цепи ДНК. Пунктирными линиями показаны водородные связи между основаниями. Как видно, аденин и тимин образуют между собой две водородные связи, а гуанин и цитозин — три. Поэтому связь G-C прочнее и GC-богатые участки двухцепочечной ДНК сложнее разделить на две цепочки.
Цепочки ДНК и РНК.
Последовательности ДНК и РНК всегда записывают от 5'-конца к 3'-концу. На то есть ряд причин:
- Синтез новых цепочек ДНК и РНК начинается с 5'-конца (ДНК-полимеразы (ферменты, синтезирующие комплементарную цепь ДНК на матрице ДНК или РНК) и РНК-полимеразы (ферменты, синтезирующие комплементарную цепь РНК на матрице ДНК или РНК) идут по матрице в направлении 3' -> 5', стало быть новая цепь синтезируется в направлении 5' -> 3');
- Рибосома читает кодоны, передвигаясь по мРНК в направлении 5' -> 3';
- Последовательность аминокислот записана в кодирующей цепи ДНК в направлении 5' -> 3' (значащая часть мРНК представляет собой точную копию участка кодирующей цепи ДНК с заменой тимина на урацил и с гидроксильной группой (-OH) вместо водорода в положении 2', разумеется);

Процесс трансляции, катализируемый рибосомой. На рисунке находящиеся в составе мРНК кодоны UUU и UCG распознаются находящимися в составе молекул тРНК антикодонами AAA и AGC. Транспортная РНК с антикодоном CCC уже отдала свою аминокислоту растущей белковой цепочке, а тРНК с антикодоном CAG ждёт своей очереди. Показанный на рисунке участок молекулы мРНК состоит из четырёх кодонов: GGGUUUUCGGUC. Кодон GGG соответствует аминокислоте глицину, UUU — фенилаланину, UCG — серину, GUC — валину. Значит данный участок мРНК кодирует фрагмент белка с аминокислотной последовательностью глицин-фенилаланин-серин-валин.
Рибосомные РНК — незаменимые компоненты рибосомы. Основной функцией рРНК является обеспечение процесса трансляции: она участвует в считывании информации с мРНК при помощи адапторных молекул тРНК и катализе образования пептидных связей между присоединёнными к тРНК аминокислотами и растущей цепью белка.
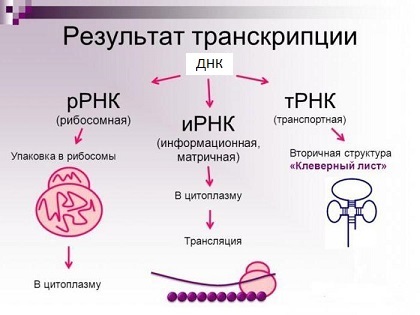
Основные типы молекул РНК (на самом деле их куда больше).


В случае с генами, кодирующими белок процесс расшифровки генетической информации выглядит так:

Прокариотический транскприпционный комплекс. Указанные на рисунке буквы являются общепринятыми обозначениями соответствующих субъединиц. σ70 — сигма фактор генов домашнего хозяйства E. coli

Кодоны в стандартном генетическом коде. Спасибо википедии за картинку.
1) Для каких целей используются бактерии в генной инженерии и почему именно они
Бактерия в генной инженерии — это потенциальный исходный материал для создания:
Интересным является тот факт, что первые успешные опыты в области генной инженерии бактерий произошли задолго до эпохальной работы Уотсона и Крика. Более того, на основании этих опытов был доказан сам факт того, что информация содержится именно в ДНК, после чего учёные могли не тратить своё время на гипотезы об РНК и белке.
Таким образом, было доказано, что носителем информации о признаках является именно ДНК. Кроме того, было наглядно показано, что возможно самопроизвольное проникновение инородной молекулы ДНК в бактериальную клетку.
Почему бактерии так популярны при очевидных недостатках (например, отсутствие эукариотических посттрансляционных модификаций)? Всё просто. Они неприхотливы в работе, просты в использовании и не требуют дорогих питательных сред.
2) Как создаётся генетическая конструкция, которую внедряют в бактерию
Современная генная инженерия бактерий в основном представляет собой внедрение плазмидного вектора (модифицированной бактериальной плазмиды, содержащей целевой ген и набор других необходимых элементов, о которых речь пойдёт ниже). Изменение хромосомы бактерии менее типично, но эта процедура также не является чем-то диковинным: например, ген РНК-полимеразы бактериофага Т7 был введёт в хромосому кишечной палочки с помощью вектора на основе профага λ в процессе создания одного из популярных в лабораторной плактике штаммов. Причин, по которым зачастую исследователь выберет внедрение гена в составе плазмидного вектора три:
- во-первых, внедрить плазмидный вектор в бактерию дешевле, чем встроить что-то в хромосому;
- во-вторых, методология обеспечения стабильности и наследования плазмидного вектора в бактериальной клетке, а также сама процедура создания нужной генетической конструкции хорошо отработана и проста в исполнении;
- в-третьих, с плазмидными векторами всё и так прекрасно работает.
Кроме гена и промотора основными элементами плазмидного вектора являются:
-
— область начала репликации плазмиды. Нужна для поддержания постоянного количества плазмиды и её наследования дочерними клетками;
Другим примером может служить, использование гена β-глюкуронидазы (GUS). Данный фермент превращает определённые соединения в окрашенные или флуоресцирующие, что может быть обнаружено визуально по окрашенности колонии. Естественно, данные соединения нужно добавлять в питательную селективную среду. Ещё один пример — использование гена зелёного флуоресцентного белка (GFP) (хотя использование GUS и GFP более типично для работ с клетками растений и животных);
Упрощённая схема плазмидного вектора. На рисунке обозначены ori, ген резистентности к антибиотику и полилинкер, содержащий 10 сайтов рестрикции эндонуклеазами.
Что ж, вектор у нас на руках. Как в него встроить ген? И вообще, где этот ген взять?
Допустим, что мы знаем последовательность нуклеотидов нужного нам гена. Тогда поступают следующим образом:
- Химически синтезировать короткие одноцепочечные полинуклеотиды таким образом, чтобы они частично перекрывались;
- Объединить эти фрагменты с помощью ПЦР.
Слева изображён процесс сборки гена методом перекрывающихся праймеров (более подробно процедура описана в спойлере ниже). Справа изображён процесс вставки гена в вектор.


На рисунке синими полосками показаны частоты кодонов у землеройки, тупайи, домашней кошки, лошади, мышиного лемура, шимпанзе и человека. Красной полосой отмечена частота кодонов у кишечной палочки E. coli.
-
Система на основе регуляторных элементов лактозного оперона E. coli (lac-оперона) и сильного промотора.
Дело в том, что у кишечной палочки есть свои правила питания. Во-первых, существует механизм подавления активности lac-оперона, который включён только тогда, когда в клетку не поступает лактоза. Это логично: зачем тратить силы на синтез того, что не пригодится? Но как только лактоза начинает поступать в клетку в достаточном количестве этот механизм выключается.
Однако, есть второй механизм подавления активности lac-оперона. Если в среде есть глюкоза, то клетка питается исключительно глюкозой, так как она активирует второй механизм ингибирования транскрипции lac-оперона. Таким образом, lac-оперон активен только тогда, когда в окружающем клетку пространстве есть только лактоза. Минусом лактозного оперона является крайне слабый промотор, поэтому в штаммах продуцентах он заменён на сильный. Сильные промоторы часто получают из патогенов. Наиболее широко используемые в генной инженерии прокариот сильные промоторы выделены из бактериальных вирусов — бактериофагов. Например, широко используется промотор фага Т7.
К слову, некоторые сильные промоторы для генной инженерии растений также выделены из вирусов, например, это промотор вируса мозаики цветной капусты.

Как было указано выше, у E. coli нет РНК-полимеразы, которая бы узнавала промоторы бактериофагов, поэтому предварительно в продуцент встраивают ген РНК-полимеразы соответствующего бактериофага.
Можно поступить и по-другому: вообще не добавлять в питательную среду глюкозу и лактозу, а потом, когда культура дорастёт до нужной плотности, добавить то, что клетка примет за лактозу, но не сможет метаболизировать или разрушить. Сейчас в качестве такого индуктора используют ИПТГ.
В современном обществе у процесса генетической модификации появились различные ассоциации с мутантами, зомби, опытами, необратимыми последствиями. Но неужели все так плохо и прогресс генной инженерии не несёт практической пользы? В блоге ЛАНИТ-Интеграции на Хабре уже есть две мои статьи про повышение урожайности картофеля с помощью цифровых технологий и про промышленное выращивание овощей. В этой статье я подробнее остановлюсь на многогранной теме ГМО и, в частности, использовании CRISPR-технологии в генной инженерии и ее перспективах.
Что такое селекция и какие методы до сих пор применяются
Селекция растений нужна для выявления образцов с наилучшими признаками по устойчивости своего вида к тем или иным болезням, вредителям, к неблагоприятным погодным условиям, а также образцов, которые дают больше урожая лучшего качества. Общая идея простая и конкретизированная, а вот методы, к которым прибегают ученые в достижении данных целей, с каждым разом становятся все сложнее, но интереснее.
Ключевые методы селекции растений:
гибридизация внутривидовая и отдалённая,
А теперь рассмотрим каждый способ отдельно. Где-то буду краток, а о некоторых, наиболее распространенных и интересных - расскажу подробнее.
Массовый отбор.
Здесь буду краток. Это самый первый вид селекции. Он стартовал с переходом человека к оседлому образу жизни. Основной принцип: бери растения, которые нравятся по любому внешнему признаку (фенотипу), например, по размеру листа, плода, семени, высоте растения, его ветвистости и т.д., и высаживай их отдельно. С пониманием физиологии и генетики растений добавилось несколько правил к данной методике, касающихся, в частности, самоопыляемых и перекрестно опыляемых растений.
Индивидуальный отбор.
Это следующая ступень развития селекции, на которой мы перестаем опираться только на фенотипические признаки растений, и включаем ещё отбор по генотипу. Однако такой метод требует значительно больше усилий. Дело в том, что каждое растение отбирается отдельно, и его потомство выращивается также отдельно. Метод хорошо подходит для растений самоопылителей, к которым относятся такие культуры, как горох, пшеница, ячмень, фасоль и др. На растениях с перекрестным опылением, когда они переопыляются между собой, и возникает расщепление признаков, необходимо вводить непрерывный многократный отбор (и не одного растения, а всей семьи, то есть потомства одного растения).
Инбридинг (инцухт-гетерозисные скрещивания)
Это близкородственное скрещивание, но в случае с растениями имеет место быть самоопыление перекрестноопыляемых растений. Методика всё ещё относится к первоначальному принципу селекции, а именно к отбору. В этом случае, как и в последующих, создание образцов будет происходить в принудительном порядке, искусственно увеличивая разнообразие форм. Близкородственное скрещивание применяется для перевода большинства генов сорта в гомозиготное состояние и, как следствие, закрепляет новые хозяйственно полезные и ценные признаки у потомства.
Гибридизация внутривидовая и отдалённая
Просто гибридизация — это процесс получения гибрида (от лат. hibrida, hybrida — помесь). Очевидность предыдущего предложения и некоторых последующих зашкаливает, но тут ничего не поделать. Начнем и практически сразу закончим с понятием “внутривидовой гибридизации”. Здесь все так же очевидно, как и в начале раздела. Скрещивание происходит между растениями одного вида, разновидности, линий или сорта. С помощью этого вида селекции создано большинство современных сортов сельскохозяйственных культур. А вот отдалённая гибридизация – это более сложный и трудозатратный процесс. Одна из основных сложностей при получении отдаленных гибридов – несовместимость половых клеток, да-да, у растений тоже присутствуют половые клетки, а также стерильность гибридов первого поколения и последующих. Преодолеть эту проблему в ряде случаев позволяет полиплоидия или беккросс. Всё-таки придётся углубиться и пояснить ещё пару понятий. Беккросс или возвратное сращивание – это когда потомство от двух видов скрещивают с одной или обеими родительскими формами или аналогичной по генотипу, здесь вроде всё просто. Полиплоидия – кратное увеличение числа хромосом, например, х2, х4 и так далее. Один из самых распространенных методов получения полиплоидов – это обработка зародышей, проростков колхицином (алкалоид растительного происхождения).
Искусственный мутагенез
В широком смысле мутации в селекции растений делятся на два типа: естественные и искусственные. Естественный мутагенез происходит без участия человека, под воздействием на организм естественных факторов окружающей среды, например, ультрафиолета, радиации и др. В отличии от естественного хода эволюции, при котором закрепляются только полезные свойства, при мутации происходят изменения, которые могут никак не влиять на выживаемость вида. При искусственном мутагенезе происходит, в принципе, то же самое, что и при естественном, только под строгим наблюдением людей в белых халатах! А ещё добавится работенка по проверке полученных мутантов и отбору наилучших.
Теперь немного раскроем тему искусственного мутагенеза. Сначала поговорим о том, что вызовет мутацию и поделим мутагенез на три основные категории:
Теперь кратко о химических мутагенах. Тут пропустим подробности воздействия на клетки. Просто запомните, к таким мутагенам относятся альдегиды, нитриты, гидроксиламин, азотистые соединения, алкилирующие соединения (этиленимин, нитрозоэтилмочевина, этилметансульфонат и др.). Эти химические вещества вступают в реакцию с нуклеиновыми основаниями (это то, что в ДНК, и нарушают принцип комплементарности, известный всем из школьного курса биологии).
Биологические мутации, как говорится, на злобу дня. Данный вид мутаций может происходить под воздействием вирусов, чистых ДНК, антивирусных вакцин. Механизм действия биологических факторов не вполне ясен. Они вызывают нарушение процесса рекомбинации. Но! Все испытания проводятся на отдельных клетках, одноклеточных организмах, растениях, простейших формах. Для влияния на большой и сложный организм, вроде человека, где и без этого в отдельных клетках периодически происходят мутации, этого недостаточно.
CRISPR
19 ноября 2018 года накануне второго Международного саммита по редактированию генома человека в университете Гонконга Хэ Цзянькуй объявил о проекте по созданию первых в мире людей с искусственно измененными генами – двух девочек-близнецов Лулу и Нана (настоящие имена неизвестны). После этого события во всем мире начали бурно обсуждать CRISPR-технологию.
Спойлер – в разделе речь пойдет о бактериях и о том, почему именно им мы обязаны существованию генной инженерии.
Давайте вспомним про дезоксирибонуклеиновую кислоту (ДНК), так как в дальнейших разделах речь пойдет как раз о работе с этой структурой. Молекула ДНК состоит из двух связанных цепочек, где вторая выступает в качестве резервной копии и хранит биологическую информацию в виде генетического кода, состоящего из последовательности нуклеотидов.
В молекуле нуклеотида в каждой из цепочек присутствует азотистое основание, которым он соединяется с основанием нуклеотида на противоположной цепочке, тем самым образовывая структуру двойной спирали молекулы ДНК.
К азотистым основаниям относят хорошо всем известные по курсу школьной биологии аденин, гуанин, цитозин, тимин. Есть еще урацил, который входит в состав рибонуклеиновой кислоты (РНК). Азотистые основания соединяются друг с другом согласно принципу комплементарности, когда одно основание соединяется с определенным другим. На основе данного принципа аденин соединяется с тимином, гуанин – с цитозином.
В структуре ДНК зашифрованы данные о том, какие белки надо строить в нашем организме. На основе тех белков, которые в нас есть, строится наш организм, зависит то, как мы выглядим и устроены. С ДНК снимается временная копия в виде молекулы РНК, которая имеет схожее, но уже одноцепочечное строение, с которого считывается последовательность нуклеотидов и строится необходимый белок. Алгоритм, по которому последовательность нуклеотидов в ДНК переводится в белковую последовательность аминокислот, называется “генетический код”.
Соответственно, если мы внесем изменение в какой-нибудь значимый участок ДНК, то это повлияет на то, какой белок у нас будет формироваться, а значит, это повлияет на то, каким будет организм.
Иммунитет можно поделить на два типа: адаптивный и врожденный. С адаптивным иммунитетом многие из нас знакомы по вирусу гриппа. Когда человек заболевает новым штаммом гриппа, организму необходимо некоторое время для выработки иммунитета, а после этого данный штамм становится нам не страшен. С врожденным иммунитетом немного проще, если он у вас хорошо действует, вы не узнаете, против чего он работает.
У бактерий система защиты очень похожа на нашу. Аналогом нашего врождённого иммунитета можно назвать систему рестрикции-модификации. При попадании чужеродной ДНК в бактерию специальные белки рестриктазы нарежут чужеродную ДНК на мелкие кусочки. Для того, чтобы рестриктаза могла отличить чужеродную ДНК от ДНК собственной бактерии, на последней бактерия вносит небольшие изменения, по которым белки рестрикции ее идентифицируют.
Рестриктазы долгое время являлись основным инструментом генной инженерии, так как они могут разрезать ДНК, и впоследствии в разрез можно запихнуть собственный кусок ДНК и собрать новую конструкцию. Интересное замечание: чтобы разрезать ДНК, используется часть, заимствованная у бактерии, а чтобы склеить – используется фермент, позаимствованный у фага. Далее такие новые конструкции мы можем поместить в растения или животных и получить их ГМО-версии.
Рестриктазы получают отдельно из различных бактерий, так как они очень специфичны к определенному участку ДНК. Рестриктазы производят на коммерческой основе, есть каталог, по которому их можно подобрать и заказать.
Все ГМО, в том числе растения и светящиеся животные, не обходятся без использования рестриктаз. Аналогом нашего адаптивного иммунитета является CRISPR – Clustered Regularly Interspaced Short Palindromic Repeat.
CRISPR-технология была открыта совсем недавно. Стало неожиданным, что у бактерий есть аналог адаптивного иммунитета. В этом случае при попадании чужеродной ДНК в клетку бактерии, она также нарезается на кусочки. Только эти кусочки не выкидываются, а встраиваются в собственную ДНК бактерии. Вставляются не в любой участок, а в специализированный, который называется CRISPR-кассета.
Спейсеры – это и есть кусочки фагов, разделенные повторяющейся последовательностью и упакованные таким образом в ДНК бактерий. Рядом с CRISPR-кассетой есть гены Cas-белков, которые аналогичны рестриктазе. После того, как кусочки чужеродной ДНК сохранились в CRISPR-кассеты, собираются Cas-белки по генам и из crispr-кассеты в них добавляется РНК, который соответствует одному кусочку фага. Этот комплекс уже готов работать. При повторном попадании фаговой ДНК в бактерию данный комплекс садится на нее и начинает передвигаться, пока не найдет совпадения по принципу комплементарности с имеющимся у него РНК, а после этого режет фаговый ДНК для его уничтожения.
Теперь немного об истории этого открытия. В 1987 году была выпущена статья, которая никак не относилась к изучению иммунитета бактерий. В статье описывалось изучение какого-то гена кишечной палочки. В ее конце авторы указали, что они обнаружили рядом с их изучаемым геном интересную последовательность в виде разных последовательностей, разделенных одинаковыми повторами. На тот момент объяснений данному участку ДНК и за что он отвечает, дано не было. Этот участок получил название только в 2002 году – Clustered Regularly Interspaced Short Palindromic Repeat (CRISPR).
Понимание, для чего это нужно, появилось примерно в 2007 году с бактериями для получения молочных продуктов, в том числе и сыра. Бактерии стали сильно поражаться вирусом, и часть из них погибала, от чего возникали большие сложности на производстве сыра. Началось изучение вопроса, что мешает части бактерий жить и не умирать. Когда стали сравнивать бактерии, которые умирали, с теми, которые не поражались, то заметили разницу как раз в CRISPR-кассете. У тех бактерий, которые не поражались вирусом в CRISPR-кассете, было ровно на один повтор больше. Самое удивительное, что этот повтор был похож на последовательность ДНК фагов, которыми они болели в этот момент. Всё встало на свои места, и ученые быстро разобрались, как это работает. В 2013 году уже появились первые научные работы о том, как это можно применить.
В чем особенность применения Cas-белков от рестриктазы? Использование таких структур на основе Cas-белков позволяет нам разрезать ДНК в произвольном месте. Для этого мы в Cas-белок помещаем вместо РНК фага собранную нами РНК, тем самым направляя белок на нужный участок ДНК, и делаем двуцепочечный разрыв. Для клетки такой разрыв очень неправильный, и она пытается это решить разными способами, из которых нам интересны два.
Подведем промежуточный итог. Для того, чтобы сделать разрез, нам понадобится Cas-белок, РНК, которую мы можем синтезировать сами, и опционально образец ДНК.
Не все так гладко, как кажется на первый взгляд. При использовании данной технологии существуют некоторые сложности. Первой сложностью можно назвать off-target-эффект. ДНК молекулы очень длинные, с большим количеством последовательностей, поэтому на ней могут находиться участки не точно, но похожие на тот, на который мы нацелились. В этом случае Cas-структура разрежет в нескольких местах, а этого нам не надо. Ко второй проблеме можно отнести соотношение двух ранее упомянутых путей восстановления разрезанной ДНК. Подставляя образец ДНК, нет гарантии (точнее она очень мала), что процесс восстановления пойдет по нему, а не кое-как.
Есть интересное решение этих проблем, которое может в той или иной степени помочь. В системе Cas-белка ломается часть, которая разрезает одну из цепей ДНК (для уточнения: в данной системе есть две структуры для разреза, и каждая для своей нити ДНК). Далее берутся две такие системы и сажаются на ДНК. При этом нам надо подобрать направляющие РНК так, чтобы системы сели рядом друг с другом, и получится, что они сделают два одноцепочечных разрыва рядом друг с другом. Такие модифицированные Cas-системы называются “никаза”. При этом разрезе клетка сильно не паникует, и вероятность сделать гомологичную рекомбинацию становится выше. Также уменьшается вероятность, что две системы найдут схожие участки рядом, тем самым практически исключается off-target-эффект.
Генетически модифицированные эмбрионы
В 2017 году проводились испытания на клетках человека, но в этом испытании дальше эмбрионов не заходили. На стадии зиготы провели генное редактирование с применением ДНК-образца и получили на выходе разный набор эмбрионов, в части которых изменений не было, часть представляла собой набор из клеток, где прошли изменения в разной степени, а часть была полностью нормально отредактирована. Данная технология, при которой из человека берутся клетки, редактируются и помещаются обратно, может применятся в медицине при лечении генетических заболеваний. Клинические испытания в данном направлении проводятся с 2018 года.
К чему могут привести внесение таких мутаций в ДНК
Мутации в живых организмах - это естественный процесс, при котором случаются также полезные мутации, например, благодаря им люди смогли усваивать лактозу. Примерно 40 мутаций получает каждое последующее поколений от предыдущего, при этом данный процесс нами не контролируется, а при геномном редактировании мы точно знаем, что и где мы заменяем и стараемся сделать что-то полезное.
Вернемся к Хэ Цзянькую и тому, что он сделал. Ученый взял женские и мужские половые клетки у пар, провел с ними экстракорпоральное оплодотворение (ЭКО), а впоследствии отредактировал ген CCR5 в эмбрионах с помощью CRISPR. Данный ген кодирует белок, при помощи которого ВИЧ проникает в наши клетки. Хэ Цзянькуй пытался провести мутацию CCR5-∆32, которая уже присутствует у некоторой части населения нашей планеты и благодаря которой эти люди невосприимчивы к ВИЧ. Также интересно, что отключение гена CCR5 имеет положительный побочный эффект на развитие мозга: улучшается память, повышается способность мозга восстанавливаться после инсульта, а также, возможно, есть связь с более высокой успеваемостью в школе и умственными способностями.
Более подробно про технологию CRISPR можно узнать по ссылке.
В заключении хотелось бы добавить, что всему свое время и прогресс необходим. Классическая селекция применялась, когда необходимо было накормить меньшее количество людей. Со временем население планеты начало увеличиваться в нелинейной прогрессии, появилась необходимость в более короткие сроки получать сорта культурных растений с повышенной урожайностью. Шло время, началась борьба за то, чтобы все посаженные растения сохранились и дали урожай. Для достижения таких результатов, помимо использования различных средств защиты растений, необходимо было начинать более сложные процессы селекции в виде отдаленной гибридизации и мутагенеза, чтобы выводить сорта, устойчивые к заболеваниям и вредителям. Новые технологии, появившиеся с генной инженерией, помогают нам проводить те же самые процессы, как в природе и классической селекции, только с большей точностью и скоростью.
Читайте также:

