Кишечная палочка в зеве у взрослых норма в таблице
Обновлено: 15.04.2024
Состав микробной флоры полости рта неоднороден. В разных участках определяется различный как количественный, так и качественный состав организмов.
Помимо перечисленных видов, в ротовой полости также обитают спирохеты родов Leptospiria, Borrelia и Treponema, микоплазмы (M. orale, M. salivarium) и разнообразные простейшие - Entamoeba buccalis, Entamoeba dentalis, Trichomonas buccalis и др.
Представители непостоянной микрофлоры полости рта обнаруживаются, как правило, в очень незначительных количествах и в короткие периоды времени. Длительному пребыванию и жизнедеятельности их в полости рта препятствуют местные неспецифические факторы защиты - лизоцим слюны, фагоциты, а также постоянно присутствующие в полости рта лактобациллы и стрептококки, которые являются антагонистами многих непостоянных обитателей полости рта. К непостоянным микроорганизмам ротовой полости относятся эшерихии, основной представитель которых - кишечная палочка - обладает выраженной ферментативной активностью; аэробактерии, в частности Aerobacter aerogenes, - один из наиболее сильных антагонистов молочнокислой флоры полости рта; протей (его количество резко возрастает при гнойных и некротических процессах в полости рта); клебсиеллы и особенно Klebsiella pneumoniae, или палочка Фридлендера, устойчивая к большинству антибиотиков и вызывающая гнойные процессы в полости рта, псевдомонады и др. При нарушениях физиологического состояния полости рта представители непостоянной флоры могут задерживаться в ней и размножаться. В здоровом организме постоянная микрофлора выполняет функцию биологического барьера, препятствуя размножению патогенных микроорганизмов, поступающих из внешней среды. Она также участвует в самоочищении полости рта, является постоянным стимулятором местного иммунитета. Стойкие изменения состава и свойств микрофлоры, обусловленные снижением реактивности организма, резистентности слизистой оболочки полости рта, а также некоторыми лечебными мероприятиями (лучевая терапия, прием антибиотиков, иммуномодуляторов и др.), могут приводить к возникновению различных заболеваний полости рта, возбудителями которых бывают как патогенные микроорганизмы, попадающие извне, так и условно-патогенные представители постоянной микрофлоры ротовой полости.
В связи с высокой частотой заболеваний ротовой полости актуально представить изучение микробиоценоза ротовой полости.
В качестве исследуемого материала были взяты данные анализа микрофлоры ротовой полости 22 пациентов поликлиники №5 Заволжского района г. Ульяновска и 66 пациентов поликлиники №2 Засвияжского района г. Ульяновска, обратившихся в поликлинику в период с сентябрь по декабрь 2006 г. и февраль по апрель 2007 г. Среди больных 33 мужчины и 55 женщин.
Пациентам исследуемой группы были поставлены следующие диагнозы: кандидоз (4 чел. - 4,55%), катаральная ангина (6 чел. - 6,81%), стоматит (12 чел.- 13,63%), глоссит (4 чел.- 4,55%), лейкоплакия (1 чел. - 1,14%), пародонтит (31 чел. - 35,23% ), пардонтоз (11 чел. - 12,5%), пульпит (1 чел. - 1,14%), гингивит (18 чел. - 20,45%).
Микрофлора полости рта крайне разнообразна и включает бактерии, актиномицеты, грибы, простейшие, спирохеты, риккетсии, вирусы. При этом надо отметить, что значительную часть микроорганизмов полости рта взрослых людей составляют анаэробные виды.
Самую большую группу постоянно обитающих в полости рта бактерий составляют кокки - 85-90 % от всех видов. Они обладают значительной биохимической активностью, разлагают углеводы, расщепляют белки с образованием сероводорода.
В зубном налете и на деснах здоровых людей присутствуют также стафилококки - Staph. epidermidis, однако у некоторых людей в полости рта могут обнаруживаться и Staph. aureus.
Палочковидные лактобактерии в определенном количестве постоянно вегетируют в здоровой полости рта. Подобно стрептококкам они являются продуцентами молочной кислоты. В аэробных условиях лактобактерии растут значительно хуже, чем в анаэробных, так как выделяют перок-сид водорода, а каталазы не образуют. В связи с образованием большого количества молочной кислоты в процессе жизнедеятельности лактобактерии они задерживают рост (являются антагонистами) других микроорганизмов: стафилококков, кишечной, брюшнотифозных и дизентерийных палочек. Количество лактобактерий в полости рта при кариесе зубов значительно возрастает в зависимости от величины кариозных поражений. Для оценки "активности" кариозного процесса предложен "лактобациллентест" (определение количества лактобактерий).
Лептотрихии относятся также к семейству молочно-кислых бактерий и являются возбудителями гомоферментативного молочно-кислого брожения. Они имеют вид длинных нитей разной толщины с заостренными или вздутыми концами, их нити сегментируются, дают густые сплетения. Лептотрихии являются строгими анаэробами.
Актиномицеты, или лучистые грибы, почти всегда присутствуют в полости рта здорового человека. Внешне они сходны с нитевидными грибами: состоят из тонких ветвящихся нитей - гифов, которые, переплетаясь, образуют видимый глазом мицелий. Некоторые виды лучистых грибов, так же как и грибы, могут размножаться спорами, но основной путь - простое деление, фрагментация нитей.
В полости рта здоровых людей в 40-50 % случаев встречаются дрожжеподобные грибы рода Candida (С. albicans). Они имеют вид овальных или удлиненной формы клеток размером 7-10 мкм, часто с отпочковывающейся новой клеткой. Кроме того, в полости рта могут встречаться и другие виды дрожжеподобных грибов, например, C. tropicalis, С. ceаsei. Патогенные свойства наиболее выражены у С. albicans. Дрожжеподобные грибы, интенсивно размножаясь, могут вызвать в организме дисбактериоз, кандидоз или местное поражение полости рта (у детей его называют молочницей). Заболевания эти носят эндогенный характер и возникают как результат бесконтрольного самолечения антибиотиками широкого спектра действия или сильными антисептиками, когда подавляются антагонисты грибов из представителей нормальной микрофлоры и усиливается рост устойчивых к большинству антибиотиков дрожжеподобных грибов.
В ходе обследования пациентов были взяты мазки со стенки языка, слизистой щек и зева, проведен микробиологический анализ микрофлоры ротовой полости.
В результате исследований были обнаружены дрожжевые грибы рода Candida (у 15 пациентов - 17,05%), Aspergillia niger (у 1 - 1,14%), Pseudomonae aeruginosa (у 1 - 1,14%), бактерии рода Staphylococcus (у 19 - 21,59%), рода Streptococcus (у 76 - 86,36%), Esherichia coli (у 4 - 4,55%), рода Klebsiella (у 3 - 3,4%), рода Neisseria (у 16 - 18,18%), рода Enterococcus (у 5 - 5,68%), рода Corynobacter (у 1 - 1,14%). Причем у 86 (97,72 %) пациентов были выявлены одновременно бактерии нескольких родов.
В ходе анализа у пациентов в микрофлоре ротовой полости выделены ассоциации микроорганизмов. Двухчленные ассоциации у 50 обследованных (56,82%), трехчленные - у 18 (20,45%), четырехчленные - у 3 (3,41%). Один вид микроорганизмов обнаружен у 17 пациентов (19,32%).
Кроме количественных показателей было охарактеризовано видовое разнообразие выявленных микроорганизмов. Род Candida: C. albicans, C. tropikalis, род Staphylococcus: Staph. Viri, Staph. Albic, Staph. Aureus, Staph. haeruelibicus, род Streptococcus: Str. Virid, Str. Epidermidis, Str. Faecabis, Str. Aureus, Str. Hominis, Str. Vissei, Str. Flaeris, Str. Salivarum, Str. Agalactika, Str. Milis, Str. Sanguis, Str. Pyogenes, Str. Anginosus, Str. Mutans, Str. Cremoris, род Neisseria: N. sicca, N. subfeava, N. feava, род Klebsiella: K. pneumoniae, а также Esherichia coli, Enterococcus faeceum, Pseudomonae aeruginosa, плесневые грибки Aspergillia niger, дифтероид Corynobacter pseudodiphteriae.
Наибольшее видовое разнообразие представлено у бактерий рода Streptococcus.
Кроме качественного состава микроорганизмов при исследовании мазков определяется их степень роста (обильный, умеренный и скудный). С обильным ростом выявлены 85 (48,85 %) микроорганизмов, с умеренным - 48 (27,59%) и со скудным - 41 (23,56 %)
Таким образом, рассмотрены качественный и количественный состав микрофлоры ротовой полости в норме и при патологиях.

Энтеробактерии (лат. enterobacteriaceae) — семейство грамотрицательных (как и другие протеобактерии) палочкообразные (бациллы), споронеобразующие бактерии, длиной 1-5 мкм, со жгутиками для передвижения. Эти бактерии — факультативные анаэробы, расщепляют углеводы с образованием муравьиной кислоты и других конечных продуктов формиатного брожения. Некоторые из них могут разлагать лактозу.
Множество представителей семейства являются частью микрофлоры кишечника человека и животных. Они представляют большое число нормальной микрофлоры человеческого организма и значительное количество патогенных микробов: сальмонелла, кишечная палочка, чумная палочка и др. Энтеробактерии определяют в различных отделах желудочно-кишечного тракта здорового человека: в тощей кишке – от 0 до 103 КОЕ/мл, в подвздошной — от 10 2 до 10 6 КОЕ/мл. В норме в составе факультативной микрофлоры кишечника они не должны превышать количество 10 4 КОЕ/г.
Другая часть этих бактерий обнаруживается в воде и почве или паразитирует на различных растениях и животных. Хорошо изучена кишечная палочка — модельный организм, используемый в молекулярной биологии и генетике, в связи с изученностью её генетики и биохимии.
Энтеробактерии в воде и почве месяцами остаются жизнеспособными, но за несколько минут гибнут от дезинфектантов и при очень высоких температурах через 1 час.
Эти бактерии вырабатывают сахаролитические, протеолитические и др. ферменты, определение которых имеет таксонометрическое значение. Образуют индол, а глюкозу, лактозу, маннит ферментируют до кислоты и газа.
Факторами патогенности являются:
- эндотоксин, который освобождается после разрушения микробных клеток и адгезины,
- цитотоксин,
- экзотоксин.
Бактерии могут проникать в макрофаги и размножаться в них. Патологический процесс усугубляется на фоне снижения активности фагоцитоза, падения барьерной функции тканей. Снижение в кишечнике полезной нормофлоры и нарушение колонизационной и защитной функции может приводить к проникновению в лимфу и кровь. Коли-бактериозы возникают при снижении количества полезной микрофлоры кишечника и иммунитета. После перенесённого заболевания невосприимчивость не формируется.
Какие заболевания вызывают энтеробактерии?

энтреробактерии e.coli
Группа энтеробактерий включающая: сальмонеллы, шигеллы, эшерихии, клебсиеллы, собственно энтеробактер, серрации, протей, морганеллы, провиденции и иерсинии в норме обитают в желудочно-кишечном тракте человека, но при снижении защитных свойств слизистой кишечника, могут вызывать инфекции желудочно-кишечного тракта или других органов.
Энтеробактерии — представители родов citrobacier, ewardsiella, enterobacter, escherichia, hafnia, klebsiella, proteus, providencia, salmonella, serratia, yersinia вызывают инфекции мочеполовой системы (в том числе циститы, пиелонефриты, цервициты и т.п.). До 80% бактерий, обнаруживаемых в моче — энтеробактерии.
Энтеробактерии становятся причиной различных заболеваний человека. Условно – патогенные бактерии вызывают гнойно-воспалительные процессы различной локализации: как эндогенные процессы — развиваются инфекции мочевыводящих путей (уретрит, цистит, пиелонефрит), половой системы (вагинит, трихомиоз, цервицит), дыхательных путей (пневмония), желудочно-кишечного тракта (холециститы, сальмонеллез, дизентерия, чума) и другие, так называемые коли-бактериозы, а как экзогенные – нагноение ран. Разные формы ОКЗ – острых кишечных заболеваний обусловлены патогенным действием различных энтеробактерий и чем агрессивнее токсины бактерий, тем тяжелее состояние, особенно у маленьких детей.
Escherichia coli – кишечная палочка в норме определяется в желудочно-кишечном тракте и синтезирует секреторные иммуноглобулины и колицины. Они тормозят рост некоторых патогенных энтеробактерий и препятствуют проникновению их в слизистую оболочку стенки кишечника. E. сoli участвует синтезе витамина К (свертываемость). Некоторые патогенные штаммы кишечной палочки могут поражать слизистую кишечника, что проявляется кровавым водянистым поносом или диареей путешественников.
У детей диарея, вызываемая патогенной энтерогеморрагической кишечной палочкой, может осложняться гемолитико-уремическим синдромом и почечной недостаточностью. Эта бактерия может поражать кровь, желчный пузырь, легкие, мочевыводящие пути и кожу. У новорожденных детей, особенно недоношенных, кишечная палочка может стать патогенным возбудителем бактериемии и менингита.
Инфекции, обусловленные клебсиеллами (Klebsiella), энтеробактериями (Enterobacteriaceae) и серрациями (Serratia), обычно встречаются в больницах, чаще при снижении способности бороться против инфекций. Эти бактерии также часто поражают мочевыводящие, половые органы. Пневмония, вызванная клебсиеллами, наиболее распространена у больных сахарным диабетом и у злоупотребляющих алкоголем и имеет часто тяжелое течение.
Симптоматика инфекций, вызываемых энтеробактериями.
Симптомы инфекционного заболевания могут быть различны, в зависимости от места развития воспалительного процесса, однако все больные жалуются на общую слабость, повышение температуры, проявления интоксикации и боли в месте заболевшего органа. Для определения патогенных энтеробактерий обязательно нужно сдать анализы – кровь, мочу, мокроту, мазки или кал, в зависимости от локализации воспалительного процесса, пройти до обследование, для выявления функциональных нарушений.
Важно соблюдать правила личной гигиены, следить за качеством, чистотой овощей-фруктов, питаться, учитывая индивидуальные особенности, избегать контакта с инфекционными больными и поддерживать свой иммунитет в норме.
Как быстро восстановиться после инфекции?
Восстановление и сохранение достаточного количества полезной нормофлоры кишечника – лакто- и бифидобактерий, способствует защите слизистой кишечника от проникновения патогенных бактерий и их токсинов в кровь и лимфу, выведению токсинов, созданию среды, в которой патогенные микроорганизмы не могут продолжать свою жизнедеятельность и выводятся из организма человека. Важно, что продукты жизнедеятельности полезных бактерий помогают иммунитету сохранять активность в борьбе с вредными бактериями.
Синбиотический биокомплекс Нормофлорины – содержащий живые активные лакто- и бифидобактерии и их метаболиты с противовоспалительным, антисептическим, иммуногенным и питательным действием на слизистые за многие годы зарекомендовал себя, как активный помощник и борец против патогенных бактерий для малышей и взрослых, беременных и больных с различными заболеваниями. Достаточно быстро при употреблении Нормофлоринов снимается интоксикация и восстанавливается функция кишечника, общее самочувствие.
Рекомендуется: как можно раньше начать принимать Нормофлорины в возрастных дозировках – Л – за 10-15 мин до еды утром (+ обед при запорах), Д – обед или вечер за 20 мин до еды, Б – на ночь или в микроклизме. Длительность приема 3-4 недели, до полного восстановления функции кишечника и улучшения общего самочувствия. Желательно 10-14 дней натощак принимать сорбенты – для выведения токсинов – зостерин или пекто, они уменьшают гнилостные, бродильные процессы, повышенное газообразование, улучшают работу кишечника.
Важно закрепить эффект восстановления микрофлоры, улучшить работу поджелудочной железы, печени, кишечника, иммунитет – для этого хорошо далее в течение месяца использовать функциональное питание – Гармония жизни. В её составе также содержатся живые полезные лакто- и бифидобактерии, их метаболиты и пектин. Вкусно, полезно и эффективно!

Мазок из зева – это доступный бактериоскопический метод исследования. В результате удается выявить состояние микробиома, выделить возбудителя, например, бактерии, вирусы или простейшие и определить чувствительность микроорганизмов к лекарственным препаратам. Именно при ангине этот метод исследования оказывается основным.
Ангина и ее особенности
Ангина – сложное и опасное инфекционное заболевание, характеризующееся острым воспалением небных миндалин или других лимфоидных образований в ротоглотке.
Спровоцировать воспаление могут грибки, бактерии или вирусы.
В клинической практике принято выделять несколько видов ангин, и классификация основана степени тяжести, состоянии пациента и какие структуры миндалин поражаются.
В рамках статьи интересует вопрос диагностики и причины возникновения воспаления. В 80% случаев причиной ангины является гемолитический стрептококк группы А, и как раз его будут искать при исследовании мазка из зева. В остальных 20% случаев возбудителями могут быть:
- стафилококки;
- аденовирусы;
- грибки.
Лечение назначается в зависимости от причины воспаления. Известно, что антибиотики, столь эффективные в лечении бактериальной пневмонии, не влияют на вирусы, а вот противовирусные не влияют на бактерии.
Когда рекомендовано проведение мазка из зева?
Показаниями для забора материала – мазка из зева, последующего посева на микрофлору будет:
- все виды ангины;
- формирование налета на миндалинах;
- гнойные образования рядом с миндалинами;
- подозрения на мононуклеоз;
- подозрение на коклюш;
- для исключения дифтерии;
- для определения антибиотикочувствительность;
- для оценки течения болезни и результатов лечения.
Как подготовиться к процедуре?
Забору биологического материала должна предшествовать подготовка. Эти простые действия помогут избежать ошибок и получить достоверные результаты.
- Во-первых, рекомендовано рассказать врачу о принимаемых лекарствах, особенно, антибиотиках. В некоторых случаях может быть принято решение об их отмене и прекращении приема. Если исследование проводится с целью оценки эффективности лечения - в отмене препаратов нет необходимости.
- Во-вторых, за 1-3 дня до проведения процедуры запрещено применять ополаскиватели для полости рта с антисептической направленностью. Исключено использование спреев, в составе которых есть антисептики, средства с антимикробной направленностью и тем более антибиотики.
- В-третьих, исследование проводится утром, натощак. Перед процедурой не рекомендовано чистить зубы, завтракать и даже пить воду и нельзя использовать жвачки.
Результаты исследования
Исследование направлено на выявление микроорганизмов и определение их количества. В мазке из зева можно обнаружить следующую патогенную микрофлору:
Эти микроорганизмы могут спровоцировать множество заболеваний и воспалительных процессов: ангины, фарингиты, скарлатину и даже пневмонию. В домашних условиях можно самостоятельно сделать тест на этого возбудителя с помощью стрептатеста.
Может не только вызывать ангину, но и стать причиной системных поражений. Стоит отметить, что эти виды микроорганизмов могут быть неактивными, не представлять опасности для организма, сдерживаться работой иммунитета. Однако, при стечении обстоятельств, например, на фоне снижения иммунитета, может вызвать болезни, в том числе, и ангину.
Это клетки, которые высвобождаются при аллергических реакциях и указывают на неинфекционную природу воспаления.
В мазке могут обнаруживаться и другие микроорганизмы:
- пневмококки;
- стафилококки;
- стрептококки;
- нейсерии;
- вирус простого герпеса;
- грибки рода Candida.
Если содержание этих микроорганизмов не превышает определенного количества, то нет необходимости проводить лечение с целью их полного уничтожения. Такие дисбиотические нарушения могут стать причиной серьезных последствий.
Положительный результат говорит о росте представителя условной или условно-патогенной микрофлоры, которые могу вызвать те или иные болезни и последствия. Отрицательный результат говорит об отсутствии бактериальных возбудителей, и, в таком случае, можно предположить вирусную или грибковую природу болезни.
При выявлении возбудителя среди бактерий, исследование продолжается, и следующий этап – определение чувствительности к антибиотикам.
Мазок из зева на микрофлору – простой, но надежный метод определения возбудителя и его антибиотикочувствительности. Эти данные с высокой точностью выявляют возбудителя, на основе которых составляется план лечения, и можно контролировать его результаты.
Слизистая оболочка верхних дыхательных путей представляет собой первую линию защиты организма против разнообразных патогенных факторов окружающей среды, таких как бактериальные, грибковые, вирусные, промышленные химические раздражители и загрязнения и обеспечивает противовирусный иммунитет. Повреждение слизистой или сухость облегчают проникновение вируса в организм. После того, как враг попал в организм и начал повреждать клетки, огромное значение играет выработка интерферонов, которые обеспечивают их невосприимчивость к действию вируса.
Противовирусный иммунитет – это очень сложный процесс, в котором участвует множество ресурсов иммунной системы. К сожалению, иммунные реакции не всегда срабатывают так, как об этом пишут в учебниках по биологии. Часто какой-либо процесс может быть нарушен, что приводит к осложнениям и проблемам. Когда снижен иммунный ответ, нужны средства, поднимающие иммунитет. Они могут быть природными, либо купленными в аптеке, главное – это эффективность и безопасность.
Слизистая оболочка верхних дыхательных путей большей частью покрыта тонким специализированным эпителием, создающим восприимчивый (чувствительный) барьер, который постоянно бомбардируется экзогенным живым или мертвым антигенным материалом.
Вдыхаемый воздух содержит значительное количество потенциально вредных веществ (газы, взвешенные корпускулярные частицы, бактерии, вирусы, микоплазмы, грибы, в том числе дрожжи, риккетсии, пыльцу, частицы слущенного эпителия человека и животных и др.). Согласно концепции местного иммунитета, слизистые оболочки и кожа как покровы, обращенные во внешнюю среду, защищают внутреннюю среду организма и сохраняют постоянство внутренней среды путем тесного взаимодействия эволюционно выработанного комплекса неспецифических и специфических механизмов защиты.
Местный иммунитет ЛОР-органов - это барьерная функция слизистых оболочек, включающая лимфоэпителиальные органы глотки, расположенные на пересечении воздухоносных и пищепроводных путей, первыми реагирующие на очередное антигенное раздражение (инфекцию) включением механизмов иммунной защиты, и неспецифические защитные факторы слизистой оболочки (мукоцилиарный транспорт, продукция лизоцима, лактоферрина, интерферона и др.)
А теперь непосредственно о микрофлоре верхних дыхательных путей и полости рта. Важно понимать, что ЛОР-органы не являются исключением в отношении микробной стерильности, т. е. в норме мы можем выявлять определенные микроорганизмы в носу, глотке и наружном ухе. Эти микробы в условиях сохранения иммунной резистентности не только не приносят нам никакого вреда, но и наоборот, оказывают положительное влияние. Они образуют так называемую биопленку (толщиной от 0,1 до 0,5 мм) – полисахаридный каркас которой, состоящий из микробных полисахаридов и муцина, предотвращает заселение организма патогенными микроорганизмами. Благодаря выделению микроорганизмами биопленки различных кислот, спирта, лизоцима (антибактериальное вещество) и стимуляции образования иммуноглобулина А тормозится развитие патогенных микробов. Кроме того, нормальные микроорганизмы препятствуют выделению токсинов патогенными бактериями.

Это лишний раз подтверждает важность сбалансированной микрофлоры для полноценной жизнедеятельности всего организма.
Нормальная микрофлора глотки разнообразна, поскольку здесь смешивается микрофлора полости рта и воздухоносных путей. Представителями резидентной микрофлоры считаются: нейссерии, дифтероиды, и гемолитические стрептококки, энтерококки, микоплазмы, коагулазоотрицательные стафилококки, моракселлы, бактероиды, боррелии, трепонемы, актиномицеты. В верхних дыхательных путях преобладают стрептококки и нейссерии, помимо этого встречаются стафилококки, дифтероиды, гемофильные бактерии, пневмококки, микоплазмы, бактероиды. Слизистая оболочка гортани, трахеи, бронхов в норме стерильна. Следует сказать, что вышеуказанный видовой спектр микроорганизмов не является неизменным. Его состав зависит от многих факторов: сопутствующей патологии, возраста, условий внешней среды, условий труда, питания, перенесенных заболеваний, травм и стрессовых ситуаций и т.д.
Такие состояния, как острые и хронические заболевания всего организма, а особенно уха, горла, носа и полости рта, аллергия, неблагоприятные физические факторы (переохлаждение, инсоляция и т. д.), химические агенты, физическое, интеллектуальное и психоэмоциональное перенапряжение, прием антибактериальных, гормональных и цитостатических препаратов, недостаточное питание, гиповитаминоз, профессиональные вредности, курение, алкоголь провоцируют нарушение нормального микробиологического равновесия в ЛОР-органах и являются причинами нарушения качественного и количественного состава микрофлоры ротоглотки. Существует бактериологическое понятие, которое характеризует изменение соотношения представителей нормальной микрофлоры, снижение числа или исчезновение некоторых видов микроорганизмов за счет увеличения количества других и появления микробов – это дисбактериоз.
Терапия дисбактериоза должна быть строго индивидуальной и направленной в первую очередь на ликвидацию источника проблемы. Например, пока не будет адекватно пролечен аденоидит (консервативно или оперативно), от дисбактериоза вряд ли возможно избавиться. Вопрос о необходимости приема антибиотика определяется исключительно течением основного заболевания: если дисбактериоз глотки вызван наличием у ребенка хронического панкреатита, то антибактериальные средства тут неуместны; если же дисбактериоз связан с запущенной формой хронического синусита или аденоидита – без этой группы лекарственных препаратов, скорее всего, не обойтись. Воспалительные очаги в носо- и ротоглотке должны быть обязательно устранены – кариозные зубы пролечены, аденоидные вегетации, небные миндалины санированы и т.д. Помните, что они могут не только вызывать местные воспалительно-инфекционные процессы и дисбактериоз ротоглотки, но и являться источником аутоинфекции и аутоинтоксикации всего организма. Убедительные данные свидетельствуют, что возникновение ряда заболеваний респираторной, желудочно-кишечной, сердечно-сосудистой систем, опорно-двигательного аппарата обусловлено очаговой инфекцией в ротоглотке. Поэтому санация полости рта и ЛОР-органов – это обязательное условие и первый шаг к выздоровлению при многих патологических процессах.
Не стоит также забывать о мерах профилактики развития инфекционно-воспалительных процессов ротоглотки и ЛОР-органов. Так, стандартными мерами профилактики являются: ежедневные гигиенические мероприятия (туалет носа), регулярное посещение врача, рациональное питание, закаливание, создание оптимального микроклимата (влажность, температура), лечение сопутствующей патологии.
Кроме вышеперечисленных мер профилактики, помочь решить проблему инфекционно-воспалительных заболеваний ЛОР-органов и помочь восстановить нормальный микробиоценоз слизистой оболочки может прием средств растительного происхождения на основе прополиса.
Прополис – это смесь природных смол, вырабатываемых пчёлами из соединений, собираемых с разных частей растений, бутонов и выделений. Современные противомикробные применения прополиса включают рецептуры для лечения синдрома простуды (инфекции верхних дыхательных путей, обычная простуда и гриппоподобные инфекции), для заживления ран, лечения ожогов, акне, простого и генитального герпеса, и нейродермита.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
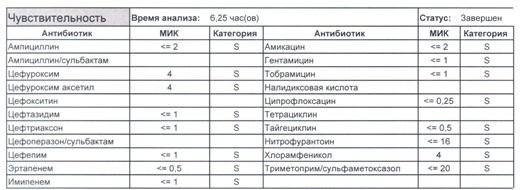
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
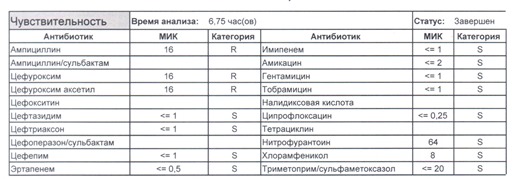
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
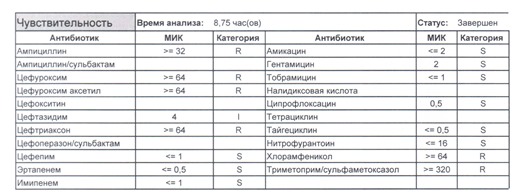
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
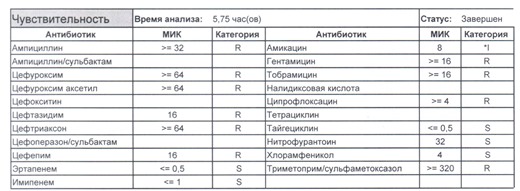
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения
Читайте также:

