Клетки с хламидийными включениями
Обновлено: 24.04.2024
Хламидиозы - разнообразные по патогенезу и клиническим проявлениям заболевания людей и животных. Наибольшее значение приобрели урогенитальные хламидийные инфекции, относящиеся к инфекциям, передаваемым половым путем (ИППП). Они поражают мужчин и женщин, регистрируются у детей и новорожденных, окажывают негативное влияние на репродуктивное здоровье и часто являются причиной бесплодия. Уровень заболеваемости урогенитальным хламидиозом в мире ежегодно составляет, по данным некоторых авторов, 90 млн. человек, что, в свою очередь, ведет к колоссальным экономическим потерям(16).
Хламидии – грамотрицательные бактерии с облигатным внутриклеточным энергозависимым паразитизмом и уникальным циклом развития, что и определяет таксономическое положение этих микроорганизмов в системе прокариотов. Chlamydia trachomatis - первый представитель обширной группы микроорганизмов, объединенных в порядок Chlamydiales. Открытие новых микроорганизмов с характерным для хламидий циклом развития параллельно с исследованиями генома ранее известных представителей рода Chlamydia привело к необходимости пересмотра классификации и номенклатуры порядка Chlamydiales (10). В соответствии с этим семейство Сhlamydiacеae, которое ранее включало только один род Chlamydia и Chlamydophila . Два новых вида, Сh. muridarum и Ch. suis, присоединившись к Ch. trachomatis, вошли в состав рода Chlamydia. Род Chlamydophila составляют уже известные виды Chlamydophila psittaci (Chlamydia psittaci), Chlamydophila pneumoniae (Ch. pneumoniae) и Сhlamydophila pecorum (Ch. pecorum).
Наиболее значимые для развитых стран урогенитальные инфекции хламидийной этиологии и их осложнения напрямую связаны с сероварами Сh. trachomatis от Д до К.
Значение и роль урогенитальных инфекций хламидийной этиологии определяется их распространением, однако его оценка связана с рядом трудностей. В частности, по различным данным, 60-80% инфекций среди женщин и до 50% - среди мужчин являются бессимптомными. Данные о частоте положительных результатов лабораторных исследований зависят от чувствительности и специфичности тестов, а также особенностей контингентов, среди которых проводилось обследование (8).
Проблемы детекции возбудителя урогенитального хламидиоза связаны и с другими обстоятельствами: наличием сочетанных (хламидийно-уреаплазменных, хламидийно-гонококковых, хламидийно-трихомонадных и других) ИППП, а также возможностью существования латентных или персистентных форм (2). Эти формы могут не отличаться по клинической картине вызываемых заболеваний, но представляют собой результат нарушения жизненного цикла хламидий на различных фазах. Латентные формы хламидий наблюдаются при ингибировании жизненного цикла на стадии элементарных телец (ЭТ) (инфекционные метаболически неактивные формы) при невозможности вступления в новый цикл развития (например, сохранение ЭТ при отсутствии чувствительных клеток-мишеней). Ингибирование перехода внутриклеточных ретикулярных телец (РТ) (вегетативные инфекционные формы) в ЭТ приводит к персистированию атипичных включений с делящимися РТ хламидий. При этом отмечается изменение чувствительности хламидий к антибиотикам. Существование персистеных форм затрудняет диагностику урогенитального хламидиоза и требует комплексного подхода к лабораторному обследованию пациентов с учетом давности заболевания и наличия симптоматики (3).
Основные принципы диагностики хламидийной инфекции заключаются в использовании:
Предпочтительным является следующий алгоритм обследования пациентов с подозрением на урогенитальный хламидиоз:
- прямая иммунофлюоресценция (ПИФ) с культурой клеток или ПЦР-анализ при диагностике симптоматических форм заболевания;
- ИФА для определения бессимптомных и осложненных форм хламидиоза обязательно в комплексе с культурой клеток, или ПЦР-анализом.
Определенной диагностической проблемой является оценка критерия излеченности: сроки исследования после терапии и используемые тесты.
Необходимо отметить, что адекватная диагностика во многом зависит от квалификации персонала и качества применяемых тест-систем.
Основными группами антибиотиков, обладающими активностью в отношении C. traсhomatis и проявляющими клиническую эффективность при соответствующих инфекциях, являются тетрациклины, макролиды, фторхинолоны, и в гораздо меньшей степени беталактамы (6, 8, 9). Оценка антибиотикочувствительности облигатных внутриклеточных паразитов – хламидий осуществляется преимущественно в культуре ткани. Вместе с тем сведения о корреляции между исследованиями чувствительных хламидий в культуре ткани и эффективностью терапии - отсутствуют. В последние годы для оценки активности антибиотиков используют детекцию в монослое инфицированных клеток хламидийной р-РНК- методом амплификации с обратной транскриптазой (13). Для большинства антибиотиков МПК, определяемая этим методом, оказывается выше, чем полученная при использовании классического культурального метода.
По всей вероятности исследования in vitro позволяют лишь качественно выявлять наличие у антибиотиков некой антихламидийной активности и предполагать большую или меньшую клиническую эффективность; результаты клинических испытаний также далеки от истины в последней инстанции, т.к. оценку чувствительности хламидий в ходе терапии практически не проводят, отдаленные результаты часто не оценивают, причины неудач лечения анализируют редко.
Как полагают многие авторы, в силу вышеуказанных причин многие эмпирически обснованные схемы терапии хламидиоза далеки от оптимальных (8).
Поскольку терапия урогенитальнного хламидиоза является весьма сложной проблемой, то наряду с известными лекарственными препаратами: тетрациклинового ряда - доксициклин; фторхинолонов – офлоксацин ; макролиды (эритромицин, азитромицин и другие) находят в последние годы при этой инфекционной патологии самое широкое применение, демонстрируя определенные преимущества перед другими группами антибиотиков.
Макролиды представляют собой антибиотики, получившие свое название из-за наличия макроциклического лактонного ядра. Кроме широко известных препаратов – эритромицина и рокситромицина, к 14-членным полусинтетическим макролидам относится кларитромицин, имеющий большое клиническое значение в отношении подавления грамположительных кокков (стафилококков, стрептококков), грамотрицательных микробов (гонококков, энтеробактерий, бордетелл, маракселл, всех видов легионелл), анаэробных бактерий (видов бактероидов, клостридий, пропионбактерий, пептококков), а также особенно микоплазм и хламидий (11).
Антимикробный эффект обусловлен нарушением синтеза белка рибосомами микробной клетки. Как правило, макролиды оказывают бактериостатическое действие, но в высоких концентрациях способны на бактерицидное воздействие. Кроме антибактериального действия макролиды обладают умеренной иммуномодулирующей и противовоспалительной активностью (17).
Кларитромицин быстро всасывается из желудочно-кишечного тракта, достигая максимальной концентрации через 1 ч. (250 мг) или 2 ч.(500 мг) - 1,2 и 2,41 мг/л соответственно; его биодоступность после приема внутрь составляет 55%.
Кларитромицин, как и другие макролиды обладает низкой степенью ионизации и растворим в липидах, в связи с чем хорошо распределяется в органах и тканях. Этот антибиотик хорошо проникает в различные клетки макроорганизма; максимальная концентрация кларитромицина в мононуклеарах и полиморфных лейкоцитах превышает сывороточные в 10-40 раз, что является более предпочтительным по сравнению с эритромицином, джозамицином и рокситромицином. Важными отличиями кларитромицина от азитромицина является то, что его активность не зависит от рН среды; кларитромицин не создает длительных субингибирующих концентраций, и его всасываемость не зависит от приема пищи.
Значительный интерес представляют данные о влиянии кларитромицина на иммунную систему человека (12). Этими и другими исследователями установлено, что кларитромицин повышает фагоцитарную активность нейтрофилов и макрофагов и усиливает миграцию их в очаг воспаления, где концентрация препарата увеличивается в десятки (30-40) раз; кроме того, он повышает активность Т-киллеров. Кларитромицин продемонстрировал очень высокую активность (МПК50 in vitro) против Сh. trachomatis и M. hominis: 0,007мг/л и 0,12мг/л соответственно, что значительно превосходит широко используемые в клинике другие макролиды и доксициклин.
Весьма ценно и то обстоятельство, что кларитромицин – это единственный макролид с высоким процентом выведения через почки ( остальные макролиды имеют ярко выраженный печёночный путь выведения ). Это позволяет рассчитывать на лучшую клиническую эффективность при лечении уретритов , простатитов и других инфекционно-воспалительных заболеваний органов мочевыводящей системы.
Установлена удовлетворительная переносимость кларитромицина (15). Побочные реакции (включая незначительные жалобы) встречаются 19,6%; среди которых чаще наблюдалась тошнота (3%), диарея (3%), диспепсия (2%), боли в животе (2%), головная боль (2%). При сравнении этих данных с другими макролидами (эритромицин, джозамицин, рокситромицин) получены близкие показатели: от 15,7 до 19%; однако реакции со стороны желудочно-кишечного тракта встречались достоверно ниже при лечении кларитромицином (7,6 и 14%). На фоне применения кларитромицина не отмечено значительных изменений лабораторных показателей. В ряде других работ процент побочных реакций кларитромицина ещё ниже, и не превышает 10%. Вообще для всех макролидов характерна хорошая переносимость и безопасность. Побочные действия нечасты и , как правило , не требуют отмены препарата. Макролиды – единственная группа антибиотиков , применяемая для лечения хламидиоза у беременных.
Таким образом, исходя из требований, предъявляемых к антихламидийным препаратам: активность в отношении патогена (Ch. trachomatis), хорошая переносимость, создание высоких внутриклеточных концентраций, можно заключить, что кларитромицин полностью соответствует этим положениям.
В последние годы получены сведения о высоком клиническом эффекте кларитромицина при терапии ИППП (7, 15). Отличный клинический эффект наблюдался у 188 из 204 больных с хламидийным уретритом (92%) и у 99 из 116 больных с нехламидийным, негонококковым уретритом, (преимущественно уреаплазменным); менее выраженный эффект получен у больных со смешанным (хламидийно-гонококковым) уретритом (55%) и уретритом, вызванным гонококками (48%). Поэтому кларитромицин (как и другие макролиды) активно не позиционируется для лечения гонорейной инфекции.
Очень хорошие результаты получены при терапии женщин с цервицитом, обусловленным Ch. trachomatis в Японии (18) –100%, причём в короткие сроки. Процент эрадикации хламидии (100%) был одинаков при 7 и 14 дневных курсах кларитромицина. Похожие данные были продемонстрированы П.В.Будановым (19) при лечении уреаплазмоза у беременных – кларитромицин опережал в среднем на 3,21 дня азитромицин и джозамицин по скорости исчезновения микробиологических признаков уреаплазмоза.
Проведя терапию кларитромицином, Н.С. и Н.Н. Потекаевы (7) достигли положительного результата в 92% (24 из 26 пациентов), причем почти в половине случаев (12) хламидиоз был ассоциирован с другими урогенитальными инфекциями: трихомонады, гонококк, микоплазмы.
Таким образом, новый макролид – кларитромицин обладает высокой эффективностью против многих грамоположительных и грамотрицательных микроорганизмов, в том числе особенно против возбудителя урогенитального хламидиоза; хорошей переносимостью, биодоступностью, иммуномодулирующим воздействием на фагоцитарно-макрофагальную систему; редкими побочными явлениями, не требующими отмены препарата; удобством в применении: 250 мг 2 раза в сутки или 500 мг 1 раз в сутки (пролонгированная форма).
В последнем обзоре по современной антибиотикотерапии (20) проф. С.В.Яковлев и В.П.Яковлев отнесли кларитромицин в число препаратов первого ряда ( вместе с традиционными доксициклином и азитромицином) для лечения хламидиоза.
Безусловно, этот препарат в ближайшее время займет ведущее место в терапии хламидиоза, микоплазмоза и других ( в том числе сочетанных) инфекций, передаваемых половым путем, а также других мочеполовых инфекций.
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Причины дисплазии шейки матки
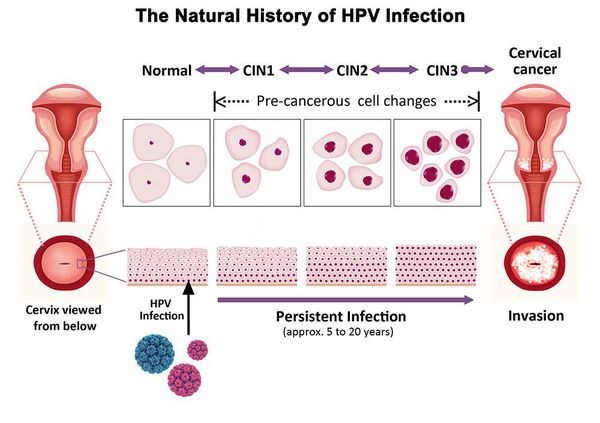
Папилломавирусная инфекция (ВПЧ) — основная причина дисплазии и рака шейки матки. К болезни приводит длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
К факторам риска дисплазии шейки матки относится длительный приём контрацептивов и курение. Выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Другие факторы риска — раннее начало половой жизни, большое число и частая смена половых партнеров, употребление алкоголя, сопутствующие половые инфекции, много беременностей и родов. Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
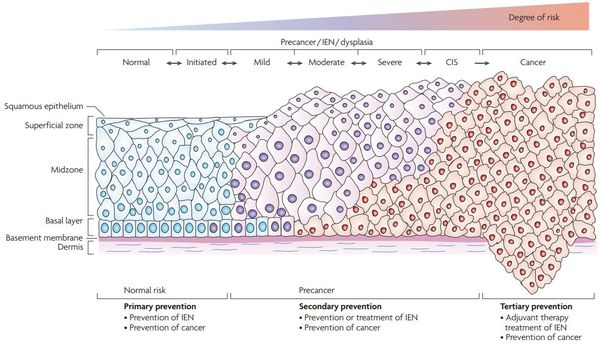
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
Классификация Папаниколау
- 1-й класс — нормальная цитологическая картина (отрицательный результат);
- 2-й класс — изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
- 3-й класс — единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
- 4-й класс — отдельные клетки с явными признаками озлокачествления;
- 5-й класс — много типично раковых клеток (злокачественное новообразование).
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
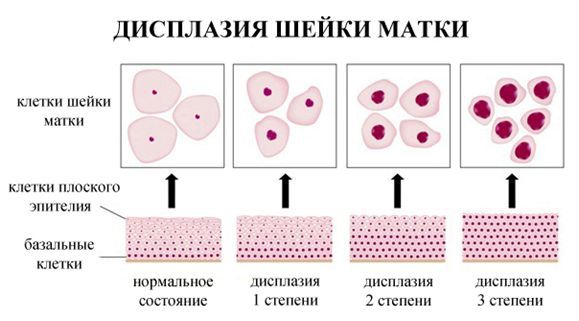
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя выделяют три степени дисплазии шейки матки:
- ЦИН 1 (дисплазия слабой степени) — признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- ЦИН 2 (дисплазия средней степени) — поражена 1/2 толщины клеточного слоя;
- ЦИН 3 (дисплазия тяжелой степени) — поражение более 2/3 клеточного слоя. [8]
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологи- ческая система Бетесда (ТСБ) |
|---|---|---|---|
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC - US, ASC - H | |
| Класс 3 ("дискариоз") | Слабая дисплазия | CIN 1 койлоцитоз | LSIL |
| Умеренная дисплазия | CIN 2 | HSIL | |
| Тяжелая дисплазия | CIN 3 | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Осложнения дисплазии шейки матки
Последствия дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
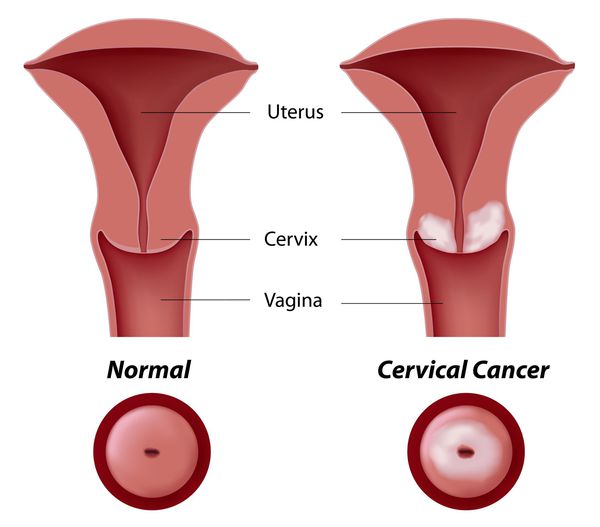
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
Методы диагностики дисплазии шейки матки
В России система цервикального скрининга включает последовательность действий:
- Цитологическое исследование: РАР-тест;
- ВПЧ-тестирование: в США и странах Евросоюза ВПЧ-тест применяется для первичного скрининга рака шейки матки (РШМ). В России его использование вариативно: при первичном скрининге в сочетании с РАР-тестом, в качестве самостоятельного теста, при ведении пациенток с неясными результатами РАР-теста (ASCUS) и для наблюдения паценток после лечения HSIL;
- Кольпоскопия: показаниями к исследованию являются положительные результаты РАР-теста (класс 2-5). Метод основан на осмотре шейки матки при помощи увеличивающих оптических систем и проведения диагностических проб с растворами уксусной кислоты и йода (Люголя). С помощью кольпоскопии определяют локализацию поражения, его размер, выбирают участок для проведения биопсии, определяют тактику лечения.
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
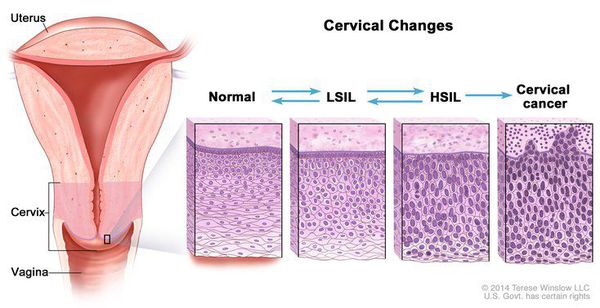
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии.
Хирургическое лечение дисплазии
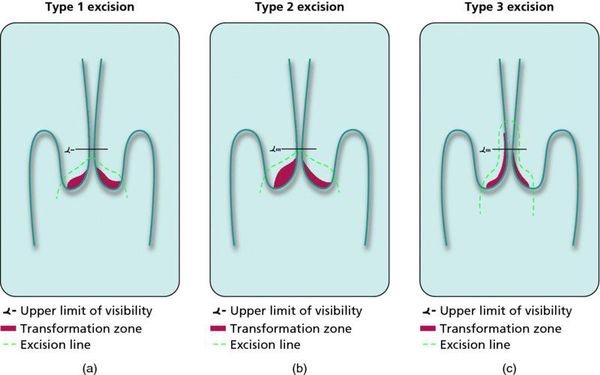
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
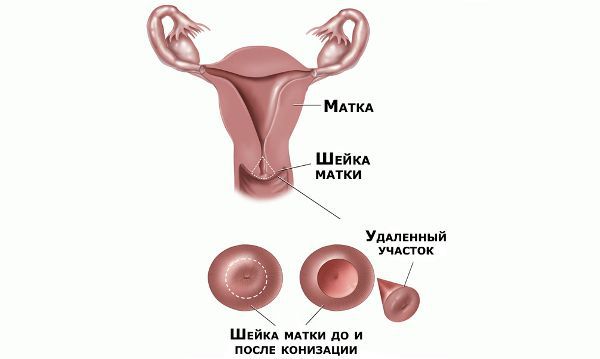
Реабилитация после хирургического лечения
В течение месяца после операции следует воздержаться от спринцеваний, половых контактов и не пользоваться тампонами. На 2–3 недели исключают тяжёлые физические нагрузки и тепловые процедуры. Незначительные сукровичные выделения, усиливающиеся иногда до менструальноподобных, в течение 10–20 дней после операции — это нормальное явление.
При реабилитации после хирургического лечения шейки матки эффективны препараты, содержащие антисептик и стимулятор регенерации эпителия.
После лечения возможен рецидив, поэтому необходимо пожизненное наблюдение: цитологический мазок через 6 и 12 месяцев после операции, затем раз в год в течение 10 лет, далее раз в 3 года.
Планировать беременность после операции на шейке матки можно не ранее, чем через 3–6 месяцев. Эти сроки будут зависеть от глубины эксцизии или конизации и длины шейки матки [9] .
Лечение дисплазии при беременности
В большинстве случаев лечение должно быть отложено на послеродовый период. При беременности на фоне дисплазии шейки матки каждые три месяца проводится кольпоскопический и цитологический контроль. При выявлении рака шейки матки пациентку консультирует онкогинеколог. Доктор подбирает тактику лечения, может потребоваться прервать беременность по онкологическим показаниям [9] .
Прогноз. Профилактика
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
- курение;
- длительное использование гормональных контрацептивов;
- многократные травматичные роды;
- ВИЧ-инфекция.
- У пациенток с ЦИН часто обнаруживают вирус простого герпеса 2 типа, цитомегаловирусную инфекцию, хламидийную урогенитальную инфекцию, бактериальный вагиноз, ассоциированный с резким снижением или отсутствием вагинальной лактофлоры, повышенным ростом во влагалище Gardnerella vaginalis и Atopobium vaginae, повышение концентрации в бакпосеве грибов рода Candida, Mycoplasma hominis.
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения", осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Урогенитальный хламидиоз. Клиника и диагностика урогенитального хламидиоза
Урогенитальный хламидиоз — острая, персистентная или хроническая антропонозная инфекция, передающаяся половым путем и характеризующаяся поражением нижних отделов мочевыводящих путей и половой системы.
В последние годы урогенитальный хламидиоз занял первое место среди венерических инфекций, заболеваемость им в 5 и более раз превышает заболеваемость гонореей. В США регистрируется около 3 млн новых случаев урогенитального хламидиоза в год, в России, по экстраполированным данным, более 1 млн случаев заболеваний. Из-за отсутствия обязательной регистрации заболеваемость урогенитальным хламидиозом в странах Азии, Африки, Латинской Америки, в странах субтропического пояса оценить не представляется возможным. Эта инфекция, по мнению экспертов ВОЗ, представляет серьезную проблему международного здравоохранения.
Возбудитель — представитель вида С. trachomatis, первично адаптированный к эпителию слизистых оболочек мочеполовых путей (в отличие от представителей вида С. trachomatis, адаптированных к оболочкам глаза и вызывающих офтальмохламидиоз — трахому и так называемый доброкачественный кератоконъюнктивит с включениями). Оба подвида близки по биологическим свойствам.
Урогенитальный хламидиоз — строгий антропоноз. Резервуаром инфекции считают женские половые органы (экологическая ниша С. trachomatis). Источник инфекции — инфицированный человек с различными формами заболевания, от манифестных до бессимптомных.
Ведущий механизм передачи возбудителя контактный с половым путем заражения. Известны случаи заболевания, возникающие при орогенитальной и аногенитальной передаче возбудителя. Некоторые авторы считают, что хламидии, обитающие в мочеполовых органах, попадая на слизистые оболочки глаз, могут вызывать экстрагенитальные инфекции —доброкачественный кератоконъюнктивит с включениями, в неэндемических районах —даже трахому. Актуален вертикальный путь распространения инфекции с антенатальным и чаще интранатальным инфицированием плода, влекущим за собой тяжелые последствия вплоть до гибели плода и мертворождения (в 5,5% случаев).
По существующим оценкам, хламидиями инфицировано 6-9% мужчин и 12-15% (возможно, больше) женщин репродуктивного возраста. Во время беременности 70% инфицированных женщин заражают плод и новорожденного, что поддерживает высокий уровень циркуляции возбудителя в человеческой популяции.
Восприимчивость к инфекции всеобщая и высокая. Иммунитет ненапряженный и непродолжительный.
Заболевание у взрослых и новорожденных может протекать манифестно и (чаще) субклинически с высокой эпидемиологической опасностью больных при том и другом варианте. С хламидиями ассоциировано 60-70% цервицитов, часты уретриты (и у мужчин, и у женщин), возможны эндометриты, сальпингиты, пельвиоперитониты, перигепатиты, у пациентов с фенотипом HLA-B27 описаны так называемые хламидийные урогенные артриты (уретро-окулосиновиальный синдром Reiter). До 70% случаев окклюзии маточных труб и трубного бесплодия связывают с хламидийной инфекцией.
Клинически установить диагноз крайне трудно, всегда требуется верификация диагноза — выделение хламидии путем выращивания в культуре клеток, ыявление антигенов возбудителя с помощью моноклональных антител. Используют ДНК-диагностику. Серологическую диагностику проводят с помощью реакции микроиммунофлюоресценции (диагностический титр — более 1:64).
Прогноз. Благоприятный; для внутриутробно инфицированного плода и новорожденного — серьезный.
Лечение. Назначают тетрациклины и фторхинолоны всех поколений (препараты противопоказаны во время беременности), эритромицины в общетерапевтических разовых и суточных дозах в течение 14-21 дня. Используют (после оценки гемо- и иммунограммы) иммуномодулирующие средства. Больных новорожденных лечат эритромицином парентерально в дозе 50 мг/кг в сутки в течение 2-3 нед и средствами патогенетической терапии в полном объеме.
Профилактика включает в себя все мероприятия, предупреждающие половую передачу возбудителя. Специфическая профилактика не разработана.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Семейство Chlamydiaceae отдела Gracilicutes включает один род Chlamydia (от греч. chlamydos, плащ; название возникло из-за сходства ретикулярной клетки с оболочкой, окружающей созревающие в ней ЭТ]. В настоящее время род включает три вида: С. trachomatis, C.psittaci и С. pneumoniae.
Все виды хламидий патогенны для человека и многих животных. Заболевания, вызываемыми ими, регистрируются повсеместно и известны как хламидиозы.

Таблица 23-1. Классификация представителей рода Chlamydia
Хламидии лабильны к действию высоких температур (погибают при 60 "С за 10 мин), но длительно сохраняются при низкой температуре.
Хламидии неспособны самостоятельно синтезировать высокоэнергетические соединения и обеспечивать собственные потребности в энергии. Нормальное развитие хламидий возможно только в условиях внутриклеточного паразитирования.
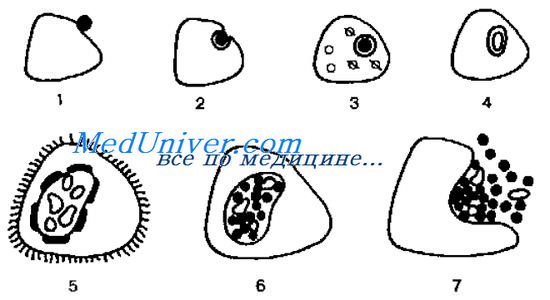
Рис. 23-1. Жизненный цикл хламидии. 1 —прикрепление элементарного тельца (ЭТ) к эпителиальной клетке; 2 — проникновение ЭТ в клетку посредством пиноцитоза; 3 — блокада фагосомо-лизосомального слияния; 4 — превращение ЭТ в ретикулярное тельце (РТ); 5 — бинарное деление РТ; 6 — созревание ЭТ внутри РТ; 7 — высвобождение ЭТ из клетки.
Хламидии размножаются бинарным делением. Жизненный цикл хламидии включает образование двух основных форм (рис. 23-1).
• Элементарное тельце хламидии (ЭТ) — мелкая (0,2-0,5 мкм) сферическая внеклеточная структура с трёхслойной клеточной стенкой. Метаболически малоактивно и адаптировано к внеклеточному выживанию. Элементарные тельца хламидий — инфекционные единицы, заражающие клетки. По Романовскому-Гимзе ЭТ окрашиваются в пурпурный цвет.
• Ретикулярное тельце хламидии (РТ) — репродукционная внутриклеточная форма. Представлено более крупным образованием (до 1 мкм), имеющим сетчатую структуру с тонкой клеточной стенкой. Развивается в течение 5-6 ч из ЭТ, проникшего в цитоплазму и претерпевшего структурные изменения. Первоначально из ЭТ образуется инициальное тельце (вегетативная форма), окрашивающееся в синий цвет по Романовскому-Гимзе. Затем инициальное тельце превращается в РТ.
После образования РТ хламидийная клетка начинает бинарно делиться, образуя тельца включений в виде вакуолей в цитоплазме инфицированной клетки. Тельца включений хламидий обычно располагаются околоядерно, по Романовскому-Гимзе окрашиваются в пурпурный цвет; их можно обнаружить методом световой микроскопии. В тельцах включений находятся делящиеся РТ. С. psittaci и С. pneumoniae образуют множество мелких телец включений, окружающих ядро. С. trachomatis образует одно большое тельце. Вследствие конденсации РТ образуется промежуточное тельце, напоминающее бычий глаз.
Промежуточные тельца хламидий трансформируются в ЭТ, готовые покинуть клетку. Выход ЭТ сопровождается гибелью инфицированной клетки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Оборудование для диагностики хламидий в материале для исследования из глаз
При взятии образцов в первые несколько дней жизни возможны отрицательные результаты посева, поскольку у новорожденных элементарные тельца формируются в течение нескольких дней. С помощью некультуральных методов — реакции прямой иммунофлюоресценции, твердофазного иммуноферментного анализа и полимеразной цепной реакции (ПЦР) — возможно исследование любых образцов, результаты получают значительно быстрее. В настоящее время выпускаются наборы для ПЦР.
Данную реакцию считают наиболее чувствительным некультуральным методом верификации хламидий. В настоящее время доступны реактивы для экспресс-ПЦР с образцами из глаза при подозрении на хламидийную и/или вирусные инфекции (например, вирус герпеса). Следует уточнять возможность проведения ПЦР в лаборатории учреждения с образцами из глаза:

2. Среды для культивирования хламидий. Необходимо помещать образцы в питательную среду сразу же после забора. В каждой лаборатории используют специфические среды, выпускаемые для определенного типа микроорганизма. Следует получить соответствующие среды в лаборатории. Ниже указаны классические среды, используемые для каждого типа микроорганизмов.
а. Питательные среды для культивирования бактерий:
(1) Триптиказо-соевый бульон.
(2) Чашки Петри с кровяным агаром.
(3) Чашки Петри с шоколадным агаром для Hemophilus influenzae, Neisseria gonorrhea.
(4) Среда Тайера-Мартина при подозрении на N. gonorrhea.
б. Сохраняющие вирусы среды, например среда М4 для транспортировки вирусов и хламидий (Remel, Lenexa, KS, USA).
в. Среда для транспортировки культуры хламидий, например среда М4 для транспортировки вирусов и хламидий (Remel, Lenexa, KS,USA).
г. Агар Сабуро при подозрении на грибковый конъюнктивит.
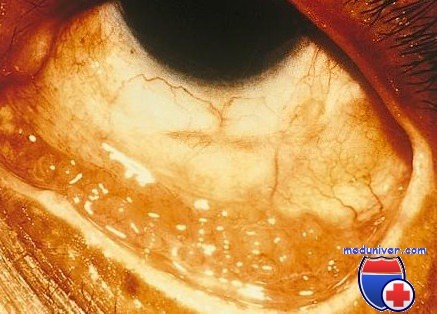
Оценка результатов цитологического исследования конъюнктивы
1. Клеточная реакция.
а. Полиморфноядерная реакция.
(1) Бактериальные инфекции.
(2) Хламидийная инфекция.
(3) Крайне тяжелая вирусная инфекция.
б. Мононуклеарная реакция: вирусная инфекция.
в. Эозинофилия и базофилия: аллергические состояния.
г. Плазматические клетки: хламидийная инфекция.
2. Интраэпителиальные клеточные включения.
а. Хламидийная инфекция:
(1) Ацидофильные включения в цитоплазме, шапочки над ядрами эпителиальных клеток.
(2) Базофильные первичные тела в цитоплазме.
б. Вирусная инфекция. Можно обнаружить гигантские многоядерные эпителиальные клетки (например, герпетический кератоконъюнктивит).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

