Клостридиальная инфекция кишечника у детей
Обновлено: 18.04.2024
Е.А. Ушкалова
Кафедра общей и клинической фармакологии РУДН, Москва
Роль Clostridium difficile в качестве этиологического фактора диареи была впервые показана в 1978 г., однако в настоящее время масштабы инфекции, вызываемой данным возбудителем, достигли эпидемического уровня, а частота и тяжесть заболевания продолжают увеличиваться не только во внутрибольничных, но и во внебольничных условиях [1]. Несмотря на успехи, достигнутые в диагностике и терапии Clostridium difficile-ассоциированных инфекций (CDI), продолжает расти частота их неблагоприятных исходов, включая летальные. Это обусловливает необходимость поиска новых лекарственных средств (ЛС) для ее лечения.
Эпидемиология и факторы риска развития инфекции, вызванной Clostridium difficile
Заболеваемость CDI начала существенно расти с конца 1990-х гг. [2]. За последнее десятилетие частота CDI в экономически развитых странах выросла на 200–400 % [3]. Только в США ежегодно регистрируется примерно 700 тыс. новых случаев CDI, которая вышла в стране на первое место среди всех инфекций, ассоциированных с оказанием медицинской помощи (healthcare-associated infections), оттеснив на второе место инфекцию, вызываемую метициллинорезистентным Staphylococcus aureus (MRSA) [4]. При этом во всем мире увеличивается частота и тяжесть внебольничных случаев CDI, которые занимают в структуре заболеваемости от 20 до 41 % и встречаются с частотой 20–30 случаев на 100 тыс. населения [5–7]. Частота CDI среди детей за последние 20 лет увеличилась в 12,5 раз [8, 9]. Одновременно повысилась тяжесть инфекции, а связанная с ней смертность увеличилась с 1999 по 2011 г. в 4 раза [10, 11]. По данным исследования, проведенного в медицинских учреждениях 14 стран Европы, тридцатидневная смертность при CID колеблется в пределах от 2,8 до 29,8 % [12], летальность во время вспышки CDI в канадской провинции Квебек в начале ХХI в. составила 6,9 % [13]. Неблагоприятные исходы наблюдаются у 40 % пациентов с внебольничной CDI, требующих госпитализации [14]. Возможно, это связано с появлением новых факторов риска развития CDI, а также распространенностью во всех регионах мира нового гипервирулентного штамма C. difficile BI/NAP1/027, характеризующегося резистентностью к фторхинолонам и гиперпродукцией токсина [15].
Традиционными факторами риска развития CDI считаются пожилой (> 65 лет) возраст, недавняя госпитализация, пребывание в стационаре или другом учреждении длительного оказания помощи, антибиотикотерапия и коморбидность (злокачественные новообразования, хроническое заболевание почек, воспалительное заболевание кишечника и иммуносупрессия) [2]. Повышение заболеваемости связывают в т.ч. с внедрением в медицинскую практику новых препаратов группы фторхинолонов [2], однако результаты недавно проведенного мета-анализа свидетельствуют, что роль фторхинолонов не следует переоценивать, т.к. CDI наиболее часто развивается при лечении цефалоспоринами и клиндамицином [16].
Дополнительные факторы риска включают контакты с активными носителями, потребление контаминированных продуктов питания, гипоальбуминемию, применение ингибиторов протонной помпы и, возможно, других кислотоснижающих ЛС, желудочно-кишечные эндоскопические процедуры и энтеральное питание через зонд [1, 3].
Отсутствие традиционных факторов риска для пациентов с внебольничной CDI и ее распространенность в группах населения, которые ранее рассматривались как имеющие низкий риск развития инфекции, например для детей и женщин в послеродовом периоде, позволяют предположить, что существуют и другие факторы риска [17, 18]. В ряде исследований показано, что в недавнем анамнезе подавляющего большинства пациентов с внебольничной CDI (до 94 %) выявляется амбулаторное посещение медицинского учреждения, что позволяет предположить, что даже кратковременный контакт с учреждениями здравоохранения служит фактором риска развития CDI [8, 19, 20]. К потенциальным факторам риска, с которыми может быть связано повышение частоты внебольничной CDI, относятся потребление контаминированной пищи и передача инфекции от человека к человеку, из окружающей среды к человеку и, возможно, от животного к человеку [1]. Резервуаром C. difficile служат бессимптомные колонизированные лица [21]. У домашних животных и скота C. difficile определяется в качестве как комменсала, так и патогена, а ее споры могут присутствовать в пище, в т.ч. в мясе, птице, морепродуктах и свежих овощах [22–26].
Предполагают, что передача инфекции от человека к человеку является важным путем распространения инфекции как в больничных, так и во внебольничных условиях. Значительную роль в трансмиссии C. difficile при несоблюдении гигиенических мер профилактики могут сыграть колонизированные медицинские работники и посетители больниц [27], а в качестве фактора риска развития рецидивов CDI у женщин в послеродовом периоде рассматривается бессимптомная колонизация детей [28]. Повторные эпизоды инфекции развиваются у 13–50 % пациентов [29], в 50–90 % случаев они являются истинным рецидивом, т.е. вызваны тем же штаммом C. difficile, что и первичный случай [30]. Также возможно реинфицирование другими штаммами микроорганизма. Частота рецидивов в рандомизированных контролируемых исследованиях составила 25 % [31, 32].
Факторы риска развития рецидива CDI включают нарушения иммунитета, исходное плохое состояние здоровья (хроническая почечная недостаточность, химиотерапия, сопутствующая бактериальная инфекция, срочная госпитализация/пребывание в палате интенсивной терапии/длительная госпитализация), нарушение кишечной микрофлоры, тяжесть первичной CDI и применение кислотоснижающих ЛС [3]. В систематическом обзоре 68 исследований наиболее значимым фактором риска оказались пожилой возраст, использование сопутствующих антибиотиков после установления диагноза CDI, применение ингибиторов протонной помпы и тип штамма возбудителя [33]. Смертность ассоциировалась с пожилым возрастом, коморбидностью, гипоальбуминемией, лейкоцитозом, острой почечной недостаточностью и инфекцией, вызванной штаммом BI/NAP1/027.
Фармакотерапия
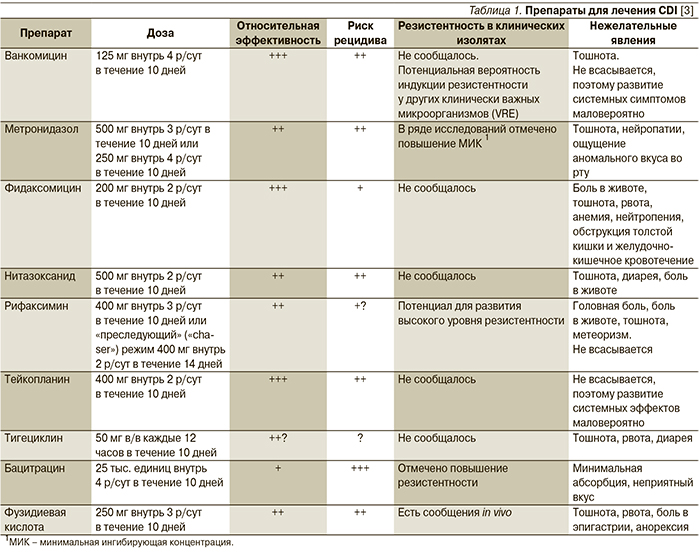
Терапия CDI зависит от тяжести заболевания. В легких случаях, проявляющихся диареей до 4 раз в сутки, не сопровождающейся общими симптомами и изменением лабораторных показателей, специфической терапии, как правило, не требуется. Достаточной мерой считаются восстановление водно-электролитного баланса и отмена антибиотика, если диарея развивается на фоне антибиотикотерапии. При более тяжелом течении заболевания с признаками колита показано назначение ЛС, эффективных в отношении C. difficile (табл. 1).
За последние 30 лет основными препаратами лечения CDI являются метронидазол и ванкомицин. По эффективности ванкомицин превосходит метронидазол [34, 35], однако в связи с риском распространения ванкомицин-резистентных энтерококков (VRE) в руководствах по лечению CDI ему рекомендуется отдавать предпочтение только при тяжелых формах заболевания, а в качестве препарата выбора при легких и среднетяжелых формах рассматривается метронидазол, хотя применение метронидазола также может приводить к колонизации VRE [36]. Для лечения токсического мегаколона рекомендуют комбинацию перорального ванкомицина и внутривенного метронидазола [37].
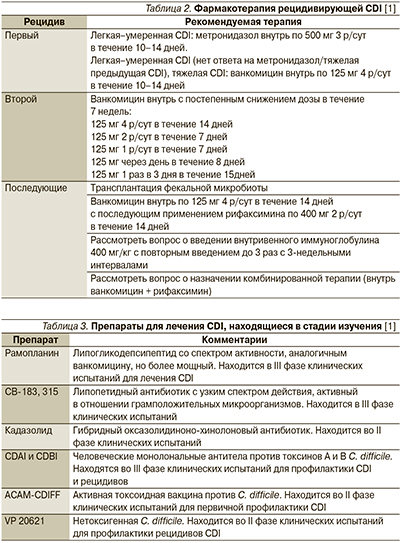
Активность в отношении C. difficile проявляет и ряд других антибиотиков (табл. 1), однако широкого применения в лечении CDI они не получили. Эффективность тейкопланина аналогична таковой ванкомицина, и он может быть альтернативой последнему [3]. Бацитрацин уступает по эффективности основным ЛС для лечения CDI вследствие быстрого развития резистентности и рассматривается в качестве резервного препарата [38]. Достоинством рифаксимина служит отсутствие у него неблагоприятного влияния на нормальную микрофлору кишечника [1]. Рифаксимин показан к лечению рецидивирующей инфекции при неэффективности стандартной терапии [38]. Препарат рекомендуется назначать в дозе 400 мг внутрь 2 р/сут в течение 14 дней сразу после завершения курса лечения вакомицином [1, 3]. Ванкомицин при рецидивах CDI применяют в виде пульс-терапии (по 125–500 мг через 1 или 2 дня) или в режиме постепенного снижения доз (табл. 2) [3].
Антипротозойный препарат нитазоксанид при легкой и среднетяжелой CDI по эффективности сопоставим с метронидазолом [38]. Опыт применения тигециклина и фузидиевой кислоты ограничен, а исходы лечения этими препаратами противоречивы [3, 38]. Фузидиевую кислоту не рекомендуется использовать в виде монотерапии [3]. При множественных рецидивах возможно применение препаратов внутривенного иммуноглобулина, однако данные об его эффективности в отношении взрослых пациентов противоречивы [1, 39]. Кроме того, они вызывают побочные эффекты со стороны различных органов и систем, включая почечную недостаточность [1, 40]. Все большее внимание исследователей привлекают пробиотики. Положительные результаты получены в ряде исследований, особенно для Saccharomyces boulardii, Lactobacillus rhamnosus GG (LGG), а также комбинированных препаратов, содержащих 8 и более штаммов [41–43], однако для определения оптимальных штаммов микроорганизмов и режимов их применения необходимы дальнейшие исследования [44].
В дополнение к ЛС для лечения рецидивирующей CDI предложена пересадка фекальной микробиоты, эффективность которой показана в клинических исследованиях, включая мультицентровое [45]. Пациентам с множественными рецидивами пересадка фекальной микробиоты обеспечивает наиболее длительный период до наступления рецидива по сравнению со всеми другими видами терапии [46].
В стадии разработки находится ряд новых ЛС (табл. 3). Достаточно новым препаратом, вышедшим на международный фармацевтическиий рынок в 2011 г., считается фидаксомицин.
Фидаксомцин
Блокируя транскрипцию генов, фидаксомицин тормозит образование спор C. difficile и угнетает продукцию токсинов [49, 50]. Угнетение споруляции под влиянием препарата может способствовать снижению риска развития рецидивов и риска трансмиссии C. difficile в больницах и учреждениях длительного ухода. Токсины существенно реже обнаруживаются после лечения в фильтрате фекалий у пациентов, получавших фидаксомицин, по сравнению с пациентами, получавшими ванкомицин (14 и 28 % соответственно) [51].
Фидаксомицин оказывает бактерицидный эффект в отношении различных штаммов C. difficile, включая гипервирулентный NAP1/B1/027 [52]. Минимальная ингибирующая концентрация фидаксомицина для других штаммов ниже, чем у ванкомицина и метронидазола. Кроме того, фидаксомицин оказывает постантибиотический эффект, продолжающийся примерно в течение 10 часов, что позволяет принимать его дважды в сутки [53]. В отличие от метранидазола он плохо всасывается в ЖКТ и создает высокие концентрации в кале, значительно превышающие МИК для C. difficile, но очень низкие концентрации в крови. В связи с узким спектром действия фидаксомицин оказывает слабое влияние на микробиоту кишечника. Он преимущественно подавляет кластеры клостридий XIVa и IV и микроорганизмы, принадлежащие к группе бактероидов/превотелл и не влияет на бифидобактерии [50, 51, 54, 55]. Таким образом, при его применении создаются более благоприятные условия для быстрого восстановления микрофлоры, снижения риска колонизации C. difficile и реинфекции, чем при применении стандартной терапии [51]. У пациентов с исходно негативной культурой фидаксомицин снижает риск колонизации VRE и Candida spp., однако у пациентов с исходно позитивной культурой в отношении VRE после лечения наблюдается повышение МИК фидаксомицина для данного микроорганизма [54].
Основанием к регистрации фидаксомицина послужили результаты двух сравнительных с ванкомицином исследований пациентов с C. difficile-ассоциированной диарей III фазы. Участники исследований принимали оба препарата в течение 10 дней: фидаксомицин (n = 564) в дозе 200 мг 2 р/сут и ванкомицин (n = 583) в дозе 125 мг 4 р/сут [31, 32]. В обоих исследованиях частота излечения была одинаковой в группах фидаксомицина и ванкомицина (88,2 против 85,8 % и 91,7 против 90,6 % соответственно). Кроме того, в исследовании Cornely et al. фидаксомицин превосходил по эффективности ванкомицин в подгруппе пациентов, получавших сопутствующие антибиотики (90,2 против 73,3 %; p = 0,031) [32], а в исследовании Louie et al. – в подгруппе пациентов, инфицированных негипервирулентным штаммом C. difficile (7,8 против 25,5 %, p < 0,001) [31]. Кроме того, частота рецидивов за первые 4 недели после лечения у пациентов, получавших фидаксомицин, была значительно ниже, чем в группе сравнения (15,4 против 25,3 %, p = 0,005) [31]. Аналогичные результаты были получены и при ретроспективном анализе объединенных результатов двух исследований: излечение наступало для 90 % пациентов, получавших сопутствующие антибиотики, в группе фидаксомицина и для 79,4 % – в группе ванкомицина (p = 0,04), частота рецидива – у 16,9 и 29,2 % соответственно (p = 0,048) [56].
В подгруппе онкологических больных лечение фидаксомицином ассоциировалось со значительным повышением по сравнению с ванкомицином вероятности достижения терапевтического (ОШ = 2,0; р = 0,065) и стойкого терапевтического ответа (ОШ = 2,56; р = 0,003) и со снижением риска развития рецидива (ОШ = 0,37; p = 0,018) [58]. У пациентов с рецидивом заболевания в течение 90 дней после первичного эпизода CDI (n = 178) фидаксомицин оказывал равный с ванкомицином терапевтический эффект, но приводил к достоверному снижению на 37 % частоты возникновения второго рецидива в течение 28 дней (20,3 против 32,3 %) [59].
Препарат хорошо переносится, в клинических исследованиях частота и профиль его побочных реакций не отличались от таковых у ванкомицина [2]. Широкое применение фидаксомицина ограничивает стоимость лечения. Средняя цена в США составляет 135 долл. за 200 мг фидаксомицина по сравнению с 0,72 долл. за 500 мг метронидазола и 31,81 долл. за 125 мг ванкомицина, а стоимость 10-дневного курса фидаксомицина в 125 раз превышает таковую 10-дневного курса метронидазола и в 2 раза – 10-дневного курса ванкомицина [2]. В реальной медицинской практике медиана стоимости лечения 1 пациента фидаксомицином составляет 19 483 долл. [60].
Таким образом, несмотря на достоинства фидаксомицина, его место в терапии CDI с учетом затратной эффективности еще предстоит определить в последующих исследованиях [61].
Литература
Об авторах / Для корреспонденции
Е.А. Ушкалова – Кафедра общей и клинической фармакологии РУДН, Москва
Для цитирования: Шульпекова Ю.О. Избыточный бактериальный рост в кишечнике: патогенетические особенности и лечебные подходы. РМЖ. 2003;5:281.
ММА имени И.М. Сеченова
Основная часть микроорганизмов поступает в просвет желудочно–кишечного тракта из ротоглотки и с пищей.
В составе нормальной микрофлоры желудочно–кишечного тракта выделено более 400 видов непатогенных аэробных и факультативно анаэробных бактерий.
Состав микрофлоры неодинаков на всем протяжении желудочно–кишечного тракта. В верхнем и среднем отделах тонкой кишки популяция микроорганизмов сравнительно небольшая (в начале тощей кишки их содержание не более 100 микроорганизмов на 1 мл содержимого) и включает преимущественно грамположительные факультативные аэробы, небольшое количество анаэробов, дрожжей и грибов.
По мере приближения к илеоцекальному клапану состав микролоры начинает все более походить на популяцию толстой кишки. В дистальном отделе подвздошной кишки содержание микробов составляет 10 5 –10 8 /г кишечного содержимого.
Наибольшее содержание микроорганизмов наблюдается в толстой кишке. Здесь их концентрация достигает 10 10 –10 11 и более на 1 г содержимого.
Микробная популяция играет важнейшую роль во внутрипросветном пищеварении, в частности, участвует в переваривании пищевых волокон (целлюлозы), ферментативном расщеплении белков, высокомолекулярных углеводов, жиров и в процессе метаболизма вырабатывает ряд полезных для организма веществ.
Главный представитель анаэробной кишечной микрофлоры – бифидобактерии – синтезируют аминокислоты, белки, витамины В1, В2, В6, В12, викасол, никотиновую и фолиевую кислоты. Выдвинуто предположение, что некоторые вещества, вырабатываемые бифидобактериями, обладают антиоксидантными свойствами и способствуют снижению риска заболеваемости раком толстой кишки.
Среди аэробных микроорганизмов важнейшая роль в метаболических процессах принадлежит кишечной палочке, обладающей большим спектром функциональных свойств. E.coli вырабатывает несколько витаминов (тиамин, рибофлавин, пиридоксин, витамины В12, К, никотиновую, фолиевую, пантотеновую кислоты), участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот, и, опосредованно влияет на всасывание железа и кальция.
Образующиеся под влиянием микрофоры продукты метаболизма белка (индол, фенол, скатол) оказывают регулирующее воздействие на перистальтическую активность кишечника.
В последнее время интенсивно изучается роль кишечной микрофлоры в формировании иммунологической реактивности и иммунологической толерантности организма.
Представители нормальной кишечной микрофлоры вырабатывают вещества с антибактериальной активностью (такие как бактериокины и короткоцепочечные жирные кислоты, лактоферрин, лизоцим), которые предотвращают внедрение патогенных микроорганизмов и подавляют избыточное размножение условно–патогенной флоры. Кишечные палочки, энтерококки, бифидобактерии и лактобациллы обладают наиболее выраженными антагонистическими свойствами в отношении патогенных штаммов.
Продуктами метаболизма молочнокислых бактерий (бифидобактерий, лактобацилл) и бактероидов являются молочная, уксусная, янтарная, муравьиная кислоты. Это обеспечивает поддержание показателя рН внутрикишечного содержимого на уровне 4,0–3,8, благодаря чему тормозится рост и размножение патогенных и гнилостных микроорганизмов в ЖКТ.
Микрофлора желудочно–кишечного тракта активно участвует в химических превращениях многих веществ эндогенного и экзогенного происхождения, в частности, лекарств. В процессе кишечно–печеночной циркуляции вещества, поступающие из просвета кишечника в печень, подвергаются конъюгации с глюкуронатом, сульфатом и другими молекулярными остатками, и многие из них затем вновь выделяются с желчью. В просвете кишечника под действием ферментов кишечной микрофлоры они подвергаются деконъюгации и другим изменениям, после чего вновь всасываются и возвращаются в печень по воротной вене.
Количественный и качественный состав кишечной микрофлоры может изменяться под воздействием различных факторов эндогенного или экзогенного происхождения. Однако это изменение следует рассматривать как вторичное по отношению к первопричинному фактору.
Избыточный бактериальный рост в кишечнике (в англоязычной литературе – bacterial overgrowth) – обусловлен нарушением качественного и количественного состава микробного биоценоза кишечника, размножением условно–патогенных бактерий в количестве, не свойственном здоровому человеку. Нельзя забывать, что избыточный бактериальный рост в кишечнике и связанные с ним клинические проявления представляет собой не самостоятельную нозологическую форму, а синдром.
Фоном для развития синдрома избыточного бактериального роста служат различные состояния, сопровождающиеся нарушением переваривания пищи, пассажа внутрипросветного содержимого; изменением иммунологической реактивности организма, ятрогенные воздействия на микрофлору кишечника.
При различных состояниях, сопровождающихся нарушением переваривания и всасывания пищи (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия, энтериты), невсосавшиеся питательные вещества служат питательной средой для избыточного размножения бактерий.
При анацидных состояниях и иммунодефицитах утрачивается регулирующее влияние со стороны организма на поддержание состава кишечной микрофлоры.
Применение антибиотиков, кортикостероидов, цитостатиков, особенно у ослабленных и пожилых пациентов, сопровождаются вмешательством во взаимоотношения микрофлоры и макроорганизма.
Пожалуй, в качестве единственной самостоятельной нозологической формы избыточного бактериального роста в кишечнике выступает псевдомембранозный колит, который обусловлен избыточным размножением Clostridium difficile – облигатно–анаэробной грамположительной спорообразующей бактерии, обладающей природной устойчивостью к большинству широко применяемых антибиотиков. Популяция C.difficile в составе нормальной микрофлоры кишечника составляет примерно 0,01–0,001%; она существенно возрастает (до 15–40%) при приеме антибиотиков, угнетающих рост штаммов кишечной флоры, которые в норме подавляют жизнедеятельность C.difficile (в первую очередь, клиндамицина, ампициллина, цефалоспоринов).
Избыточное размножение бактерий в тонкой кишке является дополнительным фактором, поддерживающим воспаление слизистой оболочки, снижающим продукцию ферментов (в наибольшей степени – лактазы) и усугубляющим нарушение переваривания и всасывания. Эти изменения обусловливают развитие таких симптомов, как коликообразные боли в околопупочной области, метеоризм, диарея, похудание.
При преимущественном вовлечении в процесс толстой кишки пациенты предъявляют жалобы на неоформленный стул, метеоризм, ноющие боли в животе.
Диагностика синдрома избыточного бактериального роста подразумевает анализ картины основного заболевания, с выявлением возможной причины нарушения микробного биоценоза кишечника. Проводится дополнительное обследование, которое может включать эндоскопическое, рентгенологическое исследование кишечника для выявления нарушений анатомического строения, оценки перистальтики желудочно–кишечного тракта; биопсию тонкой кишки – для установления диагноза энтерита, энтеропатии, диагностики ферментопатий (к сожалению, возможности проведения этого исследования в нашей стране ограничены) и др. Мало доступными на сегодняшний день, но точными методами диагностики избыточного бактериального роста являются аспирация содержимого тонкой кишки с немедленным посевом аспирата на питательную среду, а также неинвазивный дыхательный водородный тест с лактулозой. Посев кала, ранее использовавшийся в нашей стране как метод оценки микробного биоценоза кишечника, признан неинформативным, поскольку даже при максимальном приближении к правилам проведения микробиологических исследований может дать представление лишь о микробном составе дистального отдела толстой кишки.
Перед тем как непосредственно приступить к лечению синдрома избыточного бактериального роста, необходимо определить причину развития нарушений микробного биоценоза и, по возможности, устранить влияние данного фактора. Например, назначить пациенту противовоспалительную, заместительную ферментную терапию, использовать возможности по нормализации перистальтической активности кишечника.
Изменение характера питания позволяет воздействовать на микрофлору физиологическим путем. Однако диетические предписания необходимо давать с учетом основного заболевания. В любом случае, при избыточном бактериальном росте в кишечнике показано ограничение потребления легкоусвояемых углеводов и исключение потребления молока (особенно пресного). При отсутствии противопоказаний целесообразно потребление овощей, фруктов и ягод, обладающих бактерицидным действием (редька, редис, лук, чеснок, хрен, морковь, малина, клубника, земляника, черника, абрикосы, яблоки, черноплодная рябина, сок граната, гвоздика, корица, лавровый лист).
Однако при тяжелых формах избыточного бактериального роста в кишечнике показана антибактериальная терапия (назначение метронидазола по 400 мг 3 раза в день в течение недели; при неэффективности метронидазола к лечению целесообразно добавить тетрациклин по 250 мг 4 раза в день в течение 2 недель). Антибиотики резерва – ципрофлоксацин (по 500 мг 2 раза в день) и ванкомицин (по 125 мг 4 раза в день). Лечение псевдомембранозного колита проводится по определенным схемам и не рассматривается в данной статье вследствие обособленности этого заболевания.
В ряде случаев для подавления условно-патогенных микроорганизмов используются бактериофаги (стафилококковый и коли–протейный) по 50 мл 2 раза в день за час до еды в течение 3–4 дней, проводится 2–3 курса с 3–дневным перерывом.
Не менее важным и, зачастую, основным направлением лечения является воссоздание условий, благоприятных для восстановления нормальной микрофлоры. Лекарственные препараты, обладающие подобными свойствами, носят название пробиотиков.
Некоторое время назад в качестве пробиотиков особенно широко использовались биологические препараты для перорального приема, содержащие в своем составе бифидобактерии, лактобациллы, кишечные палочки с полезными сойствами. Необходимо учитывать, что микробы, вводимые в составе лекарственных препаратов, сами по себе надолго не приживаются в кишечнике и элиминируются спустя 2–3 недели. Основой лечебного действия подобных препаратов является их способность временно поддерживать ферментативную активность и защитные свойства (колициногенность) собственной микрофлоры кишечника. Ниже охарактеризованы некоторые из наиболее известных препаратов.
Благоприятные условия для размножения бифидобактерий создает дисахарид лактулоза, обладающий также слабительными и аммонийсвязывающими свойствами. Он служит питательной средой для размножения молочнокислых бактерий и источником выработки ими молочной кислоты, снижающей рН кишечного содержимого. К существенным недостаткам лактулозы относятся нередко развивающиеся вздутие живота и диарея с потерей электролитов (поэтому назначение лактулозы предпочтительно пациентам, страдающим запором). Лактулоза противопоказана при галактоземии. Доза сиропа лактулозы для взрослых варьирует от 15 до 45 мл в сутки (в 2–3 приема).
Начальная доза для взрослых составляет по 40–60 капель 3 раза в день; для детей – по 20–40 капель 3 раза в день; для детей грудного возраста – по 15–30 капель 3 раза в день. По мере клинического улучшения доза может быть уменьшена наполовину.
1. Вудли М., Уэлан А., ред. Терапевтический справочник Вашингтонского университета. Пер. с англ. – М.: Практика, 1995г.
2. Гребенев А.Л., Мягкова Л.П. Болезни кишечника. – М.: Медицина, 1994 г.
3. Денисов И.Н., Кулаков В.И., Хаитов Р.М., гл. ред. Клинические рекомендации для практикующих врачей, основанные на доказательной медицине. – М.: ГЭОТАР–МЕД, 2001г.
5. Котельников Г.П., Яковлев О.Г., ред. Практическая гериатрия: Руководство для врачей. – Самара: Самарский Дом печати, 1995г.
6. Fauci A.S., Braunwald E., Isselbacher K.J. et al., ed. Harrison’s Principles of Internal Medicine. 14th edition – Copyright (c) 1998 by The McGraw–Hill Companies, Inc., USA.
7. Herfindal Е.Т., Gourley D.R., ed. Textbook for therapeutics: drug and disease managment – 6th ed. – Copyright (c) 1996 Williams & Wilkins, Baltimore, USA.
Клостридиозы — острые инфекционные заболевания человека и животных, которые вызваны клостридиями.
Клостридиозы классифицируют по механизму возникновения на травматические и энтеральные. К энтеральным относят: клостридиоз диффициле, клостридиоз перфрингенс, ботулизм. К травматическим относят газовую гангрену и столбняк. Ниже будут рассмотрены клостридиоз диффициле и клостридиоз перфрингенс.
Клостридиоз перфрингенс – острое заболевание инфекционной природы с энтеральным путем заражения, которое проявляется синдромом гастроэнтерита или энтероколита и инфекционным токсикозом, а в более редких случаях и некротическим энтеритом или сепсисом.
Клостридиоз диффициле – острое заболевание инфекционной природы (путь заражения также энтеральный), которое вызывается антибиотикоиндуцированными штаммами клостридий диффициле и проявляется диарейным синдромом с развитием псевдомембранозного колита и инфекционным токсикозом.
Что провоцирует / Причины Клостридиозов у детей:
Человек может заразиться только некоторыми представителями клостридий 2-й и 4-й групп, которые приводят к энтеральным клостридиозам, а также возбудителем столбняка и возбудителями газовой гангрены. Данные бактерии вырабатывают специфические активные экзотоксины.
Клостридии перфрингенс длительное время считали возбудителем лишь газовой гангрены. Но в середине прошлого столетия наши связь между данными бактериями и пищевыми токсикоинфекциями.
Клостридии перфрингенс представляю собой короткие полиморфные палочки, которые не имеют жгутиков. Могут образовывать субтерминально расположенные споры. Относятся к строгим анаэробам. Их делят на шесть типов в зависимости от способности производить экзотоксины и ферменты: А, В, С, D, Е, F.
Чаще всего детский кишечный клостридиоз спровоцирован клостридиями перфрингенс типа А, в более редких случаях – типами С и F.

Патогенез (что происходит?) во время Клостридиозов у детей:
Клостридиоз перфрингенс попадает в организме в ЖКТ (желудочно-кишечный тракт) вместе с зараженной едой. Далее они следуют в тонкий кишечник, там размножаются, приводя к развитию воспалительного процесса. Через эпителиальный слой кишечника ребенка они попадают в близлежащие ткани и кровь. Так заболевание переходит в тяжелую септическую форму (но не во всех случаях).
Клостридии перфрингенс продуцируют экзоэнтеротоксины, имеющие цитолитические и некротические свойства, что и определяет основные симптомы, которые проявляются в ходе заболевания.
В кишечнике, многих органах и системах (даже в ЦНС) экзотоксины клостридии перфрингенс приводят к функциональным и структурным изменениям. Может развиться токсикоз и эксикоз. К диарее приводит местный воспалительный процесс в кишечнике ребенка.
Патоморфология клостридиоза перфрингенс. Во время болезни максимальные структурные изменения случаются в тонкой или толстой (реже) кишке. У умерших фиксируют отечность слизистой оболочки кишечника, ее гиперемированность, множественные кровоизлияния, стазы, в более редких случаях и некрозы.
Клостридиоз диффициле начинается лишь во время или по окончанию применения антибиотиков широкого спектра действия, в особенности цефамизина, ампициллина, линкомицина и клиндамицина. Это происходит по причине подавления антибиотиками естественной флоры кишечника, вследствие чего клостридии диффициле могут колонизировать кишечник, размножаясь там и образовывая токсины.
Некоторые антибиотики приводят к энтеротоксинообразованию у бактерий. Помимо этого, нормальная кишечная флора у детей и взрослых производит бета-лактамазу — фермент, разрушающий бета-лактамное кольцо бета-лактамов, чем инактивируется действие антибиотика в кишечнике.
Симптомы Клостридиозов у детей:
Инкубационный период клостридиоза перфрингенс составляет от 6 до 24 часов. Это довольно короткий срок. Болезнь имеет острое начало. Проявляются такие симптомы:
- рвота
- боли в животе (беспокойство, вялость, отказ от еды или снижение аппетита).
- часто сильно повышается температура тела
- часто фиксируют дисфункцию ЖКТ.
С самого начала клостридиоза перфрингенс стул становится жидкой консистенции, частота дефекации повышается. Стул энтеритный или энтероколитный. Болезнь протекает относительно легко, выздоровление наступает на 3-4 сутки после начала.
Если болезнь прогрессирует и не вылечена вовремя, может случиться летальный исход вследствие нарушения сердечно-сосудистой деятельности. У ослабленных детей и грудничков инфекция может генерализироваться, развивается сепсис.
Кишечный клостридиоз диффициле в большинстве случаев по симптомам аналогичен псевдомембранозному колиту, в более редких случаях – некротическому энтероколиту или диарейному синдрому. Заболевания псевдомембранозным колитом характерны для грудничков, новорожденных и дошкольников.
Псевдомембранозиый колит появляется, как правило, через неделю-10 дней после начала приема антибиотиков. Болезнь начинается остро – поднимается температура, появляются срыгивания или повторная рвота, боли в животе и диарея. Малыши отказываются от еды, родители могут заметить вздутие живота и снижение массы тела.
Кожа приобретает бледно-серый оттенок, на коже живота часто видна сеть застойных вен. Стул становится жидким, водянистым, наблюдаются примеси слизи и крови (не всегда). В некоторых случаях большая часть стула представляет собой густую белесоватую слизь и обрывки фибринозных наложений. Иногда стул гнойный, с кровянистыми примесями. Для некоторых случаев характерно кишечное кровотечение, что часто приводит к летальному исходу.
Болезнь протекает у новорожденных (в особенности – у недоношенных) тяжело. Наблюдают профузный понос, обезвоживание, расстройство периферического кровообращения или расстройство кровообращения по типу коллапса без диареи.
Если есть изъязвление пораженных участков слизистой оболочки кишечника, могут фиксировать перформацию кишечника и каловый перитонит. При этом состояние ребенка тяжелые, кожа окрашивается в серый оттенок, дыхание поверхностное, резко выражен парез кишечника, наблюдаются гиподинамия и гипорефлексия, заостренность черт лица больного ребенка. Не исключена отечность гениталий. Если лечение не начато вовремя, есть вероятность летального исхода.
Клостридии диффициле, помимо некротических энтероколитов, псевдомембранозных колитов и кишечного сепсиса могут приводить к более легким болезням ЖКТ, которые протекают схоже с энтеритами и энтероколитами, особенностей не имеют.
Диагностика Клостридиозов у детей:
Такие симптомы характерны не только для данного заболевания, потому проводят лабораторную диагностику. Используют экспресс-методы (РНГА и ИФА) для обнаружения в фекалиях больного ребенка энтеротоксина. У выделенных штаммов клостридий определяют энтеротоксигенность.
В крови у больных с кишечным клостридиозом перфрингенс наблюдают умеренный лейкоцитоз и палочко-ядерный сдвиг.
Для диагностики кишечного клостридиоза диффициле необходимы сведения анамнеза о терапии антибиотиками, а также инструментальные и клинические показатели. Проводится комплекс лабораторных исследований для обнаружения в фекалиях больного ребенка специфических токсинов (энтеро- и цитотоксина) и возбудителя.
Селективное выделение клостридии диффициле проводят с помощью циклосерин-цефокситин-фруктозного агара. В последнее время диагностику энтероклостридиоза диффициле проводят с помощью высокочувствительных методов ИФА и РЛА.
Доказать клостридиоз диффициле с помощью только обнаружения возбудителя и его токсинов в кале или другом биоматериале от больного нельзя. Потому что данные микроорганизмы и токсины могут быть и у здорового человека, в основном у недавно рожденных и детей до 6 месяцев.
Лечение Клостридиозов у детей:
Лечебные мероприятия при кишечном клостридиозе перфрингенс аналогичны таковым при других бактериальных диареях. Назначают этиотропную терапию, учитывая чувствительность обнаруженных штаммов клостридий к антибиотикам. Врачи рекомендуют использовать для лечения энтеральные формы антибиотиков, к примеру, азитромицин, амоксиклав, цефалоспорины 3-го поколения и т. д.
Комплексная терапия включает бактерийные препараты, такие как бификол или бифидумбактерин, а также другие препараты для нормализации биоценоза кишечника. Бактерийные препараты служат для прекращения колонизации кишечника клостридиями. При особо тяжелых формах заболевания, если установлен тип возбудителя, для лечения могут применять антитоксическую сыворотку в дозе 5000—10000 АЕ внутримышечно по методу Безредки или энтерально.
Под этиотропной терапией антибиотикоиндуцированного кишечного клостридиоза диффициле подразумевают введение парентеральных аминогликозидов, метронидазола, цефалоспоринов.
Клостридий диффициле можно убить ванкомицином или его аналогами. Антибиотики применяют в дозах, согласно возрасту. Курс приема антибиотиков при этом – 5-7 суток при среднетяжелых и тяжелых формах болезни.
После окончания приема антибиотиков следует назначить ребенку прием бактерийных препаратов (к примеру, линекса, бифидумбактерина, лактобактерина и пр). Это поможет нормализовать биоценоз в кишечнике.
Лечат клостридий диффициле также ферментными препаратами, например, фесталом, креоном и т. д., витаминами (в особенности – группой В). Необходима симптоматическая и патогенетическая терапия. Если есть соответствующие показания, применяют инфузионную терапию, чтобы нормализовать баланс жидкости в организме ребенка, провести дезинтоксикацию и парентеральное питание. Применяют антигистаминные препараты, а при тяжелых формах кортикостероиды и специфические антитоксические сыворотки.
Профилактика Клостридиозов у детей:
Самые важные профилактические меры заключаются в:
- строгом соблюдении санитарно-гигиенических норм приготовления, хранения и сбыта пищевых продуктов;
- активном выявлении носителей клостридий среди работников пищеблоков и детских учреждений;
- своевременной изоляции и лечении зараженных клостридиями детей и взрослых;
- санитарно-просветительной работе среди населения о правильном уходе за детьми и их кормлении;
- кратновременном хранении продуктов и термической обработке.
Профилактические меры при кишечном клостридиозе диффициле должны быть направлены, прежде всего, на предупреждение антибиотикоиндуцированности как важнейшего фактора заболевания этим клостридиозом.
Не следует использовать как профилактическое или лечебное средство антибактериальные лекарства широкого спектра действия длительными курсами.
Чтобы избежать колонизации кишечника клостридиями, необходимо вовремя лечить кишечный дисбактериоз и проводить его профилактику. В стационарах, особенно в отделениях для новорожденных, следует обеспечивать необходимый санитарно-гигиенический режим, правильную дезинфекцию инструментария, посуды, белья и т. д.
Обработка предметов проводится с помощью хлориндиоксида или его аналогов, имеющих бактерицидные и спороцидные свойства, влияющие на клостридий.
К каким докторам следует обращаться если у Вас Клостридиозы у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Клостридиозов у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .

Материал адресован врачам: инфекционистам, гастроэнтерологам, терапевтам, общей практики
Микроорганизм Сlostridium difficile — ведущая причина диарейных заболеваний, ассоциированных с назначением системных антибиотиков и действием ряда других предрасполагающих факторов. C. difficile-ассоциированная инфекция (далее — КДАИ) имеет вариабельный диапазон клинических проявлений от легкой самолимитирующейся диареи до тяжелых, порой жизнеугрожающих состояний — псевдомембранозного колита, токсического мегаколона и септического шока с летальностью до 50–60% и более.
Игорь Карпов, заведующий кафедрой инфекционных болезней БГМУ, доктор мед. наук, профессор;
Юрий Горбич, декан медико-профилактического факультета БГМУ, доцент, кандидат мед. наук;
Никита Соловей, доцент кафедры инфекционных болезней БГМУ, кандидат мед. наук;
Наталия Левшина, заведующая микробиологической лабораторией Минского горЦГЭ.
В последнее время в клинической практике наблюдается заметное увеличение частоты развития тяжелых, а также рецидивирующих и фульминантных форм КДАИ, что во многом связано с внедрением методов высокотехнологической медпомощи, ростом числа иммуносупрессированных лиц и пациентов, нуждающихся в частых и/или длительных курсах антибиотиков. По меньшей мере у 10% страдающих КДАИ развиваются осложнения, у 18–25% пациентов заболевание характеризуется рецидивирующим течением.
В Европе летальный исход регистрируется в среднем в 22% случаев подтвержденной КДАИ, причем в 40% случаев непосредственно обусловлен C. difficile.
Этиология и эпидемиология
C. difficile — грамположительная спорообразующая токсин-продуцирующая анаэробная палочка, широко распространенная в почве, воде, а также ЖКТ животных. В части случаев данный микроорганизм может являться компонентом нормальной микробиоты ЖКТ человека, особенно у новорожденных и пожилых. У большинства же пациентов C. difficile способна колонизировать ЖКТ только в случаях, когда состав его нормальной микробиоты существенно нарушен, например, из-за длительной системной антибактериальной терапии, при выполнении хирургических манипуляций на органах брюшной полости, после химиотерапии и т. д.
Частота колонизации ЖКТ C. difficile коррелирует с длительностью госпитализации, применением антибиотиков и ряда других средств, с общей тяжестью состояния пациентов.
В учреждениях здравоохранения возбудитель распространяется преимущественно в виде спор, высоко устойчивых к действию некоторых антисептиков и дезинфектантов. Основными факторами переноса служат объекты окружающей среды (постельные принадлежности, полотенца, мебель, инструментарий) и руки медперсонала. Механизм инфицирования C. difficile фекально-оральный, реализуется при заглатывании спор возбудителя. Пациенты, колонизированные C. difficile и особенно имеющие клинические проявления КДАИ, являются источником возбудителя для других пациентов и способствуют поддержанию распространения C. difficile в учреждении здравоохранения, что требует применения мер контактной изоляции и тщательного соблюдения принципов инфекционного контроля.
Патогенез и факторы риска развития симптомной КДАИ
Развитие заболевания возможно представить в виде нескольких ключевых звеньев. Вначале под воздействием ряда предрасполагающих факторов (системная антибактериальная терапия, прием цитостатиков, ингибиторов протонной помпы и блокаторов Н2-рецепторов, лучевая терапия, операции на органах брюшной полости и малого таза) нарушаются состав и видовое разнообразие микробиоты ЖКТ, теряются колонизационная резистентность и другие защитные механизмы слизистой кишечника. Затем идет колонизация C. difficile. Микроорганизм активно пролиферирует в просвете толстой кишки и начинает продуцировать токсины А (энтеротоксин), В (цитотоксин), бинарный, что приводит к развитию водянистой диареи и колита. В особо тяжелых случаях возможен выраженный некроз колоноцитов вплоть до псевдомембранозного колита, токсического мегаколона, сепсиса и септического шока.
Несколько ключевых факторов риска предрасполагают к развитию симптомных форм КДАИ:
- системная антибактериальная терапия в ближайшие 1–3 месяца любыми антибиотиками, но наиболее часто — при применении цефалоспоринов, линкозамидов, фторхинолонов, пенициллинов, карбапенемов (следует помнить, что развитие КДАИ может совпадать с началом или продолжением антибиотикотерапии либо идти после окончания курса антибиотиков, чаще в последующий месяц, редко — через 2–3 месяца);
- длительные госпитализации в учреждения здравоохранения, интернаты;
- противоопухолевая терапия (химио-, лучевая);
- пожилой возраст и тяжелая коморбидная патология;
- иммуносупрессия любого генеза;
- длительный прием ингибиторов протонной помпы и блокаторов Н2-рецепторов;
- абдоминальные хирургические вмешательства;
- наличие у пациента активной формы воспалительного заболевания кишечника;
- вспышка КДАИ в отделениях учреждений здравоохранения.
Ошибочно полагать, что антибактериальная терапия в ближайшем анамнезе является обязательным условием развития КДАИ. Более того, первый случай C. difficile-ассоциированного псевдомембранозного колита был описан американским хирургом J. Finney в 1893 году, т. е. за несколько десятилетий до появления антибиотиков. Болела 22-летняя пациентка, перенесшая операцию на желудке.
Заболевание может иметь ряд ключевых клинических проявлений.
1. C. difficile-ассоциированная диарея с частотой неоформленного стула более 3 раз в сутки, обусловленная действием факторов патогенности C. difficile. Это наиболее часто встречающееся клиническое проявление КДАИ. Тяжесть C. difficile-ассоциированной диареи может варьировать от легкой, саморазрешающейся после окончания антибиотикотерапии, до тяжелой профузной холероподобной, быстро приводящей к дегидратации.
2. C. difficile-ассоциированный колит проявляется учащенными дефекациями от 3 до 15 и более раз в сутки с водянистыми испражнениями, спастическими болями преимущественно в нижних отделах живота, субфебрильной либо фебрильной температурой и умеренным лейкоцитозом в периферической крови. При ректосигмоидоскопии или колоноскопии изменения стенки толстой кишки варьируют от очаговых участков гиперемии слизистой до изъязвлений — в зависимости от тяжести процесса.
3. Псевдомембранозный колит по клинической картине напоминает C. difficile-ассоциированный колит, однако имеет более тяжелое течение. Эндоскопическое обследование выявляет формирование на слизистой толстой кишки псевдомембран — округлых, слегка возвышающихся желтоватых бляшек из некротизированного эпителия, пропитанного фибрином.
Псевдомембраны считаются патогномоничным признаком КДАИ и обнаруживаются в большинстве случаев в ректосигмоидном отделе толстой кишки. Однако у трети пациентов типичные патоморфологические симптомы псевдомембранозного колита имеются лишь в проксимальных отделах толстой кишки при интактной слизистой ректосигмоидной области, поэтому предпочтительнее фиброколоноскопия, а не ректосигмоидоскопия. КТ органов брюшной полости с контрастированием и в некоторых случаях УЗИ также позволяют обнаружить резко выраженное утолщение стенки толстой кишки, что является достаточно чувствительным маркером этого состояния.
Манифестация фульминантного C. difficile-ассоциированного псевдомембранозного колита — выраженные боли, локализованные в нижних отделах живота, либо диффузного характера, диарея (чаще водянистая, в редких случаях с примесью крови), напряжение мышц передней брюшной стенки, лихорадка, гиповолемия, лактат-ацидоз и выраженный лейкоцитоз (до 40х109/л и более). В некоторых случаях диарея может быть малозаметной либо вовсе отсутствовать вследствие развития кишечной непроходимости и накопления жидкости в дилатированной атоничной толстой кишке.
4. Токсический мегаколон — одно из осложнений фульминантного C. difficile-ассоциированного псевдомембранозного колита. Клинически характеризуется выявлением атонии и дилатации толстой кишки (свыше 7 см в наибольшем диаметре), сопровождающейся транслокацией бактерий из просвета ЖКТ в системных кровоток, развитием септического шока и часто — полиорганной недостаточности. На обзорной рентгенографии органов брюшной полости в этом случае регистрируются перерастяжение поперечной ободочной кишки с исчезновением гаустр, зубчатая исчерченность стенки толстой кишки, уровни жидкости и газа, иногда небольшая дилатация тонкой кишки.
5. Перфорация толстой кишки — осложнение фульминантного C. difficile-ассоциированного псевдомембранозного колита, проявляющееся напряжением мышц передней брюшной стенки, исчезновением кишечных шумов, выраженной болезненностью в левом или правом нижнем квадранте живота с последующим развитием клиники разлитого перитонита. На обзорной рентгенографии органов брюшной полости выявляется свободный воздух.
Критерии тяжелого C. difficile-ассоциированного колита приведены в таблице.

Согласно рекомендациям Европейского общества по клинической микробиологии и инфекционным болезням (ESCMID), следует расценивать КДАИ как тяжелую, если есть как минимум один признак тяжелого колита (см. табл.) либо хотя бы один неблагоприятный прогностический фактор:
- возраст 65 лет и старше;
- выраженный лейкоцитоз (>15109/л);
- снижение уровня альбумина сыворотки (
- повышение уровня креатинина сыворотки (≥133 мкмоль/л или в 1,5 раза и более от первоначального уровня до момента развития КДАИ).
Таким образом, клинические проявления КДАИ обладают значительной вариабельностью, при этом легкие формы заболевания при неадекватной тактике ведения пациентов могут прогрессировать с развитием жизнеугрожающих осложнений. Особое внимание следует обратить на возможность возникновения признаков острой кишечной непроходимости и полиорганной недостаточности как первого клинического проявления тяжелой КДАИ без предшествующей диареи у лиц, получающих системную антибактериальную терапию, т. к. в этом случаи нередки диагностические ошибки и неадекватная тактика ведения (необоснованное хирургического вмешательство и назначение системной антибактериальной терапии, что ухудшает состояние пациента и зачастую становится причиной неблагоприятного исхода).
Лабораторная диагностика
Для верификации диагноза можно использовать несколько методов: реакция нейтрализации цитотоксина в культуре клеток, выделение токсигенной культуры C. difficile, определение глутамат-дегидрогеназы, иммунологическая детекция токсинов C. difficile, молекулярно-генетическая детекция генов токсигенности C. difficile (ПЦР). Реакция нейтрализации цитотоксина в культуре клеток и выделение токсигенной культуры возбудителя являются достаточно трудоемкими, дорогостоящими и длительными методами, поэтому не получили широкого распространения в современной клинической практике, хотя и являются золотым стандартом верификации диагноза при проведении научных исследований. Наиболее часто для верификации диагноза в практических условиях используются методы иммунологической детекции токсина C. difficile (иммунохроматографический анализ, иммуноферментный анализ) и молекулярно-генетическая детекция генов токсигенности. Следует отметить неприменимость рутинного бактериологического выделения возбудителя из образца испражнений как метода лабораторного подтверждения КДАИ в связи с высокой частотой бессимптомного носительства C. difficile в ЖКТ пациентов, госпитализированных в стационар или часто обращающихся за медпомощью.
ИФА-детекция токсинов А и В C. difficile доступна в лаборатории отделения инфекционной иммунологии Минского горЦГЭ. Метод обладает высокими чувствительностью (89,8%) и специфичностью (96,7%) и позволяет получить окончательный результат в течение 6 часов от начала исследования. Оптимально доставлять образцы неоформленных испражнений в лабораторию как можно раньше от момента забора, однако допускается хранение образцов при температуре +2… +8 °С в течение трех суток. При отсутствии диареи (кишечная непроходимость, перитонит) иногда исследуют смывы из дистальных отделов толстой кишки. Необходимо помнить, что имеет смысл тестировать только неоформленные образцы испражнений и только пациентов, имеющих симптомы, потенциально связанные с КДАИ.
Если лабораторные методы верификации КДАИ технически недоступны, следует ориентироваться на клинические проявления заболевания, которые могут быть сопряжены с C. difficile, и наличие у пациентов перечисленных выше факторов риска. В этом случае рекомендуется назначать терапию эмпирически, а потом оценивать эффект. Клинический ответ пациента на этиотропное лечение КДАИ — подтверждение диагноза ex juvantibus.
При появлении клинических признаков C. difficile-ассоциированной инфекции (далее — КДАИ) на фоне системной антибактериальной терапии ее следует прекратить, если позволяет состояние пациента и нет жизненных показаний для ее продолжения, т. к. большинство исследований демонстрируют уменьшение вероятности клинического излечения и значительное увеличение частоты рецидивов в случае продолжающейся антибиотикотерапии. Если врач вынужден продолжать системную антибактериальную терапию и при этом назначать этиотропное лечение КДАИ — предпочтение должно отдаваться схемам как при тяжелой КДАИ.
Оптимально также воздержаться от терапии антацидными лексредствами (ингибиторами Н2-рецепторов, блокаторами протонной помпы). Категорически запрещается использование препаратов, угнетающих перистальтику ЖКТ, в частности лоперамида, — это может приводить к утяжелению состояния пациента с КДАИ, предрасполагать к развитию псевдомембранозного колита, токсического мегаколона и перитонита.
Выбор схемы этиотропной терапии КДАИ определяется прежде всего тяжестью, а также особенностями течения заболевания (первичный эпизод или рецидив) — см. табл.
Таблица. Выбор оптимальной схемы этиотропной терапии КДАИ

Следует отметить, что согласно исследованиям применение метронидазола внутрь для терапии легкой и среднетяжелой КДАИ превосходит по эффективности его назначение внутривенно. Применение ванкомицина при данной патологии должно осуществляться только перорально: внутривенное клинически неэффективно. При пероральном использовании ванкомицина он не всасывается из просвета ЖКТ в клинически значимых концентрациях, соответственно, не обладает нефротоксичностью и другими нежелательными эффектами и может безопасно использоваться у беременных, пациентов с нарушенной функцией почек без коррекции исходной дозы.
Фекальная трансплантация микробиоты (введение донорских фекалий в просвет ЖКТ пациента путем удерживающих клизм, дуоденального зонда или при фиброколоноскопии) является перспективным методом терапии многократно рецидивирующих форм КДАИ и направлена на восстановление нормальной микробиоты кишечника и колонизационной резистентности. В систематическом обзоре Gough et al., включавшем анализ эффективности данного метода у 317 пациентов с КДАИ, разрешение заболевания отмечено в 92% случаев. Исследование van Nood et al., сравнивающее эффективность дуоденальных инфузий донорских фекалий со стандартной терапией рецидивирующих форм КДАИ, было досрочно прекращено в связи с крайне низким процентом выздоровления в группе ванкомицина (30,8% — в сравнении с 93,8% в группе фекальной трансплантации микробиоты). Несмотря на то, что в настоящее время имеются трудности и нерешенные вопросы с техническим выполнением данной процедуры, метод является крайне перспективным и, возможно, займет свое место в клинической практике уже в ближайшей перспективе.
Помимо этиотропной терапии КДАИ при наличии водянистой диареи пациенту следует проводить регидратационную терапию перорально или внутривенно полиионными растворами по принципам лечения других острых кишечных инфекций.
Эффективность проводимой терапии КДАИ должна оцениваться через 48 часов и более от ее начала. В первые 24–48 часов клинических признаков улучшения состояния (уменьшение частоты дефекаций, разрешение симптомов тяжелой и осложненной КДАИ, имевших место в дебюте заболевания) может и не быть даже на фоне адекватно проводимой терапии, и, согласно существующим рекомендациям, в эти сроки важны только стабильность и отсутствие ухудшения состояния. К признакам, указывающим на неэффективность антибактериальной терапии, относится отсутствие клинического улучшения после 3 дней проводимой терапии либо появление в процессе лечения новых симптомов тяжелой КДАИ.
В случае, если КДАИ оценивается как тяжелая, необходим динамический мониторинг уровня лактата и креатинина сыворотки крови, а также оценка степени выраженности лейкоцитоза. Отрицательная динамика по данным маркерам должна приводить к пересмотру тактики ведения пациента, в т. ч. с привлечением хирургов для решения вопроса о необходимости хирургического вмешательства.
Другие показатели, которые рекомендуется оценивать у пациентов с тяжелой КДАИ, — водно-электролитный баланс, уровень альбумина и маркеры органной недостаточности (как при сепсисе).
У части пациентов с тяжелыми проявлениями КДАИ консервативная терапия не позволяет добиться улучшения состояния и предотвращения неблагоприятного исхода лечения. Показаниями к выполнению хирургического вмешательства служат перфорация толстой кишки, появление признаков синдрома системного воспалительного ответа и ухудшения клинического состояния, не отвечающего на адекватную этиотропную терапию (включая токсический мегаколон и тяжелую кишечную непроходимость).
Выполнение операции оптимально в течение 48 часов после начала консервативной терапии (в случае отсутствия клинико-лабораторного ответа на ее проведение) или при появлении признаков полиорганной недостаточности или перфорации кишечника. Для хирургического лечения инфекций, вызванных C. difficile, чаще используются колэктомия или формирование илеостомы с возможным последующим кишечным лаважом ванкомицином.
Профилактика КДАИ
- разумное использование антибиотиков (назначение системной антибактериальной терапии только по показаниям, деэскалационный подход при получении результатов микробиологического исследования, ограничение продолжительности антибиотикотерапии, контроль за назначением антибиотиков резервной группы и т. д.);
- гигиена рук и использование перчаток при работе с пациентами, имеющими факторы риска колонизации C. difficile;
- использование униформы, контактная изоляция пациентов с клиническими проявлениями КДАИ;
- тщательная уборка окружения пациентов с использованием спороцидных средств.
Таким образом, C. difficile является одним из самых распространенных нозокомиальных патогенов XXI века, встречающимся в учреждениях здравоохранения всего мира и вызывающим большинство случаев антибиотик-ассоциированных диарей и диарей, связанных с оказанием медпомощи.
КДАИ имеют широкий спектр клинических проявлений от саморазрешающейся легкой диареи до тяжелых жизнеугрожающих состояний, зачастую с фульминантным течением, развитием серьезных осложнений и быстрым летальным исходом.
Знание особенностей течения заболевания, принципов лабораторной верификации диагноза и этиотропной терапии позволит существенно улучшить исходы КДАИ в современной клинической практике.
Читайте также:

