Когда появилась терапия от вич
Обновлено: 23.04.2024
Есть немало лекарств, которые применяются для борьбы с ВИЧ. Но такого, чтобы позволяло излечиться от вируса иммунодефицита человека, пока, увы, не изобретено.
Чем сегодня лечат ВИЧ? Какие результаты дает лечение? Об этом мы побеседовали с Наталией Сизовой, кандидатом медицинских наук, заведующей поликлиническим инфекционным отделением городского Центра по профилактике и борьбе со СПИДом и инфекционными заболеваниями.
– Наталия Владимировна, многие годы ученые ищут препарат, который полностью излечит от ВИЧ, от СПИДа. Почему до сих пор не удалось придумать такое лекарство?
– Это связано с тем, что вирус встраивается в геном человеческой клетки, и выбить эту информацию о нем, записанную в геноме клетки, чрезвычайно сложно. Поэтому до сих пор такого радикального средства, которое бы полностью убрало вирус, к сожалению, нет.
– Чудо-вакцины нет, но, тем не менее, ВИЧ-положительные люди могут вести нормальный образ жизни. Благодаря каким лекарствам, какому лечению?
У нас в Санкт-Петербурге есть пациенты, диагноз которым поставили в 1987 году. Столько лет эти люди прожили с ВИЧ-инфекцией, и надо учесть, что в самом начале не было антриретровирусных препаратов. А когда они появились, то были более тяжелые, более токсичные, чем сегодня… Тем не менее, люди живут. На моей памяти много пациентов, которые вырастили своих детей, стали бабушками, дедушками.
– Чтобы так долго жить, какие правила надо соблюдать?
– Есть люди, которым поставили диагноз, к примеру, в 2000 году, а они после этого не наблюдались у врачей. И сегодня они обращаются к нам уже в очень тяжелом состоянии, некоторым мы даже не успеваем помочь. Чудес не бывает. Самое главное для человека, которому поставлен диагноз ВИЧ — обязательно наблюдаться и своевременно лечиться, принимать антиретровирусную терапию. Сейчас большинство медиков склоняются к тому, что терапию надо начинать как можно раньше. Потому что мы знаем и на собственном опыте, и по зарубежной научной информации, что чем дольше человек ходит с иммунодефицитом (хотя он себя, может, неплохо чувствует), тем быстрее у него развивается ВИЧ-инфекция, и не исключено, что у него впоследствии появятся другие болячки, например, онкология…
– Очень важно, чтобы человек обследовался на ВИЧ, особенно если у него есть какие-то к тому показания: клинические или эпидемиологические. Например, если у него были не защищенные половые контакты. Иллюзия, что вирус поражает группу риска.
К нам всё чаще становятся на учет социально адаптированные люди, вполне благополучные. Потому что сейчас начинает превалировать половой путь передачи ВИЧ-инфекции.
Когда мы принимаем решение о начале антиретровирусной терапии, мы смотрим прежде всего на самочувствие пациента. Если человек начинает себя плохо чувствовать, у него есть какие-то клинические проявления (даже если анализы хорошие), то мы ему предлагаем начать терапию. Другой вариант: пациент чувствует себя хорошо. Главными маркерами прогрессирования заболевания являются два анализа: анализ на иммунитет (начинаем предлагать терапию, когда CD-лимфоциты в клетках снижаются ниже 350; раньше планка была 200) и такой показатель, как вирусная нагрузка (это количество вирусов в миллилитре крови). Чем выше вирусная нагрузка, тем быстрее заболевание прогрессирует. И чем выше вирусная нагрузка, тем более человек заразен. Мы предлагаем пациенту начать терапию, если вирусная нагрузка превышает 100 тысяч. Это помогает остановить быстрое прогрессирование заболевания и снизить заразность человека. Как бы там ни было, если у человека есть постоянный половой партнер и высокая вирусная нагрузка, ему обязательно нужно начинать терапию. Это не только сохранит здоровье ВИЧ-положительному, но и убережет от ВИЧ его партнера.
– Говорят, что у антиретровирусных препаратов немало побочных эффектов. Насколько они опасны и в каких случаях?
– Конечно, антиретровирусные препараты — не карамельки. Побочные эффекты можно разделить на ранние и поздние. Ранние возникают в течение первых шести недель приема препаратов. Эти побочные эффекты, как правило, тоже делятся на два вида: те, которые надо переждать, и они пройдут (например, тошнота — первый месяц тошнит, потом проходит; бывает аллергическая сыпь, которая тоже со временем проходит), и тяжелые — когда препарат не подходит человеку. Причем, зачастую побочные эффекты генетически запрограммированы. Например, у некоторых пациентов есть реакция гиперчувствительности на абакавир… Это ранние побочные эффекты. Здесь правило такое: ни в коем случае в начале терапии не отрываться от доктора, никуда не уезжать, чтобы доктор держал, что называется, руку на пульсе. Он сразу определит, не угрожают ли эти побочные эффекты жизни. Тогда можно будет успокоить больного, переждать эти эффекты.
Если же побочные эффекты жизнеугрожающие (например, у пациента резко снижается гемоглобин в крови), то тогда надо менять препараты.
Что касается поздних побочных действий… Здесь тоже самое главное — хорошо наблюдаться. Человек должен вовремя сдавать анализы, инструментально обследоваться. Доктор увидит и предупредит эти побочные действия, поменяет схему приема препаратов.
В любом случае, когда мне люди говорят, что лекарства вредны… Понимаете, мы из двух зол выбираем меньшее. Ничего страшнее вируса нет.
– Наталия Владимировна, а если не принимать терапию, пустить болезнь, как говорится, на самотек…
К сожалению, наши люди… Они полечились немного, у них стало все хорошо (то есть им кажется, что все хорошо) — и они бросают терапию. А в результате все моментально скатывается на прежние позиции. Поэтому мы постоянно объясняет нашим пациентам: надо лечиться, от этого никуда не денешься. И только тогда вы будете жить долго, активно, практически так, как живут здоровые люди.
Оригинал статьи на сайте "Курьер-Медиа"
Вы имеете возможность дать независимую оценку качества оказания медицинских услуг в нашем учреждении, заполнив АНКЕТУ на сайте Министерства здравоохранения Российской Федерации.
Началась она в середине 70-х годов прошлого века, хотя сам вирус появился гораздо раньше. Когда точно, ученые не знают, но, предположительно, это произошло в 1920-е годы в Леопольдвиле (ныне Киншаса), столице бельгийского Конго, где симианский вирус шимпанзе передался человеку при контакте с кровью животного, на шимпанзе в те времена в Конго активно охотились.
В середине 1970-х в центре внимания западных врачей и ученых оказалась загадочная болезнь, поражавшая, как первоначально казалось, лишь молодых гомосексуальных мужчин.
Они страдали от оппортунистических инфекций, приводящих к тяжелой пневмонии и особо агрессивной форме рака – саркоме Капоши. К концу 1981 года из 270 мужчин с этим заболеванием 121 умер.
Оппортунистическими называют инфекции, которые развиваются только на фоне пораженной, ослабленной иммунной системы. Существуют вирусы и клеточные организмы (бактерии, грибы, простейшие), являющиеся не патогенными (приводящими к заболеванию), а условно патогенными, обычно не вызывающие болезни у людей со здоровой иммунной системой. В нормальной ситуации эти инфекции и болезни либо вообще не развиваются, либо проявляются в неопасном для жизни виде. Примеры: цитомегаловирус, герпес, грибок Candida albicans, стафилококки и стрептококки. При ослабленном иммунитете те же самые инфекции могут вызвать тяжелую болезнь и даже стать фатальными. У больных саркомой Капоши практически в 100% случаев устанавливается разрастание вируса герпеса 8 типа.
Первоначально ученые считали, что заболевание распространяется исключительно через сексуальный контакт, однако затем врачи в США и Европе стали сообщать о сходной клинической картине у больных гемофилией и у тех, кто страдает зависимостью от инъекционных наркотиков, как мужчин, так и женщин.
1987 год – поворотный пункт

Диана, принцесса Уэльская, беседует с больным СПИДом Уэйном Тейлором в хосписе для больных СПИДом Кейси Хаус в Торонто, 26 октября 1991 год. Фото: Ханс Дерик
Прежде чем рассказать о медицинском прорыве в истории ВИЧ, нельзя не упомянуть о том, что в большинстве стран в 1980-е годы как государствами, так и социальными организациями и частными лицами была развернута огромная просветительская кампания.
Информация о путях распространения инфекции и необходимых гигиенических мерах для ее профилактики стала появляться во всех ведущих СМИ, как частных, так и государственных.
В 1987 году в Великобритании принцесса Диана открыла первое отделение для больных СПИДом в больнице Мидлсекса, и в этом же году произошло событие, ставшее поворотным пунктом в истории ВИЧ: появился первый антиретровирусный препарат зидовудин, который проложил путь к превращению диагноза СПИД из смертельного приговора в болезнь, с которой можно жить долгие годы.
Зидовудин был синтезирован в 1964 году в британском исследовательском центре Wellcome Research Laboratories (теперь он принадлежит фармацевтической компании GlaxoSmithKline) научным сотрудником Джеромом Хорвицем в качестве потенциального препарата против рака, однако никакой противоопухолевой активности на животных моделях зидовудин не продемонстрировал, а потому исследования были прекращены.
Одновременно группа сотрудников под руководством Гертруды Элайон работала над противовирусными препаратами и в штатном режиме производила скрининг различных соединений на противовирусную активность. В их число попал зидовудин, но и тут он показал лишь слабую активность в отношении вируса Эпштейна-Барра, хотя, как оказалось, вполне неплохо подавлял бактериальные инфекции.
Но когда в 1984 году лаборатория начала поиск препаратов для лечения ВИЧ-инфекции, зидовудин снова попал в поле внимания исследователей и оказался единственным соединением, полностью подавлявшим репликацию вируса.
Ингибиторы обратной транскриптазы подавляют активность обратной транскриптазы, фермента, необходимого для синтеза ДНК вируса иммунодефицита и других ретровирусов.
С 1987 года врачи начали применять зидовудин для лечения ВИЧ-положительных пациентов. Препарат работал, однако эффективность его оказалась ниже, чем рассчитывали ученые.
Антиретровирусная терапия
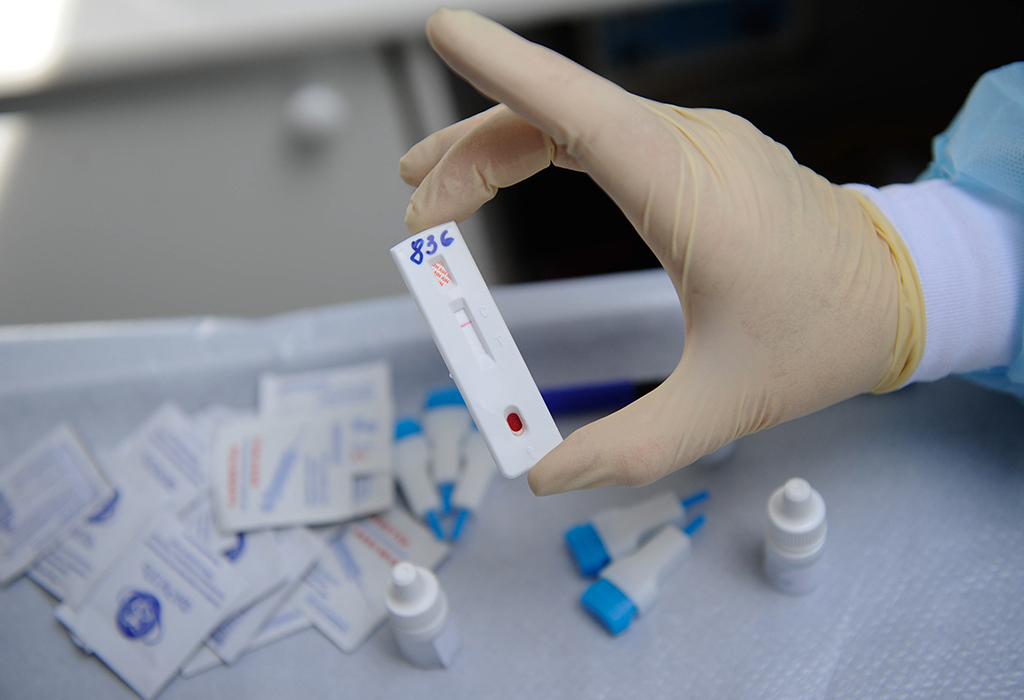
Экспресс-тест на ВИЧ и СПИД с отрицательным результатом. Фото: Кирилл Кухмарь/ТАСС
Главная проблема, затрудняющая борьбу с ВИЧ, – это его высокая мутагенность, то есть способность менять структуру гена и, таким образом, вырабатывать резистентность к лекарствам.
Именно поэтому ученые постепенно пришли к идее применения сразу нескольких препаратов. Каждый из них подавляет определенную форму вируса, и ту, которой пациент был изначально заражен, и те, которые развились за время болезни.
В 1995–1996 годах два крупных исследования, Delta (Великобритания, Франция и Нидерланды) и американское ACTG 175 продемонстрировали, что одновременное лечение двумя препаратами значительно более эффективно, чем монотерапия.
В первом исследовании ученые изучали сочетания зидовудин+диданозин и зидовудин+зальцитабин в сравнении с одним зидовудином. Сочетания оказались эффективней и позволили сократить смертность пациентов соответственно на 42 и на 32%. Сходные результаты продемонстрировало и американское исследование.
В феврале 1996 года на третьей Конференции по ретровирусным и оппортунистическим инфекциям в Вашингтоне выступил канадский исследователь Билл Камерон из Университета Оттавы, который сообщил, что ему и его коллегам удалось существенно снизить смертность пациентов с ВИЧ благодаря добавлению раствора ритонавира к стандартному протоколу лечения. (Само исследование было опубликовано несколько позже, в 1998 году).
Ритонавир относится к группе ингибиторов протеазы, еще одного фермента, необходимого для репликации вируса.
Тогда же, в 1996 году, появился новый ингибитор обратной транскриптазы невирапин, а также еще один ингибитор протеазы – нелфинавир, а в дальнейшем и другие препараты, подавляющие репликацию вируса, воздействуя на разные ее этапы.
С 1996 года высокоактивная антиретровирусная терапия (ВААРТ) начала применяться во многих странах мира, в результате чего уже в 1998 году удалось сократить не только смертность, но и число новых случаев заболевания СПИДом в 10 раз.
Дело в том, что длительная терапия позволяет снизить вирусную нагрузку до неопределяемой, а значит, человек не может передать вирус другому даже при незащищенном сексуальном контакте.
ВААРТ позволяет всем ВИЧ-положительным людям жить обычной жизнью, по продолжительности не отличающейся от человека с отрицательным ВИЧ-статусом.
Максимальное количество смертей в мире, вызванных ВИЧ, пришлось на 2004 год – 1,7 миллиона, а к 2019 году их количество сократилось на 60% и составило 690 000.
Победа? Да, но не окончательная

Кристин Ятонгу с 2006 года инфицирована СПИДом. В связи с войной лечение было прервано на 2 месяца. Сейчас она ходит в больницу Босангоа (1 час ходьбы), чтобы получить АРВ-препараты. Фото: Ton Koene / VWPics / TASS / UIG
В большинстве богатых и средне развитых стран государства берут на себя оплату ВААРТ для своих граждан, больных СПИДом. В России эти лекарства входят в список жизненно необходимых и важных лекарственных препаратов (ЖНВЛП), также оплачиваемых государством.
Несмотря на глобальные благотворительные инициативы, особенно в США и ЕС для Африки, в бедных странах люди продолжают умирать от СПИДа. На данном этапе это, как ни печально, проблема, скорее, социальная, чем медицинская.
И тем не менее, врачи и ученые не удовлетворяются достигнутым. Их работа идет сразу по нескольким направлениям.
Во-первых, они продолжают совершенствовать антиретровирусную терапию, создавая все новые препараты и даже классы препаратов.
Во-вторых, ученые работают над профилактикой заболевания.
Это, прежде всего, вакцина, разработка которой, по-видимому, подходит к концу.
Кроме того, это предэкспозиционная (доконтактная) антиретровирусная профилактика (ПрЕП), которая начала применяться в 2012 году и заключается в следующем. Половой партнер ВИЧ-инфицированного постоянно принимает препараты ВААРТ, что снижает вероятность заражения на 40-86% в зависимости от комбинации лекарств.
И, наконец, ученые всего мира не перестают стремиться к самой амбициозной цели – полному излечению пациентов от СПИДа.
Будущее уже наступает
Первым полностью излечившимся от СПИДа человеком стал Тимоти Браун, которому в 2007 году в Берлине сделали пересадку костного мозга, чтобы вылечить лейкемию.
Тимоти умер 29 сентября 2020 года, но не от ВИЧ, который не вернулся, несмотря на то, что пациент перестал принимать препараты. Вернулась лейкемия, в битве с которой 54-летний пациент, к сожалению, проиграл.
В марте 2019 года стало известно о втором в истории случае излечения ВИЧ-инфекции.
Доклад группы исследователей во главе с Равиндрой Гуптой из Кембриджского университета, подтвердивший факт полного излечения Кастильехо, был опубликован в журнале Lancet в мае нынешнего года.
Разумеется, такая терапия СПИДа не может стать широкомасштабной. При отсутствии лейкемии связанные с трансплантацией риски не оправданы, а кроме того, она требует высоких материальных издержек.
Тем не менее, кейсы Брауна и Кастильехо показывают, что полное излечение от СПИДа в принципе возможно.
Есть случаи полного излечения пациентов, начавших ВААРТ не позже 10 недель после заражения и принимавших ее в течение трех лет.
Есть несколько детей, рожденных ВИЧ-позитивными матерями и получивших препараты вскоре после появления на свет. Они остаются здоровыми и свободными от ВИЧ до настоящего момента, когда им 9–11 лет.
То, чего добилась наука уже сегодня, не может не восхищать, а значит, есть все основания с оптимизмом смотреть в будущее.
Источники:
История антиретровирусной (АРВ) терапии едва разменяла третий десяток, но это был колоссальный путь. Если в 1996 году пациентам были доступны только токсичные и малоэффективные лекарства, которые нужно было пить каждый день и горстями, то уже сейчас вовсю испытывают инъекции, способные подавлять размножение вируса на несколько месяцев. Но это на западе.
Если вы живете в России, то таблетки все еще нужно пить каждый день и (часто) горстями. Тем временем, весь мир стремительно переходит на комбинированные препараты. Сейчас их нельзя назвать революцией в терапии ВИЧ-инфекции, но комбинированные формы - их еще называют таблетками “все в одном” – определенно гораздо лучше обычной АРВ-терапиии.
Во-первых, они берут количеством: для подавления вирусной нагрузки человек принимает всего одну таблетку в день вместо четырех – восьми. Благодаря этому людям, живущим с ВИЧ, не приходится подчинять свое расписание приёму лекарств, не приходится таскать с собой мешок таблеток на случай, если ночуешь не дома, не приходится испытывать столько дискомфорта при проглатывании таблеток (да, для некоторых людей это стресс), не приходится ловить на себе косые взгляды и объяснять случайным людям особенности своего диагноза.
Приверженность к лечению – аккуратный и ежедневный прием лекарств –главное условие успешной терапии ВИЧ-инфекции. Чтобы ее достичь, таблеток в схеме должно быть меньше.
Плохая новость: в России пока недоступны все комбинированные формы, которые есть в мире. Но нужно подготовиться к тому, что когда-то они будут и у нас. Поэтому мы решили вспомнить историю таблеток “все в одном” с момента их появления.
Все больше исследований доказывают, что терапия ВИЧ-инфекции таблетками “все в одном” показывает лучшие результаты, чем схемы с несколькими таблетками, прежде всего, благодаря большей приверженности: у таких пациентов меньше случаев прерываний терапии и достоверно чаще отмечается неопределяемая вирусная нагрузка. Широкое внедрение “монорежимов” – это не прихоть, а необходимость.
Атрипла
Препарат одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США 12 июля 2006 года.
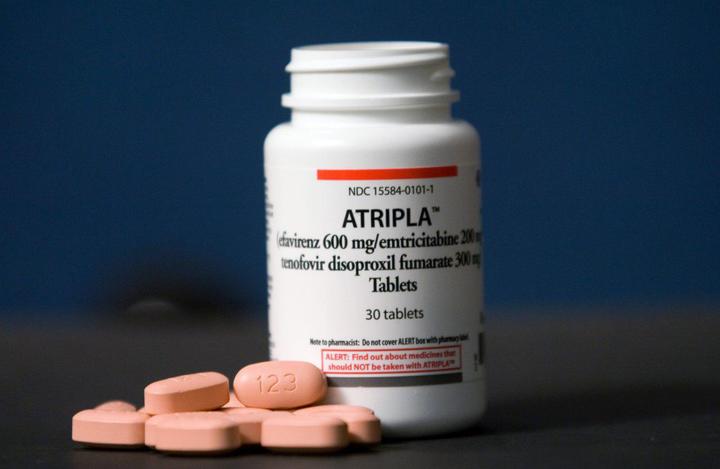
Ветеран монорежима представляет собой комбинацию из 200 мг эмтрицитабина, 300 мг тенофовира дизопроксила фумарата (TDF) и 600 мг эфавиренза. Препарат имеет ряд побочных эффектов. Среди них головокружение, головная боль, боли в животе. Длительный прием TDF может негативно влиять на состояние костей и почек. Препарат рекомендуют принимать на пустой желудок или с пищей (нежирной) – в зависимости от реакции организма. Лекарство также может взаимодействовать с другими препаратами.
Несмотря на все недостатки, Атрипла остается одним из двух препаратов “все в одном”, которые доступны в России.
Эвиплера/ Комплера
Препарат одобрен FDA в августе 2011 года.
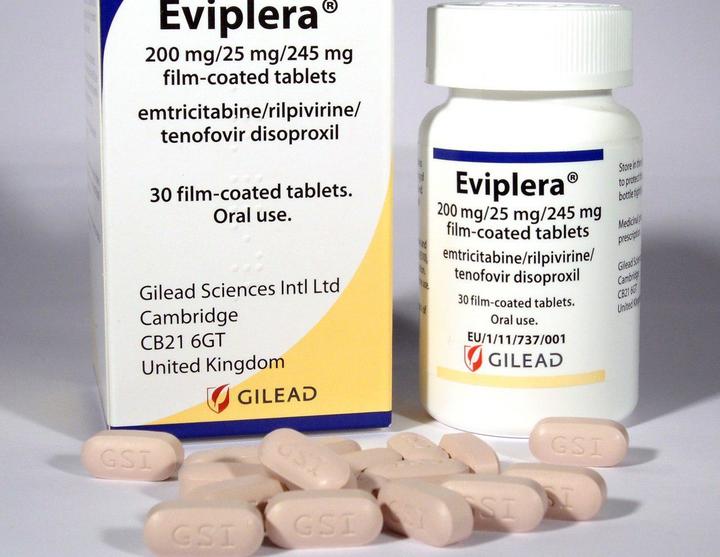
Содержит 200 мг эмтрицитабина, 300 мг TDF и 25 мг рилпивирина. Принимают с едой. Препарат подходит как для новичков, которые раньше не принимали терапию, так и для тех, кто хочет перейти на него с другой схемы лекарств.
Побочные эффекты (повышенный уровень холестерина, потеря аппетита, депрессия, слишком яркие сны, тошнота, рвота, головные боли) выражены меньше, чем у Атриплы, за счет содержания рилпивирина вместо эфавиренза.
Эвиплеру стоит с осторожностью принимать с препаратами против эпилепсии (карбамазепин, окскарбазепин, фенобарбитал), антибиотиками для лечения туберкулеза (рифампицин, рифабутин) и со зверобоем. Действие препарата также могут блокировать лекарства от изжоги (Гевискон, Ренни), препараты из группы омепразола. Поэтому пациентов настоятельно просят сообщать врачу, принимают ли они лекарства для желудка, даже если это происходит не ежедневно.
Второй и пока последний в списке препарат, доступный в России.
Стрибилд (Стрибильд)
Препарат одобрен FDA в августе 2012 года.
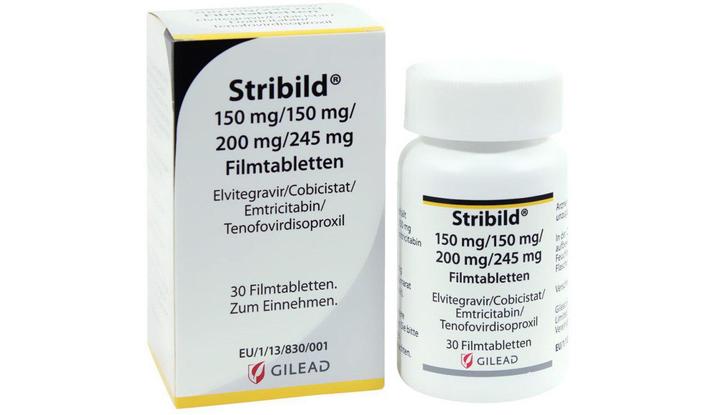
Комбинация 200 мг эмтрицитабина, 300 мг TDF, 150 мг элвитегравира и 150 мг кобицистата (препарат-бустер). Принимают один раз в день с едой.
Побочные эффекты схожи с Эвиплерой. Противопоказано пить препарат одновременно с добавками, содержащими кальций, железо, магний, алюминий или цинк. Промежуток между приемом должен составлять не менее 4 часов. Совместный прием гормональных препаратов требует консультации специалиста.
Триумек (Трайомек)
Препарат одобрен FDA в августе 2014 года.
Объединяет 50 мг долутегравира, 600 мг абакавира и 300 мг ламивудина. Лекарство нужно принимать с едой или без еды, но лучше утром, поскольку вечерний прием долутегравира может вызвать бессонницу.
Помимо стандартных побочных эффектов (сонливость, депрессия, головная боль) выделяют боли в суставах, ринит, кашель, желудочный рефлюкс и потерю аппетита. Как и Стрибилд, Триумек плохо сочетается с препаратами кальция и железа. Кроме того, абакавир и долутегравир могу вызывать аллергическую реакцию.
Генвойя
Препарат одобрен FDA в ноябре 2015 года.
Генвойя – это 200 мг эмтрицитабина, 10 мг тенофовира алафенамида (TAF), 150 мг эльвитрагравира и 150 мг кобицистата. Принимается с едой.
Побочные эффекты фактически аналогичны тем, что наблюдаются у Стрибилда, но с небольшой разницей. В составе Генвойи содержится так называемый “новый” тенофовир. При равном противовирусном эффекте и практически одинаковой цене, схема с TAF имеет значительно меньше побочных эффектов. Благодаря этому FDA исключило из аннотации к препарату предупреждение о негативном воздействии на костную ткань. Стоит отметить, что в США уже обновляют рекомендации по лечению ВИЧ-инфекции, где Стрибилд отходит на второй план как устаревший, а предпочтение отдают Генвойе.
Одефси
Препарат одобрен в марте 2016 года.
Состоит из 25 мг рилпивирина, 200 мг эмтрицитабина и 25 мг TAF. Аналог Эвиплеры/Комплеры, но с “новым” тенофовиром вместо “старого”.
Принимают один раз в день с пищей. Побочные эффекты и рекомендации по лекарственной сочетаемости аналогичны Эвиплере. Одефси, как и Генвойя, гораздо меньше влияет на состояние почек и костей за счет содержания TAF.
Не рекомендуется применять совместно с омепразолом (препарат для лечения гастрита и язвы). Кроме того, некоторые антибиотики для лечения туберкулеза могут снижать уровень TAF.
Юлука (Джулука)
Препарат одобрен FDA в ноябре 2017 года.

Первый полный безнуклеозидный режим терапии, в котором содержится только два препарата вместо трёх и более, как в стандартных схемах лечения ВИЧ-инфекции. Содержит 50 мг долутегравира и 25 мг рилпивирина. Подходит для продолжения терапии пациентов, чья вирусная нагрузка стабильно подавлена последние полгода или дольше.
Побочные эффекты те же, что и у долутегравира и рилпивирина. Но уже сейчас специалисты FDA отмечают, что токсичность препарата ниже, чем у классических схем из трех-четырех препаратов. Это связано с меньших количеством действующих веществ и отсутствием в схеме нуклеозидных (нуклеотидных) аналогов.
Перед началом приёма стоит исключить мутации вируса, которые ведут к резистентности к рилпивирину.
Биктарви
Препарат одобрен FDA в феврале 2018 года.
Содержит 200 мг эмтрицитабина и 25 мг TAF и 50 мг нового препарата под названием биктегравир. Известно, что производитель биктегравира пока не собирается выпускать его в форме отдельной таблетки – только в составе комбинированной формы.
Новый препарат считается одним из самых минимальных по количеству действующего вещества. При приеме "Биктарви" рекомендуют контролировать функцию почек.
Symfi и Symfi Lo
Препарат одобрен FDA в марте 2018 года.

Symfi включает 600 мг эфавиренза, 300 мг ламивудина и (внезапно) 300 мг TDF. Symfi Lo содержит 400 (а не 600) мг эфавиренца, 300 мг ламивудина и 300 мг TDF. Принимать рекомендуют натощак.
За счёт содержания TDF препарат может вызывать проблемы с почками и костями. У некоторые пациентов на фоне приёма препарата развивается депрессия.
У Symfi Lo лучше переносимость, благодаря меньшей дозе эфавиренза.
Symtuza
Препарат одобрен FDA в июле 2018 года.
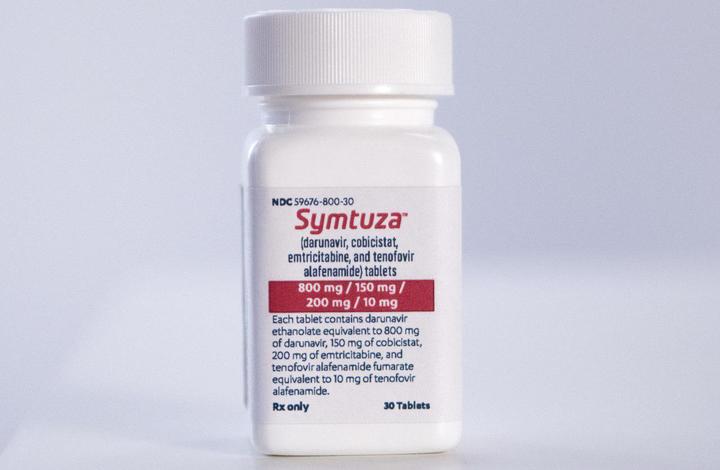
Новейший препарат включает 800 мг дарунавира, 150 мг кобицистата, 200 мг эмтрицитабина и 10 мг TAF.
Противопоказания и побочные эффекты аналогичны препаратам с теми же действующими веществами. Однако токсичное влияние на почки и скелет ниже, благодаря малому содержанию тенофовира.
При этом, кобицистат может усиливать действие других препаратов, потенциально увеличивая риск серьезных побочных эффектов.
Проведя тщательный анализ этого образца, группа ученых во главе с Майклом Уороби (Michael Worobey) из университета Аризоны показала, что этот мужчина был инфицирован ВИЧ — вирусом, вызывающим синдром приобретенного иммунодефицита.
При жизни ни сам мужчина, ни его лечащие врачи об этом не знали. Формально вирус будет открыт лишь 17 лет спустя.
Извлекая крошечные генетические фрагменты из образца ткани, команда Уороби практически полностью реконструировала геном ВИЧ в том виде, в котором он существовал в те годы. А сама работа ученого помогла пролить свет на возникновение того, что станет причиной одной из самых важных пандемий в истории человечества.
В погоне за образцами
Вирус иммунодефицита человека был выявлен в 1980-х, после того как таинственный новый синдром затронул жителей США, и, как казалось, тогда он появился из ниоткуда. На самом деле эпидемия зародилась за несколько десятилетий до этого, просто на совсем другом континенте. В Африке.
Теперь мы можем с уверенностью утверждать, что по мере распространения геном вируса претерпевал постоянные изменения: сравнивая накопившиеся мутации и оценивая время, за которое они произошли, ученые могут проследить историю эволюции вируса вплоть до самого момента возникновения.
по теме

Общество
Наиболее вероятное место его появления — южный Камерун. А приблизительное время — 1920-е годы. Именно там и тогда вирус от шимпанзе перешел к человеку, перед тем как вскоре перебраться в город, известный в наше время как Киншаса.
В густонаселенном и быстрорастущем регионе с множеством потенциальных реципиентов вирус и обосновался, чтобы затем распространиться по всему миру.
Очевидно, что огромное количество людей тогда было инфицировано ВИЧ еще прежде, чем кто-то узнал о его существовании. Образцы тканей некоторых из погибших сохранились до наших дней: они рутинно собирались для исследований патологоанатомами, обрабатывались химическим фиксатором, располагались на восковых подложках, изучались под микроскопом (скорее всего, безрезультатно), а затем отправлялись в хранилище.
Но поскольку вирус до своего появления на Западе не был идентифицирован, определить заранее, какой именно образец ткани, взятый в то время, может содержать его следы, невозможно. Искать следы вируса в таких условиях — все равно что искать иголку в тысяче стогов сена.
Более того, процесс обработки химическим фиксатором и условия хранения образцов, дошедших до нашего времени, были таковы, что негативно влияли на содержащиеся в них РНК — молекулы, составляющие геном ВИЧ.
Вирус ВИЧ под микроскопом. Компьютерная Модель.
Однако нет ничего странного в том, что за два десятилетия поисков ученым удалось найти лишь два образца со следами вируса, собранных в Киншасе в период до его открытия.
Дэвид Хо (David Ho) из университета Рокфеллера (Rockefeller University) нашел следы вируса в образце крови, взятой в 1959 году; Уороби обнаружил их в кусочке лимфатического узла из 1960 года.
В обоих случаях от молекул РНК в целом сохранилось около одного процента. Но даже этих крошечных кусочков оказалось достаточно, чтобы доказать: именно ВИЧ блуждал по Киншасе за десятилетия до его открытия, а также чтобы наметить основные вехи истории его эволюции.
В то же время, ввиду ненадежности фрагментарных свидетельств, Уороби хотел собрать геном полностью. Целиком.
Его коллеги Софи Грисилс и Том Уоттс (Sophie Gryseels and Tom Watts) для этого разработали более точную технологию извлечения РНК и применили ее к более чем 1600 образцам тканей из Университета Киншасы (University of Kinshasa). И один из них, как оказалось, действительно содержал следы вируса.
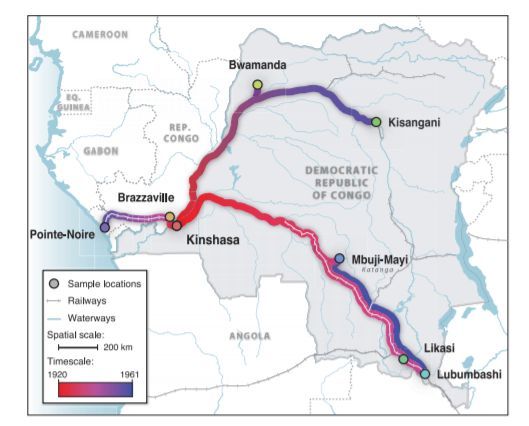
Скрытая эпидемия. Пути распространения ВИЧ в Африке до того, как вирус попал в США.
Место и время
Извлеченные образцы оказались больше всего похожи на подтип С, наиболее распространенный тип ВИЧ в Африке. Тот, что и сейчас доминирует в южной части континента.
На поверку генетический материал, попавший в руки ученых, является лишь малой частью того разнообразия, которое существовало в Киншасе в 1960-е.
А стало быть, из всех подтипов вируса лишь некоторые из тех, что в то время можно было обнаружить в городе, вырвались наружу, дабы стать общемировой проблемой.
История ВИЧ в датах
1930-е
Исследователи полагают, что приблизительно в 1930-х некая форма вируса иммунодефицита обезьян (SIV) перебралась к людям во время разделки или поедания мяса шимпанзе в Демократической Республике Конго. Этот вирус стали называть ВИЧ-1, и это самый распространенный тип вируса на сегодняшний день.
1959
Первый известный случай заболевания СПИДом выявлен при исследовании образцов плазмы крови мужчины, умершего в Демократической Республике Конго в 1959 году.
1960-е
ВИЧ-2, ареал распространения которого ограничен западной частью Африки, перешел к людям от обезьян вида дымчатый мангобей в Гвинее-Бисау в 1960-х.
Генетический анализ вируса, проведенный в 2003 году, говорит, что именно этот тип, вероятно, впервые перебрался в Соединенные Штаты примерно в 1968 году.
1970-е
На протяжении 1970-х вирус, оставаясь незамеченным, продолжает распространяться по США и остальному миру, начинается эпидемия.
1981
Высокая распространенность двух редких заболеваний — саркомы Капоши и пневмонии — отмечена среди молодых гомосексуальных мужчин в Нью-Йорке и Калифорнии в США. Это первый задокументированный случаи СПИДа. К концу года уже 121 человек умер от таинственного заболевания.
1982
Ученые центра по контролю и профилактике заболеваний (Centers for Disease Control and Prevention, CDC) в Атланте, США, предположили, что нарушение работы иммунной системы среди гей-сообщества вызвано инфекционным заболеванием. Они ввели термин Синдром приобретенного иммунодефицита (СПИД) и установили, что помимо геев в группу риска входят потребители инъекционных наркотиков, люди гаитянского происхождения и больные гемофилией. К концу 1982 года СПИД был обнаружен на пяти континентах.
1983
Эпидемия СПИДа бурно развивается в Европе: в первую очередь среди гей-сообщества, а также среди людей, имеющих тесные связи с центральной Африкой.
Начинается расследование случаев СПИДа в Руанде, Заире и других африканских странах.
1984
Используя недавно разработанные техники, в ходе нескольких исследований независимо друг от друга Люк Монтанье (Luc Montagnier) из Института Пастера в Париже (the Pasteur Institute in Paris), Франция, и Роберт Галло (Robert Gallo) из Национального института раковых заболеваний (the National Cancer Institute) в Вашингтоне, округ Колумбия, США, обнаруживают ретровирус, ответственный за развитие заболевания, известного как СПИД. Позднее он будет назван вирусом иммунодефицита человека (ВИЧ).
Случаи заболевания СПИДом все чаще начинают появляться в среде гетеросексуалов.
1985
В Атланте, США, проведена первая конференция, посвященная проблемам СПИДа.
Вслед за прошлогодним открытием вируса на рынке появляется первый метод тестирования на ВИЧ, одобренный Управлением по контролю за продуктами и лекарствами США (US Food and Drug Administration, FDA).
В США начинается тестирование крови в донорских пунктах.
1987
Азидотимидин (AZT), также известный как Зидовудин, первый противовирусный препарат, становится доступным для лечения ВИЧ после клинических испытаний. Препарат работает, блокируя действие обратной транскриптазы фермента ВИЧ, не давая вирусу размножаться в клетках. AZT замедляет развитие СПИДа, отдаляя смерть.
К 1987 году 16908 человек умерли от СПИДа в США. Всего Всемирная организация здравоохранения (ВОЗ) сообщила о 71571 случае заболевания СПИДом, из которых 47022 — в США.
По оценкам Всемирной организации здравоохранения, по всему миру носителями ВИЧ являются от 5 до 10 миллионов человек, ВОЗ запускает глобальную программу по борьбе со СПИДом.
1988
ВОЗ объявила 1 декабря всемирным днем борьбы с ВИЧ/СПИДом.
1991
Красная лента стала международным символом борьбы с ВИЧ/СПИДом.
1992
В США СПИД вышел на первое место среди причин смертности мужчин в возрасте от 24 до 44 лет.
Первые комбинированные лекарственные препараты для лечения ВИЧ появляются на рынке, после того как FDA наряду с AZT одобрило использование Zalcitabine (ddC), который также блокирует обратную транскриптазу.
Комбинированные препараты против ВИЧ оказываются более эффективными, а комплексное лечение замедляет развитие лекарственной резистентности.
1994
Использование AZT для предотвращения передачи ВИЧ от матери ребенку во время беременности рекомендовано в США. Исследование показало, что подобная терапия снижает шанс передачи вируса во время беременности до 8 %, в контрольной группе вероятность передачи составляла 25 %.
Через 12 лет после открытия вируса правительство США впервые запускает кампанию в медиа по пропаганде использования барьерных контрацептивов.
1995
ВОЗ объявила о достижении количеством зараженных миллионной отметки, всего же с начала эпидемии ВИЧ вирусом заразились более 19,5 миллиона человек.
1996
Международная инициатива по вакцинации против СПИДа (IAVI) — некоммерческая организация, базирующаяся в Нью-Йорке, — создана для ускорения поиска вакцины против ВИЧ.
90 % всех заболевших теперь проживают в развивающихся и развитых странах.
1997
Впервые благодаря появлению ВААРТ отмечено резкое падение смертности от СПИДа.
ООН объявляет, что к 2010 году 40 миллионов детей могут потерять одного или обоих родителей из-за СПИДа.
1998
Первые полномасштабные испытания вакцины против ВИЧ начинаются в США.
Две команды исследователей начинают разработку вакцин против штаммов ВИЧ, распространенных в странах Африки к югу от Сахары
В Сан-Франциско обнаружен штамм ВИЧ, устойчивый ко всем лекарственным средствам, подавляющим протеазу, которые в то время существовали на рынке. У некоторых пациентов, использующих для лечения ингибиторы протеазы, встречаются необычные побочные эффекты, такие как рост жировых отложений и проблемы с сердцем.
1999
33 миллиона человек инфицированы ВИЧ, а 14 миллионов умерли от СПИДа по всему миру.
СПИД становится одним из четырех самых массовых убийц современности.
2001
Индийская компания начинает продавать копии дорогих запатентованных лекарств против СПИДа через медицинскую благотворительную организацию в Африке. Этот шаг заставляет некоторые фармацевтические компании снижать цены.
2003
5 миллионов новых случаев СПИДа выявлены на протяжении 2003 года — самое большое количество с начала эпидемии. 3 миллиона человек умерли от СПИДа в этом же году.
2005
Около 40 миллионов человек инфицированы ВИЧ по всему миру.
Высокорезистивный штамм вируса, вызывающий быстрое развитие СПИДа, обнаружен в Нью-Йорке, США.
По оценкам ученых, сам ВИЧ возник где-то между 1896 и 1905 годом. Далеко не все вирусы так молоды. Когда ученые впервые обнаружили следы гепатита B времен Бронзового века, они подсчитали, что вирус менялся в 100 раз медленнее, чем предполагалось до этого. Открытие кардинально изменило предполагаемый период его возникновения. Даже ВИО (вирусы иммунодефицита обезьян), ближайшие родственники ВИЧ, поражающие шимпанзе, эволюционировали с разной скоростью в далеком прошлом и в новейшей истории, что делает оценку времени возникновения очень сложной.
В целом именно благодаря этому факту статистическими методами ученым удалось достаточно точно локализовать время и место начала пандемии. Установить, что с 1920-х годов именно Киншаса, ныне столица Демократической Республики Конго, стала центром первого очага эпидемии ВИЧ, а также положила начало эпидемии 1960-х годов в других частях континента.
Отсюда, из Киншасы, вирус прибыл на Гаити примерно в 1964 году. Причиной тому стало возвращение на родину жителей этого островного государства. До середины 60-х многие жители Гаити работали в только что получившем свою независимость Конго в качестве специалистов. И значительная часть гаитянских работников проживала именно в Киншасе.

Миграция из Гаити в США. Вторая половина 60-х тут наблюдается резкий рост. ВИЧ попадет в США именно в этот период.
Уже с Гаити вирус вместе с мигрантами перебрался на материк — в Соединенные Штаты Америки. Где очень быстро распространился среди гомосексуалов, воспользовавшись относительной уязвимостью перед ВИЧ именно этой группы.
Первые смерти от симптомов, крайне похожих на СПИД, будут зафиксированы здесь (преимущественно среди афроамериканских геев) уже в конце 60-х. Накануне знаменитых Стоунвольских бунтов, органично связанных с борьбой за права черного населения Америки и ставших отправной точкой эмансипации ЛГБТ-движения, завершившегося нынешней либерализаций законодательства относительной однополых браков и партнерств практически во всех западных странах.
Работа Уороби подтвердила эти и некоторые другие тезисы. Не на моделях, а на реальном генетическом материале.
Данная схема приема терапии не просто спасала жизни людей, живущих с ВИЧ (при условии доступа к необходимым услугам здравоохранения), она также восстанавливала пораженную вирусом иммунную систему, что позволило людям, принимающим высокоактивную антиретровирусную терапию (АРТ), вести нормальную и здоровую жизнь.
Однако по-прежнему оставались серьезные вызовы, такие как угроза безопасности и труднопереносимые побочные эффекты. Кроме того, необходимо было принимать большое число таблеток в разные часы в течение суток, что создавало проблемы с выполнением условий данных схем. Ситуация со временем улучшилась, и на сегодняшний день большинство ЛЖВ имеют примерно такую же продолжительность жизни, что и люди, живущие без ВИЧ.
Зачем нужно лекарство?
Тем не менее создание лекарства от ВИЧ по-прежнему является труднодостижимой задачей. Даже несмотря на наличие эффективного лечения и профилактики, лекарство от ВИЧ — важная цель. Разумеется, для ЛЖВ изобретение лекарства положит конец в пожизненной необходимости проходить терапию. На сегодняшний день будущее за препаратами долгосрочного действия, однако для 38 миллионов ЛЖВ в мире излечение стало бы идеальной целью. Мировое сообщество смогло бы приблизиться к полному искоренению ВИЧ/СПИДа и снять нагрузку с системы здравоохранения как национального, так и муниципального, и регионального уровней.
В силу этих причин целый ряд государственных деятелей, научные круги, НКО и частный сектор прилагают активные усилия по разработке безопасного и доступного лекарства от ВИЧ. По аналогии с современными схемами антиретровирусной терапии — для полного излечения от ВИЧ могут понадобиться комбинации препаратов и процедур, которые по-разному работают с вирусом. Из-за того что ВИЧ умеет коварно таиться в организме человека, создавая резервуары, не распознаваемые иммунной системой, излечение от ВИЧ может потребовать использование одной из двух основных форм либо их совместное применение (по мнению исследователей, их появление на практике состоится минимум через десятилетие). Эти два подхода носят следующие названия: 1) ремиссия без приема АРТ и 2) полное искоренение вируса.
Неопределяемые без терапии
Большинство подходов, направленных на достижение ремиссии без приема АРТ, включают в себя модификацию иммунной системы с целью установить долгосрочный контроль над вирусом. Исследователи пытаются манипулировать иммунной системой с целью заставить ее распознавать и обезвреживать зараженные ВИЧ клетки или изменять их функционирование, чтобы те лучше справлялись с инфекцией.
Перспективным методом достижения ремиссии без приема АРВТ являются нейтрализующие антитела широкого спектра действия (bNAbs). Эти белки могут предотвратить заражение человеческих клеток практически всеми штаммами ВИЧ и способствовать уничтожению уже инфицированных клеток. Несмотря на то, что такие антитела производятся организмом самостоятельно у некоторых ЛЖВ, обычно их количество слишком мало, чтобы оказать ощутимую пользу, или их выработка производится на слишком позднем сроке после заражения, в результате чего они не способны контролировать быстро размножающийся и мутирующий вирус.
В настоящее время проводятся исследования на животных и людях, принимающих АРТ, с целью определить, способны ли периодические инфузии и инъекции данных антител удерживать ВИЧ в подавленном состоянии после прекращения приема АРТ. Ученые разрабатывают варианты такого вида антител с улучшенными характеристиками, в том числе с большей эффективностью и более длительным пребыванием в организме, а также тестируют лечение комбинациями двух или трех вариантов таких антител.
Полное удаление вируса из организма
Укрепление иммунных клеток для борьбы с ВИЧ. При отсутствии необходимого лечения ВИЧ уничтожает иммунную систему большинства ЛЖВ, со временем приводя к оппортунистическим заболеваниям, связанной с ВИЧ онкологией и к смерти. Тем не менее небольшая доля ЛЖВ не принимает АРТ, при этом их вирус регулярно находится в подавленном состоянии. Каким-то образом их иммунные системы естественным путем защищают организм от вируса и его разрушительного влияния.
С этим также связан феномен людей, которые имели рискованные контакты с ВИЧ-положительными партнерами, но при этом остались не инфицированными — таким образом, их иммунная система защищает их от ВИЧ. Если у исследователей получится воссоздать аналогичный уровень резистентности организма к ВИЧ среди большинства ЛЖВ, то остановка распространения вируса и излечение будут возможными.
Пересадка стволовых клеток. В начале 1990-х ряд исследований показал, что люди с более высокой природной защитой от ВИЧ часто имели мутации в гене, который кодирует белок под названием ССR5 (этот белок возникает на поверхности иммунных клеток человека и используется вирусом для проникновения в клетку с целью дальнейшего инфицирования). Если белок CCR5 не функционирует должным образом или в принципе отсутствует, ВИЧ больше не может поглощать иммунные клетки. Если ученым удастся заблокировать функционирование ССR5 или совсем исключить появление этого белка на поверхности иммунных клеток, у них появится возможность лучше контролировать ВИЧ-инфекцию либо полностью избавить от нее организм.
По предположениям некоторых ученых, если человеку, живущему с ВИЧ, пересадят костный мозг, используя в качестве донора человека с мутацией белка ССR5, его новые клетки смогут восстановить у реципиента иммунную систему, имеющую резистентность к ВИЧ. Однако пересадка костного мозга является сложной и крайне рискованной процедурой, поэтому эту теорию можно протестировать только на тех ЛЖВ, которым жизненно необходима пересадка костного мозга для лечения тяжелой формы рака.
Браун (1996 г. р.) умер в 2020 году после рецидива рака, Кастильехо (родился в Венесуэле в 1980 г.) продолжает жить здоровой жизнью.
Главным вызовом при использовании метода генетического редактирования в клинической практике на данный момент является поиск ответа на вопрос, как доставить редактирующие гены ферменты ко всем клеткам, составляющим резервуар ВИЧ, не подвергая при этом риску безопасность пациента, — для этого необходимо проведение большего количества дополнительных исследований.
Но когда?
Читайте также:

