Комплексная терапия папилломавирусной инфекции с аллокином
Обновлено: 17.04.2024
К настоящему моменту накоплен значительный опыт использования а-, b- и у-интерферонов (ИФН) в лечении ПВИ. В большинстве исследований отмечается их невысокая активность при местном применении. Известны различные схемы и методы введения интерфероновых препаратов. Используют внутриочаговое введение ИФН-а, если плоские генитальные бородавки плохо поддаются терапии другими средствами. Назначение таким больным ИФН-а в дозе 1 млн ME приводило к клиническому излечению в 78% случаев (Гомберг М. А., 1997, 1998). В методических материалах ЦНИКВИ МЗ РФ (2003) как для внутриочагового, так и для системного применения рекомендованы большие дозы ИФН. Предлагается использовать по 1,5-3,0 млн ME ИФН 3 раза в неделю в течение 4 недель.
Рекомбинантный ИФН-а2а назначают 1-3 млн ME 3 раза в неделю подкожно в течение 1-2 месяцев или, у мужчин с перианальными остроконечными кондиломами, по 3 млн ME в день в течение 14 дней и затем 3 раза в неделю в течение 1 месяца. Рекомбинантный ИФН-а2b вводят в основание кондилом 3 раза в неделю (через день) в течение 3 недель. Одновременно проводят лечение не более 5 участков поражения. Суммарная еженедельная доза ИФН не должна превышать 15 млн ME. При отсутствии эффекта после первого курса можно провести повторный курс (Гаращенко Т. И. и др., 1993). ИФН-b (человеческий фибробластный ИФН-b) вводят в зону поражения или прилегающую область в дозе 3 млн ME в течение 5 дней в неделю на протяжении 1-3 недель.
Во время беременности видимые кондиломы часто рецидивируют, имеют тенденцию к пролиферации и становятся рыхлыми. Лечение беременных желательно проводить на ранних сроках, соблюдая особую осторожность. Рекомендуется применять только физические деструктивные методы (криотерапию и С02-лазер). Цитотоксические препараты — подофиллин, подофиллотоксин и 5-фторурацил противопоказаны для лечения беременных. Аналогичные подходы должны соблюдаться при выборе метода лечения ВПЧ-инфекции у детей.
Обследовано 124 женщины в III триместре беременности с разными субклиническими и клиническими формами ВПЧ-инфекции (Тапильская Н. Н. и др., 2006). Диагноз ставился клинически, изучение соскоба с шейки матки методом ПЦР и реакции транскрибционной амплификации NASBA-Real-time (определение клинически значимой концентрации вируса в ткани). Методом ПЦР ВПЧ выявлен у 87 (67,7%), а уточняющим методом NASBA-Real-time результаты диагностированы как клинически значимые у 41 (32,3%) беременной. Обследованы все новорожденные сразу и на 5-й день после рождения, определена цитотоксическая активность NK-клеток методом проточной цитофлюореметрии. Выявлены ВПЧ типов 6, 11, 16, 18, 31, 33, 39, 45, 56, 58, 66. Шесть из 41 (14,6%) новорожденного были инфицированы ВПЧ (6, 11, 16, 45 и 59 типы). У беременных с клинически манифестной формой ВПЧ-инфекции функциональная активность NK-клеток была достоверно сниженной.
Инфицированные беременные женщины основной группы получали препарат интерферона в виде ректальных свечей виферон-2 (500 тыс. ME интерферона-а-2b в комплексе с мембраностабилизирующими и антиоксидантными препаратами — 2,5 мг токоферола ацетата и 22 мг аскорбиновой кислоты) по 1 свече 2 раза в день 10 дней, а далее по 1 свече 2 раза в день 2 раза в неделю до родоразрешения. Виферон единственный препарат из класса рекомбинантных интерферонов, разрешенных для лечения беременных женщин. Указанную терапию ви-фероном-2 в течение 4 недель в сочетании с интравагинальным применением противовирусного препарата эпиген (синергический эффект) получили 49 беременных женщин с ВПЧ-инфекцией. В контрольной группе использовали только эпиген. Среди новорожденных основной группы инфицированных вирусом не было, в контрольной группе у 4 из 27 (14,8%) новорожденных обнаружен ВПЧ 6, 11, 33 и 59 типов. После курса лечения вифероном-2 восстановилась функциональная активность NK-клеток у беременных женщин.
Комбинированное, двухэтапное лечение папилломавирусной инфекции, когда на 1 -м этапе тем или иным способом в зависимости от выраженности и распространенности инфекционного процесса проводится разрушение папилломатозных очагов, а на 2-м этапе с целью минимизации риска рецидивирования инфекции используются имммунотропные средства, представляется наиболее перспективным. Показано, что назначение ИФН-а даже 1 раз в неделю в течение 8 недель после лазерного удаления остроконечных кондилом снижает частоту рецидивов с 24 до 7% (Klutke J. J. с соавт., 1995). Комплексное лечение распространенных кондилом электрокоагуляцией с последующим внутриочаговым и системным применением а-ИФН (1-2 раза в неделю) и лейкинферона по 10 000 ME внутримышечно, через день на курс 10-15 инъекций, значительно повышает эффективность терапии и снижает процент рецидивов (Дубинский В. В. с соавт., 1996). Снизить частоту рецидивирования ВПЧ-инфекции позволяет также назначение отечественного иммуномодулирующего препарата галавит после предварительного удаления папилломатозных элементов. Так, внутримышечное назначение этого препарата по следующей схеме: 200 мг — первый день, 100 мг — второй день, а с третьего дня по 100 мг через 48 часов, всего от 10 до 15 инъекций, в сочетании с местным назначением 1% мази галавит у 50% больных с изначально рецидивирующим течением заболевания позволяет снизить частоту рецидивирования до 12% (Ермоленко Д. К., Исаков В. А., 2003).
Хороший эффект получен при комбинированном лечении кондилом урогенитального тракта с использованием криодеструкции, затем местно наружную лекарственную форму на косметической эмульсионной основе, содержащей рекомбинантный ИФН-у для стимуляции местного клеточного иммунитета и снижения процессов пролиферации в очагах поражения (Богатырев И. И. и др., 1996). Несмотря на низкую эффективность интерферонотерапии считают, что местное и системное использование интерферонов повышает восприимчивость (чувствительность) опухолевых клеток к интерферону.
Отдельные авторы рекомендуют локальное удаление очагов папилломавирусной инфекции производить не ранее чем через 2-3 недели после окончания системной противовирусной терапии, поскольку возможно полное исчезновение кондилом или их значительное уменьшение в количестве и размерах только на фоне правильно подобранной системной терапии (Дубенский В. В., 1996; Семенов А. В., 2005).
При остроконечных кондиломах по 2 т. изопринозина 3 раза в день в течение 14-28 дней в качестве монотерапии. При комбинированном лечении с лазерной терапией С02 либо солкодермом — по 2 т. 3 раза в день в течение 5 дней, проводят 3 курса с интервалом 1 месяц. Комбинированное лечение кондиломы цервикса и вульвовагины у 64 больных изопринозином с лазерной терапией после первого курса сопровождалось выздоровлением 93%, в контрольной группе в 68% случаев. Терапия свыше 14 дней предполагает контроль содержания мочевой кислоты и трансаминаз в сыворотке крови. Возможно использование изопринозина в сочетании с ИФН. В случае вульгарных бородавок рекомендуется по 500 мг изопринозина 3 раза в день в течение 10 дней, повторные курсы проводят с интервалом в 1 месяц (Димтриев Г. А., Биткина О. А., 2006).
Галавит (активный компонент — производное фталгидразида) — новый иммуномодулирующий и противовоспалительный препарат, ампулы по 0,1 г. После обработки папиллом вводят внутримышечно по следующей схеме: 200 мг — первый день, 100 мг — второй день, а с третьего дня по 100 мг через 48 часов; курс 10-15 инъекций в сочетании с местным назначением 1% мази галавит у 50% больных с изначально рецидивирующим течением заболевания позволяет снизить частоту рецидивирования до 12% (Ермоленко Д. К., Исаков В. А., 2003).
Аллокин-алъфа — отечественный антивирусный препарат нового типа. Действующим веществом препарата является цитокиноподобный пептид аллоферон. Аллокин-альфа относится к иммунотропным лекарственным препаратам. Его действие направлено на усиление распознавания вирусных антигенов и инфицированных клеток натуральными (естественными) киллерами, нейтрофилами и другими эффекторными системами естественного иммунитета, ответственными за элиминацию вируса. Аллокин-альфа усиливает продукцию интерферона-у (ИНФ) НК-клетками в ответ на стимуляцию ИЛ-12 (Ершов Ф. И. и др., 2003). В отличие от известных индукторов ИФН, аллокин-альфа выступает в качестве кофактора, позволяя продуцирующим ИНФ-а лейкоцитам эффективно реагировать на вирусный антиген. Это дает возможность сфокусировать эффект препарата в месте размножения вируса и избежать избыточной реакции лейкоцитов за пределами очага инфекции.
Больным назначают 3-5 подкожных инъекций аллокина-альфа в дозе 1 мг с интервалом в один день. С интервалом 1 месяц возможно еще 2 курса препарата. Перспективно сочетанное использование аллокина-альфа с ИФН (свечи виферон-3), 5% линиментом циклоферона.
Алломедин (ООО Аллофарм) — гидрогель для наружного применения, предназначенный для лечения и профилактики заболеваний кожи, вызываемых вирусами простого герпеса и папилломы человека, а также для ускорения регенерации поврежденных участков кожи. Основным действующим компонентом алломедина является синтетический пептид аллоферон-3. Аллофероны — новая группа иммунотропных антивирусных препаратов природного происхождения, обладающих антипролиферативной активностью. Действие аллоферонов направлено на усиление распознавания вирусов и инфицированных ими клеток естественными киллерами, нейтрофилами и другими эффекторами естественного иммунитета. Аллоферон-3 представляет новое поколение аллоферонов, созданное с использованием методов протеомики на базе аллоферона-1 (аллокин-альфа). 8 больных женщин с ВПЧ-инфекцией шейки матки (16 и 18 тип) получали аппликации алломедина в виде монотерапии 1 раз в день в течение 3 дней, а 50 пациенткам дополнительно с алломедином еще назначались подкожно 3 инъекции аллокина-альфа ежедневно. После лечения вирус не определялся в 94-100% случаев, клиническая эффективность отмечена у 95% пролеченных больных (Черныш С. И. и др., 2005).
В настоящее время за рубежом для лечения аногенитальных папиллом рекомендуют использовать новый иммуномодулятор имиквимод (и резиквимод — более сильный аналог имиквимода), стимулирующий выработку прежде всего а-интерферонов. Препарат применяется в виде 5% крема, который наносится на очаги поражения 3 раза в неделю, что приводит к исчезновению кондилом и заживлению без образования рубцов (Tyring S. et al., 1997). После завершения успешного лечения у пациентов имеется тенденция становиться устойчивыми к появлению бородавок, что предполагает формирование иммунной памяти (Miller R. L. с соавт., 2002).
Вакцины. Ведется работа по созданию вакцин для профилактики и лечения ПВИ у человека. Считают, что вирусоподобные частицы могут защищать от первичного инфицирования, однако маловероятна их протективная роль при хронических папилломатозах. Предполагается вакцинация девочек до начала половой жизни. Наиболее перспективными мишенями для конструирования терапевтических вакцин являются онкобелки Е6 и Е7, поскольку они экспрессируются в тканях рака шейки матки и развитие опухоли обусловлено их присутствием. Ученые работают над созданием белковых вакцин Е6 и Е7, поскольку продемонстрирован цитотоксический иммунитет, индуцируемый рекомбинантным белком Е7 ВПЧ-16. Эта вакцина эффективна в отношении ВПЧ-18, а также ВПЧ-6 и ВПЧ-11, с которыми связывают развитие остроконечных кондилом (Шахова Н. М. и др., 2006).
Индукция иммунитета может быть достигнута использованием для вакцинации очищенной ДНК. Поэтому при конструировании ДНК вакцин используются вирусы осповакцины, аденовирусы, ВПГ. Технологическое производство таких вакцин легче, чем выделение белков. Препарат ДНК вакцины может содержать несколько рекомбинантных плазмид, кодирующих необходимый набор полипептидов, обеспечивающих иммунную реакцию.
Таким образом, ни один из методов лечения ВПЧ-инфекции не является безупречным, так как при использовании любого из них возможно рецидивирование инфекционного процесса. По-видимому, в ряде случаев (профилактика рака шейки матки) более эффективной может быть вакцинация, однако придется найти ответы на многие вопросы, прежде чем новые технологии будут внедрены в клиническую практику (Villa L. L., 2003).
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Владелец регистрационного удостоверения:
Произведено:
Коды АТХ
- J05AX (Прочие противовирусные препараты)
- L03A (Иммуностимуляторы)
Лекарственная форма
Форма выпуска, упаковка и состав препарата Аллокин-альфа
Лиофилизат для приготовления раствора для п/к введения в виде порошка или пористой массы белого цвета; гигроскопичен.
| 1 амп. | |
| аллоферон (гистидил-глицил-валил-серил-глицил-гистидил-глицил-глутаминил-гистидил-глицил-валил-гистидил-глицин) | 1 мг |
1 мг - ампулы бесцветного стекла (3) - упаковки ячейковые контурные (1) - пачки картонные.
1 мг - ампулы бесцветного стекла (3) - упаковки ячейковые контурные (2) - пачки картонные.
Фармакологическое действие
Противовирусное средство - олигопептид (гистидин - глицин - валин - серин - глицин - гистидин - глицин - глутамин - гистидин - глицин - валин - гистидин - глицин), по фармакологическому действию близок к интерферону альфа.
Является эффективным индуктором синтеза эндогенных интерферонов и активатором системы естественных киллеров, способен стимулировать распознавание и лизис дефектных клеток цитотоксическими лимфоцитами. В экспериментах продемонстрирована высокая эффективность в отношении инфекций, вызываемых вирусами гриппа А и В, гепатита В и С, герпеса 1 и 2 типов и папилломы человека (онкогенные типы).
Не обладает общей токсичностью, аллергенными свойствами, мутагенным и канцерогенным действием, не оказывает эмбриотоксического действия и не влияет на репродуктивную функцию.
Фармакокинетика
Быстро проникает в плазму крови, где взаимодействует с иммунокомпетентными клетками. Определение концентрации затруднено близким структурным сходством его метаболитов с белками сыворотки крови. Повышение концентрации интерферона отмечалось через 2 ч после введения и сохранялось на высоком уровне (2-2.5 раза выше обычного фонового) на протяжении 6-8 ч с достижением исходных значений к концу суток. Повышенная функциональная активность естественных киллеров наблюдалась в течение 7 дней после введения данного средства.
Показания активных веществ препарата Аллокин-альфа
Хронический рецидивирующий герпес 1 и 2 типов, в составе комплексной терапии среднетяжелой (желтушной) формы острого гепатита В.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Для п/к введения.
Разовая доза 1 мг. Схема лечения зависит от показаний к применению.
Побочное действие
Противопоказания к применению
Гиперчувствительность, выраженные аутоиммунные заболевания; беременность, грудное вскармливание (на время лечения прекращают); детский возраст.
Применение при беременности и кормлении грудью
Применение у детей
Особые указания
При монотерапии данное средство рекомендуется применять для лечения папилломавирусной инфекции, вызванной онкогенными типами вируса, при отсутствии клинических и субклинических поражений шейки матки и аногенитальной области.
В составе комплексной терапии - для лечения клинических и субклинических форм поражений шейки матки и аногенитальной области папилломавирусной инфекцией, вызванной онкогенными типами вируса.
Лечение хронического рецидивирующего герпеса 1 и 2 типов рекомендуется начинать при появлении самых первых признаков заболевания. При гепатите В - не позднее 7 дня от начала появления желтухи.
Влияние на способность к управлению транспортными средствами и механизмами
При возникновении головокружения необходимо воздержаться от управления автомобилем и работы с техникой.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
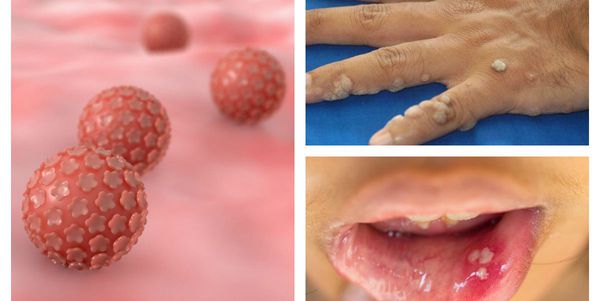
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
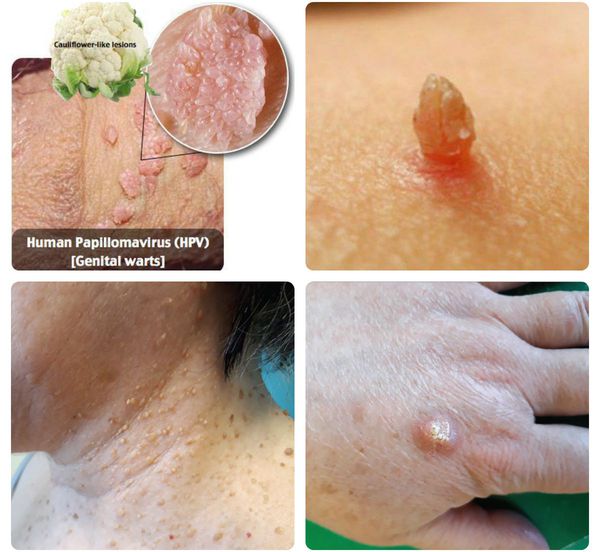
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
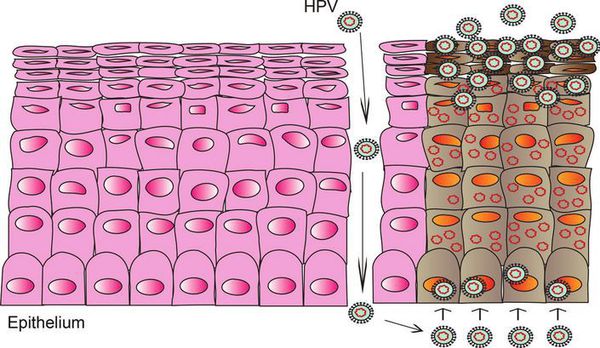
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
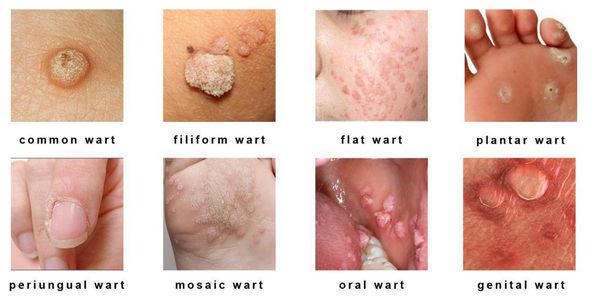
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
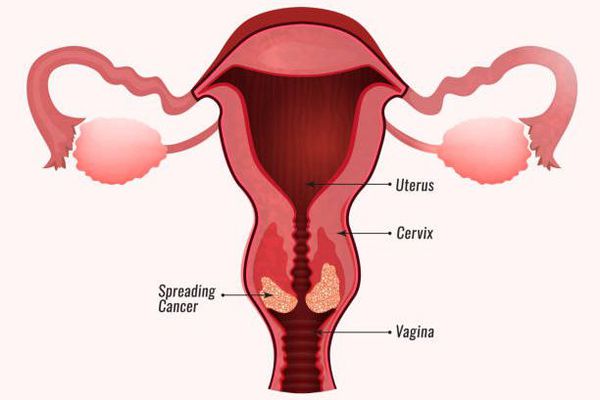
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
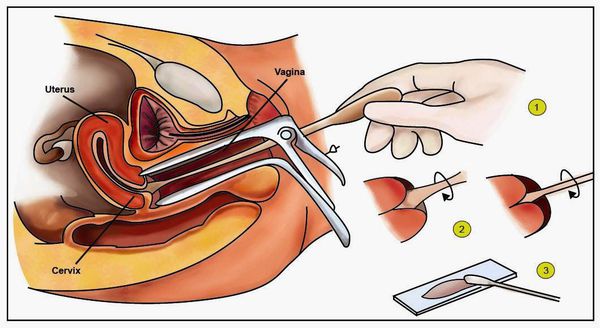
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
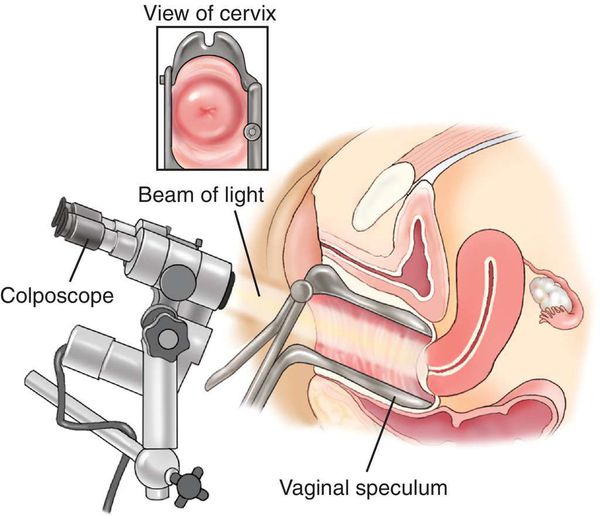
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
М.А.Гомберг, д.м.н., профессор, А.М.Соловьев, к.м.н., доцент, МГМСУ, Москва
В последнее время папилломавирусная инфекция привлекает особое внимание в связи с ролью этой группы вирусов в развитии рака. В 2008 г. Нобелевской премией по медицине было отмечено доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки. По Handley J.M., et al. (1994), к ВПЧ-поражениям относят: клинические формы — аногенитальные бородавки (остроконечные кондиломы, вульгарные бородавки), симптоматические внутриэпителиальные неоплазии на ранних стадиях при отсутствии дисплазии (плоские кондиломы); субклинические формы — бессимптомные внутриэпителиальные неоплазии при отсутствии дисплазии; латентные формы (отсутствие морфологических или гистологических изменений на фоне обнаружения ДНК ВПЧ).
Лечение аногенитальных ВПЧ-поражений, согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, должно быть направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией — CDC, Европейских рекомендациях, рекомендациях ВОЗ, и в том числе в рекомендациях РОДВ, приведен именно такой подход.
Роль вирусов папилломы человека (ВПЧ) в развитии множества доброкачественных и злокачественных новообразований кожи и слизистых оболочек не вызывает сомнений. Полагают, что все 500тыс. случаев рака шейки матки, ежегодно диагностируемые в мире, вызваны генитальной ВПЧ-инфекцией (Bulletin Word Health Organization, 2007).
В различных клинических рекомендациях и протоколах подробно описываются методы лечения именно клинических проявлений ВПЧ, но обходится стороной вопрос так называемого вирусоносительства или бессимптомного выделения вируса. Причем вопросу тактики врача при бессимптомном выделении вируса у пациента ВПЧ уделяется мало внимания не только в практических рекомендациях, но и в научно-исследовательской литературе.
Мы предлагаем свой подход к этой проблеме.
Прежде всего мы исходим из того, что наш долг — ставить во главу угла интересы пациента. Если он встревожен наличием ВПЧ и желает избавиться от этой инфекции, мы должны постараться успокоить его и обсудить все имеющиеся в настоящее время возможности лечения. В противном случае нам будет трудно рассчитывать на доверие с его стороны.
Мы считаем, что такое обсуждение должно состоять из 3 частей.
1. Информирование пациента относительно характера течения и последствий инфекции.
2. Методы профилактики рака шейки матки (при выявлении вируса у женщин).
3. Возможности воздействия на ВПЧ с целью его элиминации.
1. ИНФОРМИРОВАНИЕ ПАЦИЕНТА
При первом же визите необходимо рассказать человеку о возможных рисках, связанных с инфицированием ВПЧ. Однако консультирование нужно проводить очень осторожно, чтобы не спровоцировать у человека развитие психоневроза и канцерофобии.
Пациент с выявленным ВПЧ должен знать о своей потенциальной заразности для неинфицированных лиц, поэтому ему надо рекомендовать использовать презерватив при половых контактах и обязательно информировать своего полового партнера о вирусоносительстве.
Следует проинформировать пациентов о том, что возможно самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
2. ПРОФИЛАКТИКА РАКА ШЕЙКИ МАТКИ (ПРИ ВЫЯВЛЕНИИ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА У ЖЕНЩИН)
Всем женщинам, инфицированным ВПЧ, следует провести кольпоскопическое исследование, в том числе с окраской раствором Люголя или раствором уксусной кислоты, а также цитологические тесты по Папаниколау. Периодичность обследований обсуждается с гинекологом в зависимости от степени онкогенности выявленных вирусов и результатов кольпоскопии и цитологии. Цитологические исследования следует проводить не реже, чем 1 раз в 6 месяцев. Для женщин старше 26 лет этот подход является практически единственным способом профилактики рака шейки матки.
Имеются публикации об эффективности российского препарата индинол для профилактики рака шейки матки у женщин, инфицированных ВПЧ. Однако контролированных плацебо-исследований не проводилось.
3.ВОЗДЕЙСТВИЕ НА ВПЧ
Наиболее дискуссионным является вопрос о воздействии на выделение вируса, поэтому остановимся на нем подробнее. Врач, безусловно, должен информировать пациента о том, что в настоящее время нет методов, позволяющих достоверно и с высокой степенью вероятности устранить вирус из организма.
Необходимость проведения лечебных мероприятий обсуждается индивидуально с каждым пациентом. Желательно, чтобы врач принимал решение о проведении лечения с целью устранения ВПЧ в отсутствие клинических проявлений только после подписания пациентом информированного согласия, во избежание возможных последующих недоразумений.
Теоретически, учитывая локализацию вируса в эпителиальных клетках и то, что происходит постоянное слущивание эпителия, можно предположить, что ВПЧ может исчезнуть вместе со старыми эпителиальными клетками. Видимо, именно этим объясняются случаи самопроизвольного исчезновения ВПЧ. Между тем очевидно, что элиминации ВПЧ из организма с гораздо большей эффективностью можно добиться при активизации противовирусного иммунитета, ингибирующего размножение ВПЧ и его внедрение в другие клетки. Доказать возможность достижения такого результата на практике можно только путем проведения соответствующих специальных исследований.
Потенциально возможны 3 способа инфицирования: от матери к ребенку (трансплацентарно; во время родов, в том числе путем кесарева сечения; возможно — через слюну или грудное молоко), посредством передачи вируса воздушно-капельным или контактно-бытовым путями. Cчитается, что ВПЧ-инфекция передается в основном половым путем, что объясняет ее широкую распространенность среди сексуально активного населения. В частности, в США ежегодно диагностируют 6,2 млн новых случаев генитальной ВПЧ-инфекции (Steinbrook R., 2006).
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность. Этого можно достичь как неспецифическими, так и специфическими методами.
К неспецифическим относят различные способы укрепления защитных сил организма, так называемый здоровый образ жизни: правильное питание, профилактический прием витаминов, биологически активных добавок.
Отдельный вопрос — проведение гомеопатического лечения. Но поскольку об этих способах часто упоминается в научно-популярной литературе, в рамках данной статьи мы их комментировать не будем.
Установлено, что при применении интерферонов снижается количество вирусной ДНК (по данным ПЦР) у пациентов в очагах поражения [Arany I., et al., 1995].
Интерферон применяют местно и системно (подкожно, внутримышечно, внутривенно или ректально).
В большинстве исследований была показана невысокая эффективность наружного применения интерферона [Keay S., et al, 1988] при наличии клинических проявлений, а при лечении больных с субклиническими очагами ВПЧ-инфекции и цервикальных неоплазиях (ЦИН) были получены обнадеживающие результаты [Gross G., 1996].
По данным различных авторов, при системном применении альфа-интерферона в дозе от 1,5 до 3 млн МЕ внутримышечно или подкожно через день в течение 4 недель в качестве монотерапии у 11—100% пациентов наблюдается полное исчезновение бородавок [Gross G., et al., 1986; Zwiorek L., et al., 1989], что свидетельствует о возможном ингибирующем влиянии препаратов интерферонов на ВПЧ.
При системном применении интерферонов побочными эффектами обычно являются гриппоподобные состояния, выраженность которых зависит от полученной дозы [Handley, et al., 1994]. Эти побочные явления можно ослабить приемом нестероидных противовоспалительных препаратов.
Считается возможным самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
На российском рынке представлен широкий выбор интерферонов различных производителей, как отечественных, так и зарубежных, — генферон, виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и т.д. Предпочтительнее назначать рекомбинантные, а не человеческие интерфероны.
При назначении интерферонов надо учитывать не только частые побочные реакции, но и то, что их введение может подавлять синтез собственных эндогенных интерферонов. Поэтому в отсутствие клинических проявлений интерфероны применяют только в том случае, когда о целесообразности такого назначения свидетельствуют результы исследования иммунного статуса. Следует также отметить и высокую стоимость качественных препаратов интерферона.
Воздействовать на противовирусный иммунитет можно с помощью индукторов эндогенного интерферона и других активаторов иммунитета. На российском фармацевтическом рынке представлено много иммуноактивных препаратов, которые, согласно инструкции производителя или рекомендациям исследователей, можно применять для комбинированного лечения аногенитальных бородавок (в сочетании с различными деструктивными методами). На основании этого их можно рекомендовать для противовирусной терапии при отсутствии клинических проявлений.
Гепон — синтетический олигопептид, состоящий из 14 аминокислотных остатков, относится к группе иммуномодуляторов. Препарат показан для повышения эффективности иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами. Гепон оказывает иммунофармакологическое и противовирусное действие:
У больных с ослабленной иммунной системой гепон:
Так, например, после удаления очагов ВПЧ-поражений любым деструктивным методом, аппликации гепона (от 3 до 6 аппликаций через день) позволяют ускорить процесс заживления и снизить уровень рецидивирования. Системно препарат применяют по 2 мг перорально 3 раза в неделю. Курс можно повторять с интервалом в 1 неделю [Соловьев А.М., 2003].
Изопринозин (инозин пранобекс) — противовирусное средство с иммуномодулирующими свойствами. Препарат, индуцируя созревание и дифференцирование Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках, нормализует дефицит или дисфункцию клеточного иммунитета. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Препарат повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (IL-2), регулирует экспрессию рецепторов IL-2, существенно увеличивает секрецию эндогенного γ-интерферона и уменьшает продукцию интерлейкина-4 в организме. Изопринозин усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов. Кроме этого, он оказывает прямое противовирусное действие, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной и-РНК. Одним из показаний для применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
Для женщин старше 26 лет цитологическое исследование слизистой шейки матки, проводимое 2 раза в год, является практически единственным способом профилактики рака шейки матки.
В литературе описаны различные схемы и результаты применения изопринозина.
При инфекциях, вызванных ВПЧ, изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству на протяжении 14—28 дней для пациентов с низкой степенью риска или 5 дней в неделю последовательно в течение 1—2 недель в месяц в течение 3 мес для пациентов с высокой степенью риска.
Известно о зарубежном опыте применения инозин пранобекса в качестве терапии, дополняющей деструкцию аногенитальных бородавок [Davidson-Parker J., et al., 1988]. Препарат назначали по 1 г 3 раза в сутки в течение 14—28 дней.
В работе Забелева А.В. и соавт. (2005) показано исчезновение атипичного эпителия у женщин с ВПЧ-ассоциированными плоскоклеточными интраэпителиальными поражениями низкой степени после проведения курсов лечения изопринозином. Препарат назначали по 1 грамму 3 раза в сутки в течение 5 дней, 3 курса с интервалом в 1 месяц. В исследовании, проведенном Sun Kuie Tay (1996), показаны аналогичные результаты — улучшение морфологической картины эпителия вульвы. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, тогда как в группе, принимавшей плацебо, только у 16,7%. О прекращении выделения ВПЧ у 65,6% больных после проведения комбинированной терапии (изопринозин + деструкция очагов) ЦИН низкой степени сообщает Прилепская В.Н. (2007). При использовании только деструкции очагов этот результат был достигнут у 46,9% больных. Изопринозин назначали за 7—10 дней до проведения деструкции по 1 г 3 раза в сутки в течение 5 дней. В исследовании Шевниной И.В. (2009) показаны похожие результаты — прекращение выделения ВПЧ у 77% больных при комбинированной терапии женщин с ЦИН и аногенитальными бородавками. Изопринозин назначали по 1 г 3 раза в сутки в течение 10 дней, затем по 0,5 г 3 раза в сутки в течение 20 дней.
Для решения поднятой в этой статье проблемы интересным является факт прекращения обнаружения ВПЧ из очагов поражения в ходе проводимой комбинированной терапии с применением иммуномакса. При проведении вирусологического обследования пациентов до лечения в среднем у 70% выявлялся ВПЧ в очагах поражения. После проведенного комбинированного лечения в ходе контрольного наблюдения у 45% больных было отмечено прекращение выделения ВПЧ [Перламутров Ю.Н. и соавт., 2003]. Полученные результаты свидетельствуют, что проведение терапии иммуномаксом влияет на противовирусный иммунитет и приводит к прекращению не только рецидивов, но и выделения ВПЧ из очагов поражения. В связи с этим в перспективе иммуномакс можно будет использовать не только для лечения остроконечных кондилом, но и для предотвращения вирусовыделения у больных без клинических проявлений инфекции.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ С ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ
Панавир — растительный полисахарид, полученный из растения Solanum tuberosum, относится к классу высокомолекулярных гексозных гликозидов сложного строения с молекулярной массой 1000 кД. В настоящее время в России он является одним из самых популярных препаратов, использующихся для противовирусной терапии. Причем лечение папилломавирусной инфекции является лишь одним из показаний к его применению.
После однократной инъекции панавира в 2,7—3 раза повышается уровень лейкоцитарного интерферона, что соответствует воздействию терапевтических доз интерферона [Колобухина и соавт., 2005].
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность.
Со степенью распространенности неопластического процесса связывают эффективность препарата в отношении прекращения вирусовыделения [Иванян А.Н. и соавт., 2004]. Так, после проведения комплексного лечения у пациенток с 1-й степенью распространенности процесса вирус не выявлялся в 90,5%, при 2-й степени — в 71,1%, при 3-й степени — в 39,6%, при 4-й степени — в 9,4% случаев. Достоверное снижение вирусной нагрузки с 398,2 RLU до 176,2 RLU (p<0,05) через 1 месяц после окончания монотерапии панавиром ВПЧ-инфекции отмечает Мелехова Н.Ю. (2005).
Продолжаются исследования противовирусной активности панавира с целью установления мишени, объясняющей его высокую противовирусную активность, а также по расширению показаний к его применению. Но уже сейчас можно говорить о том, что он является одним из наиболее перспективных противовирусных агентов с доказанным иммуномодулирующим действием.
В этой статьей мы начали дискуссию о целесообразности попытки устранения папилломавирусной инфекции при отсутствии ее клинических проявлений. Существующие рекомендации по наблюдению таких пациентов могут не удовлетворить тех из них, которые хотели бы получить квалифицированную помощь в устранении этой инфекции. Поэтому мы предлагаем 3-х этапную тактику ведения таких больных: консультирование, цитологический контроль у женщин и использование противовирусных препаратов с иммуномодулирующим действием.
При папилломавирусной инфекции, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния (ИДС), обусловленные недостаточностью различных звеньев иммунной системы, поэтому для повышения эффективности лечения в схемы терапии необходимо включать кроме противовирусных (системно и местно) и иммунокорригирующие препараты, а также патогенетические средства (системная энзимотерапия, антиоксиданты, про- и пребиотики), которые облегчают состояние пациента и способствуют более действенному применению используемых лекарств. При сочетании ПВИ с другими возбудителями проводится комплексное лечение с использованием этиотропных препаратов в отношении конкретных возбудителей в стандартных дозировках. Показано, что современное лечение не позволяет избежать рецидивирования ПВИ в 20-30% случаев (Беляковский В. Н., 2003; Ван Крог Д. и др., 2002).
В последнее время стали известны особенности иммунного ответа организма человека в случае инфицирования вирусами папилломы. Известно, что вирусами папилломы не инфицируются антиген-презентирующие клетки (АПК), избегая тем самым прямого пути активации иммунитета. Ранние вирусные белки ВПЧ локализуются в основном в ядре инфицированных клеток, и у больных с ВПЧ-индуцированной дисплазией регистрируется очень слабый иммунный ответ на эти белки. В то же время ранние белки ВПЧ синтезируются активно и индуцируют процессы малигнизации инфицированных клеток. Поздние гены ВПЧ содержат кодоны, которые очень редко используются млекопитающими. За счет этого синтез капсидных белков ВПЧ протекает медленно и в малых количествах, тормозя развитие противовирусного иммунитета. Таким образом, в процессе эволюции сложился механизм, при котором вирусная инфекция на молекулярном уровне защищается от системного воздействия иммунитета хозяина (Schwarts S., 2000). У больных ПВИ отмечается снижение показателей Т-клеточного звена иммунитета, иммунорегуляторного индекса (CD4/CD8), количества клеток Лангерганса и иммунного ответа цервикальных лимфоцитов. Снижена функциональная активность натуральных киллеров (NK), уровень основных сывороточных иммуноглобулинов. Содержание ЦИК в периферической крови увеличено, что коррелировало с распространенностью и тяжестью процесса. Дисбаланс иммунной системы обосновывает использование в комплексной терапии ПВИ иммунокорригирующих препаратов. Предполагается, что чувствительность ВПЧ к отдельным химиопрепаратам обусловлена прежде всего генетически запрограммированными особенностями иммунного ответа при этой патологии. Длительное использование для лечения ВПЧ-ассоциированных заболеваний препаратов ИФН-а2 более чем у 50% пролеченных пациентов не приводит к клиническому улучшению в связи с резистентностью инфицированных клеток к ИФН. Оказалось, что это явление напрямую связано с уровнем синтеза онкобелка Е7, который нейтрализует противовирусную и противоопухолевую активность ИФН-а2 за счет избирательного блокирования большинства генов, индуцируемых интерфероном, существенно снижая эффективность интерферонотерапии (Nees M. и соавт., 2001). Установлена также способность белка Е7 внутриклеточно инактивировать фактор регуляции активности интерферона (IRF), являющегося фактором транскрипции и активирующегося в клетках под воздействием на них ИФН-а и ИФН-b, и, в свою очередь, включает транскрипцию генов, кодирующих синтез противовирусных белков. Онкобелок Е7 является мощным иммуносупрессором, значительно снижающим эффективность иммунокорригирующей терапии. Иными словами, причиной неудач терапии ВПЧ-инфекции препаратами интерферона является определяемая онкобелком Е7 устойчивость зараженных клеток в процессе лечения, из чего следуют важные выводы для клинической практики (Киселев В. И., 2004):
- местная интерферонотерапия остается важным методом лечения ВПЧ-ассоциированных заболеваний;
- измерение содержания белка Е7 ВПЧ является необходимым условием для назначения терапии и прогнозирования ее эффективности;
- в случае высокого содержания Е7 необходимы мероприятия по его снижению, что сделает опухолевые клетки более воспримчи-выми к интерферону.
Таким образом, лечение ПВИ остается довольно трудной задачей, несмотря на значительный арсенал средств и методов терапии. Поскольку полного излечения к настоящему времени достичь невозможно, считают, что целью проводимых лечебных манипуляций должна быть не элиминация возбудителя, а перевод инфекции в стадию устойчивой ремиссии (клинического выздоровления). В связи с этим предлагается следующая тактика ведения пациентов с ВПЧ-инфекцией (Беляковский В. Н., 2003):
1) разрушение папилломатозных очагов; 2) стимуляция противовирусного иммунитета, т. е. коррекция общего и местного иммунитета; 3) сочетание этих подходов, устранение факторов, способствующих рецидивам болезни. Важно помнить, что методы лечения, направленные на удаление поверхностного слоя эпидермиса без санации клеток базального слоя, неэффективны и сопровождаются рецидивом заболевания. Возможность реактивации инфекции диктует необходимость применения комбинированных методов лечения: деструкции видимых проявлений и использование (системно и местно) препаратов с противовирусной и иммуномодулирующей активностью (табл. 7, 8).
Таблица 7. Местные методы терапии остроконечных кандилом
| Деструктивные методы | Цитотоксические препараты | |
| Физические | Хирургическое иссечение | Подофиллин |
| Электрохирургические методы | Подофиллотоксин | |
| Криотерапия | 5-фторурацил | |
| Лазеротерапия | ||
| Химические | Азотная кислота | |
| Трихлоруксусная кислота | ||
| Солкодерм (уксусная + щавелевая + молочная + азотная кислоты + ионы металлов) | ||
| Ферезол | ||
Таблица 8. Принципы терапии кондилом
| Методы терапии | Средства для лечения |
| Противовирусные препараты | Мазь бонафтона 0,5-1-2% и риодоксола — 0,25 и 0,5%. Наносить 5-6 раз в день, 2-3 нед. Мазь 2% бонафтона + 0,5% риодоксола Бонафтон внутрь по 0,2 г 3 р. в день, 10 дней. 3% мазь оксолиновая, 2-3 нед. Индинол, по 2 капсулы 2 раза в день натощак, за 10 минут до еды в течение 3 месяцев |
| Цитотоксические препараты, местно | Подофиллин в виде 10-25% раствора, 1-2 р.в нед., 5 недель. Подофиллотоксин (кондилин) 2 раза в сутки в течение 3 дней с 4-дневным перерывом, повторять до 4 раз. 20% мазь подофиллотоксина. 5-фторурацил в виде 5% крема 1 раз на ночь 7 дней, или 1 раз в неделю в течение 10 недель |
| Деструктивные методы | Физические (криодеструкция, лазеротерапия, диатермокоагуляция). |
| Хирургические методы | Химические (80-90% трихлоруксусная кислота, ферезол — 1 раз в нед., солкодерм — излечение 80-90%) В т. ч. и электрохирургическое иссечение |
| Иммунологические методы | а-, b-, y-интерфероны, индукторы ИНФ, рекомбинантные ин-терлейкины (ИЛ-2, ронколейкин). Изопринозин (табл. 0,5) по 1,0 г 3 р./день, 2-4 нед. как основное лечение. Либо лазеротерапия+изопринозин по 2 табл. 5 дней, 3 курса с интервалом 1 мес. Ликопид табл. по 10 мг/день, 6 дней. 3 курса с интервалом в 2 нед. Галавит в/м., 1-й д. — 200 мг, 2-й день — 100 мг, с 111 дня — по 100 мг через день, № 10-15. 12,5% циклоферон в/м по 2 мл (250 мг) по схеме 1, 2, 4, 6, 8, 11, 14, 17, 20 и 23-й дни лечения. Местно аппликации 5% линимента циклоферона, либо гидрогель алломедина 3-4 раза в день. Изопринозином по 2 таблетки (1000 мг) 3 р/д в течение 14-28 дней в сочетании с в/м введением циклоферона по 4 мл (500 мг) № 10 по основной схеме |
| Комбинированные методы | Сочетание различных методов лечения |
При остроконечных кондиломах проводится лечение обоих половых партнеров. Рекомендуется воздерживаться от половых контактов в период приема лекарств и барьерная контрацепция в течение 6 месяцев после завершения терапии. В целом тактику лечения определяет (Баткаев Э. А. и др., 2001):
- исходное состояние иммунитета,
- наличие сопутствующей соматической патологии,
- характер урогенитальной инфекции,
- локализация патологического процесса,
- характер патологического процесса шейки матки (наличие и степень тяжести дисплазии или ее отсутствие),
- предшествующая противовирусная терапия.
Как уже отмечалось выше, в основе местного лечения лежит удаление кондилом и измененных участков эпителия. Для решения указанной задачи разработано несколько подходов (табл. 7).
Из физических методов лечения аногенитальных бородавок наиболее часто применяется лазеротерапия, особенно в детской гинекологии и у беременных женщин. Используются углекислотные и неодимовые лазеры. Следует отметить, что углекислый лазер меньше повреждает окружающие ткани, а неодимовый обладает более выраженным гомеостатическим эффектом. При необходимости можно провести обезболивание нанесением крема EMLA (ASTRA) за 10-15 минут (слизистые оболочки) или 30-40 минут (кожа) до процедуры. Если после первого сеанса лазерной терапии отмечаются остаточные явления, то рекомендуется через три недели повторить курс, после которого наблюдается полная деструкция остроконечных кондилом. Лазеротерапию у беременных женщин следует проводить не позже 35 недель беременности, тогда роды у них проходят без осложнений, связанных с ВПЧ-инфекцией. Многие авторы считают, что лазерная терапия является основным методом лечения остроконечных кондилом у беременных женщин (Козлова В. И., Пухнер А. Ф., 2000).
Криотерапия с применением жидкого азота, оксида азота и диоксида углерода в большинстве случаев является безопасным и эффективным методом лечения бородавок. Криотерапия может применяться в виде одной процедуры длительностью от 10 до 120 секунд или двух отдельных циклов (от 10 до 90 секунд). Через 3 дня на участках, подвергающихся обработке могут наблюдаться пузырьки, покраснения и изъязвления, заживающие через 1-2 недели.
Хирургический метод наиболее приемлем при лечении больных с большой площадью и большим количеством папилломатозных элементов. Отрицательным моментом является необходимость обезболивания и возможность возникновения послеоперационного рубца, поэтому бородавки, располагающиеся вокруг ануса и уретры, необходимо удалять постепенно.
Из препаратов, которые можно отнести к группе химических средств, обладающих местным прижигающим действием, следует выделить солкодерм. По своей сути это кератолитическое средство, применяемое в виде раствора, активной составляющей которого являются продукты взаимодействия органических кислот и ионов металлов с азотной кислотой. Раствор содержит нитраты в количестве 0,02 мг/мл. Солкодерм оказывает ограниченное местное действие на патологически измененные ткани, на которые он наносится. Препарат проникает в обработанную ткань и вызывает изменение ее окраски, отражающее прижизненную фиксацию обработанной области. В последующем происходит мумификация патологической ткани, по мере усиления которой струп темнеет и через несколько дней самостоятельно отпадает. Заживление происходит быстро. В терапии используют также трихлоруксусную кислоту в концентрации 80-90%, которая является слабым деструктивным химическим препаратом, вызывающим локальный коагуляционный некроз. Препарат наиболее эффективен при небольших остроконечных или вульгарных папилломах, эффективность снижается при больших или ороговевших поражениях. Спустя 1-2 недели можно проводить повторные обработки. Трихлоруксусная кислота обладает сильным разъедающим действием, и избыточное ее нанесение может вызвать сильные болевые ощущения и образование изъязвлений, а впоследствии и рубцов, поэтому для нейтрализации избытка препарата или при случайном его попадании на здоровую кожу необходимо использование раствора бикарбоната натрия. При правильном применении трихлоруксусной кислоты образуются неглубокие эрозии, не оставляющие рубцов.
Из препаратов цитостатического действия для местного воздействия на папилломатозные элементы до настоящего времени широко используется подофиллин. Впервые для лечения бородавок аногенитальной области его применил Kaplan J. W. (1942). Лекарство ингибирует митозы, а в высоких концентрациях подавляет транспорт нуклеозидов, в результате чего происходит ингибирование синтеза ДНК и размножения клеток. Препарат применяется при лечении некератизированных бородавок препуциальной области головки полового члена, венечной борозды, вульвы. Используется в виде 10-25% раствора в сочетании с настойкой бензоина. Максимальная продолжительность лечения 5 недель. Возможно развитие побочных реакций, в частности контактного дерматита, отмечающегося в 10-15% случаев. Однако далеко не все авторы приветствуют использование подофиллина, особенно его самостоятельное применение. Так, Peterson С. и соавт. (1995) отмечают, что примерно 10% сухого вещества 20%-го раствора препарата составляют 2 мутагенных флавоноида: квартцетин и комферол, поэтому авторы рекомендуют использовать лишь высокоочищенный подофиллотоксин, причем самостоятельное его применение больными возможно лишь после тщательного инструктажа.
Подофиллотоксин (кондилин) — наиболее активная в клиническом аспекте фракция в составе подофиллина. Его несомненное достоинство — возможность самостоятельного применения больными. Препарат используется только для лечения остроконечных кондилом. Обычно его наносят хлопковым или пластиковым тампоном на папилломатозные элементы 2 раза в сутки в течение 3 дней с 4-дневным перерывом. Этот цикл терапии при необходимости можно повторять до 4 раз. Общая зона обработки не должна превышать 10 см2, а общий объем использованного лекарственного средства не должен превышать 0,5 мл в день. Однако, несмотря на более высокую очистку подофиллотоксина по сравнению с его предшественником подофиллином, как подчеркивает Bonner W. с соавт. (1994), у 57% пациентов возможно развитие местных воспалительных реакций, у 48% — эритема и чувство жжения, у 47% — болезненность, у 39% — мокнутия и эрозии. К недостаткам подофиллотоксина можно также отнести его высокую стоимость и умеренную эффективность.
В последние годы для лечения ВПЧ-инфекции предпринимались попытки использования различных лекарственных средств из онкологической практики. К этой группе препаратов относится 5-фтпорурацил, который является антагонистом пиримидина и обладает способностью нарушать синтез вирусной ДНК. В виде 5% крема препарат наиболее эффективен при лечении папилломатозных элементов на сводах влагалища и дистальной части уретры. При лечении интравагинальных бородавок лекарство назначается 1 раз на ночь в течение недели или 1 раз в неделю в течение 10 недель. Подобная схема терапии позволяет добиться регресса папилломатозных элементов в 85-90% случаев. Однако при этом могут возникать мокнущие эрозии на слизистой влагалища вплоть до развития контактного дерматита.
При лечении бородавок дистальной части уретры препарат используется сразу же после мочеиспускания, на ночь в течение 3-8 дней. Однако, несмотря на довольно высокую клиническую эффективность, в этом случае у мужчин отмечается множество побочных эффектов вплоть до развития стеноза и стриктуры уретры. Эффективность лечения кондилом составляет 50-94%, уровень рецидивирования в течение 3 месяцев после лечения не менее 25%.
Индинол (индол-3-карбинол) — противоопухолевое и противовирусное природное средство, эффективное в отношении гормонозависимых заболеваний и эпителиальных опухолей органов женской половой системы, а также ВПЧ-инфекции. Препарат препятствует образованию 16-а-гидроксистерона, блокирует синтез онкобелка Е7, подавляет рост эстрогензависимых опухолей. Выпускается в капсулах по 100 мг вещества. Назначается по 2 капсулы 2 раза в день натощак, за 10 минут до еды в течение 3 месяцев. Возможен сочетанный прием индинола с другими препаратами (Димтриев Г. А., Биткина О. А., 2006; Киселев В. И., 2004).
Читайте также:

