Контактная инфекция в операционной
Обновлено: 19.04.2024
С операционной раной соприкасаются: хирургический инструментарий, перевязочный материал и хирургическое белье, руки хирурга.
Основой для профилактики контактной инфекции является стерилизация – полное освобождение какого-либо предмета от микроорганизмов путем воздействия на него с помощью физических или химических факторов.
Используемые в практике методы стерилизации должны:
обладать бактерицидной и спороцидной активностью;
быть безопасными для больных и медперсонала;
не должны ухудшать рабочие свойства инструментов.
В современной асептике используют физические и химические методы стерилизации.
Профилактика имплантационной инфекции
К материалам, имплантируемым в организм человека, относят шовный материал, скрепки, скобки, протезы сосудов, суставов, ткани и органы, дренажи, катетеры, шунты.
Шовный материал стерилизуют гамма-излучением в заводских условиях. Металлический шовный материал стерилизуют в автоклаве или кипячением. Капрон, лавсан, лен, хлопок можно стерилизовать по методу Кохера. Это вынужденный метод, он предусматривает механическую очистку шовного материала горячей водой с мылом. Мотки моют в мыльной воде в течение 10 мин, дважды меняя воду, затем отмывают от моющего раствора, высушивают и наматывают на стеклянные катушки, которые помещают в банки с притертой пробкой и заливают диэтиловым эфиром на 24 часа для обезжиривания, после чего перекладывают в банки с 70% спиртом на такой же срок. После этого шелк кипятят в течение в течение 10-20 мин в растворе дихлорида ртути 1:1000 и перекладывают в герметичные банки с 96% спиртом. Через 2 сут проводят бак.контроль.
Стерилизация кетгута химическим способом предусматривает предварительное обезжиривание, для чего нити кетгута помещают в герметичные банки с диэтиловым эфиром на 24 часа. При стерилизации по Клаудиусу эфир из банки сливают, кетгут заливают на 10 сут водным раствором Люголя, затем заменяют на свежий и оставляют еще на 10 сут. После этого раствор Люголя заменяют 96% спиртом и через 4-6 сут проводят контроль на стерильность. Метод Губарева предусматривает стерилизацию кетгута спиртовым раствором Люголя в течение 20 сут.
Лучевая стерилизация осуществляется гамма-лучами. Используются изотопы кобальта и цезия. Доза проникающей радиации должна быть значительной.
2. Антисептика. Методы. Принципы рациональной антибиотикотерапии.
Антисептика подразумевает комплекс мероприятий, направленных на уничтожение микробов на коже, в ране, патологическом образовании или организме в целом. Выделяют физическую, механическую, химическую и биологическую антисептику.
основные принципы рациональной антибиотикотерапии:
1.Целенаправленное применение антибиотиков по строгим показаниям, а не для профилактической цели.
2.Знание возбудителя. Результаты бактериологического исследования появляются только через 12 часов, а человека надо лечить сейчас же. Каждый третий случай хирургической инфекции вызван не монокультурой, а сразу многими возбудителями. Их может быть 3 и больше. В этой ассоциации один из микробов является лидирующим и наиболее патогенным, а остальные могут являться попутчиками. Все это затрудняет идентификацию возбудителя, поэтому прежде всего необходимо установить причину заболевания. В случае, когда человеку грозит тяжелое осложнение или смерть, применяются антибиотики резерва — цефалоспорины и более мощные препараты.
3.Правильный выбор дозировки и кратности назначения антибиотика исходя из поддержания в крови необходимого уровня его концентрации.
4.Профилактика возможных побочных действий и осложнений (наиболее распространенным является аллергия). Перед применением антибиотика должна быть поставлена кожная проба на чувствительность к нему. Кроме того, существуют антибиотики, которые усиливают неблагоприятное действие друг друга, есть и такие, которые его ослабляют. Для правильного выбора существуют таблицы сочетаемости антибиотиков.
5.Прежде чем начинать антибиотикотерапию, надо выяснить состояние печени, почек, сердца у пациента (особенно при применении токсичных препаратов).
6.Разработка антибактериальной стратегии: необходимо применять антибиотики в различных комбинациях. Одно и тоже сочетание препаратов можно применять не более 5–7 дней, а в случае, когда лечение не эффективно, необходимо поменять антибиотик.
7.При заболевании инфекционной этиологии надо следить за состоянием иммунной системы человека. Необходимо применять имеющиеся методики исследования гуморального и клеточного иммунитета, чтобы вовремя выявить дефект в иммунной системе.
3. Кровотечения. Классификация, методы временной и окончательной остановки кровотечения. Определение степени тяжести кровопотери.
Кровотечение – истечение крови из просвета кровеносного сосуда вследствие его повреждения или нарушения проницаемости его стенки. При этом выделяют 3 понятия – собственно кровотечение (в окружающую среду, полый орган, полость), кровоизлияние (ткани), гематома (расслоение тканей и образование полости).
- повышение проницаемости стенки сосуда (например, при авитоминозе),
- аррозия сосудистой стенки (воспаление, распад опухоли)
1) артериальное, венозное, капиллярное, паренхиматозное.
2) внутреннее (явное, т.е. кровь все равно появляется снаружи, например, мелена, и скрытое), наружное.
3) первичное, вторичное (раннее – до 4 суток, и позднее)
- легкая степень – до 10-12% ОЦК
- массивная кровопотеря – более 30% ОЦК
1) Наложение жгута. При арт кровотечении или массивном на конечности. 2 часа – на нижних и 1,5 часа на верхних, потом – перерыв 15 минут.
2) Пальцевое прижатие артерий.
3) Максимальное сгибание конечностей.
4) Возвышенное положение конечности. При венозном или капиллярном кровотечении.
5) Давящая повязка. При повреждении мелких сосудов, венозном или капиллярном кровотечении. Накладывают от периферии к центру.
6) Тампонада раны. Показания как у (5) + когда образуются полости.
7) Наложение зажима на кровоточащий сосуд. Зажим Бильрота при операциях.
8) Временное шунтирование. При повреждении крупных магистральных сосудов.
Советы хирургам по защите от инфекций передающихся через кровь
1. Какие заболевания, передающиеся с кровью, имеют наибольшее значение для хирурга?
Обычно среди возбудителей, передающихся при контакте с зараженной кровыо, основное внимание уделялось вирусу иммунодефицита человека (ВИЧ), однако рост заболеваемости гепатитом С в Северной Америке привел к тому, что именно гепатит сейчас является наиболее частым среди заболеваний, передающихся таким путем.
В настоящее время инфицирование вирусом гепатита В, который уже почти 50 лет считается профессиональной патологией хирургов, реже приводит к развитию заболевания, что связано с распространением прививок и разработкой сравнительно эффективной схемы лечения в случае контакта с вирусом.
2. Каков сравнительный риск заражения ВИЧ, HBV и HCV?
а) ВИЧ. На данный момент приблизительно 1 миллион жителей США инфицированы ВИЧ. Последние наблюдения показывают, что передача ВИЧ в больничных условиях происходит редко. Медработники составляют только 5% от всех больных СПИДом, и у большинства из них есть другие факторы, помимо профессиональных, вероятно, и вызвавшие заболевание. Наибольший профессиональный риск отмечен у медицинских сестер и работников лабораторий.
С 1 января 1998 года не отмечено ни одного документированного случая передачи ВИЧ от больного к врачу в результате профессионального контакта.
б) HBV. Нет сомнений, что все хирурги за время нормальной трудовой карьеры контактируют с HBV. Считается, что 1,25 миллиона жителей США болеют хроническим гепатитом В. Чрескожная инъекция инфицированной иглой приблизительно в 30% случаев приводит к развитию острого заболевания. В 75% гепатит В протекает клинически скрыто, а 10% инфицированных на всю жизнь остаются носителями вируса.
У многих носителей, потенциально заразных для окружающих, заболевание протекает бессимптомно, с минимальным прогрессированием или без прогрессирования. Примерно в 40% болезнь постоянно прогрессирует, приводя к циррозу, печеночной недостаточности или даже к генатоцеллюлярному раку.
в) HCV. Гепатит С стал для хирургов самой главной проблемой. Считается, что хроническим гепатитом С страдают приблизительно 4 миллиона жителей США. Риск сероконверсии при чрескожной инъекции инфицированной иглой составляет около 10%, однако в 50% острое заболевание приводит к хроническому носительству инфекции. О течении гепатита С до сих пор существуют различные мнения, однако почти у 40% больных хроническая HCV-инфекция приводит к развитию цирроза.
В последнем случае высок риск развития рака печени, вероятность которого достигает 50% в течение 15 лет.
3. Обеспечивает ли вакцинация против гепатита В полную защиту от заболевания?
В настоящее время для всех хирургов и лиц, работающих в операционной, доступна эффективная вакцинация против гепатита В. Вакцину против гепатита В получают с помощью рекомбинантной технологии; она не является разрушенными частицами вируса, полученными от инфицированных людей. Вводят три дозы вакцины, после чего следует определить титр поверхностных антител, чтобы убедиться в успешности вакцинации.
Приблизительно у 5% вакцинированных людей выработки антител не происходит и требуется повторная вакцинация. Некоторые люди остаются рефрактерными к вакцинации, для них сохраняется риск острого гепатита В. Вакцинация не гарантирует иммунизацию.
Согласно некоторым исследованиям, 50% практикующих хирургов не обладают достаточным иммунитетом к HBV из-за различных причин: отсутствия вакинации у старых хирургов, более чем 5-летнего срока после вакцинации, недостаточного количества рекомбинантной вакцины или неправильной вакцинации и, наконец, неспособности выработать соответствующий иммунный ответ.
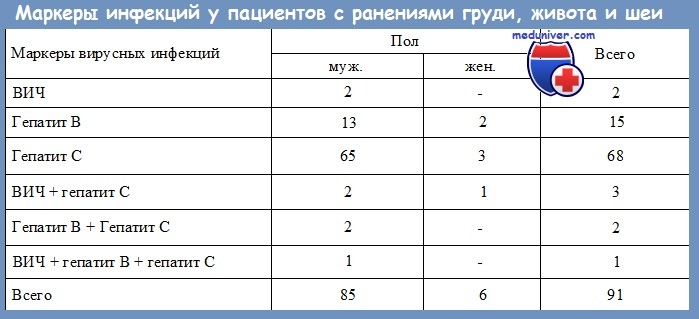
4. Существует ли риск заражения больных от хирургов, инфицированных HBV?
Передача вируса гепатита В от хирурга к больному документирована. Анализ крови хирургов, которые могут заразить больных, как правило, положителен на е-антиген вируса гепатита В. Е-антиген является продуктом распада вирусного нуклеокапсида и говорит об активной репликации вируса в печени. Обнаружение е-антигена свидетельствует о высоких титрах вируса и сравнительно высокой заразности больного.
Большое количество документированных случаев передачи гепатита В больным от лиц, занятых в хирургии, может вызвать особенные проблемы и ограничение клинической деятельности для клиницистов, передавших эту инфекцию. В одном из последних отчетов из Англии сообщается о передаче вируса гепатита В больному даже от хирурга с отрицательным анализом па е-антиген HBV.
В последнее время одна национальная организация призывает ограничить деятельность е-антиген-положительных хирургов. Вопрос, можно ли хирургу с хроническим гепатитом В продолжать практику, будет обсуждаться в будущем.
5. Какова правильная тактика при чрескожном контакте с кровью больного, у которого есть гепатит В?
Тактика зависит от вакцинированности медработника. Если он вакцинирован и имеет положительный титр антител, то ничего предпринимать не надо. Если медработник не вакцинирован и не имеет антител к HBV, то ему или ей следует ввести дозу анти-HBV иммуноглобулина и начать серию вакцинации против гепатита В.
Медработникам, которые ранее были успешно вакцинированы от гепатита В, однако не имеют или имеют незначительный титр антител, следует ввести дозу анти-HBV иммуноглобулина и повторную дозу вакцины против гепатита В. Поскольку в большинстве случаев таких контактов с больным неизвестно, инфицирован он или нет, то, в общем, хирургам необходимо знать, есть ли у них антитела, и периодически повторять иммунизацию против гепатита В через каждые 7 лет.
6. Чем HCV отличается от HBV? Кто из них опаснее?
а) Заболеваемость в США:
- HBV: примерно 1,25 миллиона больных.
- HCV: примерно 4 миллиона больных.
б) Путь и последствия заражения:
- HBV: ДНК-вирус, передающийся с кровью; острая форма переходит в хроническую в 10% случаев.
- HCV: РНК-вирус, передающийся с кровью; острая форма переходит в хроническую в 50% случаев.
в) Профилактика:
- HBV: эффективная рекомбинантная вакцина.
- HCV: в настоящее время вакцины не существует.
г) Защита после контакта:
- HBV: людям, которые не были вакцинированы и не имеют антител к HBV, целесообразно введение анти-HBV иммуноглобулина.
- HCV: клиническая эффективность анти-HCV иммуноглобулина не доказана. Среди больных, с которыми имеют дело хирурги в США, больше лиц с хроническим гепатитом С, чем с хроническим гепатитом В, а вакцины против HCV-инфекции нет. Риск сероконверсии для гепатита С составляет 10% против 30% для гепатита В, однако HCV-инфекция гораздо чаще переходит в хроническую форму (50% против 10%). Поэтому HCV-инфекция представляет для хирургов гораздо большую угрозу.
7. Насколько высок риск для медработника заразиться ВИЧ?
Передача инфекции подтверждалось, если был зафиксирован контакт медработника с кровью или биологическими жидкостями инфицированного больного, после чего была отмечена сероконверсия ВИЧ. Профессиональный риск безусловно выше у медицинских сестер и работников лабораторий. Общее число заражений несравнимо с большим количеством контактов с вирусом, которые, по всей видимости, имели место с начала эпидемии (начало 1980-х годов).
8. Меньше ли риск заражения ВИЧ при выполнении операций лапароскопическим способом?
В последнее время лапароскопическую хирургию у ВИЧ-инфицированных больных считают хорошей заменой открытым вмешательствам. Данный метод уменьшает вероятность контакта с кровью и острыми инструментами, однако за счет некоторых его особенностей возможно заражение хирургов иными путями, чем при обычной операции. При десуфляции пневмонеритонеума во время лапароскопических вмешательств происходит разбрызгивание капелек ВИЧ-инфицированной крови в операционной. Риск заражения можно уменьшить, направляя воздух в закрытую систему и принимая соответствующие меры предосторожности при смене инструментов.
9. Является ли эффективным методом защиты использование двойных перчаток?
Вследствие возможности контакта поврежденной кожи с кровыо риск заражения людей, работающих в операционной, вирусом гепатита или ВИЧ повышен. Хотя двойные перчатки могут не предотвратить повреждения кожи, показано, что они явно уменьшают вероятность контакта с кровыо. Исследования, посвященные контакту с кровыо в операционной, показали, что в 90% такой контакт происходит па коже рук хирурга дистальнее локтя, включая область, защищенную перчатками. Согласно одному исследованию, если хирург надевает две пары перчаток, то вероятность контакта его кожи с кровыо уменьшается па 70%. Прокол наружной пары перчаток наблюдали в 25% случаев, в то время как прокол внутренней пары — только в 10% (в 8,7% у хирургов и в 3,7% у ассистентов). Прокол внутренней пары перчаток отмечался при операциях, длившихся более 3 часов; он всегда сопровождался проколом наружной пары. Наибольшее повреждение происходило па указательном пальце неведущей руки.
10. Представляет ли большую угрозу для хирургов попадание капелек в глаза?
Исследование эпидемиологических центров показало, что приблизительно в 13% случаев документированной передачи ВИЧ имел место контакт со слизистой и кожей. Попадание капелек в глаза часто недооценивают, хотя этот вид контакта легче всего предотвратить. В недавно проведенном исследовании изучали 160 пар защитных экранов для глаз, используемых хирургами и ассистентами. Все операции длились 30 минут и более. На экранах подсчитывали количество капелек, вначале макроскопических, потом микроскопических. Кровь была обнаружена на 44% из исследуемых экранов. Хирурги замечали брызги всего в 8% случаев. Лишь 16% капелек были видны макроскопически. Риск попадания капелек в глаза был выше для хирурга, чем для ассистента, и увеличивался с увеличением времени операции. Доказано, что важным является также тип вмешательства: риск выше при сосудистых и ортопедических операциях. Защита глаз должна быть обязательной для всех работающих в операционной, особенно для непосредственно оперирующих лиц.
11. Как часто кровь хирурга контактирует с кровью и биологическими жидкостями больного?
Контакт с кровью возможен при повреждениях кожи (уколы, порезы) и соприкосновении с кожей и слизистыми (прокол перчатки, царапины на коже, попадание капелек в глаза). Контакт вследствие повреждения кожи наблюдают в 1,2-5,6% хирургических процедур, а контакт вследствие соприкосновения с кожей и слизистыми — в 6,4-50,4%. Разница в приводимых цифрах обусловлена различиями в сборе данных, выполняемых процедурах, хирургической технике и мерах предосторожности. Например, хирурги в San Francisco General Hospital принимают крайние меры предосторожности, надевая водонепроницаемую форму и две пары перчаток. Случаев передачи инфекции какому-нибудь медработнику при контакте его неповрежденной кожи с инфицированными кровью и биологическими жидкостями не отмечено. Однако сообщалось о заражении ВИЧ медработников, не имеющие других факторов риска, вследствие контакта с их слизистыми и кожей ВИЧ-инфицированной крови. Вероятность передачи инфекции при таком контакте остается неизвестной, поскольку в проспективных исследованиях у медработников после контакта их слизистой и кожи с ВИЧ-инфицированной кровью сероконверсии отмечено не было.
Риск заражения существует для всех работающих в операционной, однако он намного выше для хирургов и первых ассистентов, поскольку 80% случаев загрязнения кожи и 65% случаев повреждений приходится именно на них.
12. Только ли хирургической техникой объясняется загрязнение кожи?
Кожа с царапинами может контактировать с кровью или биологическими жидкостями даже при соблюдении всех мер предосторожности. К сожалению, далеко не вся защитная одежда защищает в равной степени. В одном исследовании отмечены дефекты у 2% стерильных хирургических перчаток сразу после их распаковки.
13. Какова вероятность сероконверсии после контакта крови медработника с кровью больного для ВИЧ и HBV?
Вероятность сероконверсии после укола иглой составляет 0,3% для ВИЧ и 30% для HBV.
14. Какова вероятность для хирурга заразиться ВИЧ на рабочем месте за все время его карьеры?
Риск передачи ВИЧ хирургу можно вычислить, зная частоту обнаружения ВИЧ у хирургических больных (0,32-50%), вероятность повреждения кожи (1,2-6%) и вероятность сероконверсии (0,29-0,50%). Таким образом, риск заразиться ВИЧ от конкретного больного находится в интервале от 0,11 на миллион до 66 на миллион. Если хирург выполняет 350 операций в год в течение 30 лет, то риск заражения на протяжении всей карьеры для него составляет от 0,12% до 50,0%, в зависимости от переменных величии. В этом подсчете допущено несколько предположений:
а) Мы допустили, что заболеваемость ВИЧ является величиной постоянной, однако считается, что в Соединенных Штатах за год она увеличивается на 4,0-8,6%.
б) Учитывается только контакт с зараженной кровью при повреждении кожи; возможность контакта со слизистыми и кожей (без ее повреждения) не принимается во внимание.
в) Риск считается одинаковым для всех операций, однако известно, что он зависит от длительности и срочности операции, а также от объема кровопотери.
Очевидно, что эти предположения не способствуют точности вычислений, поэтому подсчитанная вероятность — всего лишь грубая оценка на основании имеющихся данных.
15. Знают ли хирурги о своем профессиональном риске?
16. Есть ли эффективные методы уменьшить риск заражения хирургов инфекциями, передающимися с кровью?
Профилактике заражения HBV, помимо общих мер предосторожности, способствует высокоэффективная вакцина, которая, однако, не используется так часто, как следовало бы. Большинство хирургов в возрасте 45 лет и старше не вакцинированы. Также отработан протокол лечения после контакта. Наиболее прагматичный подход для профилактики передачи HCV и ВИЧ — уменьшить вероятность повреждения кожи и контакта с кожей и слизистыми за счет применения оптимальных методик и мер предосторожнсти.
Наконец, при попадании крови необходимо быстро ее удалить. При загрязнении кистей или рук следует их немедленно обработать. Если это невыполнимо, то область контакта надо смочить раствором повидон-йода, а когда это будет возможно — обработать.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Профилактика внутрибольничных инфекций. Принципы
В каждом лечебном учреждении необходимо проводить мероприятия, препятствующие возникновению и распространению инфекции. В них принимает участие весь персонал. Группа контроля за инфекционной заболеваемостью должна состоять из микробиолога (врача-инфекциониста) и квалифицированной медицинской сестры. Организация противоэпидемических мероприятий возложена на руководство учреждения. Группой будет проводиться особый контроль за распространением специфических микроорганизмов (например, МРЗС).
Группа должна осуществлять надзор за состоянием внутренней среды учреждения, принимать участие в планировании, размещении и перепланировке зданий.
При обнаружении инфекционного заболевания больного немедленно изолируют для предотвращения его распространения. Необходимо установить источник инфекции и пути её передачи, организовать проведение бактериологических исследований пациентам и медперсоналу, контактирующему с больным. Пациентов, особенно восприимчивых к инфекции, также следует размещать в отдельных палатах. При несоблюдении персоналом санитарно-гигиенических норм поддерживать противоэпидемический режим в больнице достаточно сложно. Например, значительно усложнить ситуацию может пренебрежение таким простым правилом, как обязательное мытьё рук.
Изоляция больных с открытыми ранами и после выполнения полостных операций для профилактики внутрибольничной инфекции. Пациента помещают в изолированную палату с отдельной уборной. При проведении лечебных и гигиенических процедур необходимо надевать одноразовые перчатки и стерильную одежду. После выполнения всех манипуляций их выбрасывают, а руки тщательно моют с мылом и вытирают одноразовым полотенцем. Для снижения микробной контаминации окружающей среды применяют специальные дезинфицирующие вещества, например хлорсодержащие растворы для борьбы с Clostridium difficile.
Профилактика внутрибольничных респираторных инфекций
Помимо соблюдения вышеперечисленных мер предосторожности медперсонал больницы обязан носить маски. При транспортировке из одного отделения в другое маску должен иметь и сам пациент. Строгие меры респираторной изоляции необходимы для предупреждения распространения инфекций, вызываемых мультирезистентными штаммами возбудителей туберкулёза, и тяжёлого острого респираторного синдрома. Они предполагают размещение в комнатах с отрицательным давлением и использование специальных индивидуальных респираторов.
Соблюдение мер предосторожности особенно важно во время процедур, сопровождающихся высоким риском воздушно-капельного заражения (например, при выполнении бронхоальвеолярного лаважа).
Строгая изоляция для профилактики внутрибольничной инфекции. Этот метод изоляции направлен на предупреждение распространения таких инфекций, как вирусные геморрагические лихорадки. Пациента помещают в специальный изоляционный бокс с отрицательным давлением, снабжённый собственной закрытой системой вентиляции, что позволяет избежать воздушно-капельного распространения инфекции. При работе в боксе соблюдают строгий противоэпидемический режим.
Защитная изоляция для профилактики внутрибольничной инфекции. Защитная изоляция необходима больным с повышенной восприимчивостью к инфекционным заболеваниям (например, пациентам с нейтропенией). Больного помещают в одноместную палату (бокс) с приточно-вытяжной вентиляцией и обязательной фильтрацией и дезинфекцией воздуха для предотвращения инфицирования пищи (устойчивыми грамо-трицательными бактериями — овощей или Listeria — мягких сыров).
Типирование при внутрибольничной инфекции
Типирование применяют после определения вида возбудителей, а также для диагностики перекрёстной инфекции. Выбранный метод должен быть достаточно прост и воспроизводим, дающий схожие результаты, когда используется в других лабораториях. Различают следующие виды типирования:
• простое лабораторное типирование, проводимое при помощи фенотипических маркёров;
• серологическое типирование, основанное на определении антигенной структуры возбудителя (применяют для идентификации различных штаммов шигелл, сальмонелл и др.);
• фаготипирование — установление принадлежности выделенного бактериального штамма к определённому фаготипу, основанное на различной чувствительности к бактериофагам (различные бактериофаги лизируют определённые виды бактерий). Этот принцип лежит в основе фаготипирования стафилококков, некоторых штаммов возбудителей рода Salmonella и др.;
• колицинотипирование — некоторые бактерии продуцируют белковые антибиотики, такие как колицин, которые тормозят рост родственных микроорганизмов; этот метод может быть использован для типирования штаммов родов: Shigella и Pseudomonas;
• молекулярное типирование — применение различных рестриктаз, приобретающих характерную окраску при взаимодействии с геномной или плазмидной ДНК, а также с рибосомальной РНК. Одинаковые микроорганизмы будут иметь одинаковую окраску. Кроме того, возможно определение последовательности нуклеиновых кислот. Например, при мультилокусном секвенировании-типировании используют набор из семи облигатных генов, не кодирующих факторы вирулентности или патогенности, но являющихся маркёрами филогенетического родства.
В настоящее время молекулярное типирование приобретает всё большую популярность, вытесняя другие методы.
Стерилизация для профилактики внутрибольничной инфекции
Во время стерилизации (методом автоклавирования или облучения) происходит инактивация всех патогенных микроорганизмов. В автоклаве различные предметы (например, хирургический инструментарий и др.) обрабатывают горячим паром под высоким давлением, в результате чего происходит обеззараживание любого инфицированного материала. Для обработки хрупких и чувствительных материалов используют стерилизацию в специальных автоклавах с более низким давлением и температурой, в которые пар подают в смеси с формальдегидом.
Предметы одноразового использования (пластиковые катетеры, шприцы, протезы и др.) подвергают стерилизации у-излучением во время промышленного производства. Кроме того, при условии соблюдения временных нормативов для стерилизации инструментов используют альдегиды (глутаральдегид и формальдегид). Растворы, содержащие хлор (диоксид хлора), применяют вместо глутаральдегида для снижения токсического воздействия на людей, проводящих стерилизацию.
Дезинфекция для профилактики внутрибольничной инфекции
Дезинфекция — комплекс мероприятий, направленных на уничтожение возбудителей инфекционных заболеваний. Наиболее важный этап дезинфекции — мытьё рук с мылом или очищающим средством. Дезинфицирующими называют химические средства, уничтожающие микробы или замедляющие их рост. Их используют в случаях, когда невозможно обеспечить полную стерильность (например, при обработке рук хирурга перед операцией) или после попадания биологических жидкостей (мочи, крови, кала) на различные предметы. Растворы, содержащие гипохлориты (гипохлорит натрия), эффективны в отношении вирусов. Кроме того, их применяют для обработки поверхностей.
Следует помнить, что гипохлориты обладают выраженными коррозийными свойствами. Растворы, содержащие йод и другие галогены, эффективно уничтожают бактерии (в том числе и спорообразующие), но отличаются сравнительно медленным действием. Обычно их используют для дезинфекции кожного покрова. Дезинфицирующие средства на основе фенола обладают выраженным антибактериальным эффектом. Их применяют для обработки поверхностей в больницах, лабораториях и др. Спирт (70% раствор) быстро уничтожает бактерии, грибы и вирусы. Его применяют для дезинфекции кожного покрова перед хирургическими операциями. Эффективным противобактериальным средством (особенно против стафилококков) считают хлоргексидин, который также применяют для обработки кожи.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Советы по профилактике хирургической инфекции и сепсиса
1. Верно ли утверждение, что современные антибиотики позволяют излечивать многие, если не большинство, хирургических инфекций?
Абсолютно неверно! У тяжелых хирургических больных, находящихся в отделении интенсивной терапии, частота септических осложнений возросла, и они остаются одной из основных причин смертности пациентов с полиорганной недостаточностью и иммунодефицитом. Антибактериальная терапия может ослабить смертоносную флору, но не способна компенсировать резкое снижение сопротивляемости организма инфекции: нарушение барьеров против микробной инвазии воспалительными и иммунологическими реакциями на “обычных” возбудителей.
2. При каких типах повреждений защитных барьеров микробная инвазия способна вызвать хирургическую инфекцию?
Кожа и слизистые служат барьером между окружающим миром, населенным множеством микробов, и стерильной внутренней средой тканей и органов (даже если окружающий мир представляет собой насыщенную микрофлорой трубку среди обычно стерильных полостей организма, как, например, желудочно-кишечный тракт (ЖКТ)). Легко проследить разрушение барьерной функции кожи, когда нож рассекает ее и “открывает” путь флоре внутрь или когда нож перфорирует кишечник и контаминированное содержимое вытекает в брюшную полость.
Менее очевидные дефекты в барьерах слизистой происходят при застое в кишечнике содержимого, разрушении токсинами защитных иммуноглобулинов или уменьшении синтеза последних при неадекватном питании ослабленных больных. Сообщества микробов могут проникнуть через поврежденные барьеры особенно легко, если нарушается третья линия защиты — гуморальный и клеточный иммунитет.
3. Чем отличается контаминация от инфекции?
Постоянно присутствующие на поверхности тела резидентные микробные сообщества не приносят большого вреда, а кишечная микрофлора абсолютно полезна, пока находится в кишке. В здоровом организме даже преходящее обнаружение бактерий вне их обычного местонахождения не говорит об инфекции. Например, если вы сегодня утром энергично чистили зубы, различные резидентные грамотрицательные бактерии из полости рта попали в ваш кровоток и были очень быстро элиминированы нормальными механизмами защиты — если только бактерии не столкнулись с пониженным иммунитетом или створками протеза клапана сердца.
4. Какую пользу приносит огромная масса бактерий нижних отделов ЖКТ?
Микробы могут приносить большую пользу. Это те самые бактерии, которые тысячелетиями живут в симбиозе с человеком. Они синтезируют витамин К (что мы делать без них не можем), а также своим подавляющим количеством вытесняют патогенные микроорганизмы. Они также помогают метаболизировать желчные соли и играют роль в детоксикации некоторых вредных факторов окружающей среды.
5. В случае загрязнения брюшной полости кишечным содержимым необходимо микробиологическое исследование фекальных масс с определением чувствительности к антибиотикам всех установленных микроорганизмов — правильно?
Если из-за ошибки, допущенной при заборе лабораторного материала, вам дали заключение о смешанной внутрибольничной флоре, как это изменит вашу терапию? Если, к примеру, анаэробы в фекалиях не обнаружены, будете ли вы столь уверены в их отсутствии в ране, чтобы не включать эти микроорганизмы в спектр антибактериальной терапии?
Необходимо согласиться, что микробиологическое исследование бытовых контаминантов является дорогим, неполным и неинформативным; микробиологическое исследование инфекционных возбудителей в очаге нагноения (особенно внутрибольничных, сохраняющихся после лечения) может предоставить очень важную информацию и экономически более оправдано.

6. Правила асептики; как готовить к операции кишечник?
Предоперационная подготовка включает процедуры, направленные на уменьшение количества резидентной микрофлоры перед плановым инвазивным вмешательством. Она может заключаться в простой обработке кожи тампоном со спиртом перед подкожной инъекцией или обработке хирургического поля перед разрезом.
Аналогично предоперационная подготовка кишечника направлена на уменьшение количества резидентной микрофлоры в кишке и может осуществляться путем:
(1) механического очищения (например, при помощи слабительного);
(2) осмотического или объемного разведения через клизму большим количеством физиологического и других электролитных растворов или маннитолом;
(3) приема внутрь невсасывающихся антибиотиков. Очевидно наиболее важным из этих методов является механическое очищение, поскольку оно позволяет вывести огромное количество микрофлоры, иногда составляющей две трети сухого веса содержимого толстой кишки. Одной из наиболее убедительных причин для назначения определенных пероральных антибиотиков при предоперационной подготовке кишечника является их активное очищающее действие.
7. Стерилизуем ли мы кожу или слизистые полости больного при подготовке хирургического поля к разрезу?
Я знаю единственный способ сделать больных "стерильными", который едва ли можно рекомендовать, — поместить их в автоклав вместе с хирургическими инструментами и салфетками. Но не принимая во внимание этот абсурдный пример, кожу сделать стерильной нельзя. Деконтаминационные процессы несовершенны, особенно в такой сложной ткани, как кожа, с ее бороздами и добавочными структурами, населенными бактериями. Кожа и слизистые оболочки, в отличие от рук в перчатках, не стерильны.
8. Какими способами можно уменьшить количество резидентной микрофлоры без дополнительного повреждения кожи или слизистой?
а) Объемное промывание.
б) Обезжиривание — растворяет секрет сальных желез, который может задерживать микробы.
в) Бактерицидное воздействие бактериостатических агентов.
К большому удивлению, одна дешевая, простая жидкость одновременно является растворителем, жирорастворителем и антимикробным средством — это спирт. Спирт представляет собой почти идеальный препарат для подготовки операционного поля. К его небольшим недостаткам относятся дегидратирующие свойства и небольшая вероятность воспламенения. Поскольку спирт бесследно испаряется, микробы могут распространяться с соседних участков кожи или воздушно-капельным путем, поэтому требуется дополнительная обработка операционного поля длительно действующими бактериостатиками.
Йод также убивает бактерии, но более опасен для чувствительных клеток млекопитающих. Более низкой первоначальной концентрацией йода и более длительным действием обладает йодоформ, который почти всегда применяется для обработки операционного поля. Применение влаго- и воздухопроницаемых импрегнированных “разрезаемых пленок” или предотвращающих высыхание “кольцевых салфеток” может в дальнейшем замедлять повторное загрязнение микрофлорой обработанного (но по-прежнему нестерильного) поля.
9. Какие антибиотики применяются для "санации кишечника"?
Для "санации кишечника" применяются пероральные антибиотики, которые плохо абсорбируются и уменьшают содержание микрофлоры в ЖКТ. Они являются почти идеальным компонентом для предоперационной подготовки кишечника, поскольку относятся к сильным слабительным средствам и в большинстве случаев завершают “очистку” механическим слабительным действием. Наиболее популярны препараты па основе неомиципа/эритромицина.
10. Что такое селективная деконтаминация кишечника? Как она действует?
Она не действует. Этот метод применяется у больных с высоким риском развития сепсиса от полиорганной недостаточности и направлен на поддержание барьерной функции ЖКТ и уменьшение риска “заражения” кишечной флорой. Широкие экспериментальные исследования показали, что этот метод снижает уровень летальности среди тяжелых больных с высоким риском хирургического сепсиса. Однако после длительного клинического исследования продемонстрировать улучшение показателей выживаемости не удалось. Вероятно, причина заключается в том, что лабораторные исследования проводились на здоровых животных с функционирующей защитной системой. В то же время снижение иммунитета, помимо нарушения барьерной функции ЖКТ, позволяет объяснить, почему селективная деконтаминация кишечника не приносит пользы тяжелым больным. Более того, через некоторое время микрофлора вновь заселяет очищенный кишечник, но уже вирулентными формами микробов, устойчивыми к антибиотикам широкого спектра действия. Деконтаминация все еще применяется у больных, получающих высокие дозы химиопрепаратов, перенесших пересадку костного мозга, и у некоторых пациентов, изолированных в "стерильные боксы" (например, пациенты с иммунодефицитными заболеваниями или обожженные больные).
Видео патофизиология сепсиса
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.

Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции - инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов - в 5 раз.

Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Читайте также:

