Корь синдром стивенса джонсона
Обновлено: 26.04.2024
Синдром Стивенса–Джонсона относится к тяжелым системным аллергическим реакциям замедленного типа (иммунокомплексным) и представляет собой тяжелый вариант течения многоформной эритемы ( рис. 1 ), при которой наряду с поражением кожи отмечается поражение
Синдром Стивенса–Джонсона относится к тяжелым системным аллергическим реакциям замедленного типа (иммунокомплексным) и представляет собой тяжелый вариант течения многоформной эритемы (рис. 1), при которой наряду с поражением кожи отмечается поражение слизистых оболочек как минимум двух органов [1].
Причины развития синдрома Стивенса–Джонсона подразделяют на четыре категории [2].
- Лекарственные средства. Острая токсико-аллергическая реакция возникает в ответ на введение терапевтической дозы медикамента. Наиболее распространенные причинно-значимые лекарства: антибиотики (особенно пенициллинового ряда) — до 55%, нестероидные противовоспалительные препараты — до 25%, сульфаниламиды — до 10%, витамины и другие средства, влияющие на метаболизм — до 8%, местные анестетики — до 6%, другие группы медикаментов (противоэпилептические средства (карбамазепин), барбитураты, вакцины, а также героин [3, 4]) — до 18%.
- Инфекционные агенты. Выделяют инфекционно-аллергическую форму при связи с вирусами (герпес, СПИД, грипп, гепатит и др.), микоплазмами, риккетсиями, различными бактериальными возбудителями (b-гемолитический стрептококк группы А, дифтерии, микобактерии и др.), грибковыми и протозойными инфекциями.
- Онкологические заболевания.
- Идиопатический синдром Стивенса–Джонсона диагностируется в 25–50% случаев.
Клиническая картина
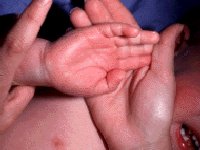
Синдром Стивенса–Джонсона чаще возникает в возрасте 20–40 лет, однако описаны случаи его развития и у трехмесячных детей. Мужчины заболевают в 2 раза чаще женщин. Как правило (в 85% случаев), заболевание начинается с проявлений инфекции верхних дыхательных путей. Продромальный гриппоподобный период длится от 1 до 14 дней и характеризуется лихорадкой, общей слабостью, кашлем, болью в горле, головной болью, артралгией. Иногда отмечается рвота и диарея. Поражение кожи и слизистых развивается стремительно, обычно через 4–6 дней, может локализоваться где угодно, но более характерны симметричные высыпания на разгибательных поверхностях предплечий, голеней, тыла кистей и стоп, лице, половых органах, на слизистых оболочках. Появляются отечные, четко отграниченные, уплощенные папулы розово-красного цвета округлой формы, диаметром от нескольких миллиметров до 2–5 см, имеющие две зоны: внутреннюю (серовато-синюшного цвета, иногда с пузырем в центре, наполненным серозным или геморрагическим содержимым) и наружную (красного цвета). На губах, щеках, небе возникают разлитая эритема, пузыри, эрозивные участки, покрытые желтовато-серым налетом. После вскрытия крупных пузырей на коже и слизистых оболочках образуются сплошные кровоточащие болезненные очаги, при этом губы и десны становятся опухшими, болезненными, с геморрагическими корками (рис. 2, 3). Высыпания сопровождаются жжением и зудом. Эрозивное поражение слизистых оболочек мочеполовой системы может осложняться стриктурами уретры у мужчин, кровотечениями из мочевого пузыря и вульвовагинитами у женщин. При поражении глаз наблюдаются блефароконъюнктивит, иридоциклит, которые могут привести к потере зрения. Редко развиваются бронхиолиты, колиты, проктиты. Из общих симптомов характерны лихорадка, головная боль и боль в суставах [5].
К прогностически неблагоприятным факторам при синдроме Стивенса–Джонсона и синдроме Лайелла относятся: возраст старше 40 лет, быстро прогрессирующее течение, тахикардия с частотой сердечных сокращений (ЧСС) более 120 уд./мин, начальная площадь эпидермального поражения более 10%, гипергликемия более 14 ммоль/л [6].
Летальность при синдроме Стивенса-Джонсона составляет 3–15%. При поражении слизистых оболочек внутренних органов могут формироваться стеноз пищевода, сужение мочевыводящих путей. Слепота вследствие вторичного тяжелого кератита регистрируется у 3–10% больных.
Дифференциальную диагностику следует проводить между многоформной эритемой, синдромом Стивенса–Джонсона и синдромом Лайелла (табл. 1). Следует помнить, что похожие поражения кожи могут встречаться при первичных системных васкулитах (геморрагический васкулит, узелковый полиартериит, микроскопический полиартериит и др.).
Диагностика
При сборе анамнеза больному необходимо задать следующие вопросы:
- Были ли у него раньше аллергические реакции? Что их вызывало? Каким образом они проявлялись?
- Что предшествовало развитию аллергической реакции на этот раз?
- Какие лекарственные препараты больной применял накануне?
- Предшествовали ли высыпаниям симптомы респираторной инфекции (лихорадка, общая слабость, головная боль, боль в горле, кашель, артралгии)?
- Какие меры принимались больным самостоятельно и насколько эффективными они оказались?
Обязательна запись о наличии лекарственной аллергии в медицинской документации.
При начальном осмотре обращают внимание на наличие изменений кожных покровов и видимых слизистых, отмечают характер высыпаний, локализацию, указывают процент поражения кожи, наличие пузырей, эпидермального некроза; стридора, диспноэ, свистящего дыхания, одышки или апноэ; гипотензии или резкого снижения обычного артериального давления (АД); гастроинтестинальных симптомов (тошнота, боль в животе, диарея); болезненность при глотании, мочеиспускании; изменение сознания.
Объективное обследование включает измерение ЧСС, АД, температуры тела, пальпаторное исследование лимфатических узлов и брюшной полости.
- Развернутый общий анализ крови ежедневно — до стабилизации состояния.
- Биохимический анализ крови: глюкоза, мочевина, креатинин, общий белок, билирубин, аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ), С-реактивный белок (СРБ), фибриноген, кислотно-щелочное состояние (КЩС).
- Коагулограмма.
- Общий анализ мочи ежедневно — до стабилизации состояния.
- Посевы с кожи и слизистых оболочек, бактериологическое исследование мокроты, фекалий — по показаниям.
С целью верификации кожных высыпаний и поражения слизистых показана консультация дерматолога. При наличии признаков поражения других органов и систем целесообразна консультация других узких специалистов (отоларинголога, окулиста, уролога и др.).
Неотложная помощь на догоспитальном этапе
При развитии синдрома Стивенса–Джонсона основное направление неотложной терапии — это восполнение потери жидкости, как у ожоговых больных (даже при стабильном состоянии пациента на момент осмотра). Проводится катетеризация периферической вены и начинается переливание жидкостей (коллоидные и солевые растворы 1–2 л), по возможности — пероральная регидратация.
Применяют внутривенное струйное введение глюкокортикостероидов (в перерасчете на преднизолон внутривенно 60–150 мг). Однако эффективность назначения системных гормонов вызывает сомнения. Целесообразным считается применение пульс-терапии в высоких дозах в ранние сроки с момента начала острой токсико-аллергической реакции, потому что плановое их назначение увеличивает риск септических осложнений и может привести к росту числа летальных исходов [5].
Должна быть готовность к искусственной вентиляции легких (ИВЛ), трахеотомии при развитии асфиксии и немедленная госпитализация в реанимационное отделение [9].
Принципы терапии в стационаре
Основные мероприятия направлены на коррекцию гиповолемии, проведение неспецифической дезинтоксикации, предотвращение развития осложнений, в первую очередь инфекций, а также исключение повторного воздействия аллергена.
Необходимо отменить все лекарственные препараты, за исключением тех, которые необходимы пациенту по жизненным показаниям.
- гипоаллергенная диета (жидкая и протертая пища, обильное питье; парентеральное питание у тяжелых больных;
- интенсивная инфузионная терапия (растворы электролитов, солевые растворы, плазмозамещающие растворы), объем около 6000 мл/сут;
- системные глюкокортикостероиды (суточная доза в перерасчете на преднизолон внутривенно 60–240 мг/сут), однако следует помнить о вероятности увеличения числа осложнений и летальных исходов;
- мероприятия по профилактике бактериальных осложнений: специально созданные стерильные условия открытым способом (отдельная палата, подогретый воздух);
- обработка кожи, которая проводится как при ожогах; в случае экссудативного компонента кожу необходимо подсушивать и дезинфицировать растворами (солевые растворы, 3% раствор перекиси водорода и др.), по мере эпителизации растворы постепенно могут быть заменены на кремы и мази (смягчающие и питательные, кортикостероидные). Наиболее часто используемые топические кортикостероиды: элоком, локоид, адвентан, целестодерм. При вторичном инфицировании применяются комбинированные мази (кортикостероидные плюс антибактериальные и (или) противогрибковые): тридерм, пимафукорт, белогент и др. Одежда больного должна быть изготовлена из мягких хлопчатобумажных тканей, кроме того, она должна быть свободной;
- обработка слизистых оболочек глаз 6 раз в сутки: глазные гели (карбомер 974Р (офтагель) по 1 капле в пораженный глаз 1–4 раза в день), глазные капли (азеластин (разрешен детям с 4 лет) по 1 капле в каждый глаз 2 раза в день и др.), при тяжелых проявлениях — кортикостероидные глазные капли и мази (преднизолон 0,5% по 1–2 капли 3 раза в день и др.);
- обработка полости рта после каждого приема пищи (реополиглюкином, перекисью водорода, дезинфицирующими растворами и т. п.);
- обработка слизистых оболочек мочеполовой системы 3–4 раза в день (дезинфицирующими растворами, солкосериловой мазью, глюкокортикостероидной мазью и др.);
- антибактериальные препараты с учетом результатов бактериологического исследования при наличии инфекции кожных покровов и мочевого тракта для предотвращения развития бактериемии. Категорически запрещено использование антибиотиков пенициллинового ряда;
- при кожном зуде и для предотвращения повторных аллергических проявлений, связанных с выбросом новых порций гистамина, применяются антигистаминные препараты, предпочтительнее II и III поколения (табл. 2).
- симптоматическая терапия, особенно анальгетические препараты, строго по показаниям [10].
В качестве гипоаллергенной назначается общая неспецифическая гипоаллергенная диета по А. Д. Адо. Она предполагает исключение из рациона следующих продуктов: цитрусовые (апельсины, мандарины, лимоны, грейпфруты и др.); орехи (арахис, фундук, миндаль и др.); рыба и рыбные продукты (свежая и соленая рыба, рыбные бульоны, консервы из рыб, икра и др.); мясо птицы (гусь, утка, индейка, курица и др.) и изделия из него; шоколад и шоколадные изделия; кофе; копченые изделия; уксус, горчица, майонез и прочие специи; хрен, редис, редька; томаты, баклажаны; грибы; яйца; молоко пресное; клубника, дыня, ананас; сдобное тесто; мед; алкогольные напитки.
- мясо говяжье нежирное, отварное;
- супы: крупяные, овощные:
– на вторичном говяжьем бульоне;
– вегетарианские с добавлением масла сливочного, оливкового, подсолнечного;
Пищевой рацион включает около 2800 ккал (15 г белков, 200 г углеводов, 150 г жиров).
- Офтальмологические — эрозии роговицы, передний увеит, тяжелый кератит, слепота.
- Гастроэнтерологические — колит, проктит, стеноз пищевода.
- Урогенитальные — тубулярный некроз, острая почечная недостаточность, кровотечения из мочевого пузыря, стриктуры уретры у мужчин, вульвовагинит и стеноз влагалища у женщин.
- Пульмонологические — бронхиолит и дыхательная недостаточность.
- Кожные — рубцы и косметические дефекты, возникшие при заживлении и присоединении вторичной инфекции.
– использование низких доз глюкокортикостероидов в начале заболевания и длительная глюкокортикостероидная терапия после стабилизации состояния больного;
– профилактическое назначение антибактериальных препаратов при отсутствии инфекционных осложнений.
Еще раз подчеркнем, что категорически противопоказаны препараты пенициллинового ряда и противопоказано назначение витаминов (группы В, аскорбиновой кислоты и др.), так как они являются сильными аллергенами.
Применение препаратов кальция (глюконат кальция, хлористый кальций) патогенетически необоснованно и может непредсказуемо повлиять на дальнейшее течение заболевания.
Дальнейшие рекомендации
Пациенту постоянно напоминают, что принимать лекарственные средства следует только по назначению врача. Больному выдают памятку по непереносимости лекарственных средств, направляют на консультацию к аллергологу или клиническому иммунологу, рекомендуют обучение в аллергошколе. Пациента обучают правильному применению средств неотложной помощи, технике инъекции на случай повторного контакта с аллергеном и возникновения тяжелых острых токсико-аллергических реакций (анафилактического шока). В домашней аптечке следует иметь адреналин, глюкокортикостероиды (преднизолон) для парентерального введения, шприцы, иглы и антигистаминные препараты.
Профилактика развития лекарственной аллергии включает соблюдение следующих правил.
- Следует вести тщательный сбор и анализ фармакологического анамнеза.
- На титульном листе амбулаторной и/или стационарной карты следует указывать лекарство, вызвавшее аллергию, реакцию, ее вид и дату реакции.
- Нельзя назначать лекарственное средство (и комбинированные препараты, его содержащие), которое ранее вызывало аллергическую реакцию.
- Не следует назначать лекарственное средство, относящееся к одной химической группе с лекарством-аллергеном, учитывая возможность развития перекрестной аллергии.
- Необходимо избегать назначения одновременно многих медикаментов.
- Следует строго соблюдать инструкцию по методике введения лекарственного средства.
- Назначать дозы лекарственных средств в соответствии с возрастом, массой тела больного и учетом сопутствующей патологии.
- Не рекомендуется назначать лекарственные средства, обладающие свойствами гистаминолиберации (парацетамол, вальпромид, вальпроевая кислота, нейролептики фенотиазинового ряда, лекарства пиразолонового ряда, препараты солей золота и др.), пациентам, страдающим заболеваниями желудочно-кишечного тракта, гепатобилиарной системы и обмена веществ.
- При необходимости экстренного оперативного вмешательства, экстракции зубов, введении рентгеноконтрастных веществ лицам с лекарственной аллергией в анамнезе и при невозможности уточнения характера имевшихся нежелательных реакций следует проводить премедикацию: за 1 ч до вмешательства — внутривенно капельно глюкокортикостероиды (4–8 мг дексаметазона или 30–60 мг преднизолона) на физиологическом растворе и антигистаминные препараты.
Таким образом, синдром Стивенса–Джонсона является серьезным заболеванием, требующим ранней диагностики, госпитализации больного, тщательного ухода и наблюдения, рациональной медикаментозной терапии.
Литература
А. Л. Верткин, доктор медицинских наук, профессор
А. В. Дадыкина, кандидат медицинских наук
ННПОС МП, МГМСУ, ЦПК и ППС НижГМА, Москва, Нижний Новгород
Болезнь Кавасаки — редкое иммунокомплексное воспалительное поражение артерий различного калибра, возникающее преимущественно у детей первых лет жизни. Болезнь Кавасаки проявляется лихорадкой, полиморфной диффузной сыпью, конъюнктивитом, поражением слизистой рта, кожи и суставов дистальных отделов конечностей, шейной аденопатией. Диагностика болезни Кавасаки основана на клинических критериях, результатах лабораторных исследований крови и мочи, данных ЭКГ, УЗИ сердца и коронарографии. Основу лечения болезни Кавасаки составляет внутривенное введение иммуноглобулина и прием ацетилсалициловой кислоты, по показаниям применяются антикоагулянты.
Общие сведения
Болезнь Кавасаки получила свое название благодаря открывшему ее в 1961 году японскому педиатру по фамилии Кавасаки. Первоначально предполагалось, что заболевание имеет легкое течение. Лишь в 1965 году был выявлен случай тяжелой сердечной патологии, связанный с перенесенной болезнью Кавасаки. В России первый клинический случай болезни Кавасаки был диагностирован в 1980 году.
Сегодня болезнь Кавасаки является одной из самых распространенных причин приобретенной патологии сердца в детском возрасте. Наиболее часто заболевание встречается среди представителей желтой расы, особенно японцев. В Японии болезнь Кавасаки диагностируется в 30 раз чаще, чем в Австралии или Великобритании и в 10 раз чаще, чем в Америке.

Причины возникновения болезни Кавасаки
Симптомы болезни Кавасаки
Болезнь Кавасаки начинается с подъема температуры тела. Без лечения лихорадка сохраняется в течение 2-х недель. Увеличение лихорадочного периода считается прогностически неблагоприятным симптомом.
Кожные проявления болезни Кавасаки могут возникнуть в течение 5 недель от начала заболевания. Они характеризуются полиморфными диффузными элементами в виде мелких плоских пятен красного цвета (макулярная сыпь), волдырей, скарлатиноподобных или похожих на корь высыпаний. Элементы сыпи располагаются в основном на коже туловища, паховой области и проксимальных отделов конечностей. Со временем возникают эритематозные участки, отмечается болезненное уплотнение кожи ладоней и подошв, обуславливающее ограничение движений в пальцах. Разрешение элементов сыпи при болезни Кавасаки начинается примерно через неделю после их появления. Эритематозные пятна сохраняются 2-3 недели, после чего их поверхность начинает шелушиться.
Поражения слизистых оболочек глаз и ротовой полости. У большинства заболевших болезнью Кавасаки в течение первых 7 дней отмечается появление конъюнктивита обоих глаз, обычно не сопровождающегося выделениями. В некоторых случаях ему сопутствует передний увеит. Наблюдается также сухость и покраснение слизистой оболочки ротовой полости, кровоточащие трещины на губах, малиновая окраска языка и увеличение миндалин. Болезнь Кавасаки в 50% случаев сопровождается увеличением шейных групп лимфатических узлов, чаще односторонним.
Поражение сердца и сосудов при болезни Кавасаки может носить характер миокардита, проявляющегося тахикардией, болями в сердце, аритмией и часто приводящего к острой сердечной недостаточности. У 25% пациентов с болезнью Кавасаки через 5-7 недель от начала заболевания выявляются аневризматические расширения коронарных сосудов сердца, которые могут приводить к развитию инфаркта миокарда. В редких случаях появляется перикардит, аортальная или митральная недостаточность. Возможно возникновение аневризм по ходу крупных артерий: локтевых, подключичных, бедренных.
Суставной синдром наблюдается в 35% случаев болезни Кавасаки и длится обычно до 1 месяца. Типичны артралгии и артриты голеностопных и коленных суставов, поражения мелких суставов кистей и стоп.
Возможно поражение органов ЖКТ с возникновением болей в животе, рвоты, поноса. В отдельных случаях наблюдается менингит, уретрит.
Диагностика болезни Кавасаки
Общепринятыми клиническими диагностическими критериями болезни Кавасаки является наличие на фоне продолжающейся более 5 дней лихорадки как минимум 4 из ниже приведенных признаков.
- Двусторонний конъюнктивит.
- Полиморфная сыпь с диффузным распространением по кожному покрову.
- Поражение слизистой рта.
- Изменения кистей и стоп с их покраснением и отеком.
- Увеличение шейных лимфоузлов.
При выявлении аневризмы коронарных артерий достаточным считается наличие 3 из указанных диагностических признаков.
Лабораторная диагностика не дает специфических признаков болезни Кавасаки, однако совокупность выявленных изменений может стать дополнительным подтверждением правильности диагноза. В клиническом анализе крови определяется анемия, лейкоцитоз со сдвигом лейкоцитарной формулы влево, тромбоцитоз, значительное ускорение СОЭ. Биохимический анализ крови выявляет повышение иммуноглобулинов, серомукоида и трансаминаз, появление ЦИК. В анализе мочи может наблюдаться протеинурия и лейкоцитурия.
С целью диагностики сердечной патологии проводится ЭКГ, рентгенография органов грудной клетки, УЗИ сердца, ангиография коронарных артерий. По показаниям проводят люмбальную пункцию и исследование ликвора.
Лечение болезни Кавасаки
Ацетилсалициловая кислота. В современной медицине этот препарат назначается только при наличие строгих показаний. Однако в лечении болезни Кавасаки он входит в перечень необходимых медикаментов. Цель его применения — снижение риска образования тромбов и противовоспалительная терапия. После снижения температуры тела дозу ацетилсалициловой кислоты понижают до профилактической.
Антикоагулянты (варфарин, клопидогрел) назначаются для профилактики тромбообразования детям с диагностированными аневризмами сосудов. Кортикостероидная терапия при болезни Кавасаки не проводится, так как исследования показали, что она повышает риск коронарного тромбоза.
Прогноз болезни Кавасаки
Примерно в 20% случаев у перенесших болезнь Кавасаки детей сохраняются изменения стенок коронарных артерий, которые в отдаленном будущем могут привести к раннему появлению атеросклероза или кальциноза с последующей ишемией сердца, угрожающей развитием острого инфаркта миокарда. Факторами риска, ускоряющими развитие изменений со стороны коронарных артерий, являются артериальная гипертензия, гиперлипидемия, курение. В связи с этим пациенты с болезнью Кавасаки после выздоровления должны находиться под постоянным наблюдением кардиолога или ревматолога, раз в 3-5 лет проходить полное обследование сердца, включая ЭХО-ЭГ.
Ключевые слова: синдром Стивенса — Джонсона, дети, триггер, маска, дебют, клиника, алгоритм лечения.
Stevens-Johnson syndrome is an immune catastrophe
S.I. Bardenikova 1 , O.S. Pentkovskaya 2 , E.K. Isaeva 2
1 Moscow State University of Medicine and Dentistry named after A.I. Evdokimov, Moscow,
Russian Federation
2 Children’s City Clinical Hospital of St. Vladimir, Moscow, Russian Federation
Stevens-Johnson syndrome (SJS) and toxic epidermal necrolysis (TEN) are rare acute life-threatening skin and mucosal disorders provoked in children mainly by infections and/or medications. According to the modern concept, SJS is a minor variant of TEN characterized by a total area of epidermal detachment less than 10% of the body surface area. However, a patient may present with deep mucosal lesions of at least two organs, e.g., larynx, trachea, bronchi, gastrointestinal tract, bladder or urethra. TEN is characterized by massive epidermolysis which involves more than 30% of the body surface area. Polypragmasia make difficulties for trigger identification while the severity depends on trigger withdrawal and elimination. This disorder is uncommon in paediatrics. Diagnosis is verified mainly by clinical manifestations. SJS debut is similar to acute respiratory infections and rash infections. Late diagnosis is associated with poor outcomes. There are no uniform treatment algorithms, individual treatment choice is required. Clinical case demonstrates that early diagnosis and treatment are vital.
Key words: Stevens-Johnson syndrome, toxic epidermal necrolysis, epidermolysis, life-threatening condition, apoptosis, children, trigger, mask, treatment algorithm.
For citation: Bardenikova S.I., Pentkovskaya O.S., Isaeva E.K. Stevens-Johnson syndrome is an immune catastrophe. Russian Journal of Woman and Child Health. 2019;2(1):66–72.
Представлен клинический случай синдрома Стивенса — Джонсона, относящегося к редким острым жизнеугрожающим заболеваниям кожи и слизистых, индуцированным у детей преимущественно инфекциями и/или лекарственными средствами. Представленный случай подтверждает необходимость своевременной диагностики и ранней терапии.
Актуальность
Патогенез апоптоза кератиноцитов
Триггерные факторы ССД
Клиническая картина ССД и ТЭН
Диагностика
В настоящее время основополагающими в верификации диагноза ССД являются клинические критерии. Диагноз очевиден при наличии типичных по внешнему виду высыпаний, при быстром прогрессировании кольцевидных элементов в буллы с положительным симптомом Никольского и одновременном вовлечении в патологический процесс слизистых оболочек не менее двух органов. Высокоспецифических лабораторных показателей наукой не найдено, однако, поскольку гранулизин продуцируется естественными киллерами и цитотоксическими CD8+ Т-клетками уже на ранней стадии ССД/ТЭН, то его определение помогает при экспресс-диагностике.
Дифференциально-диагностическими критериями ССД в синдроме ССД/ТЭН являются: характер элементов сыпи (распространенные багрово-синюшные, красные пятна или плоские атипичные мишеневидные элементы) и площадь отслоения эпидермиса менее чем на 10% поверхности тела. Площадь поражения возможно оценить приблизительно через 72 ч при стабилизации процесса на фоне стартовой терапии и прекращении новых высыпаний; столько же времени отводится и на верификацию основного диагноза [1, 2]. Методом дополнительной и дифференциальной диагностики ССД/ТЭН (с аутоиммунными буллезными дерматозами, острым генерализованным пустулезом, стафилококковым синдромом обожженной кожи) может служить гистологическое исследование кожи (биопсия). При ССД/ТЭН наблюдаются: тотальный некроз кератиноцитов базального слоя эпидермиса; образование щели над базальной мембраной; отслойка эпидермиса с образованием субэпидермальных булл; вакуольная дегенерация в глубоких слоях эпидермиса; незначительная воспалительная (лимфоцитарная) инфильтрация в зоне перехода эпидермиса в дерму; в клеточном инфильтрате обнаруживаются макрофаги и дендроциты. В период реконвалесценции реэпителизация происходит за счет миграции кератиноцитов из здоровых участков кожи в пораженные. При иммуноморфологическом (иммунофлуоресцентном) исследовании биоптата (криостатные срезы) редко и непостоянно обнаруживается отложение иммунных комплексов в коже и в мелких сосудах сосочкового слоя дермы (периваскулярно), поскольку в генезе ССД превалирует гиперчувствительность замедленного (неиммунокомплексного) типа [1, 2].
Клиническая картина
Лечение ССД и ТЭН
Клиническое наблюдение
Данный клинический случай демонстрирует типичный для детей дебют ССД с симптомов ОРЗ верхних дыхательных путей. Вероятно, в данной ситуации роль триггера, запустившего каскад иммунопатологических реакций, сыграло ЛС, поскольку выявить значимый причинный фактор среди инфекционных агентов (в т. ч. герпес-вирусов) не удалось. Следует обратить внимание на прием пациентом одновременно нескольких ЛС (антибиотик, жаропонижающее, противовирусное) в преддверии развития ССД. Полипрагмазия затрудняет определение индуктора заболевания и осложняет дальнейшие рекомендации по его элиминации. Кроме того, в дебюте заболевания у ребенка наблюдалась длительная лихорадка (более 7 дней), по поводу чего он систематически принимал нестероидные противовоспалительные препараты, вполне вероятно, это способствовало нарушению метаболизма, кумуляции ЛС, превышению допустимой терапевтической суточной и курсовой дозы, что могло вызвать токсическо-аллергическое поражение. Необходимо отметить, что клинический диагноз верифицирован на 14-й день болезни (7-й день пребывания в стационаре), поздняя диагностика повлияла на тяжесть течения ССД (у ребенка пубертатного периода!) и потребовала удвоения стартовой дозы ГКС и расширения объема активной терапии за счет ВВИГ. Использование в комплексной терапии комбинации ГКС с ВВИГ представляет практический интерес ввиду быстрого достижения положительного клинического эффекта.
Заключение
Таким образом, ССД — тяжелая системная токсикоаллергическая реакция, развивающаяся на фоне лечения и/или течения заболеваний различной этиологии. Синдром редко встречается в практике педиатра. Клиническая картина дебюта ССД нередко маскируется проявлениями банального острого вирусного заболевания, особенно герпетической группы, что требует от врача знаний, должного внимания к пациентам и взвешенной осторожности в назначении лекарственной терапии. Однако предугадать возникновение ССД/ТЭН как реакцию на терапевтическую дозу ЛС практически невозможно. В представленном клиническом случае триггерными факторами ССД явились широко используемые ЛС с различной химической структурой, которые вызвали однотипный иммунопатологический ответ с развитием токсико-аллергического поражения органов и тканей организма. Тяжесть и темпы прогрессирования синдрома в определенной степени зависят от скорости отмены и элиминации ЛС, что наглядно подтверждается историей болезни нашего пациента: повлиять на сценарий заболевания удалось лишь после верификации диагноза.
Наш педиатрический опыт подтверждает патогенетическую эффективность и целесообразность стартовой терапии ССД с применения ГКС. Однако надо иметь в виду иммунодепрессивное действие высоких доз ГКС (угнетение клеточного иммунитета, фагоцитоза и переваривающей функции макрофагов), подавляющее антибактериальную защиту. Активация микробной колонизации слизистых может быть спровоцирована терапией ГКС, однако антибактериальная терапия (с применением препаратов широкого спектра действия с учетом госпитальной микрофлоры) предотвратила развитие септического состояния. Интересен опыт комбинированной терапии — ГКС и ВВИГ, обеспечивающей надежный положительный клинический эффект и выздоровление, особенно показанной при поздней верификации диагноза. Следует заметить, что в случаях экстремально тяжелого течения ССД нельзя исключать возможность развития у пациентов вторичного иммунодефицитного состояния, в этой связи ВВИГ являются единственной возможностью восстановления иммунного баланса и модулирования иммунного ответа.
Поиск триггеров ССД в педиатрической практике целесообразно провести среди возбудителей инфекционных болезней. Рационально использовать все методы серологической и ПЦР-диагностики в остром периоде болезни, продолжить поиск в динамике в периоде реконвалесценции (через 1–3 мес.) и далее в катамнезе (до 2–3 лет) с целью предупреждения фатальных для больного рецидивов заболевания. Невысокие титры антиинфекционных антител класса IgG (например, к ВЭБ) в разгар болезни или поздние (сомнительные) титры могут служить положительными (подтверждающими) маркерами, а продолжение их медленного снижения при выздоровлении является доказательством значимости данного инфекционного агента в развитии заболевания.
Аллергологическое обследование относительно основных компонентов ЛС, вызвавшего ССД, рекомендуется провести через месяц после выздоровления, причем рациональнее воспользоваться методами in vitro, современными тест-системами молекулярной диагностики. Необходимо помнить, что в случаях развития острых лекарственных реакций по типу анафилаксии тестирование in vivo категорически противопоказано.
Профилактика эпидермолитических лекарственных реакций базируется на тщательном сборе фармакологического анамнеза, избегании полипрагмазии, использовании ЛС в строгом соответствии с инструкцией (показания, противопоказания с учетом возраста, расчет дозы на основе массы тела, рекомендуемый способ введения). На титульном листе амбу латорной индивидуальной карты развития ребенка и/или стационарной карты больного, на всех справках, направлениях на обследования и т. д. необходимо зафиксировать информацию о ССД и далее указать ЛС, вызвавшее аллергическую реакцию (дату реакции, клинические проявления). Пациенту выдаются паспорт больного аллергическим заболеванием и опознавательный браслет с указанием препаратов, вызвавших ССД. В РФ лекарственный скрининг не проводится. Вызвавшие истинную аллергическую реакцию ЛС (выпускаемые под разными торговыми названиями, содержащиеся в составе комбинированных препаратов, имеющие сходные антигенные детерминанты) не назначаются.
Разработка единых согласительных документов, объединяющих профессиональные стандарты всех специальностей, занимающихся лечением и реабилитацией пациентов с ССД (аллергологов, дерматологов), унифицирует тактические алгоритмы и обеспечит преемственность и последовательность лечебной практики, так важной для тяжелого пациента.
1. Дюбкова Т.П., Жерносек В.Ф. Синдром Стивенса — Джонсона — токсический эпидермальный некролиз у детей. Монография. Минск: РИВШ; 2013.
2. Григорьев Д.В. Многоформная экссудативная эритема, синдром Стивенса — Джонсона и синдром Лайелла — современная трактовка проблемы. РМЖ. 2013;22:1073–1108.
3. Лекарственная аллергия. Под ред. акад. Р.М. Хаитова. Методические рекомендации для врачей. М.: Фармарус принт медиа, 2012.
4. Федеральные клинические рекомендации по ведению больных синдромом Стивенса — Джонсона / токсическим эпидермальным некролизом. Российское общество дерматовенерологов и косметологов. М., 2015.
5. Федеральные клинические рекомендации по диагностике и лечению лекарственной аллергии. M.: RAAKI, 2014 (in Russ.)].
6. Федеральные клинические рекомендации по оказанию помощи детям с многоформной экссудативной эритемой и токсикодермией. Союз педиатров России. М., 2015.
7. Raj D., Brash D.E., Grossman D. Keratinocyte Apoptosis in Epidermal Development and Disease. J Invest Dermatol. 2006;126(2):243–257.
8. Cho Y.T., Chu C.Y. Treatments for Severe Cutaneous Adverse Reactions. J Immunol Res. 2017;2017:1503709. DOI: 10.1155/2017/1503709.
1. Dyubkova T.P., Zhernosek V.F. Stevens — Johnson syndrome is a toxic epidermal necrolysis in children. Monograph. Minsk: RIVS; 2013 (in Russ.).
2. Grigoriev D.V. Erythema multiforme exudative, Stevens — Johnson syndrome and Lyell syndrome are a modern interpretation of the problem. RMJ. 2013;22:1073–1108 (in Russ.).
3. Drug allergies. Ed. Acad. R.M. Khaitov. Methodical recommendations for doctors. M.: Farmarus print media, 2012 (in Russ.).
4. Federal clinical guidelines for the management of patients with Stevens — Johnson syndrome / toxic epidermal necrolysis. Russian Society of Dermatovenerologists and Cosmetologists. M., 2015 (in Russ.).
5. Federal clinical guidelines for the diagnosis and treatment of drug allergy. M.: RAAKI, 2014. (in Russ.).
6. Federal clinical guidelines for assisting children with erythema multiforme exudative and toxicoderma. Union of Pediatricians of Russia. M., 2015 (in Russ.).
7. Raj D., Brash D.E., Grossman D. Keratinocyte Apoptosis in Epidermal Development and Disease. J Invest Dermatol. 2006;126(2):243–257.
8. Cho Y.T., Chu C.Y. Treatments for Severe Cutaneous Adverse Reactions. J Immunol Res. 2017;2017:1503709. DOI: 10.1155/2017/1503709.
ОПРЕДЕЛЕНИЕ
Синдром Стивенса-Джонсона / токсический эпидермальный некролиз – эпидермолитические лекарственные реакции (ЭЛР) – острые тяжелые аллергические реакции, характеризующиеся обширными поражениями кожи и слизистых оболочек, индуцированные приемом лекарственных препаратов.
Классификация
В зависимости от площади пораженной кожи выделяют следующие формы ЭЛР:
- синдром Стивенса-Джонсона (ССД) – менее 10% поверхности тела;
- токсический эпидермальный некролиз (ТЭН, синдром Лайелла) – более 30% поверхности тела;
- промежуточная форма ССД/ТЭН (поражение 10–30% кожи).
Этиология и патогенез
Наиболее часто синдром Стивенса-Джонсона развивается при приеме лекарственных препаратов, однако в некоторых случаях причину заболевания выяснить не удается. Среди лекарственных препаратов, при приеме которых чаще развивается синдром Стивенса-Джонсона, выделяют: сульфаниламиды, аллопуринол, фенитонин, карбамазепин, фенибутазол, пироксикам, хлормазанон, пенициллины. Реже развитию синдрома способствует прием цефалоспоринов, фторхинолонов, ванкомицина, рифампицина, этамбутола, теноксикама, тиапрофеновой кислоты, диклофенака, сулиндака, ибупрофена, кетопрофена, напроксена, тиабендазола.
Заболеваемость ЭЛР оценивается как 1–6 случаев на миллион человек. ЭЛР могут возникать в любом возрасте, риск развития заболеваний возрастает у лиц в возрасте старше 40 лет, у ВИЧ-позитивных лиц (в 1000 раз), больных системной красной волчанкой и онкологическими заболеваниями. Чем старше возраст пациента, серьезнее сопутствующее заболевание и обширнее поражение кожи, тем хуже прогноз заболевания. Смертность от ЭЛР составляет 5–12%.
Для заболеваний характерен скрытый период между приемом препарата и развитием клинической картины (от 2 до 8 недель), необходимый для формирования иммунного ответа. Патогенез ЭЛР связан с массовой гибелью базальных кератиноцитов кожи и эпителия слизистых оболочек, вызванных Fas-индуцированным и перфорин/гранзим-опосредованным апоптозом клеток. Программируемая гибель клеток происходит в результате иммуноопосредованного воспаления, важную роль в развитии которого играют цитотоксические Т-клетки.
Клиническая картина
Cимптомы, течение
При синдроме Стивенса-Джонсона отмечается поражение слизистых оболочек как минимум двух органов, площадь поражения достигает не более 10% всего кожного покрова.
Наиболее тяжелое поражение наблюдается на слизистых оболочках полости рта, носа, половых органов, коже красной кайме губ и в перианальной области, где появляются пузыри, которые быстро вскрываются, обнажая обширные, резко болезненные эрозии, покрытые сероватым фибринозным налетом. На красной кайме губ часто образуются толстые буро-коричневые геморрагические корки. При поражении глаз наблюдается блефароконъюнктивит, возникает риск развития язвы роговицы и увеита. Пациенты отказываются от приема пищи, предъявляют жалобы на боль, жжение, повышенную чувствительность при глотании, парестезии, светобоязнь, болезненное мочеиспускание.
Диагностика
Диагноз синдрома Стивенса-Джонсона основывается на результатах анамнеза заболевания и характерной клинической картине.
При проведении клинического анализа крови выявляется анемия, лимфопения, эозинофилия (редко); нейтропения является неблагоприятным прогностическим признаком.
При необходимости проводят гистологическое исследование биоптата кожи. При гистологическом исследовании наблюдаются некроз всех слоев эпидермиса, образование щели над базальной мембраной, отслойка эпидермиса, в дерме воспалительная инфильтрация выражена незначительно или отсутствует.
Дифференциальный диагноз
Лечение
- улучшение общего состояния пациента;
- регресс высыпаний;
- предупреждение развития системных осложнений и рецидивов заболевания.
Общие замечания по терапии
Лечение синдрома Стивенса-Джонсона проводит врач-дерматовенеролог, терапию более тяжелых форм ЭЛР осуществляют другие специалисты, врач-дерматовенеролог привлекается в качестве консультанта.
При выявлении эпидермолитической лекарственной реакции, врач, независимо от его специализации, обязан оказать больному неотложную медицинскую помощь и обеспечить его транспортировку в ожоговый центр (отделение) либо в реанимационное отделение.
Немедленная отмена приема препарата, спровоцировавшего развитие ЭЛР, увеличивает выживаемость при коротком периоде его полувыведения. В сомнительных случаях следует отменить прием всех препаратов, не являющихся жизненно необходимыми, и в особенности тех, прием которых был начат в течение последних 8 недель.
Необходимо учитывать неблагоприятные прогностические факторы течения ЭЛР:
1. Возраст > 40 лет – 1 балл.
2. ЧСС > 120 в мин. – 1 балл.
3. Поражение > 10% поверхности кожи – 1 балл.
4. Злокачественные новообразования (в т.ч. в анамнезе) – 1 балл.
5. В биохимическом анализе крови:
- уровень глюкозы > 14 ммоль/л – 1 балл;
- уровень мочевины > 10 ммоль/л – 1 балл;
- бикарбонаты < 20 ммоль/л – 1 балл.
Вероятность летального исхода: 0-1 баллов (3%), 2 балла (12%), 3 балла (36%), 4 балла (58%), >5 баллов (90%).
Показания к госпитализации
Установленный диагноз Синдрома Стивенса-Джонсона / токсического эпидермального некролиза.
Схемы лечения
Системная терапия
1. Глюкокортикостероидные препараты системного действия:
- преднизолон (В) 90–150 мг в сутки внутримышечно или внутривенно [1]
или
- дексаметазон (В) 12–20 мг в сутки внутримышечно или внутривенно [2].
2. Инфузионная терапия (допустимо чередование различных схем):
- калия хлорид + натрия хлорид + магния хлорид (C) 400,0 мл внутривенно капельно, на курс 5–10 вливаний
или
- натрия хлорид 0,9% (C) 400 мл внутривенно капельно на курс 5–10 вливаний
или
- кальция глюконат 10% (C) 10 мл 1 раз в сутки внутримышечно в течение 8–10 дней;
- тиосульфат натрия 30% (C) 10 мл 1 раз в сутки внутривенно на курс 8–10 вливаний.
Также является оправданным проведение процедур гемосорбции, плазмафереза (C) [3].
3. При возникновении инфекционных осложнений назначают антибактериальные препараты с учетом выделенного возбудителя, его чувствительности к антибактериальным препаратам и тяжести клинических проявлений.
Особые ситуации
Лечение детей
Требует интенсивного междисциплинарного взаимодействия педиатров, дерматологов, офтальмологов, хирургов:
- контроль за жидкостным балансом, электролитами, температурой и артериальным давлением;
- асептическое вскрытие еще упругих пузырей (покрышку оставляют на месте);
- микробиологический мониторинг очагов на коже и слизистых оболочках;
- уход за глазами и полостью рта;
- антисептические мероприятия, для обработки эрозий у детей применяют анилиновые красители без спирта: метиленовый синий, бриллиантовый зеленый;
- неадгезивные раневые повязки;
- помещение больного на специальный матрац;
- адекватная обезболивающая терапия;
- осторожная лечебная гимнастика для предупреждения контрактур.
Требования к результатам лечения
- клиническое выздоровление;
- предупреждение развития рецидивов.
ПРОФИЛАКТИКА
Профилактика рецидивов синдрома Стивенса–Джонсона заключается в исключении препаратов, вызвавших данное заболевание. Рекомендуется носить опознавательный браслет с указанием препаратов, вызвавших синдром Стивенса–Джонсона.
Читайте также:

