Кортикостероиды при кератитах глаза
Обновлено: 24.04.2024
Микробный кератит у ребенка - клиника, диагностика и лечение
Инфекция роговицы здорового глаза случается редко, благодаря защитным эффектам чувствительности роговицы и мигательного рефлекса, а также наличию врожденных противомикробных агентов (например, дефензинов) в слезной пленке и на поверхности глаза. Кератит может развиться, если какой-либо из этих компонентов нарушен. Восстановление зрения и профилактика амблиопии являются основными проблемами у маленьких детей с воспалением роговицы.
Основными факторами риска микробной инфекции у детей являются травма, заболевание поверхности глаза (ВКК, трихиаз, БКК, врожденная анестезия роговицы, воздействие опухоли глазницы, болезнь сухости глаз и влияние других причин, таких как ихтиоз), системное заболевание (системный иммунодефицит, ССД/ТЭН, дефицит витамина А и корь) и ранее проводившаяся хирургическая операция на роговице.
Ортокератология (коррекция ошибки рефракции путем формирования роговицы специальной контактной линзой) является особым риском у подростков, о котором сообщается в основном в странах Азии. Относительная роль этих факторов меняется в зависимости от возраста, пола и географической широты. У детей до трех лет основными факторами риска являются системные заболевания и врожденное заболевание наружных структур глаза. В возрасте до пяти лет у детей в развивающихся странах значительным риском является бедное белками и витамином А питание.
У подростков в странах третьего мира важной причиной микробного кератита является ношение контактных линз. Частота микробного кератита у мальчиков выше, вероятно, по причине более высокого процента травм.
Кератит вызывают разные возбудители. Во всех центрах у маленьких детей регистрируется высокая частота коагулаза-отрицательных стафилококков, золотистого стафилококка и стрептококков. Инфекция Pseudomonas чаще встречается у детей старшего возраста и связана с ношением контактных линз. Грибковые инфекции регистрируются в 10-18% случаев, в субтропических и тропических регионах после травмы обычны инфекции нитевидных грибов (Fusarium, Aspergillus), а инфекции дрожжевых организмов (Candida spp.) являются особым фактором риска у ослабленных детей. Часто встречаются также полимикробные инфекции.
Может развиваться также иммунный (стерильный кератит). Он возникает вследствие иммуноопосредованного воспаления. Иммунные инфильтраты обычно небольшие, без крупного дефекта эпителия, и находятся на периферии роговицы. Они быстро реагируют на местный антибиотик и низкие дозы топического кортикостероида. Если диагноз вызывает сомнения, такие случаи следует лечить как инфекционный кератит.
а - Бактериальный кератит экспозиционного типа у ребенка с синдромом Мебиуса.
б - Тяжелое изъязвление роговицы вследствие инфекции Pseudomonas aeruginosa у подростка, носившего мягкие контактные линзы по поводу миопии.
Наблюдается обширное расплавление роговицы и гипопион.
а) Первичный осмотр при кератите. Необходимо зарегистрировать следующее:
• Размеры очагов, максимальную длину и ширину дефекта эпителия и инфильтрата и расстояние от лимба.
• Истончение стромы в процентах от нормальной толщины роговицы.
• Активность процесса в передней камере, в том числе наличие фибрина, клеток и гиперемии
• Наличие и высоту гипопиона.
• Присутствие перфорации.
• Устранимые факторы риска инфекции, такие как трихиаз или внешние воздействия.
б) Исследования. При подозрении на микробную инфекцию незамедлительно проводится терапия антибиотиками широкого спектра действия. Диагностические тесты не имеют существенного значения и могут потребовать седации пациента. Взятие материала для посева на культуру и чувствительность к антибиотикам позволяет получить эпидемиологические данные и выбрать альтернативную терапию при неэффективности проводимого лечения или ухудшении состояния. Культуральный анализ важен в следующих случаях:
• Клинический диагноз вызывает сомнения.
• Отсутствует ответ на эмпирическую терапию первого выбора.
• Подозревается необычный патоген (например, грибы, амеба, микроспоридий).
Минимальное исследование должно включать материал на слайде для микроскопии с окрашиванием по Граму, инокулированный на пластинах с кровяным агаром. Большинство видов грибов растет на кровяном агаре. При подозрении на акантамебу и грибы следует включить бедный питательными веществами агар (Стюарта) и агар Сабуро. Образцы необходимо инокулировать прямо на среду и не помещать в транспортные среды. Материал берется в форме мини-биопсии гипотермической иглой калибра 21G. Рост большинства патогенов можно ожидать через 48 часов. Посев на культуру грибов и акантамебу инкубируют до семи дней.
Чувствительность обычно определяют для бактерий и грибов, но не для акантамебы. Гистологическое исследование должно включать иммуногистохимию для идентификации кист акантамебы и трофозоитов и окрашивание серебром на гифы грибов. Конфокальная микроскопия подтверждает наличие грибов и кист акантамебы; эта процедура возможна у детей старшего возраста.

в) Терапия кератита. Основной целью терапии является стерилизация роговицы и ее заживление. Стерилизация может быть быстрой; она предшествует заживлению эпителия и разрешению воспаления.
1. Первичный выбор антибиотиков при кератите. Этот выбор зависит от местных эпидемиологических данных о распространенных патогенах роговицы и об их чувствительности к противомикробным препаратам. В зонах умеренного климата причиной более 90% инфекций являются бактериальные изоляты. В зонах тропического климата 50% случаев могут быть вызваны грибковой инфекцией. Полимикробная инфекция регистрируется в 5-10% случаев. Выбор местных антибиотиков при бактериальном кератите представлен в таблице 15.8, но его следует модифицировать в зависимости от региональных особенностей.
Первым выбором является монотерапия фторхинолоном или комбинацией концентрированных растворов аминогликозида и цефалоспорина (на рынке готовые формы отсутствуют). У взрослых эти две альтернативы обладают сравнительно равной эффективностью. Хотя устойчивость к фторхинолону и аминогликозидам является проблемой в некоторых регионах США и Индии, в Великобритании она в настоящее время отсутствует. Поскольку фторхинолоны не всегда адекватно подавляют стрептококки, целесообразно применять комбинацию фторхинолонов и цефалоспорина в повышенной концентрации, поскольку стрептококковая инфекция часто встречается у маленьких детей.
2. Лечение кератита в фазу стерилизации. В начале каждый час применяют глазные капли: длительность приема в течение 48 часов обеспечивает широкую границу безопасности. Предпочтительна госпитализация пациента, за исключением случаев гарантированной комплаентности. Частоту местной терапии уменьшают до 4 раз в день до заживления (например, реэпителизации роговицы). Для обеспечения стерилизации в случае грибковых и амебных инфекций необходима длительная терапия. Системные противомикробные препараты назначаются только при язвах рядом с лимбом, чтобы предотвратить распространение в склеру, или при наличии острой либо начинающейся перфорации роговицы.
Вспомогательная терапия может включать циклоплегию, анальгетики и гипотензивные препараты против вторичной глаукомы. Субконъюнктивальная инъекция антибиотика широкого спектра действия вводится, если было необходимо обследование под анестезией, или в случае плохой комплаентности, но при этом в роговице не достигается более высоких концентраций лекарства, чем при местном применении.
После инициации терапии возможно первоначальное усиление воспаления вследствие высвобождения эндотоксинов. Явные признаки прогрессирования заболевания спустя 48 часов (увеличивается истончение стромы или наблюдается явная экспансия язвы) указывают на нечувствительность пациента к данному виду терапии или на плохую комплаентность. При необходимости пациента госпитализируют и пересматривают результаты микробиологического анализа.
На этом этапе переход на альтернативную терапию не показан, если нет указаний на резистентность к первоначальной терапии. У детей осложнения случаются часто.
Даже при раннем распознавании и соответствующем лечении, процент хирургических вмешательств достигает 6-28%. При угрозе или фактическом наличии перфорации применение цианоакрилатного клея может стабилизировать ситуацию. Может потребоваться пластинчатая или пенетрирующая кератопластика, хотя высок риск отторжения трансплантата и амблиопатии. В случае крупных перфораций у младенцев больше подходит конъюнктивальный лоскут. Если состояние ухудшается или через неделю отмечается безболезненное воспаление, повторяют посев на культуру прихотливых, требовательных к питательным средам микроорганизмов или показана биопсия.
3. Фаза заживления. Даже после стерилизации роговичной язвы заживление может задерживаться вследствие персистирующего воспаления, токсичности терапии или неэффективного устранения провоцирующих факторов (например, незащищенности от воздействий окружающей среды, болезни сухости глаз). Следует, насколько возможно, применять лекарства без консервантов и лечить заболевание глазной поверхности.
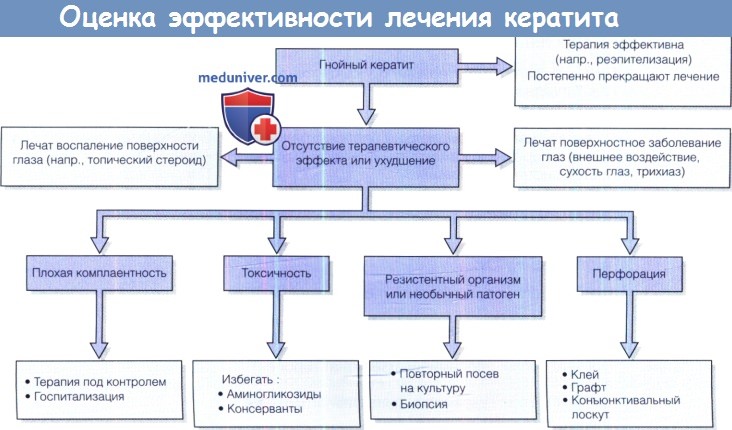
4. Применение топических кортикостероидов. Топические кортикостероиды уменьшают воспаление, которое может задерживать заживление. Однако их следует применять осторожно, поскольку при этом усиливается рост грибов и герпетическая инфекция. У взрослых применение кортикостероидов в качестве вспомогательной терапии микробного кератита особенной пользы не приносит. Заживление произойдет без топических стероидов, но медленнее, чем при их применении. У пациентов с проникающей кератопластикой, у которых исключена грибковая инфекция, кортикостероидная терапия инициируется в начале инфекции для защиты от отторжения аллографта.
Вариантом для купирования воспаления в случаях подозрения на грибковую инфекцию может быть топический циклоспорин, который не усиливает рост грибов.
г) Прогрессирующий или безболезненный микробный кератит. Микробный кератит, прогрессирующий после пяти дней интенсивной местной терапии антибиотиками широкого спектра действия, является указанием на необходимость повторного посева на культуру с применением специальных сред или биопсии роговицы с санацией язвы для усиления проникновения противомикробных лекарств. Прекращение терапии за 24 часа до повторного взятия материала может повысить шансы на выявление патогена, но существует риск быстрого прогрессирования инфекции в этот промежуток времени. При проведении биопсии половина материала направляется на гистологическое исследование, а другая половина измельчается и высевается.
Микробиолога следует проконсультировать относительно оптимальной среды для изоляции, обычно предусматривается модифицированное окрашивание по Цилю-Нильсену. Для культивирования медленно растущих патогенов может потребоваться до трех недель, поэтому лабораторию просят провести расширенную инкубацию. В ожидании результатов гистопатологического исследования, на основании клинических и эпидемиологических данных, назначают терапию, направленную против наиболее вероятного патогена.
Для грибкового кератита характерен белый стромальный инфильтрат с волнистыми краями, сателлитные очаги, гипопион и образование эндотелиальной бляшки. Лечение зависит от местных эпидемиологических данных. Рекомендации по противогрибковой терапии представлены в таблице ниже. В США и некоторых других странах препаратом выбора в случае нитевидной грибковой инфекции является доступный на рынке натамицин 5%, для Candida spp. применяется амфотерицин В. Системная терапия рекомендуется в случае глубокой стромальной инфекции нитевидных грибов из-за риска прорастания грибов через децеметову мембрану в переднюю камеру.
Субконъюнктивальные, внутристромальные или внутрикамерные инъекции амфотерицина являются дополнительными вариантами достижения терапевтических уровней концентрации лекарства. Для купирования прогрессирующей инфекции нитевидных грибов может потребоваться ранняя эксцизионная кератопластика.
В некоторых регионах новой причиной кератита является инфекция роговицы, вызванная микроспоридиями. Крупные серии случаев из Сингапура и Южной Индии сообщают об инфекции у иммунокомпетентных пациентов в связи с загрязнениями почвой, травмами и ношением контактных линз. Наиболее распространенной клинической картиной является грубая точечная эпителиопатия. Диагноз подтверждается гистологическим исследованием биопсии эпителия. Хотя рекомендуются топические фторхинолоны, заболевание разрешается самостоятельно с хорошим исходом для зрения. Строма микроспоридиями поражается крайне редко, эрадикация микроорганизмов в этом случае затруднена. Часто требуется эксцизионная кератопластика.
К вариантам терапии при поражении стромы относятся топический фумадил-В 0,3% (действующее вещество фумагиллин) и системный албендазол.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для цитирования: Ставицкая Т.В. Глюкокортикостероиды в терапии воспалительных заболеваний глаз. РМЖ. Клиническая офтальмология. 2000;1(4):120.
Воспалительные заболевания глаз являются серьезной медико-социальной проблемой практической офтальмологии, так как воспаление приводит к опасным, подчас необратимым изменениям тканей глаза. Первое место в терапии воспалительных заболеваний глаз занимают глюкокортикостероиды (ГКС). ГКС образуются из холестерина в корковом веществе надпочечников. Механизм действия стероидных гормонов сводится к регулированию активности некоторых генов. ГКС проникают внутрь клетки-мишени, в цитоплазме взаимодействуют со специфическим белковым рецептором и проникают в ядро клетки, где соединяются с участком ДНК. Их эффект развивается медленно, в течение нескольких часов, поскольку он является следствием синтеза новых РНК и новых функциональных белков, в частности, микрокортина, который тормозит активность фосфолипазы А2 и благодаря этому уменьшается образование из фосфолипидов арахидоновой кислоты – предшественника простагландинов и лейкотриенов. Противовоспалительный и противоаллергический эффекты ГКС связаны также с торможением миграции и выделения тучными клетками различных медиаторов воспаления (гиалуронидазы, гистамина и т.д.). В отличие от других противовоспалительных средств, у ГКС наиболее четко выражено антипролиферативное действие: ГКС угнетают пролиферацию фибробластов и синтез ими коллагена.
Иммуносупрессивное действие ГКС обусловлено избирательным торможением функции и развития иммунокомпетентных лимфоидных клеток, а не неспецифическим цитостатическим действием, которое свойственно другим иммунодепрессантам. Под их влиянием происходит уменьшение размеров лимфоидных органов, разрушение средних и малых лимфоцитов тимуса, угнетение антителообразования и образования иммунных комплексов.
Таким образом, ГКС обладают несколькими эффектами:
• стабилизируют клеточные мембраны тучных клеток
• уменьшают проницаемость капилляров, оказывают антиэкссудативный эффект
• стабилизируют мембраны лизосом
• обладают антипролиферативным и иммунодепресивным действием
• ингибируют экспрессию генов, кодирующих синтез белков, участвующих в развитии воспаления.
История открытия лечебного эффекта ГКС началась в 1929 г., когда Хенч обратил внимание на улучшение течения ревматоидного артрита в период заболевания желтухой. В 1948 г. был получен продукт метаболизма природного глюкокортикостероида кортизола – кортизон и начато применение ГКС.
Синтетические аналоги природных ГКС, содержащие фтор и метильную группу, более активны в связи с тем, что они медленнее метаболизируются в организме. Кроме того, они не вызывают задержку ионов натрия и воды в тканях (не оказывают минералкортикоидного действия). Сравнительная характеристика ГКС представлена в табл. 1.
Лекарственные формы, используемые в офтальмологии, содержат практически все группы ГКС:
1. ГКС короткого действия (6–8 ч) – гидрокортизона 0,5% глазная мазь (“Гидрокортизон”); 1 и 2,5% глазная мазь (“Гидрокортизон ПОС№1” и “Гидрокортизон ПОС№2,5”).
2. ГКС средней продолжительности действия (12–36 ч) – преднизолона 0,5% глазная суспензия (“Преднизолон”) и 1% глазные капли (“Инфранефран форте”).
3. ГКС длительного действия (до 72 ч) – дексаметазона 0,1% глазные капли (“Дексапос”) и 0,1% глазная мазь (“Максидекс”); бетаметазон 0,1% глазные капли (“Бетакортал”) и 0,1% глазная мазь (“Бетамофталь”).
Показания к использованию ГКС в офтальмологии довольно широки:
• аллергические заболевания глаз (дерматиты век, блефариты, конъюнктивиты и кератоконъюнктивиты)
• увеиты
• симпатическая офтальмия
• профилактика и лечение воспалительных явлений после травм и операций
• восстановление прозрачности роговицы и подавление неоваскуляризации после перенесенных кератитов, химических и термических ожогов (после полной эпителизации роговицы).
Однако подходы к использованию различных лекарственных форм зависят от выраженности противовоспалительного действия и всасываемости ГКС, входящего в состав препарата.
Например, гидрокортизон плохо проникает через роговицу во внутриглазную жидкость, и поэтому он используется для лечения аллергических и воспалительных заболеваний век и конъюнктивы. Кроме того, противовоспалительная активность гидрокортизона значительно ниже по сравнению с другими ГКС, поэтому наиболее целесообразно использование препаратов, содержащих более высокие концентрации гидрокортизона (Гидрокортизон ПОС №1% и Гидрокортизон ПОС№2,5% глазные мази). Следует отметить, что эта глазная мазь имеет мелкодисперсную структуру, поэтому лучше переносится больными при закладывании ее в нижний конъюнктивальный свод.
Наиболее широко в офтальмологии используют ГКС длительного действия, обладающие высокой эффективностью и хорошо проникающие в ткани глаза – дексаметазон и бетаметазон. Дексаметазон используется в виде глазной суспензии (“Дексаметазон”) или глазных капель (раствор – “Офтан-дексаметазон”). При выборе лекарственной формы дексаметазона следует учитывать, что продолжительность их действия одинакова, но суспензия раздражает ткани глаза и хуже переносится больными.
Более длительным противовоспалительным действием обладают растворы дексаметазона, содержащие гидроксиметилцеллюлозу (“Дексапос” 0,1% глазные капли) и мазевые формы дексаметазона (“Максидекс” 0,1% глазная мазь). При их назначении необходимо учитывать, что раствор лучше переносится больными, не вызывает затуманивания зрения и его использование предпочтительнее в раннем послеоперационном периоде.
Для профилактики и лечения воспалительных осложнений после травм и операций в практической офтальмологии широкое использование получили комбинированные лекарственные средства, содержащие глюкокортикостероид и антибиотик. Одним из препаратов данной группы является “Дексагентамицин” (глазные капли и мазь). Данный препарат содержит один из наиболее активных ГКС – дексаметазон. Вторым составляющим препарата “Дексагентамицин” является антибиотик гентамицин. Гентамицин - аминогликозид II поколения, обладающий широком спектром противомикробного действия. В зависимости от выраженности воспалительного процесса частота применения препарата может быть различной. В случае тяжелого воспаления возможно применение препарата каждые 1–2 часа. По мере уменьшения выраженности воспаления частота инстилляций снижается до 3–4 раз в день.
При использовании комбинированных препаратов необходимо помнить о возможности развития побочных эффектов, связанных с использованием как ГКС, так и антибактериального средства. Терапия ГКС может привести к повышению внутриглазного давления с последующим развитием глаукомы, помутнению хрусталика, замедлению заживления ран и развитию вторичной, в том числе и грибковой, инфекции. Длительное использование антибиотиков вызывает развитие резистентной по отношению к данному антибиотику флоры и приводит к неэффективности дальнейшей терапии.
В заключение следует отметить, что применение глюкокортикостероидных препаратов позволяет активно подавлять воспалительную реакцию в тканях глаза, и тем самым предотвращает развитие тяжелых осложнений, которые могут привести к инвалидизации больных. Клинический эффект глюкокортикостероидных средств зависит от противовоспалительной активности, продолжительности действия и всасываемости препарата. Их длительное применение может привести к серьезным побочным эффектам.
Для цитирования: Каспаров А.А. Современные аспекты лечения герпес-вирусного кератита. РМЖ. Клиническая офтальмология. 2000;1(2):59.
В странах умеренного пояса вирусные кератиты доминируют среди различных проявлений патологии роговицы. Наиболее часто это заболевание роговицы вызывает вирус простого герпеса. Герпес-вирусный кератит (ГК) прочно занимает первое место среди причин корнеальной слепоты. Клиническая тяжесть заболевания, высокая функциональная ценность глаза и социальные последствия во многом объясняют тот факт, что ГК человека, как правило, был первой мишенью для испытания новейших противовирусных средств, включая ИДУ (5-йод-2-дезоксиуридин), человеческий интерферон, и вирусный индуктор интерферона интерфероноген [1–3]. За прошедшие 30 лет сформировались три основных направления противовирусной терапии ГК:
1) химиотерапия;
2) неспецифическая (индукторы интерферона, иммуномодуляторы, интерфероны);
3) специфическая (герпетическая вакцина, противогерпетический иммуно- глобулин).
Исследования, проводившиеся в ряде научных центров нашей страны (Клиника глазных болезней ММА им.
И.М. Сеченова, НИИ глазных болезней, НИИ вирусологии им.Д.И. Ивановского, НИИ полиомиелита и вирусных энцефалитов, МНИИ глазных болезней им.Гельмгольца Минздрава РФ), впервые привели к разработке и внедрению в клиническую практику трех новых эффективных направлений в лечении ГК [4–10].
1. Метод неспецифической противовирусной терапии, высокоэффективный в лечении различных проявлений офтальмогерпеса, основан на местном и системном введении индукторов интерферона интерфероногенов, обладающих широким спектром противовирусного иммуномодулирующего действия. Налажен производственный выпуск первого отечественного высокоактивного интерфероногена полудана (комплекс поли А: поли У). В настоящее время полудан выпускается в виде ампул и флаконов-капельниц.
2. В основу не существовавшей ранее эффективной методики противорецидивной терапии положен принцип специфической иммунокоррекции посредством системного курсового введения герпетической вакцины в сочетании с кратковременными инстилляциями интерферонoгeнов. Организован производственный выпуск вакцины в Одессе и Санкт-Петербурге. Предложена очаговая аллергическая проба с герпетической вакциной, впервые открывшая возможность неинвазивной этиологической диагностики внутриглазного герпеса. На Международной конференции по глазным инфекциям (Иерусалим, 1995 г.) [5] указанные методики получили название “Русский метод иммунодиагностики и иммунотерапии” (J. Gordon).
3. Система щадящих микрохирургических методик, адаптированных к лечению активного ГК и его исходов (аргонлазеркоагуляция, микродиатермокоагуляция, внутриглазная инфузия полудана, бесшовный метод кератопластики, эксцентричная неперфорирующая миникератопластика, полная стромэктомия + кератопластика, тройная процедура и др.). Разработаны рациональные методы послеоперационной терапии, микродиатермокоагулятор для лечения язв роговицы и набор инструментария для лечебной кератопластики (совместно с Казанским медико-инструментальным заводом).
Учитывая характер данного офтальмологического издания, представляется целесообразным сделать акцент на практических аспектах лечения ГК. Лечение типичной формы ГК – эпителиального древовидного кератита – мы начинаем с частых инстилляций (6–8 раз в день) одного или двух из нижеследующих противовирусных средств: полудана, пирогенала в концентрации 20 мг в 1 мл дистиллированной воды, рекомбинантного интерферона реаферона либо 3–5 разовых аппликаций 3% мази ацикловира.
Рандомизированные исследования, проведенные в группах больных древовидным кератитом (общая численность 700 человек), показали, что большая часть приведенных противовирусных препаратов, включая 0,25–0,5% мази флореналь и теброфен, обладает примерно одинаковым терапевтическим потенциалом с Офтан ИДУ (0,1% 5-йод-2-дезоксиуридин). Первое противовирусное средство Офтан ИДУ приводит к выздоровлению 2/3 больных древовидным кератитом, и при использовании его в сроки до 3 нед дает меньше побочных реакций, чем мази флореналь, теброфен и бонафтон. Определенными преимуществами перед Офтаном ИДУ обладают полудан и ацикловир. Они заключаются в лучшей переносимости, возможности более длительного применения, а также использования других путей введения (периокулярные инъекции для полудана и пероральное применение для ацикловира), что особенно показано в случаях сочетанного поражения эпителия, стромы и наличия сопутствующего иридоциклита у больных древовидным кератитом.
Целесообразно комбинированное применение интерферона или интерфероногенов с химиотерапевтическими препаратами (Офтан ИДУ, ацикловир), обеспечивающее синергидный эффект. При этом число местных аппликаций каждого из препаратов снижают вдвое (см. таблицу).
Согласно данным Центра по офтальмогерпесу, работающему на базе НИИ глазных болезней РАМН, наилучшим образом отвечают современным требованиям, предъявляемым к лечению активных проявлений герпетической болезни глаз, два химиотерапевтических противовирусных препарата: полудан и ацикловир. Характерно, что оба препарата наряду с выраженным ингибирующим воздействием на вирус простого герпеса обладают минимальным побочным действием (токсико-аллергические реакции). Это позволяет применять их достаточно длительно не только местно в виде инстилляций и аппликаций, но и системно, что является основной предпосылкой для успешной терапии тяжелых проявлений офтальмогерпеса.
Полудан – биосинтетический полирибонуклеотидный комплекс, обеспечивающий при субконъюнктивальном введении выработку интерферона не только в тканях глаза, но и в крови (рис. 1, 2). Ацикловир – ациклический аналог дезоксигуанозина. В эксперименте на модели экспериментального герпетического кератита кроликов, а также в клинике установлено возрастание терапевтического эффекта при комбинированном применении этих двух базовых препаратов, обладающих различным механизмом ингибирующего воздействия на внутриклеточный вирус. Это выразилось в достоверном сокращении сроков лечения и увеличении числа вылеченных больных при снижении дозы каждого из препаратов. Сравнительные контрольные исследования показали, что совместное применение этих двух базовых препаратов представляется наиболее эффективным.
Третий базовый препарат – это герпетическая вакцина, ставшая основой впервые разработанной противорецидивной терапии офтальмогерпеса. Препарат создан в Институте вирусологии им. Д.И. Ивановского РАМН, а новые его возможности раскрыты в НИИ глазных болезней РАМН.
Препарат используют у больных, страдающих частыми обострениями офтальмогерпеса, применяя в межрецидивный период в виде повторяющихся каждые полгода курсов внутрикожных инъекций. Противорецидивный эффект вакцинации, заключающийся в активации клеточного иммунитета, усиливается при сочетании с местным применением индуктора интерферона полудана и системным использованием средств неспецифической иммунотерапии (тималин, тактивин и др.).
При отсутствии четких признаков ремиссии процесса при лечении противовирусными медикаментами в течение первых 3–5 дней, а нередко и в первый день обращения мы прибегаем к микродиатермокоагуляции – соскобу. Комбинированное лечение способствует существенному сокращению среднего срока лечения. Процедуру проводят с использованием специально созданного для роговицы электрохирургического высокочастотного аппарата АХВЧ-5-1-O (НПО “Экран”), обладающего плавной регулировкой, звуковой и световой сигнализацией, набором микроэлектродов. Данная методика эффективна в лечении вирусных и гнойных язв роговицы, обладает рядом преимуществ перед другими микрохирургическими приемами (механический соскоб, криопексия, лазеркоагуляция и др.), учитывая доступность прибора по цене, а также возможность использования в глазном кабинете поликлиники. Использование эксимерного лазера не решает проблему излечения активных стромальных кератитов, однако является весьма успешным в устранении поверхностных помутнений в центральной зоне роговицы после вирусных кератитов.
Лечение стромального ГК требует не только местного (инстилляции, аппликации), но и системного введения противовирусных средств. К ним в первую очередь могут быть отнесены обладающие противовирусной и иммуномодулирующей активностью полудан и реаферон, а из химиотерапевтических средств – ацикловир и его производное вальтрекс в таблетках. Следует отметить широту противовирусного спектра полудана, реаферона, оказавшихся эффективными в лечении аденовирусных кератоконъюнктивитов [9, 11].
Полудан в течение последних 10 лет зарекомендовал себя как эффективное и нетоксичное противовирусное средство. Препарат, применяемый для лечения герпетических кератоиридоциклитов в виде повторных периокулярных и внутриглазных инъекций, позволяет получить выраженный терапевтический эффект у 50–60% больных. По своей эффективности полудан не уступает ацикловиру, при этом стоимость курсовой дозы полудана (20 ампул по 10 ед.) в 2–3 раза ниже таковой при использовании ацикловира перорально (40–50 таблеток по 200 мг). Комбинированное применение обоих препаратов позволяет добиться успеха у 70% больных с признаками герпетического кератоиридоциклита (увеакератита). Исследования, проведенные НИИ глазных болезней РАМН совместно с кафедрой иммунологии РГМУ (Л.В. Ковальчук, А.С. Павлюк, Т.Ю. Ульянова), показали, что введение полудана приводило к значительному усилению активности естественных киллеров, исходно сниженной у больных офтальмогерпесом. Исследования влияния полудана на иммунологические показатели в системе in vitro показывают, что препарат стимулирует не только естественную цитотоксичность (рис. 3), но и функционирование других иммунокомпетентных клеток, в регуляции активности которых существенную роль играет интерферон [7, 9]. Впервые установлено антиапоптозное влияние полудана на культуру лимфоцитов [12]. На основе соединения полудана с аутокровью больного разработана (совместно с Е.А. Каспаровой) экспресс-аутоцитокинотерапия, позволившая повысить эффективность лечебных мероприятий при тяжелых формах герпес-вирусного кератоиридоциклита [8] (рис. 4).
Методика применения реаферона сходна с таковой при использовании полудана, терапевтическая эффективность ее несколько ниже, однако побочные аллергические реакции встречаются чаще.
В комплексном лечении стромальных форм ГК с определенным успехом используют иммуномодуляторы – тималин, тактивин, левамизол, ликопид, нуклеинат натрия и др.
В процессе изучения находятся следующие отечественные интерфероногены и иммуномодуляторы: ридостин, циклоферон, амиксин, ларифан, xeлeпин, актимол и дp. [5]. Клинические испытания первого отечественного химиопрепарата для перорального применения бонафтона не подтвердили его терапевтическую эффективность, но свидетельствовали о токсичности препарата [7].
Наш опыт подтверждает необходимость использования при лечении ГК минимума лекарственных средств помимо противовирусных препаратов: инстилляций мидриатиков, растворов антибиотиков или антисептиков при наличии патогенной микрофлоры в мазке с конъюнктивы или профилактически при обширных язвенных дефектах. Опыт показывает, что медикаментозная аллергия развивается как вследствие индивидуальной непереносимости противовирусных средств, так и при перегруженности лечения антибиотиками, витаминными препаратами и т.д. В этих случаях необходимо определить минимум хорошо переносимых противовирусных средств (растворы пирогенала или полудана), внутрь назначить антигистаминные препараты, местно – примочки с раствором борной кислоты и инстилляции кромогликата натрия (лекролина). Применение кортикостероидов противопоказано при язвенных формах ГК. В то же время, учитывая, что герпес-вирусная инфекция роговицы сопровождается целым рядом местных иммунных реакций, применение кортикостероидов показано в качестве патогенетической терапии при стромальных формах, протекающих без изъязвления. Мы предпочитаем в таких случаях применять инстилляции 0,01% дексаметазона “под зонтиком” противовирусной терапии через 1–2 нед после ее начала. Использование больших доз кортикостероидов (субконъюнктивальные инъекции) без должного противовирусного прикрытия способно привести к тяжелейшим последствиям вплоть до гибели глаза (перфорация роговицы, вторичная глаукома, гнойный иридоциклит, эндофтальмит).
При всех успехах противовирусной терапии у 30–35% больных с герпетическими кератоиридоциклитами не удается добиться излечения медикаментозным путем. В этих случаях лечение необходимо дополнять микрохирургическими методами. Наш опыт, включающий свыше 1000 операций при активном ГК и его исходах, свидетельствует о высокой эффективности ранней послойной лечебной кератопластики. Успех операции во многом определяется использованием щадящих методик операции, радикальным иссечением зоны воспаления с помощью усовершенствованного инструментария и рациональной послеоперационной терапией (интерфероногены, ацикловир, противогерпетическая вакцинация). Купирование процесса удается у 92% больных, повышение остроты зрения в пределах 0,2–1,0 с переносимой коррекцией – у 60% больных (рис. 5).
Основой противорецидивного лечения является противогерпетическая вакцинация, показанная двум группам риска: 1) больным с наличием частых обострении ГС (1 раз и более в год); 2) больным, перенесшим лечебную кератопластику. Для вакцинации используют культуральную инактивированную герпетическую вакцину, выпускаемую Санкт-Петербургским НИИ вакцин и сывороток. Схемы вакцинации подробно описаны в нашей монографии “Офтальмогерпес”. В сочетании с вакциной местно и системно применяют интерфероногены и иммуномодуляторы. Комплексное противорецидивное лечение проводится в течение 3–5 лет, способствует прекращению (60%) рецидивов или их урежению (26% больных). Лишь у 10–11% больных частота рецидивов не изменялась.
В последние годы с целью профилактики рецидивов генитального герпеса и офтальмогерпеса предпринимаются попытки длительного лечения (свыше 1 года) ацикловиром перорально. Применение такого рода лечения при ГК нам представляется весьма проблематичным как с медицинской, так и с экономической точки зрения.
В заключение хотелось отметить, что дифференцированное и своевременное использование представленных методов и средств лечения ГК во многом решеют проблему успешного контроля и управляемости герпес-вирусной инфекции роговицы.
Литература
1. Куничева Г.С., Каспаров А.А., Вильнер Л.М., Зейтленок Н.А. Клинический опыт применения интерфероногена при лечении аденовирусных и герпетических поражениях глаз // Вестн.офтальмол. 1966; 6: 17–20.
2. Kaufmnan H.E. Nesburn А.В., Maloney S.D. DU therapy of herpes simplex // Arch.Ophthalmol. 1962; 67 (5): 583–91.
3. Tommila V. Treatment of dendritic keratitis with interferon // Aсta Ophthalmol. 1963; 41 (5): 478–82.
4. Баринский И.Ф., Шубладзе А.К., Каспаров А.А., Грибенюк В.Н. Герпес (этиология, диагностика, лечение), М., Медицина, 1986; 269.
5. Ершов Ф.И. Антивирусные препараты. М., Медицина, 1998; 192.
6. Каспаров А.А. Значение индукторов интерферона в современной противовирусной терапии герпетической болезни глаз // Вести.офтальм. 1972; 2: 63–7.
7. Каспаров А.А. Офтальмогерпес. М., Медицина, 1994; 224.
8. Каспаров А.А., Каспарова Евг.А. Локальная экспресс-ауто-цитокинотерапия (ЛЭАКЦТ) – перспективное направление в противовирусной иммунотерапии заболеваний глаз // В кн.: Актуальные проблемы инфекционной патологии глаз, Уфа, 1999; 28–30.
9. Краснов М.М., Каспаров А.А., Воробьева О.К. и др. Полудан в лечении вирусных заболеваний глаз // Вестн. офтальмол. 1997; 5: 35–9.
10. Майчук Ю.Ф. Вирусные заболевания глаз. М., Медицина, 1982; 272.
11. Каспарова Е.А. Клинические особенности и иммунотерапия осложненных форм аденовирусного кератоконъюнктивита: Автореф. дис. канд.мед.наук, М., 1998.
12. Митягина О.Н., Павлюк А.С. Влияние иммуномодулятора “полудана” на клеточную регенерацию и состояние апоптоза в эксперименте// Тезисы 1-го российского симпозиума по рефракционной хирургии, М., 1999; 66.
Для цитирования: Майчук Д.Ю., Васильева О.А., Пронкин И.А. Результаты длительного применения местных кортикостероидов для лечения инфильтративной формы аденовирусного кератоконъюнктивита. РМЖ. Клиническая офтальмология. 2014;15(1):23.
Резюме Цель: изучить влияние длительной терапии местными кортикостероидами на состояние рецидивирующих субэпителиальных инфильтратов роговицы после аденовирусного конъюнктивита.
Цель: изучить влияние длительной терапии местными кортикостероидами на состояние рецидивирующих субэпителиальных инфильтратов роговицы после аденовирусного конъюнктивита.
Методы: под нашим наблюдением находились пациенты с субэпителиальными инфильтратами роговицы, сформировавшимися в результате перенесенного аденовирусного кератоконъюнктивита. Срок наблюдения составил от 6 до 12 мес. Пациенты в качестве терапии получали кортикостероиды по убывающей схеме в течение 4 и 8 нед.
Контроль внутриглазного давления (ВГД) методом пневмотонометрии проводился каждые 2 нед. во время применения местных кортикостероидов, затем 1 р./мес., т. е. на сроках 4, 5 и 6 мес. от начала лечения. На сроках 1, 3 и 6 мес. от начала терапии у всех пациентов фиксировались данные визометрии и биомикроскопии.
Результаты: в исследование включено 25 пациентов (45 глаз). При первичном осмотре острота зрения составила 0,6±0,15.
Данные пневмотонометрии у большинства пациентов (96%) оставались в пределах нормальных значений в течение всего периода наблюдения.
Максимальный прирост остроты зрения наблюдался через 3 мес. после начала лечения – на 0,3–0,4, максимально корригированная острота зрения составила 0,95±0,05 в сравнении с 0,75±0,1 к 6 мес. исследования. Полное рассасывание инфильтратов роговицы к 3 мес. наблюдения произошло у 24 пациентов (0 баллов).
Заключение: длительное использование кортикостероидов (дексаметазона) при условии постепенного снижения их концентрации для лечения субэпителиальных инфильтратов роговицы, сформировавшихся после АВКК, является безопасным и эффективным.
Ключевые слова: аденовирусный конъюнктивит, инфильтрат роговицы, кортикостероиды.
Abstract
Results of prolonged usage of topical corticosteroid
therapy for the treatment of infiltrative form
of adenoviral conjunctivitis
D.Yu. Maychuk, O.A. Vasil’eva, I.A. Pronkin
FGBU MNTK Eye Microsurgery named after acad. Fedorov S.N., Moscow
Purpose. To study the influence of the prolonged therapy of topical corticosteroids on recurrent subepithelial corneal infiltrates after the adenoviral conjunctivitis.
Methods.
Patients with subepithelial corneal infiltrates after adenoviral conjunctivitis were under an observation during 6-12 months. They were receiving corticosteroids for 4 and 8 weeks according to the decreasing scheme of treatment. Pneumotonometry was performed each 2 weeks during the treatment, then – once a month. Visometry and biomicroscopy were carried out in 1, 3, 6 months from the start of the treatment.
Results. 25 patients (45 eyes) were examined and treated. The visual acuity at the baseline was 0,6±0,15. IOP level remained normal throughout all follow-up period. Maximum increase of the visual acuity was registered in 3 months – by 0,3-0,4 and equaled to 0,95±0,05 in comparison with 0,75±0,1 which was registered in 6 months after the treatment was started. Complete resorption of infiltrates was observed by 3 months in 24 patients.
Conclusion. Prolonged treatment with corticosteroids is safe and efficient in case of epithelial infiltrates after the adenoviral conjunctivitis provided that the decreasing scheme of administration is applied.
Key words: adenoviral conjunctivitis, corneal infiltration, corticosteroids.
Материалы и методы
Под нашим наблюдением находилось 25 пациентов (45 глаз) с субэпителиальными инфильтратами роговицы, сформировавшимися в результате перенесенного АВКК. Среди пациентов – 9 мужчин и 16 женщин в возрасте от 19 до 60 лет. Срок наблюдения – от 6 до 12 мес. В исследовании приняли участие пациенты, у которых с момента завершения острой фазы АВКК прошло 3 и более месяцев. На момент обращения никакого лечения, кроме слезозаместительной терапии (30% пациентов), не проводилось. Следует также отметить, что при биомикроскопии не определялось активного воспалительного процесса, т. е. в большинстве случаев конъюнктива была спокойной, лишь у 10% пациентов отмечалась слабая конъюнктивальная инъекция. До начала лечения всем пациентам было проведено определение аденовируса в мазке с конъюнктивы методом ПЦР. В 100% случаев был получен отрицательный результат.
Пациенты в качестве терапии получали кортикостероиды (0,1% дексаметазон) по убывающей схеме в течение 4 нед., затем продолжали применять 0,005% и 0,001% раствор дексаметазона также по убывающей схеме в течение 8 нед.
Кроме того, всем пациентам на время терапии кортикостероидами были назначены корнеопротекторы (Корнерегель, Баларпан). Таким образом, по окончании 3-месячного курса дексаметазона пациенты оставались на поддерживающей слезозаместительной терапии. Контроль ВГД методом пневмотонометрии проводился каждые 2 нед. во время применения местных кортикостероидов, затем 1 р./мес., т. е. на сроках 4, 5 и 6 мес. от начала лечения.
На сроках 1, 3 и 6 мес. от начала терапии у всех пациентов фиксировались данные визометрии и биомикроскопии. Степень поражения роговицы оценивалась с помощью разработанной балльной системы: отсутствие инфильтратов – 0 баллов, от 1 до 10 инфильтратов – 1 балл, от 11 до 20 – 2 балла, от 21 до 30 – 3 балла, от 31 – 4 балла.
Состояние комфорта пациентов оценивалось по таблице, специально разработанной нами на основании самых распространенных жалоб, предъявляемых пациентами с постаденовирусными роговичными инфильтратами (табл. 1).
Заключение
Длительное использование кортикостероидов (дексаметазона) при условии постепенного снижения их концентрации для лечения субэпителиальных инфильтратов роговицы, сформировавшихся после АВКК, является безопасным и эффективным. Уровень ВГД у 96% пациентов сохранялся в пределах нормальных значений на протяжении всего периода наблюдения. Но необходимо отметить, что в большом проценте случаев через 1–3 мес. после отмены дексаметазона происходит рецидивирование инфильтратов роговицы, хотя и в меньшем объеме, чем при первичной атаке.
Глюкокортикоиды при глазных болезнях. Противопоказания к назначению глюкокортикоидов в офтальмологии
Глюкокортикоиды (кортикостероиды) весьма популярны при лечении глазных болезней. Они заслуженно считаются сильными противовоспалительными, десенсибилизирующими и иммунодепрессивными средствами. Однако уже местное применение этих лекарств, не требующее больших доз, может давать нежелательные побочные эффекты. Офтальмологам известно замедление регенерационных процессов в глазу, ухудшение течения и более частое проявление его вирусных (герпетических) заболеваний, образование помутнений в хрусталике под влиянием стероидов. Описаны также трофические поражения роговицы, мидриаз, птоз, расстройства аккомодации, помутнения стекловидного тела, застойные диски, аллергические реакции в виде конъюнктивита и поверхностного кератита [Марголис М. Г., 1972].
Очень тяжелые и отнюдь не редкие осложнения вызывают стероидные препараты при их общем применении: симптомы болезни Иценко—Кушинга, особенно у детей, задержка их роста, в любом возрасте миопатии, эмоциональные и нервно-психические нарушения, остеопорозы, васкулиты, изменения гемостаза и иммуногенеза, гормонозависимость, желудочно-кишечные страдания от дискомфорта в эпигастрии до язв желудка и пр. Полной прямой зависимости развития указанных побочных реакций и осложнений от препаратов, длительности их применения, доз, возраста, пола, характера заболеваний при лечении кортикостероидами нет. Одни больные хорошо переносят лечение, проводимое годами, нередко принимая лекарства в больших дозах, у других же отрицательные явления возникают через 3—4 нед при использовании средних доз. Тем не менее значительно больше побочных реакций дают естественные глюкокортикоиды (кортизон, гидрокортизон), причем осложнения наступают тем чаще, чем выше дозы и длительнее применение этих средств.
Значительно лучше переносят больные современные синтетические препараты среднего (триамцииолоп, преднизолон, преднизон, метилредпизолон), длительного (дексаметазон, бетаметазон, параметазон) и пролонгированного действия (кеналог). Однако следует учитывать их особенности. Так, противовоспалительный эффект триамцинолона в 1,5—2 раза выше, чом иредпизолоиа, поэтому его молено назначать больным с высоким артериальным давлепием, нарушениями углеводного обмена и пожилым людям.
Преднизон и преднизолон меньше, чем кортизон и гидрокортизон, влияют на артериальное давление, электролитпый обмен, задержку жидкостей, но обладают повышенным ульцерогенным действием, в связи с чем не показаны больным гиперацпдным гастритом и язвенной болезнью желудка.
Дексаметазон, противовоспалительный эффект которого в 4— 10 раз выше, чем преднизолона, оказывает действие, в 30 раз превышающее действие последнего на кору надпочечников, поэтому должен назначаться короткими курсами и под контролем функционального состояния этой коры. Отмена препарата возможна только при медленном снижении его доз до минимальных.
Параметазон и особенно кеналог, одна инъекция которого действует в течение 7г—1 мес, в силу их лучшей переносимости показаны для длительного применения при хронических заболеваниях и могут назначаться (кеналог) даже амбулаторно.
Отрицательное действие гормонов уменьшают диета, а также некоторые лекарственные препараты. Для применения внутрь, как правило, требуются меньшие дозы, чем при парентеральном введении. При лечении болезней глаза первый путь предпочтительнее второго.
Длительность гормонотерапии глазных болезней, как правило, должна быть небольшой: курсы от 10 до 25—30 дней, реже 1,5 — 2 мес. Доза наиболее высока в первые 2—8 дней лечения и постепенно снижается в последующие дни. Например, дозу дексаметазона нужно снижать по 1/4 таблетки, преднизолона — по 0,5 — 1 таблетке каждые 2—4 дня. При отдельных хронических заболеваниях глаза или затрагивающих орган зрения общих страданиях (болезни Стилла, Фелти, ревматизм и др.) требуются более длительные курсы гормонотерапии, для которых более пригодны глюкокортикостероиды длительного и пролонгированного действия.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

