Коваленко я р анаэробные инфекции
Обновлено: 23.04.2024
Энциклопедия Животноводства
— Человечность определяется не по тому, как мы обращаемся с другими людьми. Человечность определяется по тому, как мы обращаемся с животными.
— Человек — царь природы. — Жаль, что звери об этом не знают — они неграмотные.
Домашние животноводство
Научный подход
НАВИГАЦИЯ: Главная Малоизвестные заразные болезн ИНФЕКЦИОННАЯ ЭНТЕРОТОКСЕМИЯ ВЕРБЛЮДОВ ENTEROTOXAEMIA INFECTIOSA CAMELORUM
| ИНФЕКЦИОННАЯ ЭНТЕРОТОКСЕМИЯ ВЕРБЛЮДОВ ENTEROTOXAEMIA INFECTIOSA CAMELORUM |
|
ИНФЕКЦИОННАЯ ЭНТЕРОТОКСЕМИЯ ВЕРБЛЮДОВ ENTEROTOXAEMIA INFECTIOSA CAMELORUM Инфекционная энтеротоксемия - болезнь, обусловленная бактерийными токсинами CI. perfringens типа С и D, поступающими в органы и ткани из кишечника. Историческая справка. Инфекционная энтеротоксемия под названием размягченная почка была описана в 1910 г. у овец в Тасмании (Джилрут). В 1926 г. Беннетс (Австралия) высказал предположение, что эта болезнь наиболее часто диагностируется в период цветения трав и обусловлена адсорбцией токсинов из кишечника. В 1932 г. тот же автор выделил из кишечника павших овец микроорганизм, сходный по своим культуральным и биохимическим свойствам с CI. perfringens, и назвал его В. ovitoxicus. Культурой этого организма Беннетсу удалось воспроизвести энтеротоксемию у взрослых овец. Следует отметить, что воспроизвести энтеротоксемию у верблюдов и овец обычными методами заражения (через рот) удается редко. Инфекционную энтеротоксемию верблюдов мы впервые начали изучать в пустыне Гоби (МНР) с последующим определением выделенных штаммов CI. perfringens в ГНКИ МСХ СССР (Ф. И. Каган, А. И. Колесова, Н. Г. Ипатенко, Даждаваа). Мак Ивен Stenli, Pchtelle зарегистрировали энтеротоксемию верблюдов на Аравийском полуострове, в Экваториальной Африке и в Латинской Америке. Экономический ущерб, наносимый этой болезнью, довольно велик. В некоторых случаях поражается до 25-30% поголовья неблагополучных гуртов, а смертельность при остром течении болезни достигает 80-100%.
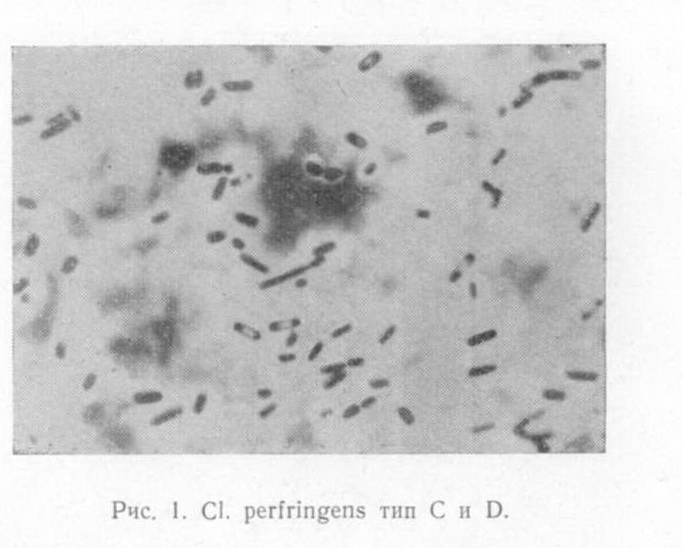
Возбудитель. Обусловливающие развитие болезни токсины образуются в кишечнике верблюдов при размножении CI. perfringens типа С и D (рис. 1). Микроб представляет собой сравнительно короткую, толстую, неподвижную палочку ,(1-1,5X3-8 мк) с обрубленными или слегка закругленными концами. В организме животных и на средах с сывороткой некоторые штаммы образуют капсулы; по Граму окрашиваются положительно. На МППБ под вазелиновым маслом рост микробов появляется через 3-4 часа и характеризуется сильным помутнением бульона, обильным газообразованием. На кровяном агаре с глюкозой образуются округлые гладкие колонии вначале сероватого, затем зеленоватого цвета, окруженные зоной гемолиза. Возбудителя энтеротоксемии находят в испражнениях и содержимом кишечника верблюдов, в трупах, а также в верхних слоях почвы пастбищ, базов, в водоисточниках на территории неблагополучных хозяйств. Споровые формы микробов очень устойчивы. При кипячении они разрушаются только через 90 минут. Эпизоотология болезни. Инфекционной энтеротексемией болеют верблюды независимо от пола и возраста, но чаще заболевает больные животные. В настоящее время болезнь верблюдов наблюдается в различных странах в определенное время года. Обострение болезни и гибель животных регистрируется осенью, зимой и особенно ранней весной. Летом энзоотия утихает. Инфекционная энтеротоксемия чаще протекает энзоотически, но иногда и в виде спорадических случаев. Болезнь считают сезонной. Она появляется в каждой географической зоне в определенное время года, преимущественно весной, реже летом и осенью, когда интенсивно растет молодая трава или происходят резкие качественные изменения травостоя. Важной эпизоотологической особенностью энтеротоксемии верблюдов является стационарность. Это связано с зараженностью почвы пастбищ, с наличием верблюдов - носителей возбудителя болезни. Патогенез. Как известно, CI. perfringens является постоянным обитателем пищеварительного тракта травоядных животных, где при благоприятных для них условиях (нарушение целостности слизистых оболочек, секреторной и моторной деятельности кишечника) они начинают бурно размножаться и вызывают заболевание со всеми симптомами инфекционной энтеротоксемии. Функциональные расстройства кишечника способствуют активизации возбудителей CI. perfringens, усиленному их размножению и образованию токсинов. Экспериментальными исследованиями установлено, что при медленном всасывании токсина и нормальной проницаемости стенок кишечника у животных смерть наступает на 4-5-й день после заражения токсиногенными штаммами большой вирулентности.
Симптоматика. Болезнь может протекать сверхостро, остро, подостро. Чаще отмечают острое течение. У больных животных ухудшается аппетит, наблюдается подтягивание живота, верблюды отбиваются от стада и бродят поодиночке, безучастны к окружающему, походка шаткая, падают на передние конечности (рис. 2). У некоторых животных появляется понос, моча иногда темного цвета. Затем развиваются симптомы поражения центральной нервной системы, слабость конечностей, дрожь мышц. Животные не реагируют на окружающее, передвигаются медленно, наталкиваясь на препятствия, внезапно падают, поднимаются, идут вперед и снова падают. У некоторых наблюдаются клонические судороги и полукоматозное состояние. При быстро нарастающих симптомах болезни животные погибают иногда на вторые сутки. У отдельных животных болезнь протекает медленнее и смерть наступает через 4-6 дней, а иногда и через 2-3 недели при явлениях резкого исхудания (рис. 3). Сверхострое течение. По нашим наблюдениям, верблюды погибают от инфекционной энтеротоксемии чаще внезапно, без каких-либо заметных клинических признаков болезни. Часто среди верблюдов, казавшихся вечером здоровыми, наутро обнаруживают несколько трупов. Отдельные верблюды, находясь на пастбище, угнетены, безучастны к окружающей обстановке. Затем становится заметным вздутие кишечника, метеоризм. Заболевшие животные неожиданно начинают пошатываться и внезапно падают. У большинства животных появляются клонические и тонические судороги и скрежетание зубами. Отмечаются ускоренное дыхание и одышка, слюнотечение (рис. 4), усиленное выделение из носовой полости серозной или серозно-геморрагической слизи, появляется понос. Верблюды с такими клиническими формами проявления болезни очень быстро погибают. При остром течении болезни отмечаются главным образом признаки нервного расстройства. Верблюды отстают от стада, стоят оцепенелые с опущенной головой или совершают круговые движения; вскоре ложатся и, как правило, больше не встают, конечности вытянуты, голова или запрокинута назад, или лежит на грудной клетке. Эти явления прерываются клоническими судорогами, животное гребет конечностями, бьет головой о землю, скрежещет зубами. Заболевают и гибнут животные независимо от пола, возраста и упитанности. При подостром течении болезни наблюдают те же признаки, но болезнь длится дольше. У больных животных отмечают признаки нарушения функции органов пищеварения. Зловонные фекалии выделяются в виде бесформенной массы темного цвета, с пузырьками газа и слизью. Появляется желтушность слизистых оболочек и конъюнктивы, усиленно выделяется слюна. У некоторых животных регистрируются клонические и тонические судороги, скрежет зубов, ускоренное дыхание, одышка, выделение серозно-геморрагической слизи из носовой полости. Моча коричневого цвета, температура тела у больных обычно невысокая, чаще в пределах нормы, появляются нервные явления, вначале возбуждение, которое сменяется депрессией. Животное ложится и погибает. Большинство больных погибает через 4-20 дней после появления отмеченных признаков. У некоторых верблюдов только резко выраженное угнетение и зловонная диарея являются признаком болезни. Патологоанатомические изменения. При вскрытии павших верблюдов обнаруживали следующие патологоанатомические изменения: тонкий кишечник на всем протяжении красновато-фиолетового цвета или усеян полосчатыми кровоизлияниями, экхимозами, слизистая оболочка кишок набухшая и покрыта слизью, а на некоторых участках гиперемирована. Рубец, сетка и книжка наполнены пищевыми массами, слизистая сычуга воспалена. Под сальником и между петлями кишок, а также вокруг серозных оболочек желудка- серозный экссудат, который также содержится в тазовой и в брюшной полостях. Мезентериальные лимфатические узлы увеличены, сочны, гиперемированы. Сосуды головного мозга инъецированы. Печень перерождена, желтоватого цвета. Желчный пузырь переполнен желчью. Легкие гиперемированы и отечны. В перикарде быстро свертывающийся экссудат соломенно-желтого цвета. Характерной особенностью у всех вскрытых верблюдов было поражение тонкого отдела кишечника в виде точечных и полосчатых кровоизлияний темно-вишневого цвета. Диагноз. Необходимо учитывать эпизоотологические данные, клиническую картину болезни и характер патологоанатомических изменений. Но решающее значение имеет бактериологическое исследование патологического материала. При инфекционной энтеротоксемии верблюдов всегда можно выделить возбудителя из содержимого тонкого отдела кишечника. В значительном количестве возбудитель болезни может быть найден в экссудате брюшной полости, в подкожном и межмышечном отеках, а также в костном мозге. Для выявления возбудителя рекомендуется бактериологически исследовать не только содержимое кишечника и паренхиматозные органы павших животных, но и трубчатые кости, жидкость, взятую из отека, и экссудат. Содержимое кишечника и других органов высевают на среду (Тароцци). Обогащение и очистка культур CI. perfringens достигается частыми пересевами ее на печеночный бульон - через каждые 4-6 часов. Пересевы повторяют до тех пор, пока быстро растущие анаэробы не будут получены в очищенной культуре, которую в последующем высевают на кровяной или глубокослойный агар. Отдельные колонии типа CI. perfringens, полученные на твердых средах, пересевают в печеночный бульон. Чистую бульонную культуру CI. perfringens проверяют на токсичность введением культуры или ее фильтрата в вену кролику или белой мыши. При помощи реакции нейтрализации типоспецифическими сыворотками идентифицируют и определяют тнповчю принадлежность микроба, выделенного из трупа. Более быстро получить результат исследования можно одновременным выявлением токсина непосредственно в содержимом кишечника, в экссудате брюшной полости, перикардиальной или плевральной жидкости. Для обнаружения токсина к содержимому тонких кишок добавляют двойное количество сте-риального физиологического раствора. Полученную смесь встряхивают 30 минут, фильтруют через фильтр Зейтца или через бактериологическую свечу. Полученный стерильный фильтрат вводят в вену кролику в дозе 1 мл или белой мыши в дозе 0,005-0,2 мл. При токсичности фильтрата подопытные животные гибнут в течение 3-5 минут с признаками поражения нервной системы. Токсин, обнаруженный в содержимом кишечника верблюдов, идентифицируют при помощи специфических типовых сывороток. Для этого берут пять проб токсического фильтрата в равных количествах (по 0,2 мл), четыре из них смешивают в равном объеме с сыворотками антиперфрингенс различных типов (А, В, С и D) - каждую пробу фильтрата с сывороткой другого типа. Пятую пробу смешивают с физиологическим раствором. Смеси ставят на 45-50 минут в термостате при температуре 37°, а затем вводят в хвостовую вену белым мышам (пять групп). Если белые мыши (одной группы) выжили, это указывает на нейтрализацию токсина, тип которого устанавливают соответственно типу антисыворотки, нейтрализовавшей этот токсин. Дифференциальный диагноз. Нужно исключить сибирскую язву, эмфизематозный карбункул, чуму, пастереллез и пироплазмоз. У верблюдов, больных сибирской язвой, всегда повышена температура тела; увеличена в объеме селезенка, она темно-вишневого цвета, выделяется Вас. anthracis. Отдифференцировать чуму можно по наличию характерных бубонов в области брюшной полости и выделению Bact. pestis. При пастереллезе повышена температура тела, наблюдаются признаки пневмонии, размягчения почек не устанавливают. Для пироплазмоза характерно увеличение селезенки и обнаружение паразитов в крови. Эмфизематозный карбункул сопровождается образованием в группе мышц крепитирующих опухолей, появлением симптомов газового отека. Во всех случаях решающее значение имеет бактериологический диагноз, основанный на выявлении микробов и их токсинов. Профилактика и меры борьбы. Для быстрой ликвидации болезни в неблагополучных гуртах в Восточно-Гобийском, Южно-Го-бийском аймаках провели поголовное клиническое обследование верблюдов и комплексное бактериологическое исследование. Животных с клиническими признаками болезни изолировали и лечили антибиотиками (пенициллин, стрептомицин, биомицин 500 000 ME на 100 кг веса животного, трехкратно с интервалом через 4 часа, курс лечения 3-4 дня) и дезинфицирующими средствами. Условно благополучное поголовье переводили на новые пастбища. Необходимо учитывать все пункты, в которых ранее регистрировали инфекционную энтеротоксемию верблюдов, и своевременно проводить в них профилактическую вакцинацию этих животных. Необходимо помнить, что в смысле заражения особенно опасны участки пастбищ, на которых ранее отмечался падеж верблюдов от этой болезни. Чтобы предотвратить инфицирование почвы, необходимо немедленно уничтожать (сжигать) трупы верблюдов и тщательно обеззараживать место, где лежал труп (пастбища, где находились больные верблюды, очищают и дезинфицируют). Зараженный навоз и остатки корма сжигают. Трупы верблюдов уничтожают вместе со шкурой. Категорически запрещается убой больных животных на мясо. Хозяйство, где установлена энтеротоксемия, объявляют неблагополучным. В период болезни верблюдиц нужно доить осторожно. Их молоко в это время нельзя использовать в пищу. Необходимо провести дезинфекцию мест, где находились трупы или были больные животные. Эффективными дезинфицирующими средствами являются: раствор хлорной извести, содержащий не менее 5% активного хлора, 10%-ный горячий раствор серно-карболовой смеси, 5%-ный раствор едкого натра и формальдегида. Дезинфекцию проводят двукратно с 60-минутным интервалом между обработками. Ограничения с хозяйств снимают через две недели после последнего случая падежа животных от инфекционной энтеротоксемии. Нами выделено 12 штаммов CI. perfringens. При проверке и перепроверке этих штаммов через год на вирулентность, токсичность и рост на питательных средах было отобрано 5 штаммов CI. perfringens типа С и D для изготовления опытной серии вакцины. Эти штаммы обладали различной вирулентностью, токсичностью и постоянным ростом на питательных средах. Вакцина, приготовленная нами в лабораторных условиях из штамма 3 67 и проверенная на лабораторных животных, зарекомендовала себя с положительной стороны. Вакцину вводили животным начиная с 6-месячного возраста внутримышечно в межреберное пространство двукратно с интервалом 15-20 дней первый раз в дозе 10 см3, второй - 15 см3. Опытную серию вакцины из указанных выше штаммов готовили на Сонгин-ском биокомбинате. Первую серию вакцины проверили на 15-20 подопытных верблюдах. Для проверки эффективности полученной вакцины верблюдов по истечении срока создания иммунитета поместили в неблагополучный по данной болезни гурт. Все вакцинированные животные остались живы, невакцинированные пали. В дальнейшем вакцину опытной серии применяли в неблагополучных по данной болезни хозяйствах в зависимости от создавшейся эпизоотической обстановки. Одним из основных методов борьбы с инфекционной энтероток-семией верблюдов является активная иммунизация животных неблагополучных хозяйств. Широкие опыты, проведенные в 1964- 1967 гг. с использованием приготовленной нами формолквасцовой вакцины из местных штаммов, показали эффективность этого метода профилактики. Благодаря вакцинации отход верблюдов от инфекционной энтеротоксемии снижался на 60%. В некоторых крупных хозяйствах, где потери верблюдов от энтеротоксемии составляли от 5 до 30%, при помощи вакцинации болезнь была ликвидирована. В настоящее время метод специфической профилактики инфекционной энтеротоксемии верблюдов успешно используют в неблагополучных хозяйствах многих стран. В последнее время для профилактики инфекционной энтеротоксемии, обусловленной CI. perfringens типа С и D, применяют вакцину с активированным при помощи трипсина токсином. Имеются указания об эффективности профилактического применения против инфекционной энтеротоксемии высокоактивной специфической антитоксической сыворотки. Стивене отмечает, что специфическая сыворотка имеет то преимущество, что сразу создает иммунитет и что такую сыворотку можно использовать для быстрого прекращения уже возникшей вспышки болезни. Кроме того, за рубежом рекламируют применение антибиотиков из группы тетрациклинов. С профилактической целью их небольшими дозами скармливают как взрослым, так и молодняку. Опыты и наблюдения, проведенные в СССР (Ляушкин, Соломатин, Каган, Полыковский и др.), подтвердили эффективность профилактического применения антибиотиков (биомицин в дозе 5-8 мг на животного для молодняка и 20-30 мг для взрослых). Ипатенко Н. Г, Даждаваа и др. Инфекционная энтеротоксемия верблюдов, вызываемая CI. perfringens типа С. - Ветеринария , 1966, № 11. Каган Ф. И. Злокачественный отек. - В кн.: Ветеринарная лабораторная практика. Сост. Ф. М. Орлов. М, 1963, т. 1. Коваленко Я. Р. Анаэробные инфекции сельскохозяйственных животных. М, 1954. Г у т и р а Ф, М а р е к И. и др. Болезни, вызываемые CI. perfringens. - В кн.: Частная патология и терапия домашних животных. М, 1954.
ЭПИЗООТИЧЕСКОЕ БЕСПЛОДИЕ STERILITAS EPIZOOTICA BOVUM (Инфекционный цервиковагинит, эпиваг, инфекционный цервикаль.
ЭПЕРИТРОЗООНОЗ ОВЕЦ EPERYTHROZOONOSIS OVIUM Эперитрозооноз - кровопаразитарная болезнь овец, характеризующаяся по.
ШОТЛАНДСКИЙ ЭНЦЕФАЛОМИЕЛИТ ОВЕЦ ENCEPHALOMYELITIS SCHOTLANDIENSIS OVIUM Шотландский энцефаломиелит, или вертячка.
ЧУМА ВЕРБЛЮДОВ PESTIS CAMELORUM Чума верблюдов - остро протекающая инфекционная, зооноз-ная болезнь, возбудителем.
ТОКСОПЛАЗМОЗ TOXOPLASMOSIS Токсоплазмоз - протозойная болезнь домашних, диких млекопитающих и птиц. Болеет и чело. В статье приводится краткое описание анаэробной инфекции, профилактика которой должна осуществляться на всех этапах оказания медицинской помощи, учитывая ее опасность и значимость в повседневной клинической практике. Анаэробная инфекция – это крайне опасный для жизни и здоровья патологический процесс, причинами которого становятся развитие анаэробной микрофлоры в мягких тканях организма. Особенностями данного вида инфекции является то, что активизация размножения микроорганизмов наступает лишь при попадании их в среду без доступа кислорода. Такие условия могут формироваться при попадании микробов в ткани при любом виде ранения. Потенциально любая рана, проникающая в подкожно-жировую клетчатку может привести к развитию этого вида инфекции. Однако наиболее часто причинами развития данного вида инфекции являются размозженные, огнестрельные, колотые ранения, ожоги и обморожения. При создании благоприятных условий скорость развития инфекции становится настолько быстрой, что без немедленной хирургической помощи состояние больного ухудшается в считанные часы и в большинстве случаев приводит к летальному исходу. Развивающаяся в тканях микрофлора оказывает агрессивное разрушительное воздействие на ткани вызывая их гибель (некробиоз), а также начинает вырабатывать токсины, быстро всасывающиеся в кровь и нарушающие обменные процессы во всех органах и тканях (сердце, легкие, печень, почки) и тем самым замыкая порочный круг развития патологического процесса. Даже при своевременно начатом лечении летальность колеблется в пределах 30-50%. Анаэробные микроорганизмы присутствуют в почве, а так же входят в состав нормальной микрофлоры толстой кишки и вызывают патологический процесс при попадании в рану извне, в момент ранения. Однако отсутствия загрязнения раны почвой, как содержащей большое количество данного вида микроорганизмов носит условный характер, так как спорообразующие микроорганизмы могут присутствовать на коже у здоровых людей не вызывая никаких патологических процессов. Попадание анаэробов в ткани может происходить при оперативных вмешательствах, инвазивных манипуляциях (пункциях, биопсии, экстракции зуба и др.) при нарушении асептики, перфорации внутренних органов, открытых травмах, ранениях, ожогах, укусах животных, синдроме длительного сдавления, криминальных абортах . Анаэробная инфекция может возникнуть у пациентов любого возраста. Анаэробные микроорганизмы делятся на облигатные и факультативные: развитие и размножение облигатных анаэробов осуществляется в бескислородной среде; факультативные анаэробы способны выживать как в отсутствии, так и в присутствии кислорода. Облигатные возбудители анаэробной инфекции делятся на две группы: клостридии и неспорообразующие анаэробы (бактероиды, вейллонеллы, пропионибактерии, пептострептококки, фузобактерии и др.). К факультативным анаэробными бактериями принадлежат кишечная палочка, шигеллы, иерсинии, стрептококки, стафилококки и др. Симптомы анаэробной инфекции. Независимо от вида возбудителя и локализации очага анаэробной инфекции, различным клиническим формам свойственны некоторые общие черты. В большинстве случаев анаэробная инфекция имеет острое начало и характеризуется сочетанием местных и общих симптомов. Инкубационный период может составлять от нескольких часов до нескольких суток (в среднем около 3-х дней). Течение анаэробной инфекции может быть молниеносным (в течение 1 суток с момента операции или травмы), острым (в течение 3-4 суток), подострым (более 4 суток). Анаэробная инфекция часто сопровождается развитием полиорганной недостаточности (почечной, печеночной, сердечно-легочной), инфекционно-токсического шока, тяжелого сепсиса, являющихся причиной летального исхода. Первичная диагностика основывается на клинических признаках. В верификации возбудителя ведущая роль принадлежит бактериологическому посеву отделяемого раны или содержимого абсцесса. Наряду с клиническими и лабораторными исследования, выполняется рентгенография, при которой обнаруживается скопление газа в пораженных тканях или полостях. Особенности течения анаэробной инфекции нередко требуют проведения повторных операций, вскрытия формирующихся гнойных карманов, обработки ран ультразвуком и лазером, озонотерапии и т.д. При обширной деструкции тканей может быть показана ампутация конечности. Важнейшими составляющими лечения анаэробной инфекции являются интенсивная инфузионная терапия и антибиотикотерапия препаратами широкого спектра действия, зачастую назначается комплекс из трех антибактериальных препаратов. В рамках комплексного лечения анаэробной инфекции находят свое применение гипербарическая оксигенация, ультрафиолетовое облучение крови, методы экстракорпоральной детоксикации. При необходимости пациенту вводится антитоксическая противогангренозная сыворотка. В случае выявления случая анаэробной инфекции в лечебном учреждении, последнее закрывается на карантин с обязательной генеральной дезинфекцией всех помещений с последующим контролем сотрудниками санитарно-эпидемиологической службы.
Новый штамм отличается чрезвычайно высокой контагиозностью (заразностью). Считается, что один заболевший человек представляет опасность для 12 окружающих. У предыдущих мутаций эта цифра не превышала 5-6. Еще одним неприятным сюрпризом стала высокая вероятность инфицирования при наличии антител к SARS-CoV-2, причем как у переболевших, так и у привитых людей. Невероятная скорость распространения вызывает тревогу и массу вопросов. Симптомы и признаки Омикрона, методы терапии и профилактики обсудим в статье.
Особенности инкубационного периодаСимптомы Омикрона Гипертермия. В сравнении с симптомами SARS-CoV-2, показатели держаться в пределах 38℃. Высокая температура характерна для не вакцинированных пациентов. После приема жаропонижающих препаратов температура спадает. Это отличает Омикрон от штамма Дельта, который проявляет устойчивую резистентность к антипиретикам.
У детей могут появляться кожные высыпания, расстройства стула. К симптомам, свидетельствующим о нарушении работы ЖКТ, врачи советуют относиться серьезно. Если на фоне диареи отсутствуют респираторные признаки болезни, скорее всего, это не связано с ковидной инфекцией. Что касается патогномических симптомов коронавируса, для Омикрона они не показательны. На аносмию, агезию (потерю обоняния, вкуса) жалуются не более 25% заболевших. Тестирование Тесты, которые сегодня предлагают лаборатории, чувствительны к Омикрону, поэтому в достоверности диагноза можно не сомневаться.
Самостоятельно выявить коронавирусную инфекцию помогают аптечные экспресс-тесты. Однако они определяют не сам вирус, а наличие или отсутствие антител lgM и lgG. Иммуноглобулины М обнаруживаются в крови на 5-7 день с момента заражения. Максимальных значений антитела достигают в острый период заболевания. В среднем IgМ сохраняются в крови до 10 дней. IgG вырабатываются чуть позже, их максимальное количество в крови обнаруживается на 10-14 день. Таким образом, если в анализе много IgМ, значит, заражение произошло недавно, если lgG — пациент находится в фазе выздоровления. По аналогичному принципу работают лабораторные тесты на определение антител к коронавирусу. Диагностика Тест ПЦР. Диагностика коронавируса с определением Омикрона и Дельты (или без уточнения штамма) в мазке, взятом у пациента из носа и ротоглотки. Лечение При легком клиническом течении инфекции назначают: Систематическое промывание носовых пазух соляными растворами, орошение увлажняющими спреями, закапывание назальных капель. В большинстве случаев достаточно простого лечения. На усмотрение лечащего врача терапию усиливают противовирусными средствами. Госпитализация требуется при нарастании симптомов — усилении катаральных проявлений, устойчивых показателях температуры выше 38℃. Тактику лечения в стационаре определяют по состоянию пациента. Вакцинация
Профилактика соблюдать дистанцию; Распространенность бактериального вагиноза (БВ) варьирует в широких пределах. Частота его встречаемости достигает 35% в общей гинекологической патологии; 10–30% — среди беременных женщин; 20–60% — среди пациенток с инфекциями, передающимися половым путем. Ключевые слова: бактериальный вагиноз, полимеразная цепная реакция в реальном времени, кандидозный вульвовагинит, комбинированный препарат (метронидазол + миконазол). Current approaches to the verification of bacterial vaginosis diagnosis and treatment tactics Far Eastern State Medical University The prevalence of bacterial vaginosis varies widely. Its incidence amounts to 35% of all gynecological pathologies; 10–30% — in pregnant women; 20–60% — in patients treated for sexually transmitted infections. Key words: bacterial vaginosis, real-time polymerase chain reaction, candidiasis vulvovaginitis, combined drug (metronidazole + miconazole). В статье представлены современные данные по эпидемиологии, этиологии, диагностике и лечению бактериального вагиноза. Подчеркнута целесообразность его диагностики методом полимеразной цепной реакции. Особое внимание уделено комбинированному препарату метронидазол + миконазол. Актуальность проблемы бактериального вагинозаОсновные компоненты микробиоты влагалищаФакторы, способствующие развитию бактериального вагинозаФормирование БВ имеет существенное отличие от классического течения инфекционного заболевания. По современной трактовке БВ — это невоспалительное заболевание влагалища, связанное с изменением его микрофлоры. Ведущую роль в развитии БВ играет снижение защитных факторов организма женщины, при котором происходит уменьшение количества или полное исчезновение палочек Додерлейна (молочнокислых бактерий, лактобактерий) и замещение их факультативной флорой [21, 22]. Клинические симптомы бактериального вагинозаДиагностикаВерификация диагноза бактериального вагинозаОсложнения бактериального вагинозаК неблагоприятным последствиям БВ относятся: Лечение бактериального вагинозаПринципиальная цель терапии БВ состоит в коррекции влагалищных симптомов. Всем женщинам с БВ необходимо проводить медикаментозную терапию. Лечение БВ снижает риск инфицирования хламидийной, трихомонадной, гонорейной инфекцией, ВИЧ, герпес-вирусной инфекцией. ЗаключениеОсложнения, связанные с БВ, обусловлены его несвоевременной диагностикой из-за неприменения современных лабораторных методов (метод ПЦР в реальном времени), открывающих новые аспекты в этиологии и патогенезе БВ, а также из-за игнорирования последствий данной патологии в виде образования биопленок и как следствие резистентности к терапии. Читайте также:
|