Красная волчанка переливания крови
Обновлено: 17.04.2024
Системная красная волчанка (СКВ) - хроническое, прогрессирующее полисиндромное заболевание, характеризующееся генетически обусловленным несовершенством иммунорегуляторных процессов, приводящим к неконтролируемой продукции антител к собственным клеткам и их компонентам, с развитием аутоиммунного и иммунокомплексного хронического воспаления.
Код МКБ 10 - М.32.
Этиология и патогенез СКВ недостаточно изучены. Предполагается сочетанное воздействие факторов внешней среды (фотосенсибилизации, стресса, нарушений питания, курения), генетических и гормональных. Возможно, что пусковым механизмом СКВ является активация вирусов (в первую очередь ретровирусов и близких к ним).
Среди конкретных механизмов развития болезни доказано влияние иммунных нарушений в Т-клеточном репертуаре и в продукции цитокинов, которые принимают участие в активации и дифференциации В-лимфоцитов в антителопродуцирующие клетки. Последнее ведет к гиперпродукции различных антител (в том числе и аутоантител), образованию циркулирующих иммунных комплексов, которые, откладываясь на базальных мембранах клеток различных органов, вызывают повреждение тканей с воспалительной реакцией и высвобождением новых антигенов, к которым формируются антитела, образуются иммунные комплексы, создавая порочный круг.
Клиническая картина СКВ характеризуется полиморфизмом симптомов и прогрессированием, при отсутствии лечения возможен летальный исход в связи с недостаточностью функции того или иного органа или присоединением вторичной инфекции.
В клинической практике при постановке диагноза СКВ используются диагностические критерии Американской ревматологической ассоциации, включающие 11 признаков:
1) эритема на лице ("бабочка");
2) дискоидная волчанка;
3) фотосенсибилизация;
4) язвы полости рта;
5) артрит;
6) серозит;
7) поражение почек (протеинурия 0,5 и более грамм в сутки, наличие цилиндров в моче);
8) неврологические нарушения (судороги или психоз);
9) изменения крови:
-
а) гемолититческая анемия,
б) содержание лейкоцитов 4х10 9 /л и ниже при двух и более исследованиях,
в) лимфопения 1,5х10 9 /л при двух и более исследованиях,
г) тромбоцитопения 100х10 9 /л;
При наличии любых 4 критериев диагноз СКВ считается достоверным.
СКВ поражает преимущественно женщин детородного возраста (20-30 лет). Многие годы беременность при СКВ считалась противопоказанием из-за существовавшего мнения, что она может быть причиной обострения и летального исхода заболевания, а также высокой частоты неонатальных осложнений. Однако совершенствование диагностики болезни, разработка современных методов ее лечения и, как следствие этого, - улучшение прогноза заболевания позволили изменить представления о беременности при СКВ.
Влияние беременности на СКВ
У многих больных СКВ беременность завершается успешно и не приводит к обострению заболевания вообще или обострение не сопровождается существенным ухудшением состояния больной и легко подавляется.
Среди факторов, определяющих вероятность обострения СКВ в период гестации, первое место занимает активность заболевания на момент зачатия.
Установлено, что наступление беременности при низкой активности СКВ в большинстве случаев не ухудшает заболевание. На прогноз заболевания не влияют длительность болезни и дозы кортикостероидных препаратов, предшествующие наступлению гестации. Зачатие в период высокой активности волчаночного процесса с тяжелыми органными поражениями почек, центральной нервной системы, легких и сердца, тем более симптомы функциональной недостаточности любого из этих органов резко увеличивают вероятность неблагоприятного исхода и СКВ, и беременности.
Для определения степени активности СКВ применяется классификация В.А.Насоновой (1972), учитывающая ряд клинико-лабораторных показателей заболевания (см. таблицу). Отсутствие активности СКВ или I (минимальная) степень активности позволяют разрешить беременить больной СКВ.
"Критическими" с точки зрения обострения заболевания, когда велика вероятность активации СКВ являются I триместр и первая половина беременности. Заслуживают внимания и первые 2-3 месяца после родоразрешения.
Клиническо-лабораторная характеристика активности патологичекого процесса при СКВ.
Влияние СКВ на течение беременности
Фертильность (способность к зачатию) у больных СКВ обычно не страдает, но тяжелые обострения заболевания и использование высоких доз кортикостероидов, умеренная почечная недостаточность вызывают субфертильность (олиго- и аменорею). К потере фертильности у больных СКВ может привести использование цитостатика циклофосфамида. Данных о влиянии других лекарственных препаратов, обычно используемых при лечении СКВ, на фертильность не имеется.
СКВ может неблагоприятно сказываться на беременности и ее исходе, что проявляется повышенной частотой самопроизвольных абортов, преждевременных родов, мертворождений и гипотрофий новорожденных, а также высоким процентом аномалий родовой деятельности и послеродовых осложнений. Поздний токсикоз у беременных с СКВ встречается в 2,8 раз чаще, чем у здоровых беременных, у 18,6% больных в последовом и раннем послеродовом периодах возникают кровотечения. Клиника гестоза может напоминать таковую при волчаночном гломерулонефрите. Только учет клинико-лабораторной картины заболевания, времени ее проявления могут быть решающими при проведении дифференциального диагноза. Различная тактика ведения больных с активным волчаночным нефритом (назначение иммуносупрессивной терапии) и гестозом (симптоматическая терапия) обусловливает практическую значимость правильной и своевременной диагностики этих состояний.
Большое значение в улучшении течения и исходов беременности и родов при СКВ имеет предшествующая гестации длительная (не менее 6-12 месяцев) ремиссия заболевания.
СКВ и антифосфолипидный синдром.
В последнее десятилетие проблема неблагоприятных акушерских исходов при СКВ приобрела новое направление, связанное с обнаружением у 30-40% больных СКВ особой группы антител - антифосфолипидных (АФА), к которым относятся: волчаночный антикоагулянт, антикардиолипиновые антитела и антитела, обусловливающие появление ложноположительной реакции Вассермана. Присутствие АФА у больных СКВ может приводить к формированию антифосфолипидного синдрома, одним из проявлений которого является привычное невынашивание беременности.
Антифосфолипидный синдром (АФС) впервые был описан при СКВ, а затем при некоторых других (преимущественно аутоиммунных) заболеваниях и состояниях. Основными диагностическими критериями АФС считают:
-венозные и артериальные тромбозы,
-привычное невынашивание беременности,
-тромбоцитопению.
При этом под "привычным невынашиванием беременности" подразумевается не менее двух случаев плодных потерь, не связанных с гинекологической или сугубо акушерской патологией.
Наличие одного из этих клинических признаков и повторных положительных анализов на волчаночный антикоагулянт и/или IgG-, IgM-антикардиолипиновые антитела позволяет диагностировать АФС.
Одновременное присутствие волчаночного антикоагулянта и антикардиолипиновых антител имеется у 60-80% больных. АФА могут исчезать или их титры уменьшаются в период между беременностями, а затем вновь появляться в очередную беременность.
Присутствие АФА у больных СКВ обусловливает до 90% случаев плодных потерь, при этом риск последних нарастает при наличии в анамнезе самопроизвольных выкидышей. Если гестация у беременных с АФС и не заканчивается смертью плода, которая чаще наступает в первой половине беременности, то у таких больных нередко наблюдаются поздний гестоз (в том числе пре- и эклампсия) и преждевременные роды. Описан и "послеродовый АФА-зависимый синдром", который проявляется тромбозами крупных и средних сосудов с соответствующей симптоматикой.
Таким образом, обнаружение АФА у беременных с СКВ в большинстве случаев осложняет течение беременности и послеродового периода и является одной из главных причин плодных потерь. Поэтому своевременная диагностика АФС, адекватная терапевтическая и акушерская тактика необходимы для улучшения исходов беременности у больных СКВ с сопутствующим АФС.
Влияние СКВ на плод (неонатальная волчанка)
Неонатальная волчанка (НВ) - следствие пассивно приобретенного аутоиммунного заболевания, серологическими маркерами которого являются антитела к растворимым антигенам тканевых рибонуклеопротеинов - Ro/Lа-антитела. С НВ связано около 1% всех случаев плодных потерь при "СКВ-беременности".
Пассвная трансплацентарная передача Ro/Lа-антител во время беременности плоду ведет к развитию у него поражения кожи и/или сердца -двум основным признакам НВ. Редко НВ сопровождается другими проявлениями (гепатомегалией, печеночной дисфункцией, спленомегалией, лимфоаденопатией, пневмонитом, тромбоцитопенией, анемией), которые обычно носят преходящий характер.
Кожные высыпания - наиболее частый синдром НВ, появляются обычно в течение первых 2-х месяцев жизни, типично - на лице и верхних конечностях, нередко после инсоляции или ультрафиолетового облучения по поводу неонатальной желтухи. Часто по форме сыпь представлена ограниченными округлыми пятнами и бляшками, нередко имеет сходство с подострой кожной красной волчанкой. Поражение обычно регрессирует в течение 6 месяцев, оставляя в отдельных случаях гипопигментацию.
Терапии НВ в большинстве случаев не требует, симптоматика стихает по мере естественного выведения материнских антител (кроме, ВППБ). Профилактическое назначение медикаментозных средств также не рекомендуется. Необходимость в дополнительной терапии возникает при наличии у матери ранее рожденных детей с НВ и предполагает применение высоких доз дексаметазона (как неинактивирующегося в плаценте) и плазмафереза в течение беременности.
Акушерская и терапевтическая тактика
1. Наступление и вынашивание беременности у больной СКВ могут быть разрешены при клинической ремиссии или минимальной клиникоиммунологической активности заболевания (I степени, по классификации В.А.Насоновой), продолжающейся не менее 6-12 месяцев до зачатия, и отсутствии симптомов функциональной недостаточности любого органа или системы.
2. Противопоказаниями для беременности при СКВ являются наличие высокой активности заболевания, симптомы волчаночного нефрита (протеинурия более 3 г/сут.), нефротический синдром, почечная недостаточность (сывороточный креатинин более 130 мкмоль/л), артериальная гипертензия, недостаточный сердечно-легочный резерв, также как функциональная недостаточность любого органа и поражение центральной нервной системы.
3. Использование медицинского аборта при СКВ как метода предупреждения обострения болезни в период гестации неоправдано. Более того, он может явиться провоцирующим фактором активации СКВ. Однако терапевтический аборт показан в случаях тяжелой почечной, сердечной или легочной недостаточности у больных СКВ.
4. Наличие АФС или отдельных его синдромов у больной СКВ требует проведения повторных исследований на АФА (как на волчаночный антикоагулянт, так и на антикардиолипиновые антитела) на этапе планирования беременности и мониторинг их при наступлении последней с целью своевременной коррекции титров АФА во избежание осложнений течения заболевания и гестационного процесса.
5. У анти-Rо/Lа-позитивных беременных с СКВ показано повторное проведение ультразвукового исследования плода и допплерометрии пупочных сосудов после 18 недели гестации для ранней диагностики нарушений сердечной деятельности плода и определения показаний для срочного родоразрешения.
6. Доза кортикостероидного препарата при условии стабильности состояния больной должна оставаться неизменной в течение всей беременности и не менее 2-х месяцев после родоразрешения. При обострении СКВ - терапия кортикостероидами усиливается до адекватной степени активности болезни. Вопрос о прерывании беременности решается индивидуально.
7. Госпитализация в родильный дом должна быть не позднее 36-37 недели гестации. В более ранние сроки при обострении течения болезни женщину целесообразно госпитализировать в ревматологический или терапевтический стационар.
8. При наличии клинических признаков активности заболевания родоразрешение производится преждевременно, что следует учитывать при определении срока госпитализации в родильный дом. В период родов показано дополнительное парентеральное введение гидрокортизона (30-100 мг/сут.) с последующим постепенным снижением этой дозы в течение 3-5 дней после родов или аборта.
9. Показаниями для оперативного родоразрешения (кесарева сечения) беременных с СКВ, кроме акушерской патологии, являются:
СПИСОК ЛИТЕРАТУРЫ
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
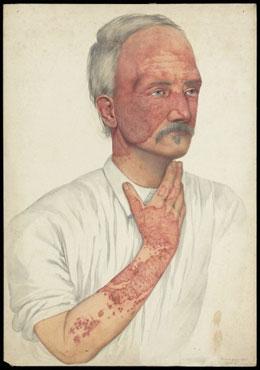
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Читайте также:

