Криптококковых инфекциях можно при трихомонаде принимать
Обновлено: 19.04.2024
Описаны клинические формы криптококковой инфекции и подходы к диагностике и лечению пациентов. Приведены схемы комбинированной терапии с применением антимикотических препаратов.
Clinical forms of cryptococcal infection and approaches to diagnosis and treatment of patients were described. The schemes of combined therapy with antimycotics were given.
На протяжении последних десятилетий грибковые заболевания не теряют своей актуальности. Среди всех инвазивных микозов криптококковая инфекция занимает одно из наиболее значимых мест, так как является жизнеугрожающим заболеванием. Даже при своевременном лечении летальность составляет от 10% до 25%, а в развивающихся странах достигает 90%. Ежегодно в мире регистрируют около 1 млн случаев криптококкоза. В России, на данном этапе, обязательная регистрация глубоких микозов отсутствует. Истинная заболеваемость не известна, но по данным Северо-Западного государственного медицинского университета им. И. И. Мечникова в Санкт-Петербурге отмечается значительный рост криптококкоза с летальным исходом в период с 2002 по 2010 г. [1–5].
Заболеванию клинически выраженными формами криптококкоза подвержены люди с нарушениями в иммунной системе. Чаще всего это пациенты с синдромом приобретенного иммунодефицита (СПИД), лейкозом, саркоидозом, лимфомой, а также пациенты после трансплантации органов и больные, получающие большие дозы цитостатиков или кортикостероидов. Заражение происходит ингаляционно, легкие являются органом первичной локализации возбудителя, где он может долгое время находиться в латентном состоянии. При нарушении функционирования иммунной системы происходит активация инфекции [11, 12].
Клиника криптококкоза зависит от локализации и распространенности процесса. По МКБ-10 выделяют легочный криптококкоз, церебральный криптоккоз, криптококкоз кожи, криптококкоз костей. Криптококкоз легких может протекать бессимптомно или сопровождаться кашлем со слизистой мокротой, слабовыраженной лихорадкой, недомоганием, редко одышкой. Рентгенологически визуализируются узелковые инфильтраты и сливные очаги, расположенные субплеврально. У больных СПИДом в 1/3 выявляется криптококковая пневмония. Заболевание характеризуется быстрым прогрессированием с развитием респираторного дистресс-синдрома и острой дыхательной недостаточностью. Криптококкоз кожи встречается в 10–15% случаев. Характеризуется появлением папул, которые трансформируются в бляшку с уплотнением и последующим изъязвлением в центре элемента. Локализуются чаще на волосистой части головы и лице. Криптококкоз костей характеризуется остеолизисом, частота встречаемости 5%. Поражаются кости таза, позвоночника, черепа, ребра [13].
Наиболее частой клинической формой является церебральный криптококкоз, который в 80–90% протекает в форме менингоэнцефалита. В центральной нервной системе (ЦНС) возбудитель диссеминирует гематогенным путем. Мишенью для патогенного воздействия криптококков является эндотелий сосудов микроциркуляторного русла. Основной способ проникновения возбудителя в вещество головного мозга это разрушение стенки сосуда. В результате этого возникает нарушение микроциркуляции, что влечет за собой дистрофию нейронов и развитие очагов некроза. Вследствие резко повышенной проницаемости сосудов происходит скопление жидкости в веществе мозга. Гистологически отмечается пролиферация дрожжеподобных грибов с инфильтрацией, представленной преимущественно лимфоцитами, гистиоцитами, небольшим числом плазмоцитов, единичными нейтрофилами. На аутопсии поражение оболочек мозга характеризуется как серозно-продуктивный менингит с точечными кровоизлияниями в мягкую и твердую мозговые оболочки. Оболочки утолщены, мутные, на поверхности множественные мелкие бугорки (скопление грибов). Патологический процесс также может охватывать базальную поверхность мозга. Причиной смерти является отек головного мозга с дислокацией стволовых структур [13, 14].
Доминирующая жалоба — постоянная головная боль диффузного характера, интенсивность которой постепенно нарастает. Тошнота, рвота отмечается у 40% пациентов. Лихорадочная реакция не постоянна, температура тела колеблется в широких пределах от 37,2 до 39,5 °С. Менингеальные симптомы (ригидность мышц затылка, симптом Кернига, симптом Брудзинского) чаще отсутствуют или бывают сомнительными. Судороги, нарушение сознания встречаются в единичных случаях и, как правило, в поздних стадиях заболевания. У некоторых больных могут выявляться застойные диски зрительных нервов, нарушение зрения, очаговая неврологическая симптоматика. При исследовании спинномозговой жидкости (СМЖ) воспалительные изменения слабо выражены. Обычно отмечается повышенное содержание белка и лимфоцитарный двух-трехзначный плеоцитоз. Характерно прогрессирующее снижение уровня глюкозы [7, 12, 13, 15, 16].
Для диагностики криптококкового поражения ЦНС основным методом является микробиологическое исследование СМЖ. Для микроскопии мазки заливают 1–2 каплями туши. Капсула Cryptococcus neoformans окрашивается не полностью и образует специфические ободки. Клетки криптококка имеют шаровидную или эллипсовидную форму. Диаметр варьирует от 5 до 7 мкм, редко от 2 до 15 мкм. Капсула хорошо окрашивается, по методу Моури альциановым синим в сине-зеленый цвет. Этот метод окрашивания позволяет визуализировать фагоцитированные криптококки. Эффективность данного метода достигает 97% [5, 17].
Для подтверждения диагноза решающее значение имеет культуральный метод. Растет Cryptococcus neoformans от 48 до 72 часов, на сусло-агаре или среде Сабуро, при температуре 37 °С. Внешне это белые, гладкие, блестящие слизисто-тягучие колонии. Получение культуры криптококка позволяет определить чувствительность выделенного штамма к антимикотическим препаратам. Микробиологическая диагностика применяется и при других формах криптококковой инфекции. Субстратами для исследования являются кровь, мокрота, отделяемое кожных элементов. Из дополнительных методов используется латекс-агглютинация. Показатели специфичности и чувствительности стандартных тестов превышают 90%. В последние годы все шире в диагностических целях применяется полимеразная цепная реакция (ПЦР), ценность этого метода заключается в том, что он позволяет в кротчайшие сроки установить диагноз [14, 16, 17].
Методы нейровизуализации (компьютерная томография и магнитно-резонансная томография) в части случаев позволяют получить дополнительные данные о характере процесса. У 34% отмечается атрофия коры головного мозга, у 11% поражение вещества головного мозга как диффузного, так и очагового характера (криптококкома). Гидроцефалия выявляется у 9%, в 50% патологические изменения не обнаруживаются [13, 17].
Для лечения менингоэнцефалита криптококковой этиологии необходимо использовать антимикотические препараты, проникающие через гематоэнцефалический барьер (ГЭБ) в терапевтических концентрациях. К ним относят флуцитозин, амфотерицин В, флуконазол. Флуцитозин обладает как фунгистатическим, так и фунгицидным действием. Встраиваясь в рибонуклеиновую кислоту (РНК) возбудителя, нарушает образование белков, а также подавляя активность тимидилатсинтетазы, препятствует синтезу грибковой дезоксирибонуклеиновой кислоты (ДНК). Его концентрация в СМЖ составляет 75% от концентрации в плазме. Амфотерицин В обладает в большей степени фунгистатическим действием. Механизм действия заключается в способности связываться с эргостерином клеточной мембраны возбудителя. В мембране образуются поры, нарушается барьерная функция, что влечет за собой потерю клеточных структур и гибель гриба. Его концентрация в СМЖ при внутривенном введении составляет 5%, поэтому предпочтительно эндолюмбальное введение. Комбинация этих двух препаратов дает лучший терапевтический эффект, в отличие от монотерапии. Кроме того, это позволяет уменьшить дозу амфотерицина В и, тем самым, снизить его токсический эффект и сократить продолжительность курса лечения. Применение комбинированной терапии позволяет предотвратить или отсрочить развитие резистентности возбудителя. Чувствительность Cryptococcus neoformas к амфотерицину В составляет 68%, флуцитозину 54%. Столь же хорошо проникает в биологические среды организма флуконазол, его концентрация в СМЖ составляет около 85%. Фунгистатический эффект данного препарата заключается в способности угнетать синтез эргостерина мембраны грибов. Чувствительность к нему составляет 74% [16, 22, 23].
В настоящее время используется следующая схема лечения: амфотерицин В 0,7–1,0 мг/кг/сут в сочетании с флуцитозином 100 мг/кг/сут в течение двух недель, а затем флуконазол 800–400 мг/сут не менее 10 недель. Если состояние пациента не улучшается в первые две недели лечения, то лечение амфотерицином В продлевают. Для лиц с сохраняющимся фактором риска повторного развития инфекции (больные СПИДом) рекомендуется поддерживающая терапия флуконазолом 200–400 мг/сут от 6 месяцев до года. Основной побочный эффект данного лечения это токсическое воздействие на почки, которое может отмечаться у 80% пациентов. Поэтому целесообразно применение липосомального препарата амфотерицина B (Амбизом), обладающего меньшей токсичностью. Возможно также эндолюмбальное введение амфотерицина В в дозе 0,25–1,0 мг 2–4 раза в сутки. При возникновении рецидива заболевания рекомендуется использовать амфотерицин В или липосомальный амфотерицин В в дозе 1 мг/кг/сут в течение 4–10 недель. В качестве поддерживающей терапии флуконазол 800–1200 мг/сут не менее 10–12 недель. В процессе лечения необходим регулярный контроль чувствительности штаммов криптококка к антимикотическим препаратам для корректировки терапии в случае резистентности возбудителя [5, 16, 24].
Помимо этиотропной терапии необходима коррекция внутричерепного давления, так как его стойкое повышение свидетельствует о возможности развития отека и набухания головного мозга (ОНГМ) с дислокацией, являющейся главной причиной летальности. Это осложнение возможно и на фоне специфической терапии, т. к. лизис криптококка приводит к освобождению токсических компонентов клетки, способствующих повышению проницаемости сосудов. Поэтому необходимо систематическое проведение дегидратационной терапии с использованием петлевых и осмотических диуретиков. При давлении СМЖ выше 250 мм в. ст. рекомендуются ежедневные пункции до снижения показателей. Стойкое повышение давления СМЖ требует постоянного дренажа (вентрикулоперитонеальный шунт) [5].
Об эффективности лечения судят по клиническому состоянию больного и улучшению состава СМЖ. Прежде всего, нормализации уровня глюкозы, отрицательному результату микроскопического и бактериологического исследовании ликвора, а также по результатам ПЦР. Снижение микробной нагрузки на 2–3 порядка в течение двух недель является хорошим прогностическим признаком и критерием адекватности терапии [2, 16].
Летальность при криптококкозе без применения антимикотической терапии достигает 100%. Она обусловлена: поздней диагностикой, резистентностью возбудителя, возможностью развития ОНГМ на фоне антимикотической терапии, низкой приверженностью больных к лечению или отказом от нее (в первую очередь ВИЧ-инфицированных) [16, 25].
Таким образом, проблема криптококкового поражения ЦНС приобретает все большую актуальность. Малая информативность клинической картины болезни требует от врачей при появлении неврологической симптоматики, прежде всего длительной головной боли у больных из группы риска раннего исследования СМЖ, даже при отсутствии менингиальных симптомов. В процессе лечения необходимо повышенное внимание к состоянию больного (возможность внезапного развития ОНГМ), микробиологический контроль СМЖ с определением чувствительности возбудителя (возможность формирования резистентности) и определения микробной нагрузки методом ПЦР как самого достоверного метода оценки эффективности лечения.
Литература
О. Е. Волкова 1
Ю. Я. Венгеров, доктор медицинских наук, профессор
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Что такое трихомониаз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агапова Сергея Анатольевича, венеролога со стажем в 39 лет.
Над статьей доктора Агапова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Урогенитальный трихомониаз — это передающаяся половым путём инфекция мочеполовой системы, вызванная влагалищной трихомонадой (Trichomonas vaginalis).
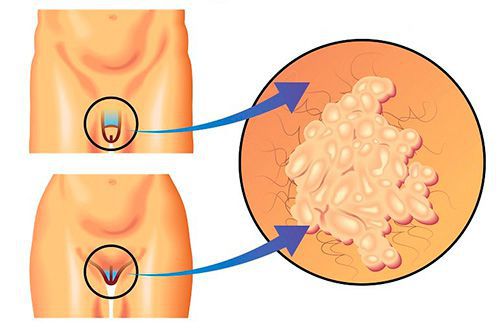
Насколько распространён трихомониаз
Что такое трихомониаз, трихомонады и их виды
Причиной заболевания является инфицирование мочеполовых органов влагалищной трихомонадой — одноклеточным жгутиковым простейшим организмом изменчивой формы, который в естественных условиях может существовать и размножаться только в организме человека. Помимо вагинальной трихомонады у человека могут паразитировать ещё два вида — кишечная трихомонада (Pentatrichomonas hominis) и ротовая (Trichomonas tenax), однако их роль в возникновении заболеваний мочеполовой системы не установлена.
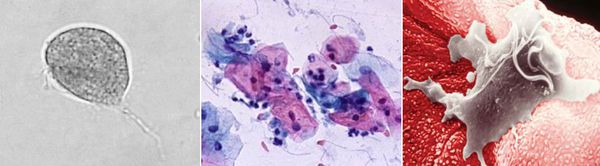
Трихомонада, так как не образует цист и других устойчивых форм, быстро погибает во внешней среде вследствие высыхания, легко разрушается при кипячении, воздействии антисептиков и этилового спирта. Однако может сохранять некоторое время жизнеспособность во влажной среде. Исследованиями установлено, что трихомонады могут выживать до 45 минут на сидениях унитазов, нижнем белье и в воде ванны. [3]
Как можно заразиться трихомониазом
Пути передачи инфекции:
Факторами риска являются:
- случайные половые связи;
- половой контакт, незащищённый барьерной контрацепцией (презервативом);
- злоупотребление алкоголем и наркомания; [7]
- атрофия шейки матки — вследствие снижения защитных свойств из-за уменьшения эстрогенов в тканях; [8]
- наличие других половых инфекций, таких как ВИЧ-инфекция, бактериальный вагиноз, вульвовагинальный кандидоз, генитальный герпес, хламидиоз. [9]
Защищает ли презерватив от трихомониаза
Использование презервативов снижает вероятность заражения. Однако микроорганизмы могут попасть на области, не закрытые ими, поэтому презервативы не могут полностью защитить от трихомониаза [52] .
Передаётся ли трихомониаз во время орального секса
Микроорганизмы способны поражать различные части тела, например, руки или рот. Оральный секс с инфицированным партнёром может привести к заражению трихомониазом ротовой полости [52] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы трихомониаза
Чаще трихомониаз диагностируется у женщин, чем у мужчин. У 10-30 % женщин и у 45-50 % мужчин отмечается асимптомное течение заболевания . [10]
Симптомы трихомониаза у женщин
У женщин трихомонады преимущественно поражают влагалище, откуда они могут проникать в уретру, бартолиновы железы, мочевой пузырь и канал шейки матки. В редких случаях трихомонады паразитируют в полости матки, маточных трубах, почечных лоханках и прямой кишке. [11]
Основными симптомами трихомониаза у женщин являются:
Редкими проявлениями трихомониаза у женщин являются:
- макулярный кольпит (клубничный цервикс) — кровоизлияния в слизистую влагалища и шейку матки, напоминающее ягоду клубники; [12]
- эрозивно-язвенные поражения вульвы и преддверия влагалища. [13]
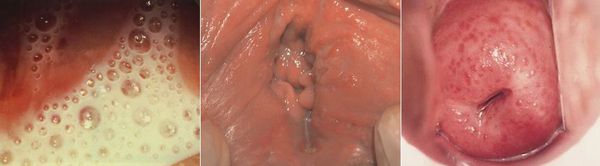
Симптомы трихомониаза у мужчин
У мужчин трихомонады поражают слизистую оболочку мочеиспускательного канала, нередко проникая в уретральные железы и лакуны. Ввиду неблагоприятных условий для существования в мужской уретре трихомонад, заболевание часто носит транзиторный (временный) характер. Этим же объясняется и большой процент асимптомных форм трихомониаза у мужчин. [14]
Основными симптомами трихомониаза у мужчин являются:
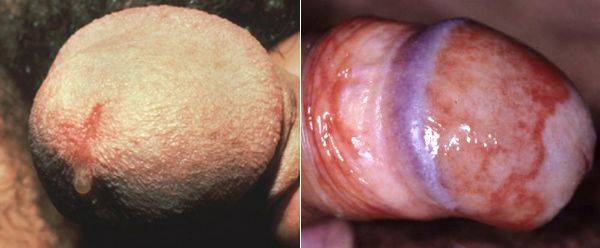
Редким проявлением трихомониаза у мужчин является баланопостит (воспаление головки и крайней плоти полового члена). Описаны его эрозивно-язвенные формы. [15]
Патогенез трихомониаза
Проникая в урогенитальный тракт человека, трихомонады прикрепляются к эпителиальным клеткам, что приводит к повреждению и воспалительной реакции клеток эпителия. В этой реакции важное значение имеет адгезин — белок, продуцируемый паразитом. [16]
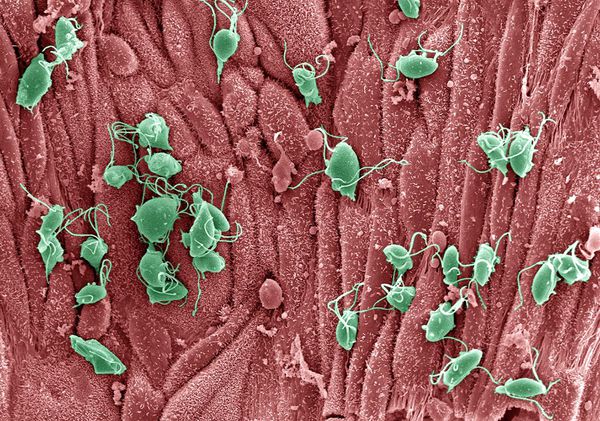
Трихомонады выделяют многочисленные протеолитические ферменты, которые участвуют в цитотоксичности, гемолизе (разрушении эритроцитов и выделении гемоглобина) и уклонении от иммунных реакций. Ферменты находятся во влагалищных выделениях инфицированных женщин вместе с антителами, которые их распознают. Важную роль играет фермент муциназа, который значительно облегчает проникновение трихомонад в слизистые оболочки. [17]
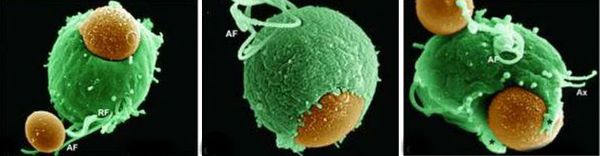
Трихомонадная инфекция вызывает клеточный, гуморальный и секреторный иммунные ответы. Однако эти реакции не способны защитить пациентов от реинфекции, поэтому повторное инфицирование встречается часто. Антитела и компоненты комплемента, присутствующие в сыворотке крови и секрете половых желез у некоторых больных, могут воздействовать на паразита путём стимуляции нейтрофилов, которые способствуют уничтожению трихомонад через классическую систему комплемента. Также антитела могут блокировать адгезию (прилипание) паразита к поверхности слизистой оболочки. [21]
Классификация и стадии развития трихомониаза
По Международной классификации болезней 10-го пересмотра трихомониаз разделяют на:
A59.0 Урогенитальный трихомониаз;
- Бели (вагинальные выделения), вызванные Trichomonas vaginalis; (N51.0), вызванный Trichomonas vaginalis;
A59.8 Трихомониаз других локализаций;
A59.9 Трихомониаз неуточнённый.
Стадии заболевания
После скрытого (инкубационного) периода, продолжающегося от 4 до 28 дней с момента заражения, приблизительно у 40-50% мужчин появляются признаки уретрита в виде слизистых выделений из уретры, а у 70-90% женщин — признаки вульвовагинита, характеризующегося зудом, жжением и наличием обильных мутных выделений из влагалища. [10] В остальных случаях болезнь протекает первоначально бессимптомно. В дальнейшем, если вовремя не получено лечение, развитие заболевания происходит по следующим сценариям:
- Длительное бессимптомное носительство, при котором нет никаких субъективных и объективных симптомов.
- Длительное рецидивирующее течение, при котором симптомы заболевания могут временно возобновляться и самопроизвольно исчезать.
- Ранее развитие осложнений может возникать как при течении заболевания с клиническими симптомами, так и при бессимптомном течении.
- Позднее развитие осложнений возникает при длительно текущем бессимптомном или хроническом рецидивирующем процессе.
Осложнения трихомониаза
В отличии от других половых инфекций – хламидийной и гонококковой — осложнения при трихомониазе встречаются гораздо реже.
Осложнения у мужчин
Эпидидимит — воспаление придатка яичка, очень редкое осложнение трихомонадной инфекции. Чаще всего это хронический процесс, хотя встречаются описания острых форм. [22]
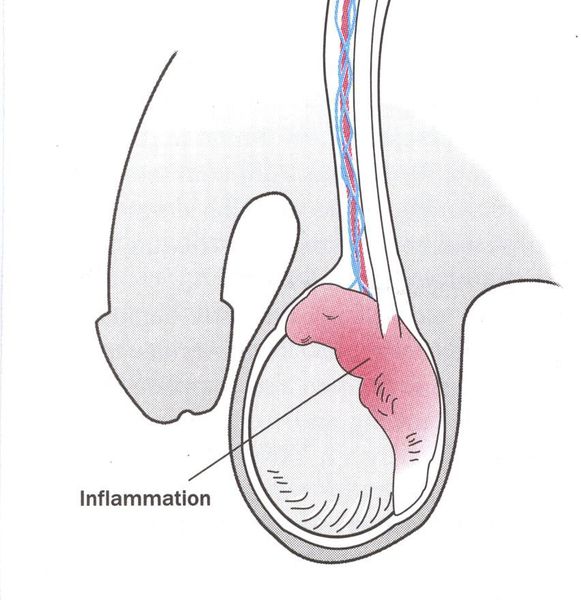
Редким осложнением трихомониаза является простатит. Сообщается о нескольких случаях хронического простатита, вызванного трихомонадной инфекцией. [23]
Нарушение фертильности. Проведенные исследования показывают негативное воздействие трихомонад на сперматозоиды мужчин в виде снижения их подвижности. [24]
Сообщается также о случае трихомонадного двухстороннего конъюнктивита. [31]
Осложнения у женщин
Воспалительные заболевания малого таза, вызванные вагинальной трихомонадной инфекцией, являющиеся причиной трубного бесплодия и синдрома хронической абдоминальной боли, описаны, в основном, у ВИЧ-позитивных женщин. [25]
Проведённые исследования указывают на повышенный риск преждевременных родов, рождения ребёнка с низким весом у инфицированных влагалищной трихомонадой женщин. [26]
Также трихомонадная инфекция в 2-3 раза увеличивает риск заражения ВИЧ. [32]
Очень редким осложнением трихомониаза является цистит. В медицинской литературе описано всего несколько случаев. [33]
Прочие осложнения
Сообщалось о паранефральном абсцессе [27] , абсцессе головного мозга [28] у новорождённого, абсцессе срединного шва полового члена [29] у мужчины, вызванных вагинальной трихомонадой.
Описаны случаи неонатальной трихомонадной пневмонии у новорождённых, успешно вылеченных метронидазолом. [30]
Диагностика трихомониаза
Для диагностики трихомониаза применяются микроскопические, цитологические, бактериологические, молекулярные лабораторные тесты и инструментальные методы обследования.
Показаниями для диагностики трихомониаза являются [2] :
- наличие признаков воспалительного процесса мочеполовых органов;
- беременность (при постановке на учёт по поводу беременности, при сроке беременности 27-30 недель и 36-40 недель, при поступлении на роды без документов о результатах обследования на половые инфекции);
- предстоящие оперативные вмешательства на половых органах и органах малого таза;
- бесплодие и выкидыши в анамнезе;
- половые контакты с больными половыми инфекциями;
- сексуальное насилие.
Микроскопическое исследование
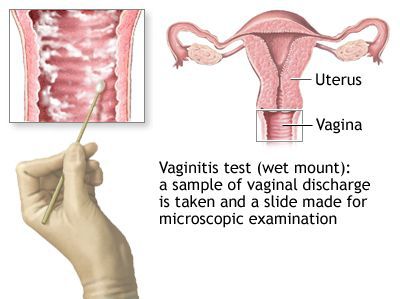
Микроскопия окрашенного препарата (окраска по Романовскому, Папаниколау) не рекомендуется из-за субъективизма при интерпретации результатов исследования. [2]
Культуральное исследование
Молекулярно-биологические методы
Материалом для исследования методом ПЦР при диагностике трихомониаза являются:
- у женщин: выделения из уретры, канала шейки матки, влагалища, первая порция мочи);
- у мужчин: выделения или соскоб из уретры, первая порция мочи, секрет предстательной железы, в редких случаях — сперма. [2]
Требования для получения достоверных результатов исследования:
- Забор материала должен осуществляться не ранее чем через месяц после полученного лечения.
- При отсутствии или скудных выделениях из уретры забор материала должен проводиться через 2-3 часа после последнего мочеиспускания, а при наличии обильных выделений — через 10-15 минут после мочеиспускания.
- Во время менструации забор материала для исследования проводить запрещается.
- Должны быть соблюдены сроки и условия доставки образцов в лабораторию.
Серологическое исследование
Метод иммуноферментного анализа (ИФА) для обнаружения антител классов IgA, IgM и IgG к антигенам T. vaginalis применять не допустимо. [2]
Применение биологических (парентеральное введение пирогенала, гоновакцины), химических (внутриуретральное введение растворов серебра) и алиментарных провокаций (приём алкоголя и острой пищи) с целью повышения выявляемости трихомонад при проведении лабораторных тестов нецелесообразно, так как эффективность этого метода не доказана. [2]
Лечение трихомониаза
Многочисленными исследованиями и клиническими испытаниями было установлено, что наиболее эффективными препаратами для лечения трихомониаза являются препараты группы 5-нитроимидазолов, а среди них — метронидазол, тинидазол и орнидазол.
Современными отечественными и зарубежными руководствами предложены следующие схемы лечения этими препаратами.
Метронидазол (Трихопол, Метрогил, Флагил) — эффективность его применения составляет 90-95%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 7 дней [36] или 2,0 г перорально однократно. [37]
Для осложнённых форм: 500 мг перорально 3 раза в сутки в течение 7 дней или 2,0 г внутрь 1 раз в сутки в течение 5 дней. [38]
Для беременных: 2,0 г однократно (лечение проводится не ранее II триместра беременности). [39]
Для детей: 10 мг на кг массы тела перорально 3 раза в сутки в течение 5 дней. [40]
Тинидазол (Фазижин, Тиниба) — эффективность применения составляет 86-100%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 5 дней или 2,0 г перорально однократно. [35]
Для осложнённых форм: 2,0 г перорально 1 раз в сутки в течение 3 дней. [37]
Орнидазол (Тиберал, Гайро, Дазолик) — эффективность применения составляет 90-100%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 5 дней [41] или 1,5 г перорально однократно. [42]
Для осложнённых форм: 500 мг перорально 2 раза в сутки в течение 10 дней. [38]
Для детей: 25 мг на кг массы тела перорально 1 раз в сутки в течение 5 дней. [39]
Другие препараты из группы 5-нитроимидазолов — менее распространены и изучены, чем вышеизложенные препараты, однако применяются в клинической практике:
- Тенонитрозол (Атрикан) — 250 мг перорально 2 раза в день в течение 4 дней; [43]
- Ниморазол (Наксоджин) — схемы применения при неосложнённом трихомониазе: 2,0 г перорально однократно или 1,0 г перорально через каждые 12 часов – три приёма, или 250 мг перорально 2 раза в день в течение 6 дней. [44]
- Секнидазол (Тагера) — 2,0 г перорально однократно (эффективность 97%). [45]
Причины неудач в лечении
В 5 % случаев трихомонады устойчивы (резистентны) к перечисленным препаратам [46] . Центры по контролю за заболеваемостью (США) в таких случаях рекомендуют увеличить дозировку и длительность применения медикаментов [47] : Метронидазол — 2,0 г перорально однократно в сутки в течении 7 дней или Тинидазол 2,0 г перорально однократно в сутки в течении 7 дней.
Дисульфирам-подобная реакция на препараты
Нитроимидазолы блокируют и снижают выработку фермента алкоголь-дегидрогеназы, что приводит к повышению уровня и накапливанию токсического ацетальдегида в крови. При приёме алкоголя в любых концентрациях во время лечения препаратами, входящими в группу нитроимидазолов, через 10-20 минут возникает реакция в виде тошноты, рвоты, головной боли, затруднения дыхания, судорог. Длительность её составляет несколько часов. Реакция наблюдается при приёме метронидазола, тинидазола [48] и орнидазола [49] .
Помимо исключения алкоголя, рекомендаций по изменению привычек или особенностям питания при лечении трихомониаза нет.
Установление излеченности трихомонадной инфекции
Проводится через две недели после окончания лечения микроскопией и культуральным посевом и через 4 недели методом ПЦР. При отрицательных результатах лабораторных тестов пациенты дальнейшему наблюдению не подлежат. [2]
Можно ли заниматься сексом при трихомониазе
Заниматься сексом можно через 7-10 дней после завершения лечения трихомониаза. Примерно каждый пятый выздоровевший заражается вновь в течение трёх месяцев после окончания лечения. Чтобы избежать повторного заражения, лечение должны пройти все сексуальные партнеры. Если симптомы возникли снова, нужно пройти повторное обследование [52] .
Прогноз. Профилактика
Прогноз при раннем выявлении и вовремя начатом лечении благоприятный. При неосложнённых формах трихомонадной инфекции после однократного курса выздоровление составляет 95-100%. Лица с осложнёнными формами и метронидазол-устойчивыми формами заболевания после проведённого лечения должны находиться под динамическим наблюдением.
Половые партнёры больных трихомониазом должны быть пролечены независимо от результатов их обследования на наличие трихомонад.
Самой эффективной мерой профилактики является использование презервативов при случайных половых контактах.
Ввиду бессимптомного течения инфекции лицам, имеющим несколько половых партнёров в год или случайные половые связи, рекомендовано ежегодное обследование на наличие трихомонад.
В настоящее время вакцины, предотвращающей заражение трихомониазом, не создано. В 80-е годы прошлого века была создана коммерческая вакцина Солкотриховак, состоящая из лиофилизата Lactobacillus acidophilus, которая по утверждению фирмы-производителя оказывает положительный эффект при рецидивирующем трихомониазе и бактериальном вагинозе. [50] Однако последующими исследованиями предположение о том, что защитный механизм действия вакцины связан на антигенном сходстве применяемых штаммов лактобацилл и вагинальной трихомонады, было отвергнуто. [51]
Криптококкоз - диагностика, лечение
Эпидемиология криптококкоза. Частота криптококкоза у ВИЧ-инфицированных больных составляет 5—12 %, при трансплантации органов— 1—26 %. В гематологической практике инфицирование криптококками наблюдается редко, преимущественно при лимфомах, лимфогранулематозе, редко при трансплантации костного мозга. Инфекция возникает при выраженном нарушении клеточного иммунитета, длительном применении глюкокортикоидных и иммуносупрессивных препаратов.
Возбудителями криптококкоза являются дрожжевые грибы Cryptococcus spp., преимущественно Cryptococcus neoformans. Инфицирование происходит в большинстве случаев через верхние дыхательные пути ингаляционным путем, реже через кожу.
Клиническая картина криптококкоза. Инвазия криптококками происходит прежде всего в легких, но эта патология диагностируется крайне редко ввиду неспецифичности клинических проявлений. Течение криптокко-вой пневмонии может варьировать от бессимптомных проявлений при мелкоочаговом поражении легких до развития острого респираторного дистресс-синдрома. На рентгенограмме определяются интерстициальные поражения легочной ткани или инфильтраты, иногда образование полостей или накопление жидкости в плевральных полостях.
При гематогенной диссеминации поражается головной мозг. Наиболее часто возникает менингит, реже образуются множественные очаги в веществе головного мозга. Для церебрального криптококкоза специфично подострое прогрессирующее течение, симптомы заболевания эволюционируют в течение нескольких месяцев. Инфекция быстро прогрессирует у больных с выраженным иммунодефицитом. Клиническая симптоматика включает лихорадку, тошноту, рвоту; менее чем у трети больных отмечаются менингизм, изменение сознания, очаговые нарушения.
Типично повышение внутричерепного давления, которое может привести к летальному исходу вследствие вклинения ствола мозга в затылочное отверстие. Очаги в веществе головного мозга могут быть изолированными (10 %) или сочетаться с менингоэнцефалитом.
У 25—50 % больных, кроме поражения ЦНС, происходит диссеминация криптококков в другие органы: печень, селезенку (гепатоспленомегалия), глаза, кожу, суставы, кости, развивается депрессия кроветворения. При диссеминированном процессе может инфицироваться простата, являясь в дальнейшем источником реактивации инфекции после прекращения лечения.
Диагностика криптококкоза. Обычно диагностика криптококковой инфекции не представляет больших трудностей. В цереброспинальной жидкости при микроскопии (в капле туши) или при культуральном исследовании (посев) криптококки выявляются у 50—90 % больных. Проводят также микробиологические исследования крови, мочи, секрета простаты, биопсийного материала.
Высокой чувствительностью и специфичностью обладает тест на криптококковый полисахаридный антиген в цереброспинальной жидкости. Антиген криптококка также можно исследовать в крови, моче. Ложноположительные результаты теста возможны при инфекциях, обусловленных Trichosporon beigelii и Stomatococcus mucilaginosis, наличии ревматоидного фактора, злокачественном новообразовании.
Диагностическую люмбальную пункцию с измерением давления рекомендуется проводить при любой форме криптококкоза (легочной или внелегочной), несмотря на отсутствие клинических симптомов со стороны ЦНС, с обязательным определением антигена в цереброспинальной жидкости и проведением микробиологического исследования. Диагноз криптоккового менингита ставят на основании выявления Cryptococcus spp. при микроскопии или в культуре или определения антигена Cryptococcus spp.
Люмбальная пункция необходима как для выявления (или исключения) наиболее частых и опасных очагов диссеминации криптококкоза, так и для выбора антимикотической терапии. При криптококковом менингите повторную диагностическую люмбальную пункцию проводят через 2 нед лечения антимикотиками.
Лечение криптококкоза. Комбинация амфотерицина В (0,7— 0,8 мг/кг) с 5-флуцитозином (37,5 мг/кг каждые 6 ч) относится к наиболее эффективным схемам лечения криптококкоза, являясь терапией выбора при менингеальной форме заболевания. Своевременная сочетанная терапия приводит к излечению 70—90 % больных. Антимикотическая терапия двумя препаратами проводится в течение 2 нед или до ликвидации клинических проявлений инфекции (нормализация температуры тела, отсутствие тошноты, головной боли), далее продолжают лечение флуконазолом (дифлюкан) в дозе 400 мг/сут не менее 10 нед, иногда до 6—12 мес. В случае проведения иммуносупрессивной терапии продолжают прием флуконазола в дозе 200 мг/сут.
Альтернативными режимами лечения криптоккокоза являются следующие: амфотерицин В по 0,7— 1,0 мг/кг в сутки в течение 2 нед, далее флуконазол по 400 мг/сут не менее 8—10 нед или флуконазол 400 мг/сут в течение 6—10 нед, или сочетание флуконазола по 400 мг/сут и 5-флуцитозина (37,5 мг/кг каждые 6 ч) в течение 10 нед, или липосомальный амфотерицин В по 4—5 мг/кг в сутки в течение 2 нед, затем флуконазол. Консолидация флуконазолом проводится в течение 6—12 мес.
Обязательным условием успешного лечения криптококкового менингита является снижение внутричерепного давления. Интракраниальная гипертензия может быть заподозрена на основании следующих симптомов: усиление головной боли, тошнота, рвота, нарушение сознания, снижение остроты зрения. В качестве стартовой терапии в этих случаях проводят люмбальную пункцию, удаляя большой объем цереброспинальной жидкости (25 мл). В дальнейшем люмбальные пункции повторяют, при необходимости проводят шунтирование.
Итраконазол (по 200 мг 2 раза в сутки) назначают только в случае плохой переносимости флуконазола. Результаты терапии данными препаратами не являются идентичными: при лечении итраконазолом реже достигается стерилизация цереброспинальной жидкости, чаще возникают рецидивы криптококкоза. Итраконазол не рекомендуется назначать при криптококковом менингите.
Новый противогрибковый препарат вориконазол (вифенд) проявляет большую активность, чем флуконазол, в отношении С. neoformans; кроме того, он проникает через гематоэнцефалический барьер, но из-за отсутствия клинических исследований не может быть рекомендован для терапии криптококкоза.
Профилактика рецидива криптококкоза проводится при всех последующих курсах иммуносупрессивной терапии. Препаратом выбора является флуконазол (200 мг/сут), альтернативные средства — амфотерицин В (1 мг/кг в сутки раз в неделю) или итраконазол (по 200 мг 2 раза в день).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекция вызванная Cryptococcus neoformans: диагностика, лечение, профилактика
Единственным представителем рода Cryptococcus, способным вызывать инфекцию у человека, считают Cryptococcus neoformans, сапрофит, входящий в состав нормальной микрофлоры животных. В редких случаях вызывает хронический лимфоцитарный менингит у пациентов с лимфомой, принимающих глюкокортикоиды или цитотоксические препараты, или у лиц, входящих в группу риска (заводчики голубей).
Cryptococcus наиболее опасен для пациентов с недостаточностью Т-клеточного иммунитета.
Патогенез инфекции Cryptococcus neoformans. Факторы патогенности — антифагоцитарная капсула, меланин, лизирующие ферменты.
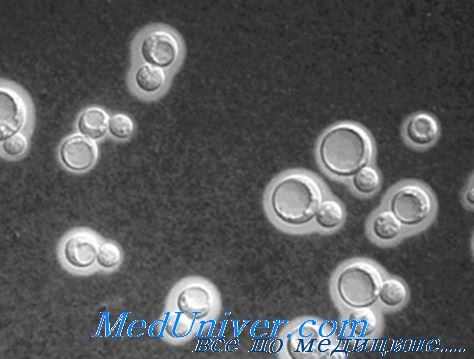
Возбудитель микозной инфекции Cryptococcus neoformans
Клинические признаки инфекции Cryptococcus neoformans. Заболевание обычно протекает в форме подострого менингита, но известны случаи развития пневмонии и фунгемического шока. У пациентов со СПИДом часто возникают рецидивы, поэтому им необходимо пожизненное проведение профилактической терапии.
Лабораторная диагностика инфекции Cryptococcus neoformans:
• Прямая микроскопия после окраски по Граму или индийской тушью в ликворе.
• Латексный тест (для определения капсулярного полисахаридного антигена).
• Культивирование на кровяном агаре или среде Сабуро.
• Биохимические тесты.
• Секвенирование 18S рибосомальной РНК.
Лечение инфекции Cryptococcus neoformans. Препарат выбора — амфотерицин В (для снижения токсичности применяют липосомальную форму препарата). Подтверждена эффективность флуцитозина и флуконазола.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Асептический менингит. Криптококковая инфекция. Лечение криптококковой инфекции.
Асептический менингит, как правило, развивается в момент сероконверсии ВИЧ, т. е. при появлении в крови больного специфических антител к вирусу. Клиническими признаками данной патологии являются головные боли, лихорадка, менингеальные знаки и в некоторых случаях — поражение черепных нервов, спутанность сознания и сонливость. Асептический менингит обычно носит самоограничивающийся характер и не требует никакого другого лечения, кроме анальгетиков. Хронический субклинический асептический менигит нередко наблюдается у больных ВИЧ. Отмечается умеренное повышение уровня белка в ЦСЖ, умеренный лифоцитарный плеоцитоз, повышение индекса иммуноглобулинов и иногда — олигоклональные антитела.
Важно дифференцировать это состояние от нейросифилиса или другой оппортунистической инфекции. При нарастании иммунодефицита плеоцитоз обычно исчезает. Больным с выраженным иммунодефицитом при развитии асептического менингита необходимо провести тщательное обследование на оппортунистическую инфекцию.
Криптококковая инфекция
1. Течение криптококковой инфекции. Cryptococcus neoformans — это самый частый возбудитель менингита у больных СПИДом — он обнаруживается примерно в 10% случаев. Кроме поражения нервной системы нередко наблюдается криптококковое поражение легких, костного мозга, печени и кожи. Локализованные очаги криптококкового поражения — криптококкомы — расположены в паренхиме мозга. Грибок попадает в организм человека с вдыхаемым воздухом и проникает в ЦНС гематогенным путем. Клинические симптомы поражения становятся очевидными при нарастании иммунодефицита.
2. Клиническая картина криптококковой инфекции. Чаще всего встречается криптококковый менингит, единственными признаками которого могут быть головная боль и лихорадка. Менингеальные знаки положительны менее чем у половины больных. Может также отмечаться поражение черепных нервов и у некоторых больных — нарушения со стороны желудочно-кишечного тракта. При вовлечении в процесс паренхимы мозга появляются припадки и очаговые симптомы. Поражение вещества мозга иногда встречается изолированно, без оболочечного процесса.
3. Диагностика криптококковой инфекции. Нейровизуализационное обследование не всегда выявляет патологию. У больных с менингитом может наблюдаться накопление контраста в мозговых оболочках. Криптококкомы могут накапливать и не накапливать контраст. Кисты, образующиеся в пространствах Вирхова-Робина на уровне базальных ганглиев и в других отделах не накапливают контраст. Плеоцитоз в ЦСЖ выявляется не всегда. Снижение концентрации глюкозы и умеренное повышение уровня белка в ЦСЖ — неспецифические изменения и наблюдаются не во всех случаях. Обычно наблюдается повышение титра криптококкового антигена в сыворотке крови, а также положительна культура криптококка. Эти тесты, как правило, негативны при изолированных очагах в паренхиме мозга. Для подтверждения диагноза необходима биопсия очагов в веществе мозга.
4. Лечение криптококковой инфекции
- Начальная терапия. Лечение криптококкового менингита рекомендуется начать с амфотерицина В в дозе 0,6—1,0 мг/кг/сут. одновременно с флуцитозином в дозе 25,0—37,5 мг/кг 4 раза в сутки у больных с нормальной функцией почек. В некоторых случаях ограничиваются терапией одним амфотерицином В. Альтернативным методом лечения является терапия флуконазолом в дозе 200 мг 2 раза в сутки. Этот препарат не менее эффективно подавляет клинические признаки заболевания, но санация цереброспинальной жидкости происходит медленнее. Данный метод рекомендован больным без нарушения интеллекта и с титрами криптококкового антигена менее 1:1000. Лечение амфотерицином В продолжают до достижения общей дозы 1 г, затем переходят на флуконазол в дозе 200 мг внутрь 2 раза в сутки, в течение 10 недель. После санации ЦСЖ переходят на поддерживающий режим терапии.
- Вспомогательная терапия. Пациентам со значительным повышением уровня внутричерепного давления назначается ацетазоламид в дозе 250 мг 4 раза в сутки и/или дренаж ЦСЖ посредством многократных ЛП или установки шунта.
- После достижения санации ЦСЖ больному показана пожизненная поддерживающая терапия флуконазолом в дозе 200 мг/сут.
- Лечение амфотерицином В часто сопровождается побочными эффектами. Лихорадка й озноб подавляются ибупрофеном, аспирином или гидрокортизоном в низких дозах. После инфузионного введения амфотерицина у пациентов часто развивается тошнота, рвота, учащение дыхания и артериальная гипотензия. Препарат оказывает токсическое воздействие на почки. При появлении признаков почечной недостаточности необходимо снизить дозу препарата и количество вводимой жидкости. Возможна боль в месте введения лекарства, боли в суставах и мышцах. Могут наблюдаться флебит, нарушение электролитного баланса с гипокальциемией, гипо- и гиперкалиемией и гипомагниемией. Описаны токсические поражения печени, тромбоцитопения, лейкопения и гранулоцитопения, а также нарушения свертываемости крови, припадки, снижение слуха, энцефалопатия, нейропатия и анафилактические реакции.
5. Ожидаемый результат лечения криптококковой инфекции. Смертность вследствие криптококкового менингита у больных СПИДом составляет 10-25%. Плохими прогностическими признаками являются психические нарушения, титры криптококкового антигена выше 1:1024, наличие очагов криптококковой инфекции за пределами ЦНС, повышение внутричерепного давления и гипонатриемия. После окончания основного лечения необходимо исследовать ЦСЖ. При положительной культуре криптококков терапия должна быть продолжена флуконазолом в высоких дозах. Уровень криптококкового антиггена к в сыворотке не может служить достоверным показателем эффективности лечения.
6. Профилактика криптококковой инфекции. Исследования показали, что риск развития криптококкового менингита несколько ниже у больных СПИДом, принимающих флуконазол в дозе 100-200 мг/сут.
- Вернуться в оглавление раздела "Неврология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

