Критерии диагностики больного инфекционным заболеванием
Обновлено: 22.04.2024
Инфекции вызывают, в основном, следующие виды микроорганизмов: бактерии, вирусы, грибы, простейшие. Их обнаружение — достоверный признак инфекционного процесса.
Лаборатория располагает арсеналом методов, однако только 5 из них наиболее широко распространены:
Культуральный метод (метод посева)
Выявляет чистую культуру возбудителя. Метод сводится к тому, что полученный материал (мазок со слизистой оболочки, кровь, гной, кал и т.д) высевается на питательные среды. Среды могут содержать различные компоненты. Но суть сводится к следующему: микроорганизмы должны дать рост и колонии. Если есть рост патогенных микроорганизмов, то определяется их чувствительность к лекарствам: антибиотикам и бактериофагам.
Серологический метод (метод антител к возбудителю)
Тоже позволяет поставить диагноз. Метод основан на обнаружении в крови антигенов возбудителя или антител — специальных белков, которые образуются в организме в ответ на присутствие и размножение болезнетворных микроорганизмов. Антитела образуются постепенно, поэтому в крови их можно обнаружить только к концу первой недели инфицирования. Это главный недостаток метода.
Молекулярно-биологический метод (метод полимеразной цепной реакции (ПЦР), метод амплификации РНК (NASBA))
Определяет генетический материал возбудителя — ДНК или РНК в образцах (соскоб со слизистой, кровь, моча, кал и т.д). Чтобы уловить малые концентрации ДНК или РНК, необходимо увеличить количество копий. Для этого исследуемый образец помещают в прибор — амплификатор, который позволяет увеличить число копий ДНК в геометрической прогрессии. Для этого метода диагностики крайне важен правильный забор биоматериала.
Микроскопический метод (исследование под микроскопом)
Подразумевает приготовление препаратов на стекле. Материал: кровь, отделяемое слизистых оболочек и т.д. Стекла могут быть окрашенными или неокрашенными, в зависимости от типа инфекции. Врач исследует препарат под микроскопом и выдает результат на основании визуальной оценки: размер, форма, отношение к красителям и т.д.
Метод газовой хроматографии (ГХ-МС)
Выявляет возбудителей по продуктам их жизнедеятельности. Материал: кровь, моча, кал, отделяемое ран, слизистых оболочек.
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
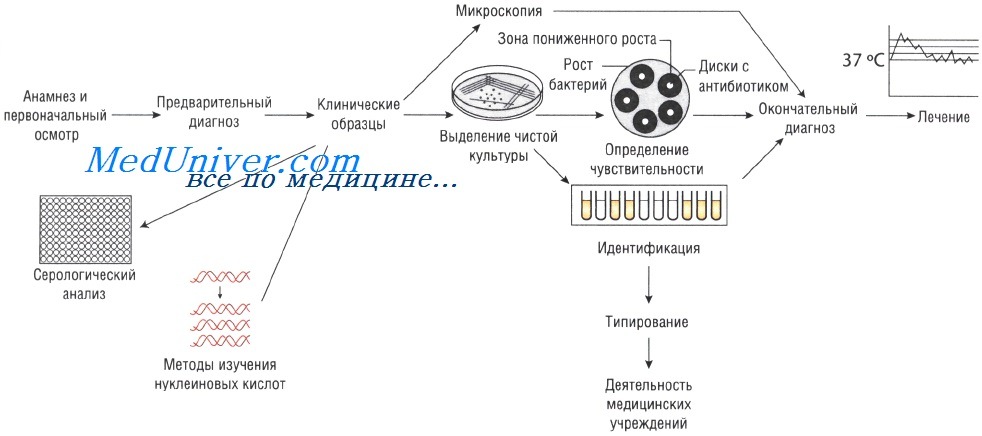
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекционные болезни характеризуются специфичностью, контагиозностью и цикличностью.
Специфичность инфекции
Каждую инфекционную болезнь вызывает конкретный возбудитель. Однако известны инфекции (например, гнойно-воспалительные процессы), вызываемые различными микробами. С другой стороны, один возбудитель (например, стрептококк) способен вызывать различные поражения.
Контагиозность инфекционного заболевания. Индекс контагиозности инфекции.
Контагиозность (заразительность) определяет способность возбудителя передаваться от одного лица к другому и скорость его распространения в восприимчивой популяции. Для количественной оценки контагиозности предложен индекс контагиозности — процент переболевших лиц в популяции за определённый период (например, заболеваемость гриппом в определённом городе за 1 год).
Цикличность инфекционного заболевания
Развитие конкретного инфекционного заболевания ограничено во времени, сопровождается цикличностью процесса и сменой клинических периодов.
Стадии инфекционной болезни. Периоды инфекционной болезни.
Инкубационный период [от лат. incubatio, лежать, спать где-либо]. Обычно между проникновением инфекционного агента в организм и проявлением клинических признаков существует определённый для каждой болезни промежуток времени — инкубационный период, характерный только для экзогенных инфекций. В этот период возбудитель размножается, происходит накопление как возбудителя, так и выделяемых им токсинов до определённой пороговой величины, за которой организм начинает отвечать клинически выраженными реакциями. Продолжительность инкубационного периода может варьировать от часов и суток до нескольких лет.
Период развития болезни. На этой фазе и проявляются черты индивидуальности болезни либо общие для многих инфекционных процессов признаки — лихорадка, воспалительные изменения и др. Б клинически выраженной фазе можно выделить стадии нарастания симптомов (stadium wcrementum), расцвета болезни (stadium acme) и угасания проявлений (stadium decrementum).
Реконвалесценция [от лат. re-, повторность действия, + convalescentia, выздоровление]. Период выздоровления, или реконвалесценции как конечный период инфекционной болезни может быть быстрым (кризис) или медленным (лизис), а также характеризоваться переходом в хроническое состояние. Б благоприятных случаях клинические проявления обычно исчезают быстрее, чем наступает нормализация морфологических нарушений органов и тканей и полное удаление возбудителя из организма. Выздоровление может быть полным либо сопровождаться развитием осложнений (например, со стороны ЦНС, костно-мышечного аппарата или сердечно-сосудистой системы). Период окончательного удаления инфекционного агента может затягиваться и для некоторых инфекций (например, брюшного тифа) может исчисляться неделями.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика инфекций (infectio – перевод с латинского – заражение). Инфекционные заболевания человека представляют собой группу болезней, вызываемых специфическими болезнетворными возбудителями, которые могут передаваться от зараженного человека здоровому. Нередки и случаи передачи патогенных агентов человеку от носителей инфекций или заболевших животных (зоонозные заболевания). Следует отметить, что большинство зоонозных инфекционных заболеваний не передается от человека к человеку. У человека и животных (домашних и диких плотоядных) насчитывают более 300 общих инфекционных возбудителей, из которых более 80 заболеваний вызываются бактериями, свыше 100 – вирусами, около 20 - грибами, 80 заболеваний связано с заражением гельминтами и около 20 - простейшими.
Известны инфекционные болезни, вызываемые, так называемыми арбовирусами – вирусами, передающимися людям через укусы насекомых, например клещей, комаров, блох и др., которые инфицируются от домашних или диких животных. Самая распространенная известная арбовирусная инфекция – клещевой энцефалит. Вирус геморрагической лихорадки также передается клещами. Как известно, клещи являются переносчиками и бактериальных инфекций, например клещевого боррелиоза (болезнь Лайма) или туляремии, хотя туляремию относят к зоонозным заболеваниям, передающимся человеку при непосредственном контакте с больными животными (грызунами), а также при употреблении зараженных продуктов или воды (алиментарный путь заражения). Таким образом, для каждой инфекции у человека характерен свой возбудитель и определенный путь передачи. Возбудителями инфекций могут быть бактерии, вирусы, риккетсии (микроорганизмы, сочетающие в себе особенности бактерий и вирусов), спирохеты, грибки, протозойные (паразитирующие простейшие, одноклеточные), глисты, которые выводятся из организма больного человека или животного при выдохе, мочеиспускании, дефекации, кашле, рвоте, и когда при определенных условиях этот биологический патологический материал становится источником заражения здорового человека.
Согласно литературным данным в настоящее время известно 1415 возбудителей инфекционных и паразитарных болезней. Наиболее обширную группу составляют болезни, вызываемые бактериями и риккетсиями (538 нозологий). Второе место принадлежит паразитарным болезням - 353 нозологии. Вирусные инфекции составляют 217 нозологий. Постоянно возникают новые или впервые выявленные инфекционные заболевания. Так, начиная, с 1970-х голов ежегодно регистрируется, по крайней мере, одно инфекционное заболевание. За последние годы стали известны более 30 инфекционных заболевании, это и ВИЧ, легионеллез, эпидемический ротавирусный гастроэнтерит и ряд африканских лихорадок (например лихорадка Эбола).
В настоящее время существенную роль в распространении инфекционных болезней играет развитие туризма, а также миграционные процессы.
Классификация инфекционных заболеваний
Что касается классификации основных инфекционных болезней человека, то существуют разные системы группировки инфекционных заболеваний. В нашей стране одной из наиболее распространенных является классификация Л.В. Громашевского, построенная в зависимости от локализации возбудителя в организме и механизме его передачи, таких групп насчитывается 5:
- кишечные инфекции;
- инфекции дыхательных путей;
- кровяные инфекции;
- инфекции наружных покровов;
- инфекции с различными механизмами передачи, например передающиеся половым путем, воздушно-капельным путем (один из самых распространенных), фекально-оральный, контактный, трансмиссионный, вертикальный от матери к плоду, от матери к новорожденному в родовом акте, внесенные при операциях, инъекциях и т.п.)
Кроме того в РФ принята также международная более многоступенчатая классификация инфекционных заболеваний:
- кишечные инфекции;
- туберкулез;
- бактериальные зоонозы;
- другие бактериальные заболевания;
- полиомиелит и энтеровирусные болезни центрально нервной системы;
- вирусные заболевания, сопровождающиеся высыпаниями;
- вирусные заболевания,которые передаются членистоногими;
- другие вирусные заболевания;
- риккетсиозы и другие инфекции, передаваемые членистоногими;
- сифилис и другие венерические инфекции;
- заболевания. которые вызываются спирохетами;
- грибковые заболевания (микозы);
- гельминтозы;
- другие инфекции и паразитарные заболевания.
Инфекционные заболевания вызывают у пациента значительные изменения в картине крови, при многих инфекционных болезнях изменяется функция различных внутренних органов – печени, сердца, легких, мозга, почек, кишечника, практически все инфекционные заболевания протекают с изменениями широкого спектра биохимических параметров, отражающих различные стороны патогенеза. Установлено также, что, к примеру, вирусы краснухи, герпеса, коксаки, полиомиелита, цитомегаловирус и эховирусы (род энтеровирусов) могут вызывать серьезные нарушения в развитии плода и новорожденного. Кроме того в настоящее время есть основания считать, что некоторые группы вирусов могут быть виновниками возникновения диабета первого типа, к ним относят вирус Коксаки, вирус краснухи, реовирус 3 типа, вирус энцефаломиокардита, вирус эпидемического паротита, цитомегаловирус, вирус гепатита А.
Диагностика инфекций
Диагноз инфекционного заболевания основывается на анамнезе больного, эпидемиологическом анамнезе, включает инструментальные методы обследования и, как правило, диагностика инфекционных заболеваний не обходится без использования комплекса лабораторных методов. Диагностика инфекционного заболевания начинается с базовых лабораторных методов исследования: это – клинический анализ крови. Известно, например, что в клиническом анализе крови лейкоцитоз чаще всего выявляется в результате инфекционного заболевания, что многие вирусные, бактериальные и рикетсиозные болезни приводят к нейтропении (снижение нейтрофилов), а частой причиной лимфоцитоза и/или моноцитоза является инфекционный мононуклеоз.
Такой показатель крови, как скорость оседания эритрорцитотв (СОЭ), не являясь самостоятельным диагностическим показателем в силу своей неспецифичности, является индикатором общего неблагополучия и продолжает активно использоваться в медицинской практике для выявления и мониторирования инфекционных и воспалительных заболеваний различного происхождения.
Общий анализ мочи является лабораторным тестом, который часто используется при исследования инфекционных заболеваний не только почек, но и инфекций другой локализации.
Так некоторые инфекционные заболевания сопровождаются протеинурией нефротического типа (количество белка в моче не менее 3г/л). Например хронические инфекционные заболевания могут стать причиной нефротического синдрома. Развитие протеинурии нефротического типа могут вызвать, например, бактериальный эндокардит, туберкулез, сифилис, лепра, гепатит В и С, мононуклеоз, цитомегаловирусная инфекция, ветряная оспа, малярия, токсоплазмоз, шистосомиаз. Появление в моче бактерий и возникновение воспаления указывает на наличие инфекционного заболевания мочеполовой системы.
Достаточно эффективным при инфекционных заболеваниях является использование комплекса биохимических тестов, поскольку количественные и качественные изменения биохимических показателей в крови происходящие во время болезни, отражают происходящие при заболевании биохимические нарушения и позволяют следить за динамикой патологического процесса и адекватностью лечения.
К таким эффективным биохимическим параметрам, которые исследуются при инфекционных и воспалительных заболеваниях другого происхождения, например, относится – спектр белков сыворотки крови (белки острой фазы), ферменты и некоторые другие биохимические показатели. Использованием специфических лабораторных методов, например, при диагностике причин лихорадки неясного генеза, хронических инфекций выполняют ис.
В практической медицине часто требуется более глубокое лабораторное исследование с следования мазков из горла, посевы крови, мочи и других жидкостей и выделений организма для выявления бактерий, грибков, иногда, при изменениях характера стула, назначают исследования кала на яйца глист.
В настоящее время в лабораторной диагностике для выявления инфекционных возбудителей широко используются следующие специфические лабораторные методы:
- микроскопические методы, позволяющие идентифицировать инфекционного возбудителя в биологическом патологическом материале с помощью разнообразных типов микроскопов после приготовления окрашенных или нативных мазков. , который заключается в выделении чистой культуры возбудителя из патологического материала, с дальнейшей его идентификацией по морфологическим, культуральным, биохимическим, антигенным, токсикогенным (применяя специфические методы) свойствам и определение его чувствительности к антибиотикам и другим химиотерапевтическим препаратам. Эти исследования часто проводят при подозрении на гнойно-воспалительные заболевания. , в основе которых лежит специфическое взаимодействие антигена и направленных к нему антител. Эти исследования позволяют с диагностической целью определять (качественно и количественно) как антигены так и антитела к ним. Использование в лабораторной практике таких серологических методов как: ИФА(иммунофементный анализ), иммунофлюоресцентный, иммунофлюоресцентныф анализ - позволяет определять в крови больного антитела, относящиеся к различным классам иммуноглобулинов (ИГ А, ИГ М, ИГ Ж). Существование определенной закономерности в динамике выработки специфических антител различных классов при инфекционном заболевании позволяет судить как о стадии так и об интенсивности инфекционного процесса.
- Молекулярно-биологические методы, к которым относится полимеразная цепная реакция (ПЦР-метод).
В основе ПЦР-диагностики лежит молекулярно-биологический метод амплификации (многократное копирование) малых фрагментов нуклеиновых кислот бактерий, вирусов, хламидий, микоплазменных и др. с помощью фермента ДНК- полимереразы. ПЦР-диагностика позволяет провести прямую идентификацию нуклеиновых кислот(РНК или ДНК), то есть генетического материала, инфекционного агента в различном биологическом материале.
Читайте также:

