Крутиков сепсис в комбустиологии
Обновлено: 18.04.2024
При перепечатке текстовой информации и фотографий гиперссылка на сайт обязательна. Все права на графические и текстовые материалы принадлежат их авторам.
Изолированные из ожоговых ран 499 штаммов микроорганизмов представлены 19 видами с преобладанием Staphylococcus aureus (21,8 %) и Staphylococcus epidermidis (21,2 %). На долю бактерий рода Staphylococcus пришлось 45,3 % штаммов, Acinetobacter – 17,6 %, Pseudomonas – 11,2 %, Enterococcus – 7,6 %. Staphylococcus aureus и Staphylococcus epidermidis оказались резистентными к 15 антибиотикам из 16 исследованных с частотой от 2,2 до 83,3 %. Высоко эффектиивными антистафилококковыми лекарственными средствами являются ванкомицин, рифампицин, линезолид. По спектру устойчивости оба вида бактерий существенно не разнились к 14 препаратам из 16. Наиболее часто обнаруживаемые в ожоговых ранах палочковые формы бактерий (Acinetobacter, Pseudomonas) оказались резистентными с частотой от 28,6 % до 100 % к исследованным антибиотикам из классов цефалоспоринов, пенициллинов, фторхинолонов, карбапенемов, аминогликозидов. Лишь к циклическим полипептидам полимиксину В и колистину не выявлено ни одного устойчивого штамма.
Isolated from burn wounds 499 strains of microorganisms represented by 19 species, with a predominance of Staphylococcus aureus (21,8 %) and Staphylococcus epidermidis (21,2 %). The proportion of bacteria of the genus Staphylococcus accounted for 45,3 % of the strains Acinetobacter – 17,6 %, Pseudomonas – 11,2 %, Enterococcus – 7,6 %. Staphylococcus aureus and Staphylococcus epidermidis were resistant to 15 of 16 antibiotics studied with the frequency from 2.2 to 83.3 %. High effektiv antistaphylococcal drugs are vancomycin, rifampicin, linezolid. The spectrum of the stability of both types of bacteria were not significantly different for 14 of the 16 drugs. The most frequently detected in the burn wounds of the rod-shaped forms of bacteria (Acinetobacter, Pseudomonas) were resistant with a frequency of 28,6 to 100 % to investigated antibiotics from the classes of cephalosporins, penicillins, fluoroquinolones, carbapenems, aminoglycosides. Only to cyclic polypeptides polymyxin and colistin not identify any resistant strain.
![]()
Журнал
Автор статей - Крутиков М.Г.
МАРКЕРЫ ВОСПАЛЕНИЯ В ДИАГНОСТИКЕ ОЖОГОВОГО СЕПСИСА
Проект протокола диагностики и лечения ингаляционной травмы у пострадавших с многофакторными поражениями
Местное использование антимикробных средств для лечения ожоговых ран
Инфекция — одна из ключевых проблем в комбустиологии. По представлениям большинства исследователей ожоговая рана представляет основную опасность в плане возможности развития и генерализации инфекционного процесса. Частота инфекционных осложнений ожоговых ран и ожоговой болезни столь велика, что от решения вопросов борьбы с инфекцией во многом будет зависеть прогресс в лечении обожженных в целом ….
Опыт применения неинвазивной вентиляции легких как метода оказания респираторной поддержки у тяжелообожженных
Одним из современных методов респираторной поддержки при острой дыхательной недостаточности является проведение неинвазивной вентиляции легких с помощью различных лицевых масок. Данный метод респираторной поддержки при острой дыхательной недостаточности у части больных способен стать альтернативой традиционной инвазивной (эндотрахеальной) вентиляции легких
Остаточные длительно существующие ожоговые раны:определение и особенности лечения
Микробиологическая оценка эффективности современных антимикробных препаратов для местного лечения ожоговых ран
Главенствующая роль инфекции в патогенез не только ожоговых ран, но и ожоговой болезни является общепризнанным фактом и остается одной из основных причин развития осложнений и летальных исходов у обожженных (Polk H.C., 1979; Кузин М.И. с соавт., 1982; Mackie D.P., 1992; Вихриев Б.С., Бурмистров В.М., 1986; Goodwin C.W., Yurt R.W., 1986 Pruit B.A., 1998; Азолов В.В. с соавт., 1999; Алексеев А.А., 1993, 1999). При этом улучшение контроля над раневой инфекцией во многом связано с применением местных противомикробных средств, которые используются для ее профилактики и лечения, как при непосредственной обработке ожоговых ран, так и в составе влажновысыхающих, мазевых и других раневых повязок.
Сепсис в комбустиологии
Обширное ожоговое поражение сопровождается развитием целого комплекса изменений в организме пострадавших, получивших название ожоговой болезни. В патогенезе ожоговой болезни одно из ведущих мест принадлежит инфекции. При этом, инфекционный процесс, начавшийся в ожоговой ране, имеет тенденцию к генерализации и часто приводит к такому тяжёлому осложнению, как сепсис.
Сравнительная оценка эффективности различных методов подготовки ожоговых ран к аутодермопластике
Термические поражения представляют серьезную медицинскую, социальную и экономическую проблему.
Фармакокинетика антибактериальных препаратов у обожженных
История развития исследований фармакокинетики антибактериальных препаратов в комбустиологической клинике насчитывает не многим более четверти века. При этом объем этих исследований, как показывает анализ имеющихся публикаций, достаточно ограничен.
Антибиотикопрофилактика в комбустиологии (Обзор литературы)
Бобровников А.Э.
Крутиков М.Г.
Институт хирургии им. А.В.Вишневского РАМН
г.Москва
Инфекция является одним из ведущих факторов, определяющих патогенез не только ожоговых ран, но и ожоговой болезни в целом (И.И.Колкер, 1980; K.Moran, A.Munster, 1987; А.А.Алексеев, 1993; В.В.Азолов с соавт., 1997), оставаясь одной из основных причин развития осложнений и летальных исходов у обожженных (Б.С.Вихриев с соавт., 1986; И.Р.Вазина с соавт., 1988; C.C.Dasco et all., 1987; W.F.McManus, 1989). Основную опасность при ожоговой болезни представляет раневая инфекция (И.И.Колкер, 1985). Помимо непосредственной угрозы для жизни больного, длительное существование инфекции ожоговых ран приводит к задержке процесса заживления, образования грануляционной ткани при глубоких ожогах, к лизису вновь образованного эпителия, углублению ожогов II — IIIа степени и способствует избыточному рубцеванию, которое продолжается в результате хронической воспалительной реакции (J.A.Moncrieff, 1974; T.R.Hunt, 1979). Актуальными остаются вопросы инфекции при проведении ранней эксцизии ожоговой раны (Е.A.Deitch, 1985; С.И.Воздвиженский с соавт., 1993) и ее своевременном аутодермопластическом закрытии (Н.И.Атясов, Е.Н.Матчин, 1989; В.П.Яковлев с соавт., 1994), при применении таких современных методов лечения, как трансплантация кератоцитов (Herzog S.R. et all., 1988; De Luca M., 1989, Teepe R.G.C., 1990; С.Ф.Малахов с соавт., 1994) и культивированных аллофибробластов (Д.С.Саркисов с соавт., 1993; Е.В.Глущенко с соавт., 1993). Именно поэтому разработка комплекса методов профилактики инфекции и инфекционных осложнений ожоговой болезни является одним из главных направлений современной комбустиологии.
Профилактика инфекционных осложнений у ожоговых больных входит в комплексное лечение ожоговой болезни и включает в себя целый ряд принципов и патогенетически обоснованных положений:
Повышение естественной защитной способности организма. Теоретические соображения и клинические исследования показали, что понижение защитной способности организма после ожога является более важным фактором, определяющим тяжесть инфекционного процесса, чем вирулентность бактерий (С.М.Вуль, Ю.М.Панова, 1976; М.Г.Григорьев с соавт., 1984; И.И.Колкер, 1985; Д.С.Саркисов с соавт., 1986; Л.О.Шкроб с соавт., 1987; С.М.Вишневская с соавт., 1987; М.Г.Крутиков с соавт., 1999). Необходимость коррекции иммунного статуса обожженных в настоящее время не вызывает сомнений. Поэтому широкое использование в комбустиологии нашли методы иммунопрофилактики (Р.И.Муразян с соавт., 1984; И.И.Колкер, 1984; С.Р.Петров, 1986; Т.Н.Лукоянова, 1991; А.А.Алексеев, 1993), идет разработка и внедрение новых иммуностимулирующих и иммуномодулирующих средств. Многие авторы указывают на эффективность их применения у больных с термической травмой (О.М.Захарченко с соавт., 1986; R.M.Kean et al., 1982;, А.А.Алексеев с соавт., 1990, 1999; Ch.F.Snelling, E.German, 1992).
Профилактика эндогенного инфицирования. Эндогенное инфицирование составляет 30 — 50% всей инфекции в хирургии (F.D.Daschner et all., 1982). Принятые строгие меры изоляции, соблюдение асептики и антисептики могут ограничить колонизацию ран извне потенциально патогенными микроорганизмами (экзогенная флора). Однако, существуют инфекции эндогенного происхождения, то есть вызываемые аутофлорой больного, в отношении которых эти меры недостаточно эффективны. Поражают они наиболее ослабленных в иммунном отношении больных, каковыми и являются обожженные. Проводимая терапия, в том числе антибактериальная, приводит к нарушению колонизационной резистентности и заселению пищеварительного тракта, а затем и дыхательных путей назокомиальными условно-патогенными бактериями, преимущественно грам-негативными. Желудочно-кишечный тракт самого обожженного может служить главным резервуаром патогенных микроорганизмов. Известно, что в 80% случаев раны колонизируются микроорганизмами, исходящими из собственного гастро-интестинального тракта пациента, в то время, как остальные 20% колонизируются перекрестным заражением (Burke et all, 1977). Условно-патогенные микробы из очагов дисбиоза могут вызвать бактериемию уже через 12 ч после травмы (С.М.Вуль и соавт., 1979). Важной составной частью системы профилактики инфекции у тяжелых ожоговых больных является выполнение в выборочном порядке обеззараживания пищеварительного тракта с помощью орального применения антибиотиков (селективная деконтаминация) (F.Jarrett et all., 1988; W.L.Manson et all., 1987, 1990, 1992, 1994). По данным ретроспективного исследования A.P.Davi с соавт. (1992) выполнение этого мероприятия играет положительную роль в предотвращении колонизации и возникновения инфекции у ожоговых больных.
Удаление некротизированных тканей в области ожога. Cope в 1947 году сообщал, что раннее иссечение ожогового струпа с последующей аутодермопластикой снижает частоту раневой инфекции и вероятность плохого приживления трансплантата. C.Miller (1981) показал, что первые часы после бактериального заражения являются критическим периодом для развития последующей бактериальной инфекции. Угроза сепсиса особенно велика до очищения ожоговой поверхности от некротических масс (А.Н.Орлов, Н.И.Лаврентьев, 1961; C. Liedberg et all., 1960; L.Koslowski, 1963). По мнению ряда авторов, в случаях раннего оперативного закрытия ожоговых ран и применения антибиотиков сепсис реже осложняет ожоговую болезнь (Ю.Ю.Джанелидзе, 1952; М.И.Шрайбер, М.И.Долгина, 1966; Б.С.Вихриев, В.М.Бурмистров, 1981). На модели ожоговой травмы у мышей Ю.И.Червенков с соавт. (1988) показали, что ранее иссечение ожоговой раны с одномоментной трансплантацией кожи восстанавливает поступление нейтрофилов в область воспалительных повреждений кожи, необходимое для сдерживания бактериального распространения. A.Basil с соавт. (1978) в экспериментах на животных показали, что раннее проведение иссечения является важным фактором успешного лечения, а отсрочка в выполнении эксцизии увеличивает процент смертности.
Darryl с соавт. (1982) дали заключение о существенном снижении частоты сепсиса и бактериального инфицирования ран у ожоговых больных после иссечения некротических тканей и трансплантации аутокожи. Анализ относительной степени риска показал, что у больных без иссечения в 6,3 раза более вероятно развитие ожогового сепсиса, и в 4,6 раза — существенного нагноения ожоговых ран.
Внедрение в России системы активного хирургического лечения обожженных, включающего проведение ранних некрэктомий и этапных аутодермопластик, в широкую клиническую практику позволило к 1990 г. заметно сократить сроки стационарного лечения при глубоких ожогах (до 36,6 койко-дней), а летальность — до 19,9 — 26,1% (Н.И.Атясов, 1994).
В работе Scott-Conner и др. (1988) показано, что скорость закрытия ожоговых ран коррелирует с показателями выживаемости и смертности обожженных. Известно, что промедление с пересадкой кожи увеличивает риск развития септицемии (В.Рудовский с соавт.,1980).
Тем не менее, каждое хирургическое вмешательство уменьшает и без того низкую сопротивляемость организма, больные становятся более восприимчивы к инфекции (J.P. Jouglard, 1979; Н.И.Атясов, 1994). Это обстоятельство является одним из самых серьезных препятствий для проведения ранней некрэктомии. У больных с небольшой площадью ожога возможность возникновения сепсиса не велика, но он становится серьезной проблемой в тех случаях, когда площадь ожога превышает 30% поверхности тела и большая часть его представляет глубокие поражения (М.И.Кузин, В.К.Сологуб, В.В.Юденич, 1982). Хирургическое иссечение с одномоментной аутодермопластикой как метод лечения глубоких ожогов первоначально было предложено для ожогов с ограниченной площадью (Jackson, 1969; Janzekovic, 1970). Применение этой концепции для закрытия обширных ожоговых ран стало реальным только после успехов в области интенсивного лечения обожженных, и, в том числе, — рационального применения антибактериальных препаратов.
Применение местных антимикробных средств. Использование местных антимикробных средств (поливинилпироллидонйодина, гелей на водорастворимой основе и многих других), а также физических методов лечения (ультрафиолетовое облучение, лазеротерапия, озонотерапия и другие) (W.W.Monafo, 1979; В.К.Сологуб с соавт., 1984; А.А.Алексеев, 1991) достоверно уменьшает степень бактериальной колонизации ожоговой раны (M.Robson, 1979; J.Heggeres et all., 1987 и др.). В силу полиэтиологичности ожоговой инфекции, высокой резистентности флоры ожоговых ран к антибактериальным препаратам, применяемым местно, этих противомикробных агентов часто бывает недостаточно (I.A.Holder, 1976; 1979; K.Bridges, E.J. Lowbury, 1977; J.P.Heggers, M.C.Robson, 1978; J.Heggers et all., 1987; Л.А.Блатун, 1998), что приводит к необходимости использовать системные антибактериальные препараты.
Системная антибиотикопрофилактика ожоговой инфекции. Мнения разных авторов о роли антибиотиков в профилактике и лечении обожженных расходятся. Первый опыт использования антибиотиков в комплексном лечении обожженных показал их высокую эффективность (Ю.Ю.Джанелидзе, 1952; Н.Л.Сельцовский, 1952). По мнению Н.Н.Приорова (1960), антибиотикам принадлежит значительная роль в профилактике и борьбе с инфекцией у обожженных. Широкое применение антибиотиков, как средств значительно снижающих риск инфекционных осложнений у пострадавших от ожогов, рекомендовали М.В.Шеляховский (1960), G.E.Collentine (1967), Г.И.Богословский (1968). Ряд других авторов, не исключая возможность использования антибиотиков при лечении обожженных, указывали на целесообразность ограниченного их применения (А.А.Вишневский с соавт., 1962; Т.А.Арьев, 1963; М.И.Шрайбер и М.И.Долгина, 1966; T.Barkley et all., 1961; W.W.Monafo, 1979). Г.Л.Минкова (1969) указывает на целесообразность назначения антибактериальной терапии больным с обширными глубокими ожогами с профилактической целью сразу после окончания периода шока. Широкие показания к назначению системных антибактериальных препаратов представлены в работах Б.С.Вихриева (1981, 1984). По мнению R.I.Inman с соавт. (1984), показаниями к системному использованию антибиотиков у обожженных являются: инвазивная раневая инфекция, инфекции дыхательных путей и мочевого тракта, наличие ингаляционного поражения, а также длительное применение систем для внутривенных вливаний. Для P.Roulland (1976) критерием начала антибиотикотерапии является критическое значение уровня обсемененности ожоговой раны. P.Knolle (1984) в своей работе считает применение системных антибиотиков целесообразным, но с учетом индивидуального подхода к выбору препарата и его дозировки.
В то же время, ряд ученых критикуют широкое применение системных антибиотиков в качестве средства профилактики инфекции. Так, J.A.Moncriff (1974) отмечал, что контроля за инфекцией ожоговой раны можно добиться, используя местные антибактериальные средства, а при неэффективности последних рекомендует введение антибиотиков под струп, избегая широкого применения системного лечения. M.Sepetjian с соавт. (1974) считал применение системной антибиотикотерапии в лечении обожженных бесполезным и опасным. H.H.Stone (1966) представил случаи раннего синегнойного сепсиса как следствие шаблонной антибиотикопрофилактики. MacMillan (1975) в группе больных, получавших антибиотики с профилактической целью, в 2 раза чаще наблюдал септические и другие опасные для жизни инфекции, у них в 2 раза чаще выявлялись грибы в моче и в ране. Также Bennett (1978) резко ограничивает профилактическое использование системных антибиотиков у ожоговых больных, ограничивая их применение лишь периодом трансплантиции кожи. G. Ducel (1984) приводит данные об угнетении иммунитета и развитии устойчивой микрофлоры на фоне лечения антибиотиками. По мнению S.Abston с соавт. (1987), системное применение антибиотиков оправдано лишь при наличии септического состояния, а назначение антибиотиков на неопределенный срок с целью профилактики инфекции неэффективно и может вызывать изменение нормальной флоры организма, развитие аллергических реакций и колонизацию раны резистентными видами микроорганизмов. В обзоре за 1985 год R.G.Tompcins и J.Е.Burke отмечали, что традиционное применение системных антибиотиков на всем протяжении лечения ожога с целью профилактики развития раневой инфекции этой цели не обеспечивает и их назначение нецелесообразно. В некоторых случаях и на короткое время антибиотики могут дополнять естественную способность организма предупреждать развитие инвазивной инфекции. R.G.Tompkins и J.F.Burke выделили два основных показания для системного назначения антибиотиков: наличие установившейся (подтвержденной) инфекции и профилактика инфекции в отдельные периоды ослабления естественной защитной способности организма, к которым относят период ожогового шока и иссечение колонизированного ожогового струпа. Одно из указанных клинических состояний наступает немедленно после травмы (в период ожогового шока), когда защитная способность организма в значительной степени понижается (S.A.Workman, M.F.Lovia, 1987; И.И.Долгушин с соавт., 1989). При этом первоначально предлагалось вводить больным пенициллин или эритромицин сразу после получения ожога с целью профилактики развития стрептококкового раневого целлюлита, что на данном этапе смогло привести к снижению ранней смертности от сепсиса, вызванного b-гемолитическим стрептококком группы А. Однако исследования M.B.Durtschi с соавт. (1982) показали, что рутинная профилактическая пенициллинотерапия не в состоянии снизить частоту раннего Гр+-целлюлита, а у ряда пациентов приводит к дрожжевой колонизации гастро-интестинального тракта. J.W.Alexander (1971) наблюдал увеличение встречаемости грибов рода Candida и более серьезных инфекций при посевах ран и мочи у пациентов, получавших пенициллиновую профилактику. K.Wickman (1970) отмечал, что с назначением профилактически пенициллина на срок от 5 до 7 дней было связано более быстрое появление резистентной Гр-микрофлоры. Системная антибиотикопрофилактика пенициллином, назначаемая шаблонно всем обожженным в ранние сроки после травмы, вскоре была прекращена, что не увеличило числа стрептококковых целлюлитов (J.W.Alexander, 1971; M.B.Durtschi. et all., 1982; D.R.Haburchak, B.A. Pruitt, 1978; R.B.Lindberg et all., 1976).
Таким образом, вопрос о показаниях к проведению системной антибиотикопрофилактики у обожженных до конца не решен и требует дальнейших исследований. Имеется 4 клинические ситуации, в которых профилактическое назначение системных антибиотиков может быть оправдано (C. Clifford et al., 1987). Хотя их эффективность и в этих ситуациях остается до конца не доказанной при контрольных исследованиях, эмпирическое назначение короткими курсами системных антибактериальных препаратов для профилактики остается общей практикой в большинстве ожоговых центров (D. Fasano et all., 1990; R.P.Papini et all., 1995; G.L.Rodgers et all., 1997; J.A.Steer et all., 1997).
Эти ситуации следующие:
Таким образом, системная антибиотикопрофилактика, как правило, используется при выполнении оперативных вмешательств у обожженных.
Появление широкого арсенала современных антибактериальных средств диктует необходимость разработки показаний к их рациональному назначению, в том числе для антибиотикопрофилактики ожоговой инфекции при хирургическом лечении обожженных, определение схем применения, построенных на основе современных методов исследования в клинике.
Сепсис в комбустиологии
Крутиков М.Г.
Научно-практический центр термических поражений МЗ РФ
Института хирургии им. А.В.Вишневского РАМН
г. Москва
Обширное ожоговое поражение сопровождается развитием целого комплекса изменений в организме пострадавших, получивших название ожоговой болезни. В патогенезе ожоговой болезни одно из ведущих мест принадлежит инфекции. При этом, инфекционный процесс, начавшийся в ожоговой ране, имеет тенденцию к генерализации и часто приводит к такому тяжёлому осложнению, как сепсис.
Вместе с тем, сепсис следует рассматривать, как наиболее грозное инфекционное осложнение ожоговой болезни, вызываемое разнообразными возбудителями или их токсинами на фоне измененной реактивности организма больного.
В настоящее время отмечается не только увеличение частоты сепсиса при термических поражениях, но и ухудшение прогноза, что во многом является следствием неадекватного и
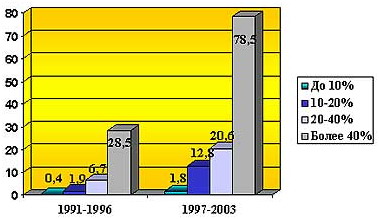
Рис. 1 Частота сепсиса у обожженных в зависимости от площади глубоких ожогов.
несвоевременного лечения пострадавших с первых часов после травмы (2,3). Данные нашего Института за последние годы полностью подтверждают это положение. При этом обращает на себя внимаение связь между частотой развития сепсиса и тяжестью травмы (рис.1)
Значительно выросла и летальность при сепсисе (рис. 2)
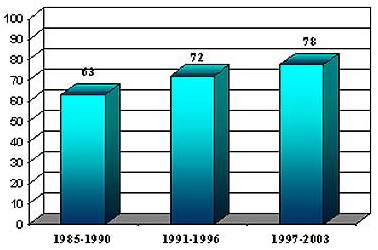
Рис.2 Летальность у больных с ожоговым сепсисом
В ряде случаев основное значение в развитии сепсиса имеют микроорганизмы, которые распространяясь с током крови приводят к развитию метастатических гнойников, в других случаях основное значение имеют микробные токсины, действие которых приводит к запуску каскада реакций в организме больного, приводящих к поражению внутренних органов (3). Помимо этого влияние на развитие сепсиса оказывают продукты распада тканей при их разрушении.
В патогенезе развития сепсиса ведущую роль играет состояние макроорганизма. Только состоянием защитно-приспособительных сил больного, которое не всегда удается конкретизировать диагностически, можно объяснить развитие сепсиса у больных с ограниченными ожогами и, напротив, отсутствие септических проявлений у больных с обширными глубокими термическими повреждениями.
Ожоговая травма создает все предпосылки, благоприятствующие ослаблению иммунобиологических сил организма: это ожоговый шок, нарушения обменных процессов, эндокринной регуляции, интоксикация, белково-энергетическая недостаточность. Вместе с тем, важное значение, по-видимому, принадлежит неблагоприятным факторам, воздействующим на иммунную реактивность больного до получения ожоговой травмы: недостаток и несбалансированность питания, авитаминозы, алкоголизм, повторные травмы, хронические заболевания, эндокринопатии и т.д. Следует учитывать также возраст больного. К сожалению, учесть весь комплекс предрасполагающих факторов, определить исходное состояние иммуннобиологических систем больного не представляется возможным.
В качестве патогенетических звеньев, приводящих к генерализации инфекции, со стороны иммунной системы и факторов неспецифической защиты организма в первую очередь следует рассматривать функциональную недостаточность фагоцитарного звена иммунитета (8). Как показали наши исследования, снижение поглотительной и переваривающей функций фагоцитов в ране, нарушение выработки ими супероксиданионов приводит к недостаточности местных барьерных механизмов и способствует поступлению бактерий и их токсинов в кровяносное русло. Часто сами фагоциты являются средством транспортировки бактерий, которые находясь внутри этих клеток преобретают дополнительную защиту от бактерицидных субстанций крови и действия антибиотиков (1,4). Риск развития сепсиса многократно возрастает при стойких нарушения Т- и В- звеньев клеточного иммунитета и нарушении выработки иммуноглобулинов, особенно класса G (1,5). Большое значение для характера течения сепсиса и его исхода имеет состояние обезвреживающей функции ретикулоэндотелиальной системы. При сепсисе органы, богатые ретикулоэндотелиальной тканью (печень, селезенка, костный мозг, почки и др.) активно участвуют в дезинтоксикации организма и освобождении его от инфекции. Чем выше фагоцитирующая способность клеток этих органов, тем меньше вирулентность микробов и больше вероятность благоприятного исхода. Чем эта способность ниже, тем больше вероятность не только дегенеративного, но и метастатического поражения этих органов, приводящая к летальному исходу. Токсинемия, как один из ведущих компонентов сепсиса, приводит к тяжелым нарушениям функций, а затем и морфологии паренхиматозных органов, вызывает нарушения белкового, углеводного обменов, витаминного, электролитного и кислотно-щелочного балланса, нарушает систему кроветворения, что приводит к развитию анемии. Эти нарушения в еще большей степени снижают сопротивляемость организма к инфекции, что создает порочный круг, приводящий к прогрессированию заболевания и часто к летальному исходу (1).
Роль микробного фактора, в первую очередь, определяется свойствами возбудителя. Так, стафилококковый сепсис большей частью протекает с метастазами, тогда как сепсис, вызванный грамотрицательными микроорганизмами чаще приводит к картине токсического повреждения органов и тканей, в значительном проценте случаев приводя к развитию септического шока. Важным фактором в плане возможности развития сепсиса следует считать количество микроорганизмов, выделяемых из ожоговых ран (6). Наши исследования показали, что в абсолютном большинстве случаев при развитии сепсиса количество микроорганизмов превышало критический уровень 105 КОЕ в 1 гр ткани раны (Lg КОЕ > 5), часто Lg КОЕ превышал 9 — 11.
Распространение инфекции из очага поражения, которым в большинстве случаев является ожоговая рана, осуществляется в основном гематогенным, реже лимфогенным путем. Помимо источника бактерий и токсинов ожоговая рана является источником многочисленных нарушений в организме пострадавших, усугубляющих течение ожоговой болезни и сепсиса, что предопределяет важность ее как можно более раннего закрытия. Однако, даже полное восстановление целостности кожных не всегда приводит к видимому влиянию на течение сепсиса, что в ряде случаев бывает связано с уже развившимися метастатическими очагами, или с цепью системных патологических реакций, развившихся в ответ на действие микробных токсинов.
Таким образом, патогенез ожогового сепсиса чрезвычайно сложен и зависит от многочисленных факторов и их сочетаний (рис 3). Только основанная на постоянном динамическом наблюдении оценка изменений в организме обожженного позволяет прогнозировать и диагностировать сепсис, построить эффективную схему комплексного патогенетического лечения этого осложнения.
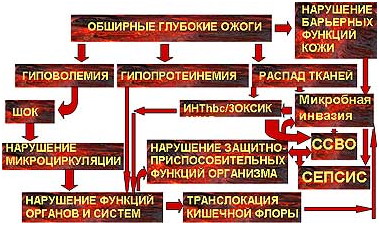
Комплексное обследование и лечение 327 больных с ожогами от 25 до 85% поверхности тела при площади глубоких ожогов от 9 до 75% поверхности тела, из которых у 211 был диагностирован сепсис, позволяет определить наиболее характерные и достоверные клинические и лабораторные критерии этого осложнения.
- Внезапное ухудшение общего состояния больного, не соответствующее стадии развития заболевания и характеру течения раневого процесса.
- Высокая лихорадка постоянного или, чаще, гектического характера с потрясающими ознобами.
- Расхождение частоты пульса и температуры тела.
- Прогрессирующее ухудшение общего состояния, несмотря на активное лечение, нарушения сердечно-сосудистой деятельности, функций почек и печени.
- Резкое ухудшение состояния ожоговой раны с появлением атрофичных грануляций, очагов вторичных некрозов.
- Прогрессирующая анемизация с уровнем гемоглобина не превышающим 90 ЕД.
- Лимфопения со снижением количества лимфоцитов менее 10 в 1 мл крови, нейтрофилез со сдвигом лейкоцитарной формулы влево.
- Увеличение СОЭ более 60 мм/час
- Высокая обсемененность ожоговых ран, превышающая критическую величину.
- Выделение при биопсии микробов в составе ассоциации из 4 -5 и более микроорганизмов.
- Стойкая бактериемия, определение в гемокультуре ассоциаций микроорганизмов.
- Признаки иммуносупрессии, проявляющиеся в снижении функциоальных резервов нейтрофильных лейкоцитов (уменьшение фагоцитарного числа и фагоцитарного индекса, снижение продукции супероксиданиона угнетение или гиперстимуляция спонтанной люминолзависимой хемилюминисценции с одновременным снижением индекса хемилюминисценции), прогрессирующее уменьшение количества Т и Т-активных лимфоцитов, В-лимфоцитов, угнетение продукции иммуноглобулина G, прогрессивное увеличение уровня макромолекулярных циркулирующих иммунных комплексов с параллельным снижением уровня церуллоплазмина, снижение уровня сывороточного лизоцима.
Таким образом, дифференциальная диагностика сепсиса и проявлений септикотоксемии, как стадии ожоговой болезни, являющейся по сути гнойно-резорбтивной лихорадкой, достаточно трудна. Для своевременной диагностики сепсиса у обожженных необходимо постоянное динамическое наблюдение за больными с анализом всех перечисленных выше симптомов. Диагносцированный сепсис или высокий риск его развития требует немедленного начала комплексной интенсивной терапии, учитывающей все звенья патогенеза этого осложнения.
Комплекс лечебных мероприятий можно условно разделить на две группы:
Основные задачи общего лечения сепсиса:
- Борьба с инфекцией и интоксикацией.
- Нормализация иммунологического статуса организма.
- Поддержание гомеостаза.
- Коррекция нарушенных функций органов и систем.
В борьбе с инфекцией основное значение имеет рациональная антибактериальная терапия. Выбор антибактериального препарата должен основываться на данных антибиотикограмм с обязательным учетом чувствительности выделенной из крови или ожоговых ран микрофлоры. Антибактериальную терапию следует проводить длительно, со своевременной сменой препаратов в максимальных дозах. Все препараты вводятся внутривенно. Микробиологический мониторинг проводится 1 раз в 7 — 10 дней. При тяжелом течении инфекции проводится комбинированная антибактериальная терапия двумя или тремя препаратами. При сепсисе, вызванном грамположительной флорой антибиотиками выбора являются полусинтетические пенициллины широкого спектра действия, цефалоспорины II поколения, линкомицин, а также фузидин и диоксидин. Альтернативная терапия — фторхинолоны и ванкомицин. При грамотрицательном сепсисе лечение проводят карбенициллином, гентамицином или амикацином в максимкальных дозах. Предпочтительнее комбинация карбенициллина с аминогликозидом. Альтернативная терапия — цефалоспорины III поколения (цефтриаксон, цефоперазон или сульперазон, цефтазидим и др.), ципрофлоксацин, карбепенемы. В лечении сепсиса хорошо зарекомендовали себя комбинации ципрофлоксацина с диоксидином, карбенициллина с гентамицином и диоксидином. Сепсис, вызванный неспорогенными анаэробными бактериями требует терапии клиндамицином, далацином С или метронидазолом. При грибковом сепсисе — препараты выбора — амфотеррицин В и флюконазол. Тяжелый сепсис требует немедленного включения в терапию карбепенемов (имипенем, меропинем), при сепсисе, вызванном MRSA — ванкомицина или линезолида.
Дезинтоксикационная терапия осуществляется с помощью форсированного диуреза, либо с применением методов экстракорпоральной дезинтоксикации (плазмаферрез или гемосорбция).
К средствам, повышающим реактивность организма, можно отнести переливание компонентов крови. Из средств пассивной иммунизации хороший эффект в зависимости от возбудителя сепсиса получен при использовании гиперимунной антистафилококковой или антисинегнойной плазмы, антистафилококкового гамма-глобулина. При угнетении различных звеньев иммунитета на основании данных иммунограмм применяют препараты тимуса (тималин, Т-активин), лейкинтерферон, декариес, препараты человеческих иммуноглобулинов, тромбо-лейкомассу, лейкоцитарную массу иммунизированных доноров или ожоговых реконвалисцентов. Основным методом иммунокоррекции является иммунозаместительная терапия очищенными человеческими иммуноглобулинами.
С целью лечения белково-каллорийной недостаточности широко применяется парентеральное и энтеральное питание. Важное место занимает в комплексном лечении сепсиса коррекция электролитных расстройств, кислотно-щелочного равновесия, борьба с гипоксией.
При нарушении функций сердечно-сосудистой системы в комплексную терапию включается кардиотропная поддержка, при поражении печеночной паренхимы — гепатопротекторы, при поражении легких необходима респираторная поддержка, вплоть до проведения ИВЛ, ингаляционная терапия, применение муколитических и бронхолитических средств. В особо интенсивных лечебных мероприятиях нуждаются больные с клиникой септического эндокардита.
Несмотря на комплекс терапевтических мер, направленных на борьбу с ожоговым сепсисом, прогноз при этом осложнении остается серьезным, хотя во многом зависящем от ранней диагностики и максимально интенсивной и последовательной терапии. В этой связи огромное значение приобретает комплекс мер, направленных на профилактику развития сепсиса у обожженных. Этот комплекс мер включает в себя: своевременное и адекватое лечение ожогового шока, адекватную дезинтоксикацию в периоде острой ожоговой токсемии и септикотоксемии, как можно более раннее очищение ожоговых ран от некроза и их аутодермопластическое закрытие, коррекцию нарушенного метаболизма, нормализацию антиинфекционной резистентности организма, борьбу с раневой инфекцией. Всех больных с площадью глубоких ожогов более 20% поверхности тела следует рассматривать в качестве группы риска в плане возможной генерализации инфекции и применять все доступные средства и методы общего и местного лечения для предотвращения этого грозного и опасного для жизни осложнения ожоговой болезни.

1. Алексеев А.А. Основные статистические показатели работы ожоговых стационаров Российской федерации за 2009 год / А.А. Алексеев, Ю.И. Тюрников // III съезд комбустиологов России 15-18 ноября 2010: сб. науч. трудов. – М., 2010. – С. 4–6.
2. Алексеев А.А. Антибактериальная терапия в комплексном лечении и профилактике инфекционных осложнений при ожогах / А.А. Алексеев, М.Г. Крутиков, В.П. Яковлев // Русский Медицинский журнал. – М., 1997. – № 5. – С. 24–30.
3. Избранные труды по комбустиологии / под ред. Островского Н.В. – Саратов: Научная книга, 2009. – С. 269.
4. Интенсивная терапия ожоговой болезни / Е.Н. Клигуненко с соав. // М.: МЕДпресс-информ, 2005. – С. 61–75.
7. Практическое руководство по антиинфекционной химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. – Смоленск: МАКМАХ, 2007. – 464 с.
8. Хирургические инфекции кожи и мягких тканей. Российские национальные рекомендации / под ред. В.С. Савельева с соав. – М.: Компания БОРГЕС, 2009, – С. 78–82.
9. Hemdon D. Modern burn care / D. Hemdon, M. Spies // Semin Pediatr Surg. – 2001. – Vol. 10, № 1. – P. 28–31.
10. Magliacani G. Antmicrobial therapy problems in burn sepsis / G. Magliacani, M. Stella, M. Calcagni // Ann Medit Burns Club. – 1994. – Vol. 7, № 2.
11. Pruitt B.A., Use of wound biopsies in the diagnosis and treatment of burn wound infection / B.A. Pruitt, A.T. McManus, S.H. Kim and W.G. Cioffi // US Army Institute of Surgical Research, Fort Sam Houston, USA. – Steinkopff Verlag Darmstadt. – 1993. – Р. 55–63.
Ожоги являются одним из наиболее часто встречающихся видов травматизма. Так, по данным 30 ожоговых центров за год за помощью обратилось около 157000 пострадавших, из них было госпитализировано 22057 пациентов, из которых у 1919 (8,7 %) больных травма закончились летальным исходом [1]. Для сравнения, в Соединенных Штатах Америки ежегодно около 2 млн человек получают ожоги, из которых приблизительно 100 тыс. требуют госпитализации и до 5000 случаев заканчиваются летально. При этом наиболее частой причиной смерти пострадавших от ожогов остаются инфекция и инфекционные осложнения ожоговой болезни, из которых превалируют пневмония и сепсис [8].
Общеизвестно, что все ожоги либо первично инфицированы, либо бактериальная обсемененность раны наступает уже в первые часы после травмы. Кроме непосредственной угрозы для жизни больного, имеющаяся инфекция значительно замедляет эпителизацию ожоговых ран, в том числе препятствуя своевременному оперативному лечению по восстановлению кожного покрова, а также ведет к формированию гипертрофических и келоидных рубцов. Инфекция ожоговых ран при длительном существовании может осложняться генерализацией, развитием сепсиса, ведет к развитию системного воспалительного ответа, результатом которого может явиться полиорганная недостаточность и смерть [2, 3, 4. 8]. Факторами риска летальности при ожогах являются:
• Неадекватная антибактериальная терапия, либо адекватная, но начало которой отсрочено более чем на 24 часа.
• Имеющиеся MRSA (метициллин-резистентные) и MRSE (аминогликозидустойчивые) штаммы микроорганизмов.
• Возраст (дети до 10 лет и взрослые старше 60 лет).
• Бактериемия, пневмония, наличие сопутствующих заболеваний.
• Не санированный первичный локус инфекции.
• Продолжительность антибактериального лечения менее 14 дней.
Таким образом, одной из основных составляющих лечения больных с термической травмой является адекватная антибактериальная защита пациента.
Инфекции у обожженных разделяют на три типа (по G. Magliacani и M.Stella, 1994) [10]:
1. Нозокомиальные инфекции, связанные с окружающей средой больницы, полирезистентной флорой, характеризующейся перекрестным инфицированием через определенные источники.
2. Ятрогенные инфекции, связанные с инвазивными диагностическими и лечебными процедурами.
3. Оппортунистические инфекции, связанные с обычной флорой и иммунокомпрометированным хозяином.
По гистологическим признакам ожоговой раневой поверхности различают стадии развития инфекционного процесса в ране (B.A. Pruitt, 1993; М.Г. Крутиков, 2000) [2, 11]:
а) поверхностная – микробы на ожоговой раневой поверхности;
б) проникновение – микроорганизмы в толще ожогового струпа;
в) пролиферация – появление и изменение численности микробов в пространстве под струпом.
а) микроинвазия – мелкие фокусы микрооргинизмов в измененной ткани соседнего с подструпом пространства;
б) генерализация – микрофокальное или широко распространенное проникновение микробов глубже в измененную подкожную ткань;
в) микрососудистая – вовлечение небольших кровеносных и лимфатических сосудов.
Условно-патогенная микрофлора выявляется на ожоговой поверхности уже в первые сутки с момента травмы. В последующем бактерии могут проникать в разрушенные волосяные фолликулы, а при глубоких ожогах ‒ в подкожно-жировую клетчатку и далее по кровеносным и лимфатическим сосудам разноситься по всему организму, вызывая генерализованную микробную инвазию. Генерализация инфекции наиболее часто происходит при площади ожоговых ран более 15 % поверхности тела (у детей до 12 лет – более 5 % поверхности тела), при площади глубоких ожоговых ран более 5 % поверхности тела, при наличии сопутствующих заболеваний (сахарный диабет, ОРВИ, пневмония, другие очаги острой и хронической инфекции), при иммунодефицитных состояниях, базисном лечении иммунодепрессантами и кортикостероидами, а также при сочетании с термоингаляционной травмой. Все перечисленные состояния требуют назначения антибактериальных препаратов по абсолютным показаниям, причем начало системной терапии антибиотиками должно происходить в первые 12–24 часа после травмы для предотвращения генерализации [4].
Адекватная стартовая антибактериальная терапия является основным фактором лечения ожоговой болезни и выживаемости пациентов. При этом при назначении антибиотиков выбранные препараты должны по возможности охватывать весь спектр потенциальных возбудителей инфекции и выбираться с учетом риска мультирезистентности возбудителей.
Цель ‒ определение оптимальных схем назначения, длительности и эффективности использования того или иного антибактериального препарата, схем перехода между препаратами и явилось целью нашей работы.
Материалы и методы исследования
За период с 2009 по 2012 гг. нами было обследовано 118 пациентов в возрасте от 18 до 65 лет с ожогами от 10 % до 35 % поверхности тела. Из них 72 пациента (61 %) были мужчины и 46 (39 %) – женщины. Из общего числа пациентов более половины (81 больной – 68,6 %) изначально при поступлении в стационар были госпитализированы в отделение реанимации и интенсивной терапии для ожоговых больных, где находились до стабилизации состояния от 8 до 35 дней. Из общего числа обследованных больных у 32 (27,1 %) были выявлены различные сопутствующие заболевания, у 26 (22 %) пациентов имелась термоингаляционная травма.
До начала антибактериальной терапии в течение первых суток с момента получения травмы у всех исследованных пациентов (100 %) был проведен бактериальный мониторинг раневых поверхностей. В последующем бактериологическое обследование повторялось каждые 5–7 дней до излечения пациента и выписки из стационара. Исследование выполнялось диско-диффузионным методом (в соответствии со стандартом NCCLS). Кроме раневого отделяемого исследовались кровь, моча, экссудат трахеобронхеального дерева, удаленные магистральные катетеры. Также использовался метод определения минимальной подавляющей концентрации препарата (МПК).
Микрофлора ожоговых ран была представлена, как правило, ассоциациями грамположительных и грамотрицательных микроорганизмов, а также грибов. Наиболее часто встречались St. aureus (40,4 %), Ps. Aeruginosa (31,6 %), реже встречались St. saprophyticus, Proteus, Candida albicans и tropicalis, Acinetobacter baumannii. Из комбинаций наиболее часто встречались Staph. aureus и Ps. Aeruginosa (41,3 %). Кроме того, в процессе лечения ожоговой травмы из всех выявленных штаммов стафилококка у 61,7 % больных выявлялись так называемые MRSA штаммы (рис. 1). Устойчивость синегнойной палочки выявлена была в 37,7 % случаев (рис. 2).
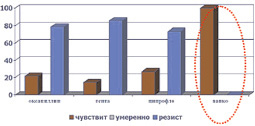
Рис. 1. Резистентность штаммов St. aureus
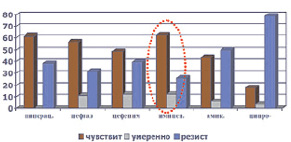
Рис. 2. Резистентность госпитальных штаммов Ps. aeruginosae
В последующем при сохраняющихся ожоговых поверхностях, при снижении чувствительности микроорганизмов к проводимой терапии, на 10–14 сутки выполнялся переход на цефалоспорины III–IV поколения (Цефотаксим, Цефепим) в сочетании с аминогликозидами (Амикацин), фторхинолоны I–II поколения (Ципрофлоксацин). Показаниями для смены антибактериального препарата были отсутствие чувствительности выделенной флоры к используемому препарату, а также отсутствие положительной динамики состояния пациента, нарастание симптомов системной воспалительной реакции через 48–72 часа.
В дальнейшем при выявлении MRSA и MRSE микроорганизмов, снижении чувствительности к вводимым антибиотикам (повышении МПК > 1 мг/л), что наблюдалось к 22–26 суткам, используемые препараты меняли на гликопептиды (Ванкомицин) и фторхинолоны III–IV поколения (Левофлоксацин, Моксифлоксацин) в качестве монотерапии, либо назначалось сочетание цефалоспоринов III–IV поколения (Цефоперазон+сульбактам, Цефепим) с гликопептидом (Ванкомицин). В некоторых случаях применялись карбапенемы (Имипинем, Меропенем) – при сохранении к ним чувствительности микроорганизмов. Использование подобной терапии осуществлялось еще в течение 8–12 дней. Кроме того, начиная с 8–10 дня от начала антибактериальной терапии из-за снижения колонизационной резистентности желудочно-кишечного тракта и повышения риска развития кандидоза, использовались противогрибковые препараты (Нистатин, Флюконазол) и пробиотики (эубиотики).
Таким образом, в процессе исследования мы, как правило, следовали классической схеме ЭСКАЛАЦИОННОЙ антибиотикотерапии, т.е. назначали изначально антибиотики с относительно нешироким спектром активности, предполагая малую вероятность наличия у пациента в ранние сроки после травмы устойчивых возбудителей [2, 4, 6, 8], а затем переходили на препараты резерва.
Увеличение продолжительности применения антибактериальных средств более 10–14 дней (несмотря на приведенные в аннотации к препаратам и описанные в руководствах по использованию лекарственных средств сроки [7]) проводилось также под контролем бактериального исследования пациентов, и было обусловлено длительностью течения болезни и особенностью лечения больных с термической травмой. Учитывалось общее состояние больного, показатели лабораторных и клинических исследований.
Критериями эффективности антибактериальной терапии явились:
• Регресс системной полиорганной недостаточности.
• Отсутствие нагноения в ране (стерильные посевы на 3,7 сутки).
• Отсутствие генерализации инфекции и вторичных очагов.
Доза вводимого препарата в некоторых случаях увеличивалась в 1,5–2,0 раза, что создавало адекватную подавляющую концентрацию препарата в крови и тканях. Увеличение дозы обусловлено не только ростом резистентности микроорганизмов, но и измененной фармакокинетикой у ожоговых больных, о чем писал Zaske et al. еще в 1976 г. К тому же бактериальный киллерный эффект не является зависимым от концентрации, а является функцией времени, в течение которого поддерживаются концентрации на уровне, приблизительно в 4 раза превышающем МПК. В то же время нет никаких доказательств того, что токсичность препарата соответствует высоким его концентрациям (Moellering R.C., 1994) [5].
Исходя из данных постулатов, в среднем, прием антибиотиков одной группы и поколения (например, цефалоспоринов II–III поколения + аминогликозида) продлевался до 30 ± 5 дней. При исследовании именно к этому времени чувствительность имеющихся на ранах микроорганизмов к данным препаратам приближалась к минимальной. Однако при увеличении длительности использования одного препарата или сочетания препаратов сохранялась возможность продолжить адекватную терапию пациентам, переходя на описанные выше схемы по эскалационной программе, не теряя возможность в случае крайней необходимости использовать препараты резерва и не формируя к ним антибиотикорезистентности.
Результаты исследования и их обсуждение
Анализируя полученные результаты исследования, нами составлены схемы оптимальной системной антибактериальной терапии ожоговой болезни (табл. 1 и 2).
Читайте также:


