Кто как лечится от волосяного лишая
Обновлено: 19.04.2024
Приведены критерии диагностики красного волосяного лишая Девержи и подходы к лечению больных. Применение синтетических ретиноидов дает возможность повысить эффективность терапии таких пациентов. Однако лечение БД является длительным и всегда сопровождаетс
Красный волосяной лишай Девержи (син.: болезнь Девержи; pityriasis rubra pilaris; lichen ruber acuminatus) — гетерогенное хроническое воспалительное заболевание кожи, которое подразделяется как на наследственные формы, передающиеся аутосомно-доминантно, так и на спорадические, приобретенные. Хотя принято считать, что название и описание принадлежит Альфонсу Девержи, о первом случае сообщил в 1828 г. Клаудиус Таррал. Он отмечал изолированные чешуйчатые высыпания, пронизанные в центре волосом, при пальпации которых на поверхности кожи прощупывается очень плотная шероховатость [1–6].
Болезнь Девержи (БД) — редкое заболевание, составляющее 0,03% всех болезней кожи. Этиология и патогенез дерматоза до сих пор до конца не изучены, мнения современных авторов расходятся. Теория наследственной предрасположенности занимает главенствующую роль, хотя существуют и другие теории [3, 5]. Иммуноморфологическое исследование клеток воспалительного инфильтрата у больных БД характеризовалось повышенным количеством клеток с экспрессией маркеров, принимающих участие в развитии воспалительной иммунной реакции по механизму гиперчувствительности замедленного типа. Это позволяет отнести заболевание к хроническим дерматозам, характеризующимся гиперпролиферацией кератиноцитов, опосредованной Т-клетками [7]. По данным К. Н. Суворовой и соавт. (1996), начало заболевания может отмечаться во всех возрастных периодах от 5 до 72 лет. Течение заболевания хроническое, иногда десятилетиями, сезонности не отмечается [8].
В 1980 г. Гриффитс описал 5 клинических форм заболевания, которыми достаточно долго пользовались врачи:
- Классический взрослый тип заболевания.
- Атипичный взрослый тип.
- Классический ювенильный тип.
- Ограниченный ювенильный тип.
- Атипичный ювенильный тип.
Однако в современной дерматологии принято считать, что классический взрослый тип и классический ювенильный типы заболевания имеют идентичные клинические проявления и различаются только возрастом пациентов. По этой причине в настоящее время классификация БД включает три клинические формы:
- Классический тип.
- Ограниченный ювенильный тип.
- Тип, связанный с ВИЧ-инфекцией [6].
Клиническая диагностика заболевания основывается на характерных признаках:
Однако довольно часто высыпания при БД напоминают псориазиформные элементы, а наличие диффузной эритродермии придает схожесть дерматоза с псориазом и токсикодермией. Псориаз и БД объединяют не только сходство клинических проявлений, но и механизмы развития воспалительного процесса. Результаты гистологического и иммуноморфологического исследования, проведенного О. Р. Катуниной (2005), свидетельствуют об общем патогенетическом пути развития воспалительного процесса в коже при псориазе и БД. В обоих случаях происходит активация антигенпредставляющих клеток, гиперпролиферация кератиноцитов, которые, приобретая черты иммуноцитов, способствуют поддержанию патологического процесса [7].
Диагностика
Следующим очень важным симптомом БД является характерная окраска кожи — кирпично-красная или морковная, описанная многочисленными авторами [3–10]. Нами отмечено, что морковный оттенок кожи имели 7 пациентов (30,4%), а у остальных наблюдалась кирпично-красная окраска (n = 16; 69,6%). Однако ладонно-подошвенный гиперкератоз, развившийся у 19 (82,6%) из наблюдаемых нами больных, во всех случаях давал желтовато-морковную окраску кожи.
Хотя поражение ногтевых пластинок среди обследованных больных диагностировалось только у 18 (78,2%) пациентов, хочется отметить, что выраженность данного признака, скорее всего, зависит от давности заболевания, поскольку скорость роста ногтевой пластинки значительно медленнее, чем развитие патологического процесса. Это предположение подтвердили наши наблюдения: у больных, имеющих поражение ногтевой пластинки, длительность заболевания составила от 4 до 10 месяцев. Изменение ногтевой пластинки характеризовалось подногтевым гиперкератозом, изменением цвета, продольной и поперечной исчерченностью. Однако онихолизис, характерный для псориаза, не отмечен ни у одного пациента.
Как уже упоминалось выше, у большинства наблюдаемых нами пациентов с БД (n = 21; 91,2%) первоначально правильный диагноз не был установлен. Пациенты получали гипосенсибилизирующие и антигистаминные препараты, а более половины из них (n = 15; 65,2%) — пролонгированные стероиды, но, несмотря на интенсивную терапию, положительной динамики в лечении не отмечалось. Данный факт еще раз подтверждает, что БД резистентна к обычной терапии. Резюмируя вышесказанное, можно выделить основные дифференциально-диагностические признаки, позволяющие отличить красный волосяной лишай от псориаза:
- хорошее общее состояние больных БД сохраняется даже при диффузном поражении кожного покрова, в отличие от псориаза;
- характерным признаком является наличие островков здоровой кожи;
- первичным элементом является остиофолликулярная папула;
- кирпично-красная или морковная окраска кожи;
- отсутствие инфильтрации, лихенификации и обильного крупно-пластинчатого шелушения, свойственных псориазу;
- онихолизис, характерный для псориаза, наблюдается очень редко;
- ладонно-подошвенный гиперкератоз без инфильтрации, дающий желтовато-морковный оттенок кожи;
- торпидность к гипосенсебилизирующей, антигистаминной и гормональной терапии.
Лечение
В настоящее время препаратами, воздействующими на процессы кератинизации, являются ретиноиды. Впервые в 1930 г. Moore синтезировал ретинол из каротиноидов и начал изучать его действие на организм. Сегодня доказано, что витамин А участвует в регуляции и пролиферации многих типов клеток с момента эмбриональной закладки и в течение всей жизни. Наиболее эффективным среди всех синтетических ретиноидов в лечении БД является Неотигазон в дозе 0,5–0,7 мг/кг/сутки [4–6, 10].
Неотигазон (ацитретин 10 мг, 25 мг) обладает выраженной липофильностью и легко проникает в ткани. Нужно учитывать, что из-за индивидуальных различий всасывания и скорости метаболизма ацитретина дозу нужно подбирать индивидуально. Начальная суточная доза составляет 25 или 30 мг в сутки в течение 2–4 недель. Капсулы лучше принимать один раз в сутки вечером во время еды или с молоком. Как правило, терапевтический эффект достигается при суточной дозе 30 мг. В некоторых случаях бывает необходимо увеличить дозу до максимальной, равной 75 мг/сутки. Однако не следует рассчитывать на быстрый клинический эффект от проводимой терапии при лечении БД, особенно у взрослых. Наше мнение совпадает с мнением зарубежных авторов, которые считают, что симптоматическое улучшение при БД наступает в течение 1 месяца, но значительное улучшение и, может быть, разрешение процесса возможно в течение 4–6 месяцев, а по некоторым данным средняя продолжительность терапии составляет около 4 лет [6]. Наши наблюдения за пациентами с БД установили средний срок терапии 9 месяцев (рис. 4).
.jpg)
Учитывая возможность развития тяжелых побочных явлений, при длительном лечении следует тщательно сопоставить возможный риск с ожидаемым терапевтическим эффектом. Противопоказаниями к применению Неотигазона являются гиперчувствительность к препарату (ацитретину или наполнителям) или к другим ретиноидам; тяжелая печеночная и почечная недостаточность; выраженная хроническая гиперлипидемия, хронический алкоголизм; желчнокаменная болезнь, хронический панкреатит; заболевания центральной нервной системы, сопровождающиеся повышением внутричерепного давления. А. А. Кубанова и соавт. (2005) указывают на противопоказания к назначению ретиноидов при наличии в анамнезе эпителиомы (в том числе семейной), чешуйчато-клеточной или базально-клеточной карциномы [10]. Неотигазон обладает сильным тератогенным действием. Риск рождения ребенка с пороками развития особенно высок, если Неотигазон принимают до или во время беременности, вне зависимости от дозы и продолжительности терапии. В литературе указываются различные временные промежутки между окончанием приема ретиноидов и беременностью, необходимые для исключения риска возникновения тератогенного эффекта. По данным различных авторов этот период составляет от 6 месяцев до 2 лет [10].
У пациентов с сахарным диабетом ретиноиды могут улучшить или ухудшить толерантность к глюкозе, поэтому на ранних этапах лечения концентрацию глюкозы в крови следует проверять чаще обычного.
Из-за риска развития гипервитаминоза А следует избегать одновременного применения витамина А и других ретиноидов. Поскольку как Неотигазон, так и тетрациклины могут вызывать повышение внутричерепного давления, их одновременное применение противопоказано. При комбинированном применении метотрексата и Неотигазона возникает риск развития гепатита, поэтому назначение одновременно этих двух препаратов также противопоказано.
Для уменьшения токсического влияния Неотигазона на организм назначают адъювантную терапию: гепатопротекторы, липотропные средства и желудочные ферменты, витамины группы В, никотиновую и пантотеновую кислоты. Для снижения риска возникновения гиперлипидемии, во время лечения следует избегать пищи, богатой жирами.
Согласно мнению различных авторов, альтернативными методами лечения могут быть Преднизолон (15–20 мг/сут), Дипроспан (2,0 в/м один раз в 10 дней № 3) и цитостатики: Проспидин (по 50–100 мг в/м ежедневно на курс 2,0–3,0 г) или Метотрексат (15 мг в/м один раз в 7 дней) [6, 11].
Наружное лечение во время приема ретиноидов принципиального значения не имеет, однако существенно улучшает общее состояние больного и повышает качество его жизни. Используются как классические мази и кремы, так и современные средства по уходу за сухой кожей различных фирм производителей. Для ликвидации массивных роговых наслоений назначаются мази с 2–5% салициловой кислотой, 10% мочевиной, 1–20% яблочной кислотой.
Кроме того, для лечения пациентов с БД применяется физиотерапия. В основном используются различные ванны: сульфидные продолжительностью 6–10 мин через день, на курс 12–15 ванн; радоновые ванны положительностью 10–20 мин через день; в домашних условиях возможно применять крахмальные ванны: 300–500 г картофельного крахмала разводят в 2–5 л холодной воды и затем вливают в ванну температурой 36–37 °С, длительность процедуры 15–20 мин через день, курс составляет 15–20 процедур. У детей продолжительность процедуры не должна превышать 15 минут, курс составляет 8–12 ванн.
До сих пор не решен вопрос о целесообразности применения ультрафиолетового облучения (УФО) у таких пациентов, мнения современных авторов противоречивы и требуют дальнейшего изучения [6, 12]. Согласно нашим наблюдениям у всех обследованных пациентов УФО или инсоляция провоцировали обострение процесса.
Благодаря достижениям отечественной и зарубежной науки в последние годы произошли существенные сдвиги в понимании клинико-генетического полиморфизма наследственной кожной патологии, значительно продвинулись познания в области патоморфологии и иммуноморфологии, что расширило возможности точной диагностики БД. Применение синтетических ретиноидов дало возможность повысить эффективность терапии этой категории больных. Однако лечение БД является длительным и всегда сопровождается развитием ряда побочных эффектов, что приводит к ограничению возможностей назначения препарата пожилым людям и пациентам с отягощенным анамнезом.
Литература
А. А. Кубанов*, доктор медицинских наук, профессор
Ю. А. Галлямова **, 1 , доктор медицинских наук, профессор
* ФГБУ ГНЦДК МЗ РФ, Москва
** ГБОУ ДПО РМАПО МЗ РФ, Москва
Abstract. Diagnostics of Devergie pityriasis rubra pilaris criteria and approaches to treatment are presented in the article. Application of synthetical retinoids allows increasing effectiveness of therapy of such patients. But treatment of Devergie disease require long time and is followed by development of several side effects that cause limitations for prescription of medicine to elderly people and to patients with compromised history.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лишай: причины появления, симптомы, диагностика и способы лечения.
Определение
Лишай – это общее название многих заболеваний различного происхождения. Объединяет их лишь определенная схожесть внешних проявлений – пятна на коже, склонные к шелушению. Эти заболевания никак не связаны между собой, имеют различную этиологию (причины) и симптоматику, соответственно, отличаются как способами диагностики, так и лечения.
Лишаями называют такие заболевания как красный плоский лишай, розовый, отрубевидный, блестящий, линейный (полосовидный), тропический, амилоидный, а также опоясывающий и стригущий.
Причины появления лишая
Красный плоский лишай
Точные причины возникновения этого заболевания до сих пор не установлены, поэтому часто его относят к группе аутоиммунных болезней (иммунная система проявляет агрессию по отношению к собственным здоровым клеткам, в результате чего происходит самоповреждение тканей). Чаще отмечается у женщин в возрасте от 40 до 65 лет.
Провоцирующими факторами могут служить стрессовые ситуации, прием некоторых лекарственных препаратов, токсические воздействия, нарушения гормонального фона, возможно, вирусный гепатит С.
Опоясывающий лишай
Возбудитель опоясывающего лишая, или опоясывающего герпеса – вирус герпеса человека 3-го типа (Vаricella zoster virus).
Вирус способен находиться в организме человека в течение всей жизни, либо никак не давая о себе знать, либо проявляясь таким заболеванием как опоясывающий лишай.
Детская болезнь ветряная оспа (ветрянка) - сигнал о том, что встреча с вирусом состоялась. Опоясывающий герпес — это рецидив болезни в зрелом возрасте. Риск развития заболевания повышен у пациентов, инфицированных ВИЧ, после пересадки костного мозга, химиотерапии и лечения системными глюкокортикостероидами (гормонами), а также при наличии лейкоза и лимфомы.
Опоясывающий герпес может быть ранним маркером инфицирования ВИЧ, указывающим на первые признаки развития иммунодефицита.
Стригущий лишай
Возбудитель стригущего лишая, или микроспории - грибы рода Microsporum. Стригущий лишай – очень заразное заболевание. Заражение происходит в основном при контакте с больными животными или через предметы, инфицированные их шерстью.
Наиболее частый источник болезни - кошки (особенно котята), реже - собаки, кролики, морские свинки, хомяки.
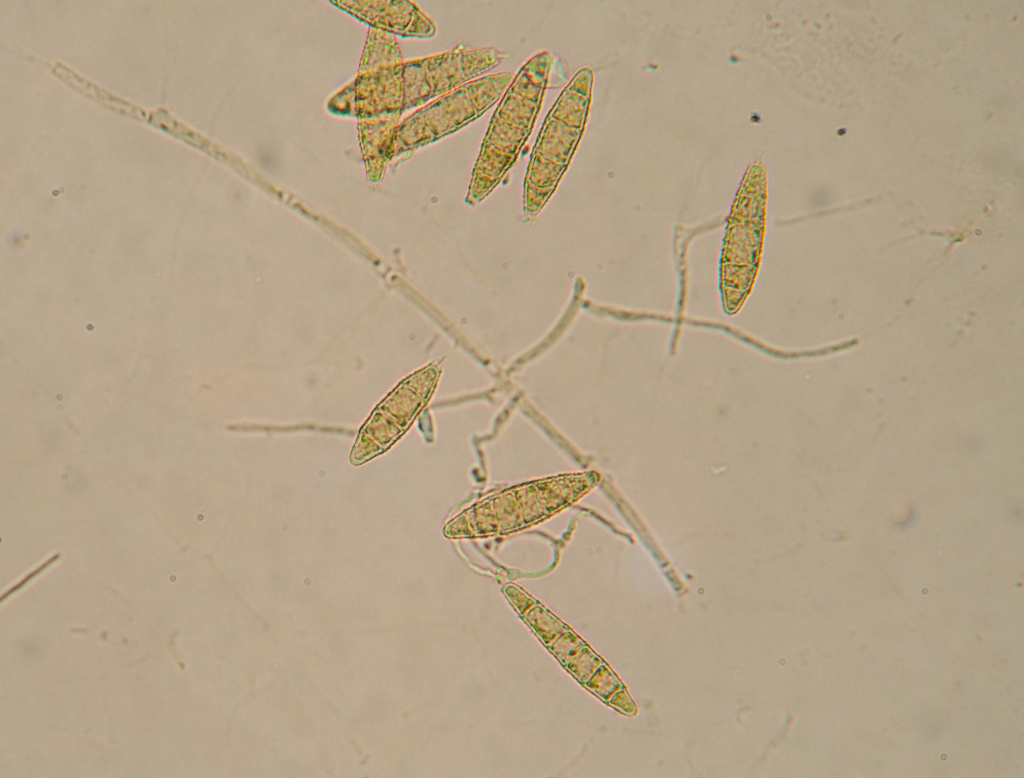
Макроконидии гриба Microsporum canis
Как правило, микроспория наблюдается в мае-июне и в сентябре-ноябре, причем болеют преимущественно дети (даже новорожденные), взрослые - редко. Однако в последние годы увеличилось число больных с хроническим течением заболевания на фоне тяжелых системных поражений – красной волчанки, хронического гломерулонефрита, иммунодефицитных состояний, интоксикаций.
Классификация заболеваний
Формы красного плоского лишая:
- типичная,
- анулярная,
- гипертрофическая,
- атрофическая,
- эрозивно-язвенная,
- буллезная,
- пемфигоидная,
- пигментная,
- эритродермическая,
- инверсная,
- фолликулярная,
- актиническая, или субтропическая.
- опоясывающий лишай с энцефалитом (воспалением вещества головного мозга),
- опоясывающий лишай с менингитом (воспалением оболочек головного и спинного мозга),
- опоясывающий лишай с другими осложнениями со стороны нервной системы,
- опоясывающий лишай с глазными осложнениями,
- диссеминированный (распространенный) опоясывающий лишай,
- опоясывающий лишай с другими осложнениями,
- опоясывающий лишай без осложнений.
- везикулярная,
- без сыпи,
- генерализованная (высыпания по всему кожному покрову),
- диссеминированная (высыпания располагаются вдали от пораженного нервного ствола),
- опоясывающий герпес слизистых оболочек,
- офтальмогерпес (поражение глаз),
- атипичные формы: буллезная (крупные пузыри), геморрагическая (пузырьки с кровянистым содержимым, глубокое поражение кожи), гангренозная (на коже остаются рубцы), абортивная (легкая).
- поверхностная микроспория волосистой части головы,
- поверхностная микроспория гладкой кожи (с поражением пушковых волос \ без поражения пушковых волос),
- глубокая нагноительная микроспория.
Высыпания возникают на коже, локализуясь симметрично на сгибательных поверхностях конечностей, туловище, а также на слизистых оболочках полости рта, иногда пищевода, области промежности и ануса, реже поражаются ногти, волосы, ладони, подошвы и лицо.
Опоясывающий лишай
При опоясывающем лишае элементы сыпи расположены асимметрично. Клиническая картина заболевания включает кожные проявления и неврологические расстройства.
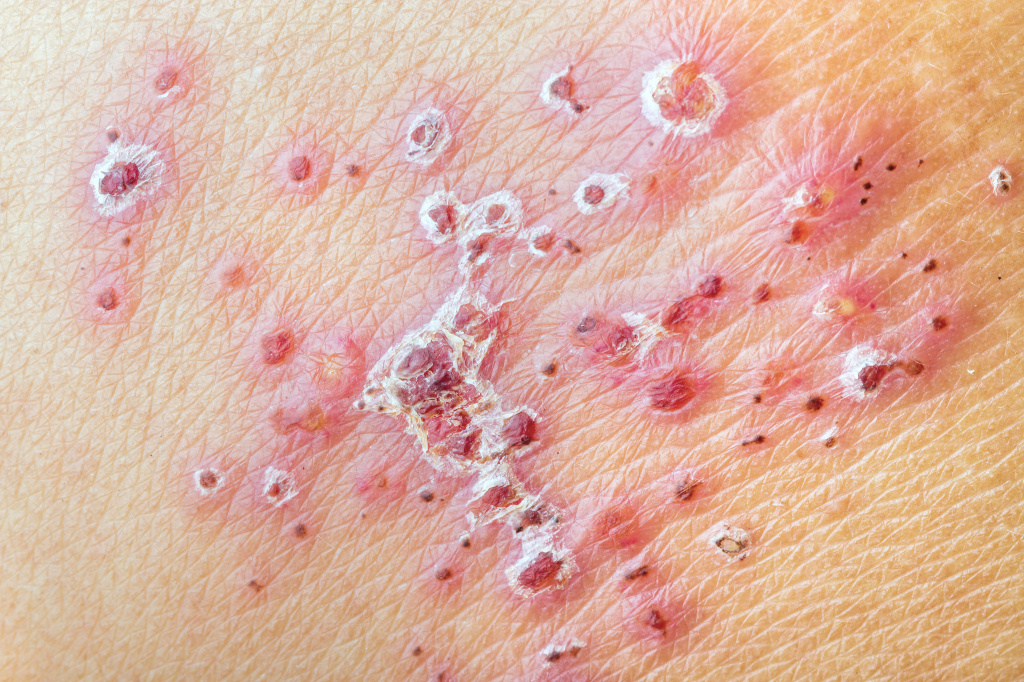
У большинства больных наблюдается повышение температуры тела, недомогание, увеличение регионарных лимфатических узлов.
При более легкой, абортивной форме заболевания пузырьки не развиваются.
Боль является основным симптомом опоясывающего герпеса. Она может быть разной интенсивности, тупой или острой, колющей, жгучей, простреливающей или ноющей. Боль часто предшествует развитию кожной сыпи и наблюдается в течение нескольких месяцев или даже лет после разрешения высыпаний (постгерпетическая невралгия).
Болевой синдром, зуд, жжение, как правило, сопровождаются нарушениями сна, потерей аппетита и снижением веса, хронической усталостью, депрессией.
Стригущий лишай
Стригущий лишай поражает волосы, гладкую кожу, очень редко – ногти. Очаги заболевания могут располагаться как на открытых, так и на закрытых частях тела. На гладкой коже они имеют вид отечных, возвышающихся красных пятен с четкими границами, округлыми или овальными очертаниями, покрытых сероватыми чешуйками. Количество очагов при микроспории гладкой кожи, как правило, не более трех, а их диаметр колеблется от 0,5 до 3 см.
У большинства больных в инфекционный процесс вовлекаются пушковые волосы, могут поражаться брови, веки и ресницы.
При микроспории гладкой кожи субъективные ощущения отсутствуют, иногда больных может беспокоить умеренный зуд.
В случае поражения волосистой части головы очаги располагаются в затылочной, теменной и височной областях. Сначала возникает небольшое шелушение, затем формируются 1-2 крупных (от 3 до 5 см в диаметре) очага и несколько мелких (0,3-1,5 см). Волосы здесь обломаны и выступают над уровнем кожи на 4-5 мм.
Диагностика лишая
Красный плоский лишай
В большинстве случаев диагноз ставится на основании данных клинической картины. Однако при наличии сложных форм заболевания для уточнения диагноза проводят биопсию очагов поражения кожи с последующим гистологическим исследованием.
Перед назначением терапии необходимы лабораторные исследования, включающие общий (клинический) анализ крови, общий анализ мочи, биохимический анализ крови: АСТ, АЛТ, общий билирубин, триглицериды, холестерин, общий белок.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Фолликулярная форма красного плоского лишая (плоский волосяной лишай, декальвирующий плоский лишай) - одна из наиболее частых причин развития рубцовой алопеции волосистой части головы. По данным В.Г. Корнишевой и Г.А. Ежова (2012) в 90% случаев псевдопелада Брока вызвана красным плоским лишаем. Поражение волосистой части головы может быть изолированным, а также сочетаться с нерубцовой алопецией в области подмышечных впадин и лобка, а также фолликулярными папулами на коже туловища и конечностей (синдром Литтла-Лассюэра-Пиккарди) (Скрипкин Ю.К., Мордовцев В.Н., 1999). Не всегда бывает представлена вся триада, но два симптома встречаются наиболее часто: фолликулярные папулы на коже и рубцовая алопеция волосистой части головы (С.И. Довжанский С.И., Суворов А.П., 1976). Большинство ученых относят заболевание к атипичным формам красного плоского лишая, что подтверждается характерными патоморфологическими изменениями.
Под нашим наблюдением находились 11 пациентов с фолликулярным декальвирующим красным лишаем, 10 женщин и 1 мужчина. Средний возраст заболевших был 49,3 лет. Длительность заболевания в среднем составляла 3,8 года. У одной больной очаги выпадения волос появились во время беременности, другая пациентка связывает возникновение заболевания с началом менопаузы, одна – с ошибочным приемом внутрь раствора хлорной извести. Из сопутствующих заболеваний у 7 больных регистрировались заболевания желудочно-кишечного тракта (хронические гастрит, холецистит, панкреатит, рефлюкс-эзофагит), у 5 – артериальная гипертония, у 4 обследованных имелась гипофункция щитовидной железы, у 2 – сахарный диабет 2 типа. Ранее 4 пациента не лечились, остальные использовали только местную терапию (д´арсонваль волосистой части головы, масла, шампуни от выпадения волос), без особого эффекта.
При осмотре на коже волосистой части головы, преимущественно в теменной области, у всех пациентов наблюдались очаги облысения округлой и причудливой формы, диаметром от 1 до 3 см, сливающиеся друг с другом. Кожа в этих участках была гладкая, блестящая, устья волосяных фолликулов отсутствовали, у большинства больных по периферии очагов алопеции отмечалась гиперемия с нечеткими границами и имелись отдельные мелкие фолликулярные и перифолликулярные плоские папулы красного цвета и у 2 больных - желтоватые мелкие пятна. У 3 пациентов волосы по периферии участков алопеции легко эпилировались вместе с некротизированной внутренней корневой оболочкой. У 3 обследованных женщин мы наблюдали алопецию в области подмышечных впадин и лобка. У 1 мужчины на коже передне-боковой поверхности голеней выявлены фолликулярные папулы красного цвета, на поверхности более свежих элементов имелись роговые шипики, часть папул была экскориирована и располагалась линейно на месте расчесов. У 2 человек на коже боковой поверхности плечей отмечались мелкие шиповидные узелки без видимых воспалительных явлений. Мелкие плоские блестящие папулы розового цвета с фиолетовым оттенком имелись на коже поясницы у 1 женщины и в области лучезапясного сгиба - у мужчины. Типичная форма красного плоского лишая на слизистой щек имелась у 3 больных. Субъективно 5 пациентов беспокоил зуд в области высыпаний, 3 – чувство жжения.
Дерматоскопическая картина участков поражения на коже волосистой части головы характеризовалась белым перифолликулярным гиперкератозом, устья волосяных фолликулов в очагах алопеции не определялись. При гистологическом исследовании биоптатов в участках алопеции выявлены атрофия эпидермиса, сглаженность эпителиальных выростов, по периферии очагов фолликулярный гиперкератоз, гипергранулез, у нижнего полюса фолликула и вокруг волосяного мешочка отмечался густой лимфо-гистиоцитарный инфильтрат, клетки которого проникали в наружное корневое влагалище. В дерме определялись периваскулярные инфильтраты и отдельные участки характерной инфильтрации лимфоидными клетками верхних отделов дермы.
В составе комплексной терапии, наряду с препаратами, улучшающими микроциркуляцию (пентоксифиллин), витаминами группы В и топическими кортикостероидами в форме лосьона и крело, был использован отечественный селективный иммуносупрессор Тимодепрессин. Препарат вводился ежедневно внутримышечно по 2 мл в течение 10 дней двумя циклами с интервалом в 10 дней. Отмечен регресс гиперемии в очагах поражения в среднем на 5,2 день, тест натяжения волос стал отрицательным на 6,1 день, значительное уплощение и побледнение окраски папул на волосистой части головы и туловище наблюдалось к концу первого цикла введения Тимодепрессина у всех пациентов. К окончанию второго цикла у 9 больных папулезные высыпания на волосистой части головы и у 2 на туловище разрешились, у 2 человек сохранялись единичные бледно-розовые элементы на коже головы. Субъективные жалобы в виде зуда и жжения купировались на 7,8 день.
Таким образом, включение в состав комплексной терапии больных плоским волосяным лишаем Тимодепрессина позволило достичь выраженного клинического эффекта. Побочных эффектов и осложнений в процессе лечения не выявлено.
Выходные данные: Бабушкина М.В., Загртдинова Р.М., Лоншакова Т.М. Рубцовая алопеция волосистой части головы при красном плоском лишае.
Тезисы XXXI научно-практической конференции Рахмановские чтения.
Moretta G, De Luca EV, Di Stefani A. Management of refractory pityriasis rubra pilaris: challenges and solutions.
Лечение рефрактерного красного волосяного отрубевидного лишая: проблемы и решения
Gaia Moretta, Erika V De Luca, and Alessandro Di Stefani, Институт дерматологии, Университетская поликлиника Фонда А. Джемелли, Католический Университет Святого Сердца, Рим, Италия
Введение
Красный отрубевидный волосяной лишай (PRP) - редкое хроническое папулосквамозное заболевание с нарушением ороговения, частота которого составляет от 1 на 5000 до 1 на 50000 без гендерной предрасположенности (1).
Патогенез до сих пор неясен: была выдвинута гипотеза, что он вызван аномальным иммунным ответом на различные антигенные стимулы, такие как инфекции, травмы и злокачественные новообразования (2, 3).
Большинство случаев являются спорадическими, но были описаны семейные формы заболевания, в частности, связанные с мутациями в гене CARD . При PRP эпидермис находится в гиперкинетическом состоянии с увеличением пролиферации фолликулярных кератиноцитов.
Было высказано предположение о патогенетической роли дефицита или нарушения функции витамина А (7) или снижения сывороточного уровня ретинолсвязывающего белка, который является носителем витамина А (8), наряду с некоторыми клиническими сходствами с фринодермией (кожным проявлением дефицита витамина А) (9).
Клиническая картина
Как правило, PRP характеризуется небольшими фолликулярными папулами диаметром ~1 мм с центральной кератотической пробкой, сливающимися чешуйчатыми желто-розовыми пятнами и пальмоплантарной кератодермией.
Поражения симметричны и диффузны и появляются сначала на разгибательных поверхностях конечностей, плеч и ягодиц, обычно распространяясь каудально с возможным развитием эритродермии (1, 7).
Дифференциальный диагноз с псориатической эритродермией проводится при определении участков непоражённой кожи. Шелушение встречается часто и по характеру оно мелкопластинчатое, отрубевидное на лице и коже головы и крупнопластинчатое в нижней части тела.
Кожа на ладонно-подошвенных областях имеет тенденцию к утолщению и появлению желто-оранжевого цвета с четко очерченными границами. Иногда пациенты жалуются на лихорадку, озноб, зуд и недомогание (1, 7).
Поражение ногтей также очень часто сопровождается подногтевым гиперкератозом и желто-коричневыми пятнами (10).
Слизистая оболочка полости рта также может быть покрыта белыми пятнами и линиями: эритематозные болезненные высыпания с белыми полосами могут появляться на слизистой оболочке щек, десен и языка, имитируя признаки красного плоского лишая (11).
У взрослых поражения кожи появляются сначала на лице и волосистой части головы, распространяясь в каудальном направлении, в то время как у детей PRP обычно появляется в нижней части тела. Однако клиническая картина и эволюция PRP очень изменчивы.
Классификация
В 1980 году Гриффитс (13-15) классифицировал PRP на следующие пять типов на основе клинических особенностей, возраста начала и прогноза: классический взрослый тип I, атипичный взрослый тип II, классический ювенильный тип III, ограниченный ювенильный тип IV и атипичный ювенильный тип V.
Позже был добавлен VI тип, связанный с вирусом иммунодефицита человека (ВИЧ) (16). Классический взрослый тип I является наиболее распространенным с острым началом и составляет ~50% пациентов. Обычно это начинается с появления одного эритематозного пятна на верхней половине туловища. Последовательно кожные поражения распространяются каудально в течение нескольких недель или месяцев и могут развиться в эритродермию с типичными островками пальмоплантарного желто-оранжевого гиперкератоза. Продолжительность течения этой формы составляет ~3-4 года (13-15). Атипичный взрослый тип II, развившийся у 5% пациентов, имеет хроническое течение до 20 лет. Он характеризуется ихтиоидными поражениями, особенно на коже нижних конечностей, в сочетании с алопецией и участками экзематизации (13-15). Классический ювенильный тип III аналогичен взрослому типу I, но поражает детей (10% пациентов) и имеет более благоприятное клиническое течение, чем у взрослых, обычно наступает ремиссия через 1 год (12). Описанный ювенильный тип IV поражает детей, а также молодых взрослых (25% пациентов); развивается фолликулярный гиперкератоз и эритема, обычно только на коленях и локтях с четко очерченными границами. Пальмоплантарное поражение также характерно при этой форме, а также дорсальное поражение кистей и стоп. В большинстве случаев она остается локализованной, но может характеризоваться ремиссиями и обострениями (12, 17, 18). Атипичный ювенильный тип V встречается в первые несколько лет жизни у 5% пациентов; он хронический и характеризуется фолликулярным гиперкератозом и склеродермическими поражениями кожи верхних и нижних конечностей, в то время как эритема не выражена (13-15).
Связанная с ВИЧ форма VI похожа на тип I, с симметричной зудящей сыпью, представленной эритематозными и шелушащимися фолликулярными папулами, но она имеет более тяжелое течение и, как правило, невосприимчива к лечению.
Заметное закупоривание фолликулов является еще одной распространенной находкой при этой форме; однако другие фолликулярные проявления могут быть связаны с PRP, связанным с ВИЧ, такими как конглобатные угри, гнойный гидраденит и остистый лишай (16).
Эта классификация условная: на самом деле не всегда возможно отнести каждую форму PRP к одному типу, поскольку могут возникать промежуточные формы и переход от одного типа к другому (15).
Диагноз
Диагноз в основном клинический, основанный на вышеуказанных критериях. Однако иногда, особенно когда PRP находится в форме эритродермии, довольно трудно установить четкий клинический диагноз, и его можно ошибочно диагностировать как псориаз, фолликулярную экзему, фолликулярный ихтиоз, генерализованную реакцию гиперчувствительности, Т-клеточную лимфому и lichen planopilaris (1-7).
В последние несколько лет дермоскопия применялась и для оценки воспалительных кожных заболеваний, и она была предложена в качестве возможного дополнительного способа в клинической диагностике, позволяющей лучше дифференцировать PRP от псориаза: псориатические поражения обычно представлены равномерно распределенными точечными сосудами на светло-красном фоне, в то время как поражения при PRP представлены линейными и точечными сосудами и круглыми/овальными желтоватыми областями (19-21).
Недавно два случая PRP у взрослого и подростка были изучены также с помощью конфокальной микроскопии, которая может представлять собой дополнительный инструмент для повышения достоверности диагностики (21).
На самом деле, клинико-патологическая корреляция остается “золотым стандартом” для диагностики PRP, исключая другие дерматозы, особенно псориаз и лимфому кожи.
Типичными гистопатологическими признаками PRP, хотя и не патогномоничными, являются чередующиеся ортокератоз и паракератоз как в вертикальном, так и в горизонтальном направлениях, образующие шахматный рисунок; другими частыми находками являются гипергранулез, закупорка фолликулов, широкие сетчатые гребни, узкие дермальные сосочки и редкий поверхностный периваскулярный лимфоцитарный инфильтрат (22).
Терапия
Лечение PRP включает в себя местную и системную терапию в зависимости от распространенности и тяжести заболевания (таблица 1).
Местное лечение
Местное лечение показано при локализованных формах, таких как PRP III типа, и всегда рекомендуется также в сочетании с системной терапией при тяжелых формах для уменьшения кожных симптомов, таких как зуд и жжение (1, 23, 24).
При локализованных формах PRP основным терапевтическим выбором (23, 24) является местная терапия, включающая кортикостероиды средней и высокой активности, кератолитики, смягчающие средства и производные витамина D, такие как кальципотриол (25), третиноин и тазаротен (18, 26).
Местное лечение в сочетании с системной терапией полезно для лечения гиперкератоза и пальмоплантарной кератодермии, а также для улучшения текстуры кожи, уменьшения шелушения, эритемы и инфильтрации, в частности, рекомендовано применение кератолитиков (5-10% мочевины или 5% салициловой кислоты) и смягчающих средств (27).
Системные методы лечения
Системные методы лечения показаны при заболеваниях средней и тяжелой степени тяжести. Традиционная системная терапия основана в основном на применении ретиноидов, которые фактически рассматриваются как терапия первой линии как у взрослых, так и у детей (1, 27).
К сожалению, существуют рефрактерные случаи, которые не поддаются лечению или рецидивируют после прекращения приема препарата. В этих случаях лечение является сложным, и стандартного терапевтического протокола пока не существует.
Лечение в основном основано на отчетах о случаях заболевания или серии клинических случаев, поскольку из-за редкости заболевания никогда не проводилось контролируемых рандомизированных исследований (27).
Ретиноиды
Системные ретиноиды рассматриваются в качестве системной терапии первой линии для взрослых и детей с PRP, поскольку большинство отчетов о случаях и серий случаев демонстрируют их эффективность (27-39).
Клинический ответ на ретиноиды, как правило, проявляется через 3-6 месяцев терапии, но у некоторых пациентов требуется более длительное лечение. Наиболее часто используются изотретиноин и ацитретин, но есть некоторые данные также об эффективности алитретиноина для PRP (27-30, 35-38).
В ретроспективном исследовании Eastham и соавт. (27) все 12 пациентов, получавших ацитретин, восемь пациентов, получавших ацитретин в монотерапии в дозе 25-50 мг/сут, два пациента, получавшие ацитретин в сочетании с метотрексатом, и два пациента, получавшие ацитретин в комбинации с циклоспорином, сообщили о частичном или значительном улучшении во время лечения.
В проспективном исследовании изотретиноин (2 мг/кг/сут) применялся у 45 пациентов с PRP , и после 4 недель терапии у 28 (62%) пациентов наблюдалось значительное улучшение (29).
В другом ретроспективном исследовании, включавшем 15 пациентов, получавших изотретиноин (в основном 40 мг два раза в день), у 10 (67%) пациентов был полный клиренс в среднем в течение 25 недель (16-44 недель), и только у трех пациентов наблюдалась рефрактерность к лечению (30).
В клинической практике рекомендуемая дозировка изотретиноина для взрослых с PRP составляет 1 мг/кг/сут, в то время как ацитретин используется в дозировке 0,5–0,75 мг/кг/сут. Однако высокие дозы ретиноидов плохо переносятся из-за частых кожно-слизистых побочных эффектов.
Наиболее частыми побочными эффектами ретиноидов являются сухость кожи и слизистых оболочек, гиперлипидемия, повышение уровня трансаминаз и нарушение зрения или оссификации.
У детей ретиноиды могут вызывать гиперостоз и преждевременное закрытие эпифиза, особенно детей в препубертатном возрасте, получавших высокие дозы. Кроме того, ретиноидов следует избегать женщинам детородного возраста из-за их тератогенного эффекта: следует избегать беременности во время и в течение 3 лет после лечения ацитретином и во время и в течение 6 недель после терапии изотретиноином.
Из-за редкости заболевания и отсутствия стандартизированных исследований отсутствуют согласованные данные о продолжительности лечения, риске рецидива при прекращении лечения или необходимости в поддерживающем лечении.
Фототерапия
Доказано, что ультрафиолетовая фототерапия B (UVB) и псорален-ультрафиолетовая терапия A (PUVA) являются успешным способом лечением у некоторых пациентов, страдающих PRP (39, 40), хотя реакция на свет довольно вариабельна. И наоборот, у некоторых пациентов были описаны обострения PRP (8, 41, 42).
Сообщалось, что ацитретин используется в качестве комбинированной терапии с узкополосным УФ-излучением (43), ультрафиолетовым излучением A1 (UVA1) (44) и PUVA (28).
В недавнем отчете о случае PRP у детей было доказано, что фототерапия узкополосным УФ-излучением была успешной после 2 месяцев лечения в сочетании с местными смягчающими средствами, кремом с гидрокортизоном и кальципотриеном, достигая >90% клиренса (45).
Метотрексат
Метотрексат является альтернативным вариантом лечения PRP в качестве средства второй линии (27, 34). В ретроспективных исследованиях была отмечена эффективность еженедельных доз 5-25 мг. Другое ретроспективное исследование продемонстрировало благоприятный ответ у 8/14 пациентов с PRP I типа: средняя продолжительность лечения составила 6 месяцев (от 1 до 12 месяцев) (30).
Другое ретроспективное исследование продемонстрировало эффективность метотрексата в сочетании с ретиноидом, несмотря на повышенный риск гепатотоксичности (33). В другом исследовании, включавшем пять пациентов, было доказано, что метотрексат, рефрактерный к ретиноидам, эффективен (34).
Желудочно-кишечные расстройства является частым побочным эффектом. Дополнительными серьезными побочными эффектами, которые всегда следует проверять, являются панцитопения, гепатотоксичность и пневмонит. Кроме того, его следует избегать женщинам детородного возраста из-за его тератогенного эффекта.
Другие иммунодепрессанты
В частности, циклоспорин можно считать приемлемой терапией для пациентов, которые не реагируют на ретиноиды или метотрексат, и может использоваться как у взрослых, так и при ювенильной формах. Кроме того, эфиры фумаровой кислоты могут быть альтернативным вариантом (51).
Биологические препараты
Учитывая клиническое и гистологическое сходство между псориазом и PRP, все биологические препараты, одобренные для лечения псориаза, также использовались при лечении рефрактерных форм PRP или у пациентов, резистентных или имеющих противопоказания при стандартных системных методах лечения (27, 34).
Поскольку патогенез PRP все еще не ясен, было выдвинуто предположение, что TNF-альфа является ключевым цитокином (52).
Совсем недавно ингибиторы пути IL-23/IL-17 также успешно применялись при PRP, и у пациентов с PRP были обнаружены повышенные уровни IL-17, что дает обоснование для применения этих новых методов лечения (53).
Однако клинический опыт применения биологических препаратов при лечении PRP ограничен отчетами о случаях, а серии случаев и многоцентровые рандомизированные клинические испытания не проводились из-за низкой частоты PRP.
Напротив, также наблюдаются случаи PRP, невосприимчивых к биологическим препаратам, хотя о них редко сообщается, как например, недавно описано в случае PRP IV типа, резистентного к ингибиторам анти-ФНО-альфа и ИЛ-23 (54).
Анти-ФНО-альфа (инфликсимаб, этанерцепт и адалимумаб)
За последние 10 лет ретроспективные исследования и отчеты о случаях показали, что анти-ФНО-альфа-препараты эффективны при лечении PRP как у взрослых, так и у детей (53-64).
Систематический обзор PRP I типа, включающий 15 пациентов, получавших инфликсимаб, этанерцепт или адалимумаб, показал полный ответ у 12/15 пациентов и частичный ответ у 2/15 пациентов. Только в одном случае улучшения не наблюдалось. Шесть пациентов получали анти-ФНО-альфа в качестве монотерапии, в то время как девять пациентов получали лечение в сочетании с ацитретином или метотрексатом (63).
В большинстве случаев ингибиторы ФНО-альфа использовались в качестве средств второй линии при рефрактерном PRP к традиционному системному лечению. В серии случаев из семи пациентов с рефрактерным началом у взрослых PRP доказал эффективность инфликсимаба (три пациента) и этанерцепта (пять пациентов), 5/7 пациентов получали комбинированную терапию низкими дозами ацитретина (0,2 мг/кг/сут).
У всех пациентов наблюдался значительный клиренс на 12-й неделе, и инфликсимаб был ассоциирован с более быстрым ответом, чем этанерцепт. Во время наблюдения только у пациента, страдающего PRP II типа, развился рецидив через 2 месяца после прекращения лечения (51).
В недавнем ретроспективном исследовании 40 пациентов с PRP, проведенном в центре третьего уровня, девять пациентов получали анти-ФНО-альфа-препараты с благоприятным ответом в течение 5-7 недель.
Несмотря на это, большинство из них получали начальную терапию другим системным препаратом (метотрексат, ацитретин или преднизон) (27).
У пациента, страдающего PRP I типа, получавшего адалимумаб и достигшего клинической ремиссии через 4 месяца, были обнаружены повышенные уровни мРНК TNF-альфа в пораженной и окружающей нормальной коже.
Этот вывод согласуется с наблюдаемой клинической ремиссией и поддерживает использование анти-ФНО-альфа для лечения PRP (64).
Ингибиторы IL-23 и IL-17 (устекинумаб и секукинумаб)
В нескольких отчетах о случаях описано применение устекинумаба при PRP I типа, рефрактерном к традиционной системной терапии или анти-ФНО-альфа-агентам (65-69).
Устекинумаб продемонстрировал выраженную и быструю эффективность в уменьшении признаков и симптомов заболевания, а также в долгосрочном контроле заболевания (69).
В недавней серии случаев у трех пациентов, страдающих рефрактерным PRP, был взят образец биопсии пораженной кожи, и была изучена экспрессия мРНК клеток, вырабатывающих врожденные провоспалительные и Т-клеточные цитокины.
Анализ экспрессии генов выявил увеличение цитокинов Т-хелперов (Th) 1 и, в частности, цитокинов Th17, таких как IL-17A, IL-22 и IL-23. У одного пациента уровни IL-17A в образцах пораженной кожи были измерены до и после лечения устекинумабом и снижены после улучшения состояния кожи.
Этот отчет о случае свидетельствует о роли оси IL-23/Th17 в PRP, предоставляя обоснование для таргетной терапии, нацеленной на этот путь в качестве варианта лечения рефрактерного PRP (53). Недавно было показано, что секукинумаб эффективен для лечения PRP в двух отчетах о случаях (70, 71).
В первом случае он был использован у пациента с PRP I типа, рефрактерным к ацитретину (70).
Во втором случае было предложено в качестве приемлемого варианта лечения рефрактерного PRP II типа, при этом улучшение эритемы и пальмоплантарной кератодермии наблюдалось через 2 недели лечения и не было рецидива после 6-месячного наблюдения (71).
Другие методы лечения
Недавний случай доказал эффективность апремиласта в лечении рефрактерного PRP: после 4 недель терапии пациент сообщил о значительном улучшении, а через 6 месяцев наблюдения у него/нее наблюдалось полное исчезновение кожных поражений (72).
Экстракорпоральная фотохимиотерапия также использовалась для лечения двух пациентов с эритродермическим PRP I типа в сочетании с системными ретиноидами и циклоспорином, с хорошими результатами (73). В другом отчете сообщалось, что случай PRP у взрослых II типа был успешно пролечен внутривенным иммуноглобулином (74).
Вывод
PRP-редкое воспалительное заболевание кожи, которое может оказать серьезное влияние на качество жизни пациентов, особенно в хронической и рефрактерной формах. Было испытано много терапевтических вариантов, но у нас нет стандартного протокола для лечения PRP.
Лечение рефрактерных форм остается сложной задачей. Биологические агенты, по-видимому, представляют собой новое эффективное лечение PRP, хотя следует провести многоцентровые рандомизированные клинические испытания, прежде чем рассматривать их в качестве варианта терапии первой линии.
Дальнейшее понимание патогенеза заболевания, возможно, позволит выявить некоторые клинические и фенотипические особенности различных форм PRP в качестве прогностических факторов, позволяющих сделать индивидуальный терапевтический выбор.
Читайте также:

