Кто нибудь вылечил микобактериоз легких
Обновлено: 18.04.2024
Инфицирование атипичными микобактериаями. Инфекции атипичных микобактерий.
По данным исследований, проведенных в Москве, Киеве, Ленинграде, Львове, Фрунзе и других городах, атипичные микобактерий составляют в среднем 1,67% среди 17 495 выделенных культур. Неодинакова и частота различных видов атипичных микобактерий. По данным Н. М. Макаревич (1973), среди общего числа ското-хромогенные штаммы высеваются в 55,8% случаев, нефотохромогенные— в 25%, быстро растущие — в 10,8%, фотохромогенные — в 8,3%.
Сравнительно чаще выделяют атипичные микобактерий из пораженных периферических лимфатических узлов у детей. По данным Schroder (1969), они составили 12% среди всех видов микобактерий туберкулеза, обнаруженных при этой форме процесса в 1958—1966 гг. в ФРГ.
Следует, однако, подчеркнуть, что патогенными считаются лишь те атипичные кислотоустойчивые микобактерий, которые повторно высеиваются из мокроты одного и того же больного или из резецированного легкого и другого органа, образуют многочисленные колонии в культурах и вызывают патологические изменения в организме у некоторых лабораторных животных, например у белых мышей.
Уверенность в заражении такими микобактериями возрастает, если больные реагируют на гомологичные сенситины, полученные из того или иного вида типичных микобактерий, более интенсивными внутрикожными реакциями, чем на стандартный туберкулин. Известным подтверждением этиологической роли атипичных микобактерий в генезе болезни служит также обнаружение методом двойной диффузии в агаре специфических антител в сыворотке крови больных (Jenkins, 1959).
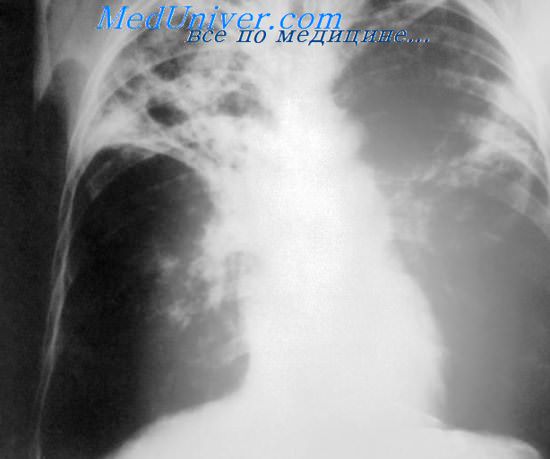
Атипичные микобактерии могут проникнуть в организм различными путями: с воздухом, пылью, водой, с плохо обработанными продуктами от животных, при контакте с зараженными домашними животными и птицами. Возможность передачи инфекции от человека человеку не установлена.
Н. М. Макаревич (1973) выделила атипичные микобактерий из мокроты 102 больных, 84 из которых поступили в клинику с диагнозом: туберкулез легких. Однако этиологическая роль этих видов микробов в развитии болезни была подтверждена лишь в 25 случаях; в остальных — они были сопутствующими микобактериями и не влияли на клинику и течение специфического легочного процесса.
Обращает на себя внимание, что большинство больных микобактериозами — мужчины преимущественно среднего и пожилого возраста. Часть из них заняты в профессиях, связанных с уходом за животными и с вдыханием угольной или металлической пыли. У них не отмечается контакта с бацилловыделителями. Заболевание протекает хронически на протяжении многих лет с выраженной наклонностью к фиброзу, развитию эмфиземы и возникновению кровохарканья. Образующиеся каверны в легких часто тонкостенные и не сопровождаются бронхогенпым обсеменением. При всех указанных формах болезни туберкулостатические препараты I ряда оказываются неэффективными из-за устойчивости к ним атипичных штаммов микобактерий. В последнее время установлено известное терапевтическое действие в этих случаях циклосерина, канамицина, этамбутола и рифампицина, к которым атипичные микобактерий оказываются чувствительными.
Совместно с Н. М. Макаревич и Б. Я. Бакаповой мы имели возможность наблюдать больного М., 65 лет, страдавшего микобактериозом, вызванным М. fortuitum.
Микобактериоз — болезнь будущего, утверждают некоторые авторы. Трудно сказать, оправдается ли это предположение. Тем не менее повсеместно накапливающиеся клинико-лабораторные наблюдения побуждают к дальнейшим углубленным исследованиям в этой области и уточнению взаимосвязи туберкулеза и микобактериоза.
Обобщая приведенные данные, следует, таким образом, прийти к выводу, что форма и характер течения туберкулеза в какой-то степени определяются теми или иными биологическими свойствами микобактерий.
Известную роль в клинических проявлениях болезни играют пути заражения. При крайне редко встречающемся внутриутробном инфицировании поражаются главным образом печень, селезенка, брюшина, мезен-териальные лимфатические узлы и в меньшей степени — легкие. Подобное явление отмечается и при заражении большой дозой микобактерий алиментарным путем. На это указывают, например, результаты клинического и секционного исследования детей в Любеке, которым при вакцинации ошибочно была введена культура вирулентных микобактерий человеческого типа. Первичный комплекс среди умерших у 85% находился в брюшной полости и у 15% — в легких. У 104 человек из 174 оставшихся в живых и длительно наблюдавшихся крупные обызвествленные очаги обнаруживались в забрюшинных лимфатических узлах, у 59 — в шейных и лишь у 11 — в легких и во внутригрудных лимфатических узлах.
В Баварии, где еще в 1952 г. был широко распространен туберкулез среди рогатого скота, а население часто пользовалось сырым молоком и непастеризованными молочными продуктами, при обследовании большой группы клинически здоровых школьников у 43% из них были обнаружены обызвествленные забрюшинные и брыжеечные лимфатические узлы. В этих случаях, очевидно, имело место энтеральное заражение микобактериями бычьего типа.
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
На сервисе СпросиВрача доступна консультация детского фтизиатра по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно. Задайте свой вопрос и получите ответ сразу же!

Здравствуйте,Юрий! Если есть возможность,пришлите, пожалуйста,снимок лёгких
На данный момент вы не являетесь бактериовыделителем ,после поставленного диагноза как правило пьют до года препараты

Данный штамм микобактерий непатогенен и не вызывает инфекции, вы не опасны ни себе ,ни окружающим
Точно ли это туберкулёза ? Больше на саркаидоз похоже.
Потому я бы хотела снимки посмотреть ваши
Эвелина,на данный момент все анализы и снимки у врача, я лежу в нии фтизиопульмонологии, последний снимок делали после операции, перед выпиской из склифа, с момента операции прошёл месяц, больше ни снимков , ни КТ не делали

Здравствуйте, Юрий. Если четко доказано, что нет сочетанной патологии : туберкулезный + нетуберкулезный микобактериоз и исключен туберкулёз, необходимо лечить именно нетуберкулезный микобактериоз. Его лечат совместно фтизиатры и пульмонологи. Схема лечения составляется после определения возбудителя заболевания ( биопсия и гистологическое исследование, посев мокроты на питательную среду с определением чувствительности к препаратам). То, что вы продолжаете принимать препараты первого ряда, не правильно. Но, возможно, ещё не определен возбудитель и вас лечат, чтобы исключить сочетанную патологию. Если анализы мокроты отрицательные, сложнее определить возбудителя. Выясните у лечащего врача природу заболевания (возбудителя). Одной из наиболее распространенных схем является - кларитромицин + рифампицин +этамбутол, но это если возбудитель чувствителен к этим препарптам
Чаще всего микобактериоз является не самостоятельной болезнью, а осложнением, возникающим в результате нарушения работы каких-либо систем организма. Такая патология возникает после попадания в организм человека нетуберкулезных микобактерий (НТМ). Без современной диагностики, определения причины и терапии болезнь способна привести к непоправимым последствиям.
В чем суть проблемы?
Сегодня насчитывается более 200 видов бактерий, из них около 70 являются факторами заболеваний человека в разных органах и системах, отмечает медик. Наибольшее значение в клинической практике имеют виды МАС, M. kansasii, M. fortuitum, M. abscessus и M. Chelonae.
Группы риска
Риску заражения наиболее подвержены:
- пациенты с синдромом приобретенного иммунодефицита и другими иммунодефицитами;
- лица после трансплантации внутренних органов;
- пациенты с термическими травмами;
- больные пневмокониозами;
- больные хронической обструктивной болезнью легких;
- больные бронхиальной астмой;
- больные муковисцидозом;
- больные бронхоэктазиями;
- больные саркоидозом;
- больные легочными фиброзами различной природы;
- больные с онкологическими заболеваниями;
- лица, длительно получающие глюкокортикостероидную или иммуносупрессивную терапию;
- лица пожилого возраста;
- больные туберкулезом, а также лица, излеченные от данного заболевания.
Соответственно, с вопросами диагностики микобактериозов сталкиваются врачи самых разных специальностей.
Как заражаются?
Основным природным резервуаром M. avium, отмечает специалист, служат открытые водоемы, M. Kansasii — водопроводная вода, M. xenopi — система горячего водоснабжения. Есть данные о том, что НТМ выделяются из биоматериала животных (крупный рогатый скот, свиньи) и птиц (голуби, воробьи, куры).
Симптомы проблемы
Следует учитывать возможную транзиторную колонизацию слизистых оболочек верхних дыхательных путей НТМ из окружающей среды, в связи с чем выделение микроорганизмов данной группы не всегда является критерием для постановки диагноза.
Важна оценка клинического значения в следующих случаях:
- Многократное выделение НТМ из отделяемого нижних дыхательных путей в 74% случаев является поводом для постановки диагноза.
- Из мочи в 90% случаев выделяются непатогенные НТМ и другие кислотоустойчивые микроорганизмы.
- НТМ выделены из пробы, полученной в стерильных условиях, из закрытого очага (абсцесс, биопсия, операционный материал).
- НТМ выделены из образца обычно стерильной ткани или жидкости (костный мозг, кровь, спинномозговая жидкость).
Как лечат
«Назначение терапии необходимо в тех случаях, когда имеет место выраженная симптоматика заболевания и определены микобактериологические аспекты микобактериозов. Лечение микобактериоза является еще более сложным по сравнению с лечением туберкулеза.
В.А. Сергеева (1), Т.Н. Панкова (2), Т.В. Гаврищук (2)
1) Саратовский государственный медицинский университет им. В.И. Разумовского, Саратов, Россия; 2) Саратовская городская клиническая больница № 1 им. Ю.Я. Гордеева, Саратов, Россия
Обоснование. Микобактериоз легких представляет собой сложное для диагностики и лечения заболевание, развивающееся преимущественно у иммунокомпрометированных пациентов с ВИЧ, а также с рядом сопутствующих заболеваний легких, в т.ч. с бронхоэктатической болезнью (БЭБ).
Описание клинического случая. Представлено динамическое клиническое наблюдение молодой пациентки с сочетанием БЭБ и МБЛ. Описаны ключевые этапы диагностического поиска и сложности установления окончательного диагноза. За длительным безуспешным лечением инфильтративного туберкулеза левого легкого с переходом в цирротический туберкулез последовало оперативное вмешательство в виде резекции левого легкого и пересмотр окончательного диагноза в пользу МБЛ. При этом в клиническом наблюдении продемонстрировано взаимовлияние МБЛ и БЭБ в виде неблагоприятной коморбидной ситуации, при которой возможно прогрессирование обоих заболеваний ввиду неэффективности проводимой терапии.
Заключение. Опыт, вынесенный из представленного клинического наблюдения, может быть полезным коллегам при ведении таких коморбидных пациентов. В терапевтической практике достаточно часто наблюдаются пациенты с БЭБ, но в редких случаях диагностический поиск проходит детально в плане выявления у них МБЛ. В то же время среди пациентов с выделением в мокроте кислотоустойчивых бактерий и рентгенологических изменений в легких незамедлительно устанавливается диагноз туберкулеза, что также не исключает диагноза МБЛ. Накопление опыта терапевтических стратегий таких пациентов тоже будет полезным для создания согласованного документа или рекомендаций ведения пациентов с сочетанием этих заболеваний.
Введение
В повседневной клинической практике терапевту приходится сталкиваться с пациентами, страдающими различными острыми и хроническими заболеваниями легких, среди которых бронхоэктатическая болезнь (БЭБ) занимает особое место. При БЭБ, особенно в дебюте заболевания, симптомы не отличаются специфичностью, многие укладываются в клиническую картину более привычных нозологических форм, таких как хронический бронхит, пневмония, бронхиальная астма, хроническая обструктивная болезнь легких (ХОБЛ) и др. [1]. При обзорной рентгенографии органов грудной полости (ОГП) выявить четкие рентгенологические паттерны не удается [2, 3], а компьютерная томография при этом проводится не всегда. Бронхоскопия и исследования, позволяющие выявлять специфические лабораторные маркеры заболевания, не всегда доступны лечебным учреждениям терапевтического профиля.
В литературе до сих пор ведутся дискуссии о первичности и вторичности развития бронхоэктазов на фоне тех или иных патологических состояний, при этом генетическим дефектам и хроническому воспалению дыхательных путей, чаще связанному с респираторными инфекциями и бронхообструкцией, придают основное значение [2, 4, 5].
Микобактериозы – отдельная группа инфекционных заболеваний, вызываемых нетуберкулезными микобактериями. Начиная с конца XX в. во всем мире растет число случаев этих заболеваний, особенно среди лиц с иммунодефицитными состояниями, ВИЧ-инфекцией, хроническими заболеваниями легких, в числе которых стоит и БЭБ [1, 3, 4]. Официальной статистики по микобактериозу легких (МБЛ) в России нет, отсутствуют нормативные документы по диагностическим и лечебным подходам, социальной поддержке таких пациентов, нет четкого понимания, кто из специалистов ответствен за их лечение и наблюдение [5].
Клинический случай
Представляем клиническое наблюдение пациентки Ж. 37 лет с ВЭБ и МБЛ, которое может быть интересным в плане накопления практического опыта ведения таких пациентов.
Впервые к врачу, будучи взрослой, обратилась в 21 год (2003). На фоне переохлаждения отметила повышение температуры до 38,3°С, появление боли в грудной клетке при глубоком дыхании. Кашель беспокоит пациентку с детства, но в тот период стала отходить мокрота зеленоватого оттенка. При рентгенографии ОГП были выявлены изменения в нижней доле левого легкого инфильтративного характера. Поставлен диагноз внебольничной пневмонии, назначена антибактериальная терапия (АБТ), на фоне которой сохранялись рентгенологические изменения в нижней доле левого легкого, что объясняли вероятным наличием бронхоэктазов. Детального обследования в то время не проводилось.
В декабре 2015 г. в возрасте 33 лет впервые попала в терапевтическое отделение 1-й Городской клинической больницы им. Ю.Я. Гордеева (1ГКБ) Саратова. Предъявляла жалобы на кашель с зеленоватой мокротой, повышение температуры, боль в грудной клетке слева при дыхании и кашле, слабость, потливость, снижение аппетита. Заболела остро после контакта с больной ОРВИ дочерью. 04.12.2015 появился кашель с зеленоватой мокротой, повысилась температура до 38°С. Начала самостоятельно принимать амоксициллин, ацетилцистеин.
К 08.12.2015 состояние несколько улучшилось: кашель беспокоил меньше, но продолжала отходить зеленая мокрота, температура снизилась до 37,5°С, отмечалась только в вечерние часы.
С 09.12.2015 отметила появление боли в грудной клетке слева при дыхании, температура тела – 39°С. Доставлена скорой помощью в отделение терапии. При поступлении выписок из ОКТБ не предоставила, сообщила только, что проходила обследование на туберкулез, и данный диагноз подтвержден не был. Объективно: состояние средней тяжести. Кожные покровы чистые, влажные, без сыпи и видимых отеков. Пальпируются единичные подмышечные лимфоузлы размером с горошину, безболезненные, подвижные. Частота сердечных сокращений (ЧСС) – 100 в 1 минуту, артериальное давление (АД) – 110/70 мм рт.ст., рост – 168 см, масса тела – 52 кг, ИМТ – 19 кг/м2, температура тела – 37,5°С. Форма грудной клетки воронкообразная, деформирована за счет впалой грудины. Обе половины грудной клетки синхронно участвуют в акте дыхания, число дыхательных движений – 18 в 1 минуту. При аускультации: дыхание над большей поверхностью легких жесткое, слева в нижних отделах незначительно ослабленное, там же выслушиваются влажные, мелкопузырчатые, незвучные хрипы. По данным рентгенографии ОГП: слева в S9, S10 определяется затемнение средней интенсивности неоднородной структуры за счет инфильтрации легочной ткани. Справа легочные поля прозрачны, легочный рисунок не изменен. Корни легких существенно не изменены. Синусы плевры свободны. Границы средостения смещены из-за разворота. Диафрагма куполообразная, расположена обычно. Заключение: вероятная левосторонняя нижнедолевая пневмония.
С первых суток пациентка получала внутривенно антибактериальные препараты: цефтриаксон (2 г в сутки) в комбинации с линкомицином (900 мг в сутки), муколитическую терапию. Несмотря на стабилизацию состояния, снижение температуры тела с сохранением субфебрилитета в вечерние часы, улучшение общего самочувствия, уменьшение слабости, кашель с отделением зеленоватой мокроты сохранялся. При рентгеноконтроле на 9-е сутки динамики не выявлено, сохранялась инфильтрация легочной ткани нижней доли левого легкого. В связи с этим проведена смена АБТ на левофлоксацин 750 мг в сутки, прием муколитических препаратов (амброксол через небулайзер) продолжен. На этом фоне уменьшение кашля, прекращение отхождения зеленоватой мокроты, стойкая нормализация температуры тела. На рентгенограмме через 7 дней: сохраняется пятнисто-тяжистое затемнение нижней доли левого легкого. Нижняя доля левого легкого выглядит уменьшенной в объеме. Сердце смещено влево. Справа без инфильтративных и очаговых изменений легочной ткани. Корни тяжистые. Синусы свободны. Заключение: рентгенологическая картина характерна для бронхоэктазов левого легкого. Пациентка была выписана из отделения с улучшением, рекомендовано дальнейшее наблюдение и обследование у пульмонолога.
С апреля 2018 г. отметила значительное ухудшение самочувствия. Кашель усилился, появилась одышка при умеренной физической активности, слабость. Самостоятельно обратилась в ОКТБ, где прошла обследование.
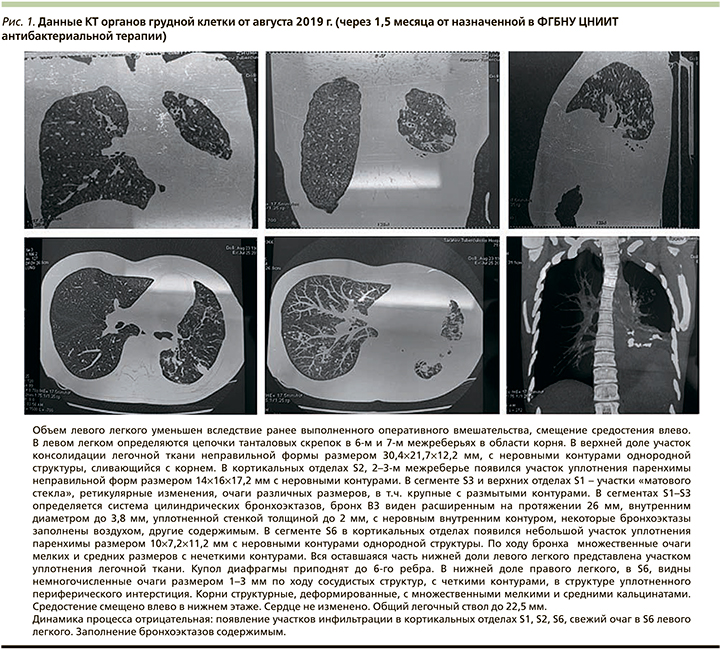
В связи с тем что МБЛ часто развивается у пациентов с ВИЧ-инфекцией [3, 7], пациентка была обследована на ВИЧ, хронические вирусные гепатиты. Результаты серологического исследования отрицательные. Рекомендованное лечение пациентка самостоятельно прервала в связи с развитием аллергических реакций. Данные КТ через 1,5 месяца после назначенного лечения (рис. 1) свидетельствовали об отсутствии положительной динамики.
30.10.2019 у пациентки появилась субфебрильная температура, увеличилось количество мокроты, на фоне кашля развилось кровохарканье, в связи с чем вызвала скорую помощь и была доставлена в терапевтическое отделение 1ГКБ. Со слов больной, до настоящего времени в мокроте очень редко отмечались прожилки крови, в день поступления в стационар в мокроте появились темно-красные сгустки в значительном количестве, данные симптомы отмечала трижды за предшествовавшие госпитализации трое суток; светлая мокрота в объеме до 50 мл отходит ежедневно, раз в 2 недели ее объем достигает 200 мл, при обострении заболевания мокрота приобретает желто-зеленый цвет, иногда с неприятным запахом.
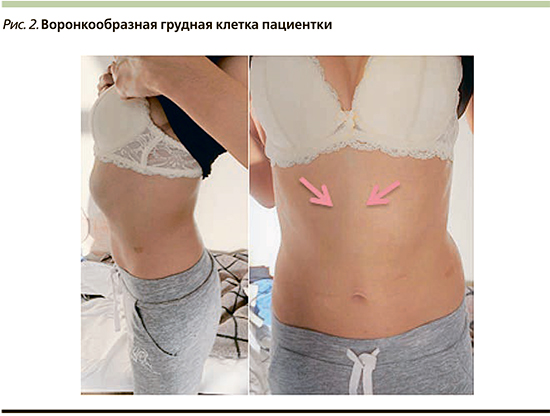
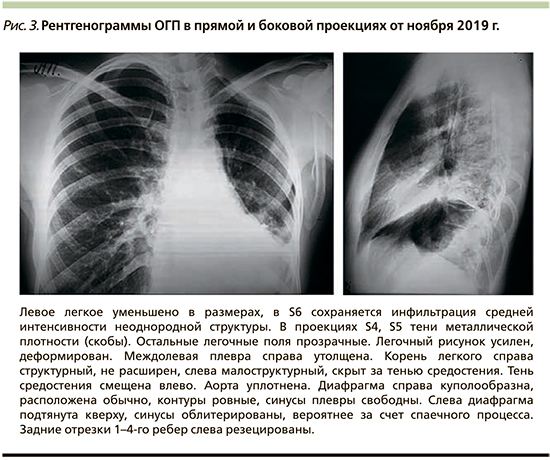
Данные обследования. Состояние пациентки удовлетворительное, занимает активное положение. Температура тела нормальная. Кожные покровы обычной окраски, лимфоузлы не увеличены. Грудная клетка деформирована (грудина вдавлена — воронкообразная грудная клетка; рис. 2), на левой половине грудной клетки имеются послеоперационные рубцы. Акропахии нет. В легких аускультативны сухие свистящие хрипы в проекции верхней доли левого легкого, нижней доли правого легкого на форсированном выдохе; незвучные влажные хрипы в проекции верхней доли левого легкого. Тоны сердца ясные, ритмичные, ЧСС – 82 в 1 минуту, АД –110/75 мм рт.ст. Отеков периферических и полостных не отмечено. На рентгенограммах (рис. 3) свежих инфильтративных изменений не выявлено, т.е. исключена внебольничная пневмония. Показатели общих анализов крови, мочи, биохимического анализа крови, С-реактивного белка в пределах нормальных значений. Признаков дыхательной недостаточности в покое нет, сатурация кислорода в покое – 95%, при умеренной физической активности возникает одышка. При этом занимается восточными танцами, йогой, с повседневной физической активностью справляется. Данные ЭКГ: синусовая тахикардия, ЧСС – 82 в 1 минуту, горизонтальное положение электрической оси, неполная блокада правой ножки пучка Гиса.
Проведена гемостатическая терапия (этамзилат внутримышечно 500 мг в сутки) с положительным эффектом, рецидива кровохарканья не было. С целью профилактики гемоаспирационной пневмонии к лечению добавлены амоксициллин/клавуланат+метронидазол. Для проведения бронхоскопии и определения дальнейшей тактики ведения пациентка переведена в отделение торакальной хирургии, где при обследовании показаний к оперативному вмешательству выявлено не было, выписана под амбулаторное наблюдение пульмонолога.
При рассмотрении данного клинического наблюдения сразу возникает вопрос относительно очередности развития патологических процессов в легких пациентки и их взаимовлиянии. Учитывая длительный анамнез инфекционных и хронических заболеваний легких, которыми пациентка страдала в детстве, включая врожденную пневмонию, вероятность первичного развития БЭБ очень высока. При первой госпитализации в возрасте 21 года в нижней доле левого легкого были выявлены бронхоэктазы. Затем последовал 15-летний период длительного диагностического поиска с тест-лечением инфильтративного туберкулеза, оперативным вмешательством по поводу развития цирротического туберкулеза, наконец повторным исследованием мокроты и операционного материала, изменением диагноза на МБЛ вследствие неэффективности проводимой химиотерапии. Таким образом, хронологически о наличии БЭБ стало известно раньше, чем о МБЛ. По данным литературы, легочные инфекции, вызванные атипичными микобактериями, наиболее часто встречаются среди лиц с иммуносупрессивными состояниями, у пациентов с заболеваниями легких, например БЭБ [3, 4, 6], что укладывается в клиническую картину заболевания нашей пациентки.
Кроме того, доказано, что M. avium нельзя считать обычным представителем бактериальной микрофлоры при БЭБ [13]. И если ранее считалось, что эти микроорганизмы колонизируют легкие при уже сложившихся структурных изменениях бронхиального дерева, в частности бронхоэктазах, при этом не вызывая прогрессирования процесса, то последние данные говорят о развитии инфильтративных изменений в легких и прогрессирующем ухудшении легочной функции на фоне инфицирования M. avium [13].
В нашем случае нельзя исключить, что клиническая картина хронического обструктивного бронхита, по поводу которого пациентка наблюдалась еще у детского пульмонолога, а впоследствии развитие бронхоэктазии – это и есть вариант течения микобактериоза дыхательных путей. Вопросы о хронологической последовательности развития патологий и их взаимовлиянии остаются дискутабельными. В литературе последних лет дискуссия о взаимовлиянии атипичных микобактерий и БЭБ продолжается [14].
Сложности подбора терапии в условиях данной коморбидности также неоднократно обсуждались в литературе. Известно, что M. avium характеризуется устойчивостью к большинству противотуберкулезных препаратов [13]. И даже после проведенного с положительным эффектом первоначального курса терапии возможны рецидивы инфекции [13]. Курс АБТ, по данным некоторых авторов [1, 7], должен продолжаться 10–12 месяцев после получения абациллярной мокроты. В ситуации с нашей пациенткой высокой приверженности проводимой терапии не наблюдается. Вне лечебных учреждений антибактериальные препараты она не принимает, т.к. считает их малоэффективными. Кроме этого у нее неоднократно развивались аллергические реакции на антибиотики группы макролидов, фторхинолонов, входящие в схемы лечения инфекции M. avium. По некоторым данным, частота плохой переносимости АБТ при лечении МБЛ может достигать 63% [1].
Результаты последней КТ ОГП (см. рис. 1) свидетельствуют о сохранении активного МБЛ у пациентки. В отношении БЭБ также нельзя констатировать стабилизацию течения процесса. Развившееся легочное кровотечение можно расценивать как прогрессирование заболевания и дальнейшую деструкцию бронхиального дерева. Таким образом, необходим дальнейший поиск оптимального лечения пациентки в данной клинической ситуации.
Заключение
В России нет статистических данных о распространенности МБЛ. При этом среди пациентов, обратившихся за медицинской помощью в ЦНИИТ с 2011 по 2014 г. в рамках диагностики туберкулеза, 59,6% был установлен данный диагноз [1]. С проблемой МБЛ может столкнуться терапевт или пульмонолог, при этом необходимо помнить, что пациент мог наблюдаться в прошлом с иным диагнозом, в т.ч. с туберкулезом, либо в анамнезе есть упоминание о наличии бронхоэктазов.
Подбор адекватной АБТ в представленном клиническом наблюдении будет ключевым звеном успеха в лечении пациентки. Элиминация M. avium как одного из ведущих факторов деструктивных изменений в бронхиальном дереве позволит уменьшить частоту обострений БЭБ и стабилизировать состояние пациентки, тем самым улучшить ее качество жизни. В связи с этим необходимо дальнейшее бактериологическое исследование мокроты с определением антибиотикочувствительности и подбора новых схем химиотерапии, в т.ч. с учетом переносимости.
Вклад авторов
Сергеева В.А., Панкова Т.Н., Гаврищук Т.В. – сбор информации, интерпретация данных, написание статьи. Все авторы имели неограниченный доступ к данным и участвовали в обсуждении результатов исследования, а также прочли и одобрили окончательный вариант рукописи.
Литература
1. Эргешов А.Э., Шмелев Е.И., Ковалевская М.Н.и др. Микобактериозы в практике врачей пульмонологов и фтизиатров. Туберкулез и болезни легких. 2016;94(9):39–43.
2. Авдеев С.Н., Черняев А.Л., Синопальников А.И. и др. Бронхоэктазы в фокусе междисциплинарного подхода. XXVII Национальный конгресс по болезням органов дыхания. Эффективная фармакотерапия. Пульмонология и оториноларингология. 2018;1(10):36–50.
3. Соколина И.А. Имидж-диагностика микобактериозов легких. Consilium Medicum. 2017;3:24–28.
4. Эргешов А.Э., Шмелев Е.И., Ковалевская М.Н. и др. Нетуберкулезные микобактерии у пациентов с заболеваниями органов дыхания (клинико6лабораторное исследование). Пульмонология. 2016;26(3):303–8.
5. Зарембо И.А., Киселева Е.А., Зарайская Л.С. и др Бронхоэктазы: современный взгляд на проблему. Практическая пульмонология. 2015;4:27–33.
6. Griffith D.E., Aksamit T., Brown-Elliott B.A., et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med. 2007;175(4):367–416. Doi: 10.1164/rccm.200604-571ST.
8. Соломай Т.В. Эпидемиологические особенности микобактериозов, вызванных нетуберкулезными микобактериями. Санитарный врач. 2015;3:30.
9. Matveychuk A., Fuks L., Priess R., et al. Clinical and radiological features of Mycobacterium kansasii and other NTM infections. Respir Med. 2012;106(10):1472–77. Doi: 10.1016/j.rmed.2018.05.007.
10. Гунтупова Л.Д., Борисов С.Е., Соловьева И.П.и др. Микобактериозы во фтизиопульмонологической практике: обзор литературы и собственный опыт. Практическая медицина. 2011;3(51):39–50.
11. Сергеева В.А., Стешенко Р.Н., Рощина А.А.,Астраханцева Ю.С. Трудный диагноз: Бронхиолоальвеолярный рак в практике пульмонолога. Трудный пациент. 2017;15(10–11):30–36.
12. Сивокозов И.В., Шмелев Е.И., Ловачева О.В. Трудности дифференциальной диагностики диссеминированных процессов в легких. Медицинский совет. 2013;11:58–61.
13. Парсонз П.Э., Хеффнер Д.Э. Секреты пульмонологии. М.: МЕДпресс-информ, 2004.
Инфекции вызванные микобактериями (Mycobacterium tuberculosis, leprae, avium и т.д.): диагностика, лечение, профилактика
Насыщенная липидами клеточная стенка микобактерии обусловливает их кислотоустойчивость. Существует более пятидесяти видов микобактерии, большинство из которых присутствует в окружающей среде и не представляет опасности для человека.
Эпидемиология и патогенез туберкулеза (Mycobacterium tuberculosis)
Основной путь передачи туберкулёза — воздушно-капельный. Лёгкие являются первым органом, поражаемом при туберкулёзе. В месте проникновения возбудителя формируется воспалительный очаг (первичный комплекс), из которого инфекция может распространиться по всему организму (милиарное распространение). Заболевание может неожиданно разрешиться либо перейти в локализованный процесс (например, менингит).
Устойчивость к туберкулёзу обеспечивает Т-клеточное звено иммунитета. При его нарушении болезнь может рецидивировать (предполагаемый риск составляет 10%). Яркую клиническую картину заболевания чаще обнаруживают у пациентов со сниженным иммунитетом (например, у больных с ВИЧ-инфекцией).
Mycobacterium tuberculosis фагоцитируются макрофагами, но не инактивируются фаголизосомами, а размножаются в цитоплазме клеток. Выраженный иммунный ответ приводит к локальному разрушению тканей (образование полостей в лёгких — каверн) и возникновению симптомов, обусловленных цитокин-индуцированной системной воспалительной реакцией (лихорадка, потеря массы тела).
В качестве факторов вирулентности выступает большое количество антигенов, в том числе липоарабиноманнан (стимулятор цитокинов) и супероксиддисмутаза (обеспечивает выживаемость внутри макрофагов).
Клинические признаки туберкулеза
Возбудитель может поражать любой орган: он имитирует как воспалительные заболевания, так и злокачественные новообразования. Симптомы туберкулёза лёгких — хронический кашель, кровохаркание, лихорадка, потеря массы тела, рецидивирующая бактериальная пневмония. При отсутствии лечения болезнь переходит в хроническую форму, характеризующуюся постепенным ухудшением состояния.
При туберкулёзном менингите отмечают повышение температуры, помутнение сознания, при поражении почек — лихорадку, потерю массы тела, а также признаки локальной инфекции, осложнённой фиброзом мочеточников и гидронефрозом. Прогрессирование туберкулёза костей, обычно поражающего пояснично-крестцовый отдел позвоночника, характеризуется признаками вертебрального коллапса и сдавления нервов.
Кроме того, гной из очага инфекции может проникать под оболочку поясничной мышцы, в результате чего возникает паховый абсцесс. Поражение крупных суставов приводит к артриту и разрушению суставной ткани. При абдоминальной инфекции наблюдают брыжеечную лимфаденопатию, хронический перитонит, а также лихорадку, потерю массы тела, асцит, признаки нарушения всасывания в кишечнике. Диссеминированная (милиарная) инфекция может протекать без симптомов поражения лёгких.
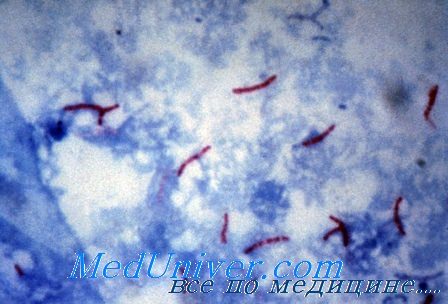
Микобактерии туберкулеза
Лабораторная диагностика туберкулеза (Mycobacterium tuberculosis)
• Культивирование на средах, обогащенных липидами (яичные среды), или с добавлением малахитового зелёного (среда Левенштейна—Йенсена) для подавления роста других бактерий. Препарат окрашивают по методу Циля—Нильсена.
• Определение чувствительности штаммов на скошенной питательной среде Левенштейна—Йенсена.
• Молекулярно-генетические методы (помогает уточнить наличие гена ргоВ, идентифицировать туберкулёзный антигенный комплекс и определить устойчивость к рифампицину).
• Типирование Mycobacterium tuberculosis с помощью анализа полиморфизма длины рестрикционных фрагментов.
• Измерение уровня цитокинов периферической крови, продуцируемых моноцитами (для диагностики остроты процесса).
Лечение и профилактика туберкулеза
Для лечения туберкулёза лёгких применяют этамбутол в комплексе с пиразинамидом (в первые 2 мес) и рифампицин и изониазид (на протяжении 6 мес). При поражении других органов используют такую же схему лечения, основанную на способности лекарственного препарата проникать в различные ткани (например, в спинномозговую жидкость). В последнее время всё чаще выделяют мультирезистентные штаммы возбудителя туберкулёза.
Вероятность их обнаружения зависит от числа случаев неполного излечения, уровня жизни и др. В этом случае для лечения используют препараты второй линии: аминогликозиды, фторхинолоны, этионамид или циклосерин (после обязательного определения чувствительности возбудителя к антибиотикам).
Вакцинация аттенуированными (ослабленными) штаммами (вакцина для профилактики туберкулёза, синоним — вакцина Кальметт—Герена, БЦЖ) позволяет избежать милиарного распространения инфекции, но клинические исследования в некоторых странах не подтвердили её эффективности. Пациентам с высоким риском развития туберкулёза назначают профилактическое лечение рифампицином и изониазидом, а лицам с ВИЧ-инфекцией рекомендован приём рифабутина или кларитромицина в течение длительного времени.
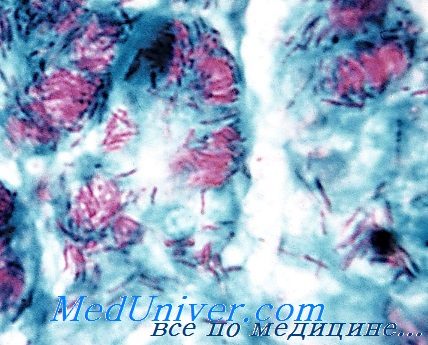
Микобактерии лепры
Инфекция вызванная Mycobacterium leprae - Лепра
Возбудителя лепры (проказы) до настоящего времени не удалось культивировать на искусственных питательных средах.
Mycobacterium leprae вызывает поражение периферических нервов, сопровождаемое нарушением болевой чувствительности. Разрушение и деформация суставов и фаланг пальцев делают пациентов физически недееспособными. Итог заболевания индивидуален и зависит от иммунного ответа. В настоящее время выделяют три типа иммунного ответа при лепре:
• туберкулоидный (превалирует Thl-ответ);
• лепроматозный (преобладает Тh2-ответ);
• пограничный.
При туберкулоидном типе инфекции у пациентов развивается стойкий клеточный иммунитет, возникает большое количество гранулём, трофические поражения нервов. В тканях обнаруживают небольшое количество бактерий. Для лепроматозного типа характерен слабый клеточный иммунитет, отсутствие гранулём и генерализованная инфекция (леонтиаз, депигментация и нарушение чувствительности).
Диагноз основан на результатах микроскопического исследования препаратов поражённой кожи (окраска по Цилю-Нильсену) и биоптатов кожных покровов гистологического исследования. Для лечения применяют рифампицин, дапсон и клофазимин, эффективные на ранних стадиях заболевания, но неспособные препятствовать повреждению нервов и деформации конечностей, при возникновении которых необходимо хирургическое вмешательство.
Микобактерии не вызывающие туберкулез
Различные виды микобактерий могут вызывать локализованные или диссеминированные заболевания у лиц со сниженным иммунитетом. Некоторые из них могут инфицировать имплантируемые ткани.
Mycobacterium avium. В состав комплекса входят Mycobacterium avium, M. intracellular и М. scrofulaceum. Некоторые из них поражают птиц, других животных, являясь санрофитами окружающей среды. Их считают наиболее распространённой причиной микобактериального лимфаденита у детей, остеомиелита у пациентов со сниженным иммунитетом и пневмонии у лиц пожилого возраста. При прогрессирующей ВИЧ-инфекции эти микроорганизмы способны вызывать диссеминированные инфекции и бактериемию.
Возбудители из авиум-внутриклеточного комплекса устойчивы к действию большинства противотуберкулёзных препаратов, поэтому для лечения инфекций, вызванных ими, применяют методы комплексной терапии с использованием рифабутина, кларитромицина и этамбутола. При развитии лимфаденита иногда требуется хирургическое вмешательство.
Mycobacterium kansasi, M. Malmoense, M. Xenopi. Вызывают вялотекущую инфекцию лёгких, похожую на туберкулёз, у пациентов с хроническими заболеваниями лёгких (бронхоэктазией, силикозом, хронической обструктивной болезнью лёгких). Начальную терапию осуществляют с помощью стандартных препаратов после определения чувствительности микроорганизмов к антибиотикам.
Mycobacterium marinum, М. ulcerans. Mycobacterium marinum вызывают хронические гранулематозные инфекции кожи. Возбудитель обитает в реках, запущенных бассейнах и неухоженных садках для рыбы. Заболеванию свойственно возникновение множественных гнойничковых очагов, покрытых твёрдой коркой. Инфекции, вызванные М. ulcerans, распространены в сельскохозяйственных зонах Африки и Австралии. Бактерии обычно поражают нижние конечности, при этом обнаруживают папулёзные очаги, сопровождаемые изъязвлением и глубоким повреждением тканей (включая костную).
Видео диагностика и лечение микобактериоза. Д.м.н., профессор В.Н. Зимина
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

