Лабораторная диагностика кокцидиоза у кур
Обновлено: 19.04.2024
Кокцидиоз у кур встречается достаточно часто, особенно на крупных птицефабриках. Болезнь поражает молодняк, смертность которого может достигать 80% от общей массы поголовья. В экономическом плане такие потери крайне неуместны. Как предупредить заболевание и обезопасить хозяйство – полная инструкция в статье.
Этиология
Возбудитель данной патологии – простейшее одноклеточное именуемое кокцидией. У кур заболевание провоцирует более 10 разновидностей паразита, среди которых наиболее патогенны:
- Eimeria tenella – поражает слепые отростки кишечника;
- E. Necatrix, E. Brunette, E. Maxima – поражают тонкий кишечник, так же прямую кишку и клоаку;
- при попадании таких слабовирулентных эймерий, как E. Mitis, E. Praecox – болезнь носит хроническое течение.
Одна птица может одновременно заразиться разными видами кокцидий.
К болезни наиболее восприимчив молодняк возрастом до полутора месяца, реже – до полугода. Болезнь протекает остро, в тяжёлой форме, летальность у цыплят может достигать 80-100%.
Взрослая птица, хотя и заражается кокцидиозом, но клинически это никак не проявляется, может наблюдаться снижение продуктивности и яйценоскости. У кур – бройлеров снижается привес.

К кокцидиозу восприимчивы все породы кур.
Причины заражения
Зачастую кокцидиоз возникает в хозяйствах, где грубо нарушаются санитарно-гигиенические нормы и в весенне-летний период. Кокцидии попадают в организм птицы с кормом, либо водой.
Факторами для заражения служат:
- больные цыплята, недавно переболевший молодняк, взрослые куры-носители;
- скудный рацион;
- повышенные температурные показатели в курятнике;
- повышенная влажность воздуха, сырость;
- трава, используемая в качестве корма, заражённая ооцистами кокцидий;
- заражённая почва в вольерах для выгула;
- заражённая, своевременно не убранная подстилка в курятнике;
- загрязнённый инвентарь, сменная одежда персонала и посуда;
- ооцисты могут распространять грызуны, насекомые.
Кокцидии очень устойчивы во внешней среде, могут сохранять инвазионные свойства до 1 года.
При разных способах содержания цыплят
Новорожденные цыплята содержащиеся на полу, заражаются контактируя с загрязнёнными кокцидиями поверхностями, либо через пищу. Диагностируют заболевание через 10-14 дней, реже в течение 3-4 недель после заражения, в зависимости от следующих факторов:
- состояние иммунной системы на момент заражения;
- возраста;
- разновидности паразита и степени его вирулентности.
Течение болезни характеризуется, как тяжёлое, отмечается высокая гибель цыплят.
В 2-х месячном возрасте, если птицу до этого содержали в клетках, и далее выпустили на пол – заражение кокцидиозом начинается на 5-10 сутки, достигая пика за 3 недели. Это говорит о том, что птица не сталкивалась с возбудителем ранее и не успела приобрести иммунитет. Течение болезни имеет лёгкий характер.
Отсюда следует, что клеточное содержание, при правильном уходе и должном санитарном состоянии в птичнике, уместнее напольного.
Стадии и симптомы кокцидиоза у кур
Кокцидии имеют сложный цикл развития. Клинические проявления болезни меняются, в зависимости от стадии их развития в организме птицы:
Первая стадия
Характеризуется проникновением эймерий в подслизистую оболочку кишечника, где они начинают размножение. Период длится примерно 5 суток, в течение которых паразит разрушает ткани кишечника, вызывая кровотечения и воспалительную реакцию.
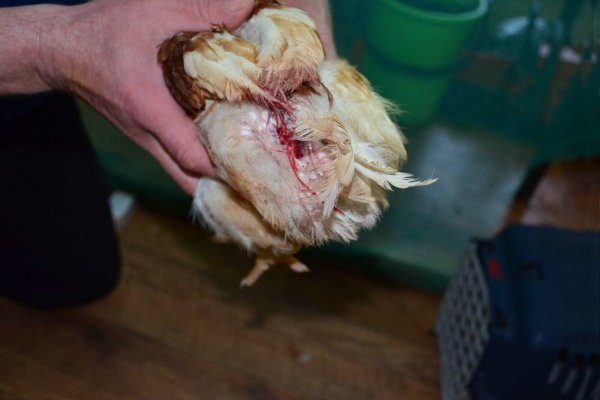
Начальная стадия может закончиться по разным сценариям:
- В случае правильного функционирования иммунных сил организма, птица переболевает в слабой форме с мало выраженными симптомами (абортивная форма). Наблюдается подавление жизнедеятельности кокцидий и полное выздоровление.
- При низких показателях иммунитета происходит активное размножение эймерий, с последующим распространением паразита в другие органы. Далее происходит переход на следующую стадию.
Вторая стадия
Во время второй стадии происходит проявление клинических признаков. Стадия длится приблизительно 7 дней. Деятельность кишечника нарушается, питательные вещества прекращают всасываться и поступать в кровь. Причиной этому служат повреждения слизистой на больших участках.
В организме повышаются энергозатраты для жизнедеятельности, усиливается кровотечение и начинает развиваться анемия.
Вышеперечисленные изменения служат благоприятной средой для развития условно-патогенных микроорганизмов – кишечной палочки, кокков.
Заболевшие кокцидиозом куры, на фоне сниженного иммунитета, могут параллельно страдать от различных бактериальных инфекций.
Далее происходит полное нарушение обмена веществ, поступление в организм питательных элементов прекращается.
В патологический процесс вовлекается нервная система. У цыплят наблюдаются неврологические отклонения – нарушение походки, сопровождающееся потерей равновесия, парезы конечностей и дезориентация.
Токсические продукты деятельности эймерий усиленно попадают в кровь, вызывая сильнейшую интоксикацию – состояние птицы резко ухудшается, наблюдаются следующие симптомы:
- общая слабость – молодняк взъерошен, основное время проводят сидя;
- полный отказ от корма, быстрое исхудание;
- отмечается бледность видимых слизистых оболочек;
- диарея, цвет фекалий различных оттенков;
- угнетённое состояние.
При тяжёлом течении болезнь заканчивается смертью птицы, в менее тяжёлых случаях начинается следующая стадия.
Третья стадия
Третья стадия характеризуется ослаблением негативного воздействия кокцидий на организм, подавлением их жизнедеятельности и постепенным выздоровлением. В этой стадии кровотечение в кишечнике прекращается, нормализуется кроветворение.
Существует опасность гибели птицы из-за дистрофических изменений.
Четвёртая стадия
В четвёртой стадии отмечается полное восстановление иммунитета и обменных процессов. Работа кишечника и органов налаживается, нормализуется аппетит и пищеварение.
Рекомендуем также прочесть статью, которая расскажет о других заболеваниях кур.
Для тех, кому легче воспринимать информацию на слух, рекомендуем следующее видео, в котором специалист подробно расскажет о кокцидиозе у кур:
Диагностика
Для полноценной диагностики кокцидиоза применяют комплексные исследования, которые включают в себя:
- эпизоотологическую картину;
- клинические проявления;
- патологоанатомические изменения;
- лабораторные данные, которые показывают наличие эймерий на разной стадии своего развития в кале.
Дифференцируют кокцидиоз от боррелиоза, гистомоноза, пуллороза и трихомоноза (при инфекционных заболеваниях гибнут птицы всех возрастных групп, что при кокцидиозе не наблюдается).
Препараты для лечения и профилактики кокцидиоза
Ниже описанные лекарственные средства применяются исключительно для ремонтного молодняка и цыплят бройлеров. Применение у взрослых птиц яйценоских пород запрещено – препараты откладываются в яйцах.
Разнообразие препаратов, обладающих антикокцидийными свойствами, делятся на 2 вида.
Средства, используемые непосредственно для лечения кокцидиоза:
- Байкокс – ветеринарный препарат, обладающий выраженным действием против возбудителей кокцидиоза у кур. Применяется при выявлении первых симптомов путём смешивания препарата с водой в дозе 1 мл 2,5% Байкокса на 1 мл жидкости (на 100 кг живой массы используют 28 мл лекарственного средства). Птицу отпаивают в течение 2 суток. При тяжёлой форме заболевания приём повторяют через 5 дней.
- Ампролиум 30%. Применяют, начиная с 3-дневного возраста, перемешивая с кормом или водой. Суточная доза составляет 400 г препарата на 500 л воды (250 мг на 1 литр), которую используют в течение 7 дней для лечения кокцидиоза.
Важно готовить свежий раствор ежедневно.
Для смешивания с кормом используют профилактическую дозу в 400 г/1 тонну. И 850 г/1 тонну – в качестве лечебной дозировки в течение 10 дней.
Медикаменты, которые используют в качестве профилактической меры. Птица получает препарат ежедневно (за 5 суток до предполагаемого убоя препарат давать прекращают). К ним относятся:
- Препараты в виде гранулированного порошка, которые обладают широким спектром действия против кокцидий, подавляя жизнедеятельность паразита на любой стадии их развития и защищая поголовье от массового заражения. Применяют: Аватек 15%, Кокцисан 12%, Цигро 1% из расчёта 0,5 кг на 1 тонну готового корма, Цикостат 66 в дозировке 33 г на 1 тонну корма.
- Жидкие препараты, которые имеют схожее вышеописанному действие, например, Медикокс. 8 мл лекарственного средства разводят в 100 мл воды.
Своим методом борьбы с кокцидиозом у кур делится заводчик в своём видео ниже:
Для предотвращения привыкания к одному действующему веществу в крупных хозяйствах рекомендуется ежемесячно чередовать препараты.
Методы профилактики
Сложность при проведении профилактики состоит в том, что:
- ооцисты кокцидий обладают высокой выживаемостью в меняющихся условиях внешней среды;
- дезинфицирующие средства, применяемые в ветеринарии, часто бессильны – ооцисты проявляют сильную устойчивость к ним;
- эймерии очень быстро размножаются.
Главные меры успешной профилактики:
Конечно, данные рекомендации не решат полностью проблему кокцидиоза в хозяйстве, но значительно снизят риск глобального распространения паразитов.
В связи с риском привыкания к кокцидиостатикам, разработаны вакцины против кокцидий – Кокцивак, Иммукокс, Ливакокс. Неудобства в применении составляет высокая стоимость, поэтому ими в основном прививают кур-несушек и ремонтный молодняк.
Кокцидиоз – распространённая проблема. Полностью избавится от паразита хоть и не представляется возможным, но поддержание правильных санитарно-гигиенических показателей в силах любого фермерского хозяйства. Выполнение рекомендаций ветеринарного врача и своевременная обработка помещений – залог высокой продуктивности и здоровья птицы.
Текст ГОСТ 25383-82 Животные сельскохозяйственные. Методы лабораторной диагностики кокцидиоза

ЖИВОТНЫЕ СЕЛЬСКОХОЗЯЙСТВЕННЫЕ
МЕТОДЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ КОКЦИДИОЗА
ГОСТ 25383-82 (СТ СЭВ 2547-80)
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО СТАНДАРТАМ
РАЗРАБОТАН Министерством сельского хозяйства СССР ИСПОЛНИТЕЛИ
Б. Л. Тимофеев, И. А. Коблова, Л. М. Шало за
ВНЕСЕН Министерством сельского хозяйства СССР
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 11 августа 1982 г. № 3154
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
ЖИВОТНЫЕ СЕЛЬСКОХОЗЯЙСТВЕННЫЕ Методы лабораторной диагностики кокцидиоза
Donic-Xr* ипитшК. .Methods of laboratory diagnostics

Постановлением Государственного комитета СССР по стандартам от 11 августа 1982 г. № 3154 срок действия установлен
с 01.01.83 до 01.01.88
Несоблюдение стандарта преследуется по закону
Настоящий стандарт распространяется на все ви iu сельскохозяйственных животных и птиц и \сгаплвливаег методы лабораторной диагностики кокцидиоза.
Стандарт полностью соответствует СТ СЭВ 2547—80.
1. МЕТОДЫ ОТБОРА ПРОБ
IЛ. Для проведения исследований отбирают пробы кала животных, пробы патологического материала, а также пробы но стилки.
1.2. Пробы кала берут от живых п павших животных.
1.2.1. От живых животных пробы кала берут у животных из одного стада, станка или же стаи с учетом числа животных в группе.
Если число животных в группе менее 100, кал берут не менее чем от 20 животных; в группе с числом животных от 101 до 500 — от 10%; с числом животных от 501 до 1000 — от 5% и с числом животных свыше 1000—от 2% животных.
1 2.2. Кал берут из прямой кишки животного. От каждой головы крупного рогатого скота берут 50 г кала, овец, коз и свиней -20 г, домашней птицы и кроликов— 10 г.
Отобранные пробы смешивают, иолуч а я объединенную пробу.
В случае проведения исследований кала от к аж юго животного смешивание проб не производят.
Издаике о фициальное
Перепечатка воспрещена (О Издательство стандартов, 1982
Допускается отбирать пробы кала с пола станков, выгулов и т. п.
1.2.3. От павших животных кал берут из конца ободочной кишки или из прямой кишки в количествах, указанных в п. 1.2.2.
1.2.4. Отобранные пробы кала упаковывают в полиэтиленовый пакет или помещают в хорошо закрывак щийся сосуд.
До проведения исследований пробы хранят при температуре 2—4°С или консервируют, добавляя 2,5%-ный раствор бихромата калия.
1.3. Пробы патологического материала отбирают при вскрытии павших животных.
Пробы берут из патологоапатомически измененных частей кишки, у кроликов—также из желчного пузыря и паренхимы печени, у гусей — из почек. Если пробы нельзя исследовать сразу, кишку разрезают в продольном направлении и помещают в 2,5%-ный раствор бихромата калия. Из печени кроликов вырезают беловатые очаги и консервируют их тем же способом. Пробы для гистологического исследования хранят в 10%-ном растворе формальдегида.
1.4. Пробы подстилки в зависимости от размера помещения отбирают не менее чем из десяти разных мест в бумажный или полиэтиленовый пакет.
1.5. Ко всем отобранным пробам прилагают сопроводительный документ с указанием:
возраста и пола животных;
заболеваемости или смертности;
способа проведенной санитарной обработки;
даты взятия материала для исследования. 2
2. МЕТОДЫ ИССЛЕДОВАНИЙ
2.1. Методы определения наличия ооцист в кале
Сущность метода заключается в определении с помощью микроскопа наличия ооцист кокцидий, всплывающих на поверхность раствора с исследуемым материалом.
2Л.1. Аппаратура, материалы и реактивы
2.1.1.1. Для проведения исследования применяют: микроскоп с окулярным микрометром марки МБИ-3 по ГОСТ
весы лабораторные по ГОСТ 24104—80;
центрифугу марки М-24 или других марок с частотой вращения 2000 об/мин;
сита с ячейками размером 0,5—1,0 мм 2 ;
стаканы стеклянные вместимостью 150—200 см 3 по ГОСТ 10394—75;
чашки стеклянные лабораторные по ГОСТ 10973—75; стекла предметные по ГОСТ 9284—75 и покровные по ГОСТ 6672—75;
пипетки градуированные вместимостью 50 см 3 по ГОСТ 20292—74;
посуду лабораторную фарфоровую; воронки стеклянные по ГОСТ 8613—75; штатив для пробирок; петли;
вату Iигроскопическую медицинскую по ГОСТ 5556—75; натрий хлористый по ГОСТ 4233—77; цинк сернокислый по ГОСТ 4174—77; магний сернокислый по ГОСТ 4523—77; воду дистиллированную по ГОСТ 6709—72.
2.1.2. Подготовка к исследованию 2Л.2.1. Приготовление раствора Бреза
Готовят насыщенный раствор сульфата магния и насыщенный раствор тиосульфата натрия. Растворы смешивают с дистиллированной водой в соотношении 3:3:1.
2.1.2.2. Приготовление флотационного раствора
К 1 л горячей дистиллированной воды добавляют избыток соответствующего химического реактива (насыщенного раствора хлористого натрия пли сульфата цинка или раствора Бреза), выдерживают в течение 12 ч и фильтруют через вату в чистую склянку. Плотность флотационного раствора должна составлять приблизительно 1,3 г/см 3 .
2.1.3. Проведение исследования
2.1.3 1. Из пробы выделяют навеску кала массой 3 г, заливают в ступке 15—20 см 3 воды, размешивают до жидкой консистенции и процеживают через сито и воронку в центрифужные пробирки.
Пробирки центрифугируют с частотой вращения 2000 об/мин в течение 1—2 мин. Жидкую часть сливают, затем добавляют 10 см 3 флотационного раствора и тщательно перемешивают палочкой так, чтобы не образовались пузыри. Не рекомендуется встряхивать содержимое пробирки. Пробирки с флотационным раствором снова центрифугируют, как указано выше.
С помощью петли пз каждой пробирки берут по три капли раствора и наносят на предметное стекло. Покровное стекло используют лишь для рассеяния капли в случае недостаточной обзорности поля зрения. При массовых исследованиях одной и той же пробы допускается не обжигать петлю после каждого переноса
раствора на предметное стекло, достаточно лишь промыть ее несколькими резкими движениями в пробирке с водой. Однако в начале и конце исследования петлю необходимо обжигать.
Определение наличия ооцист проводят под микроскопом, используя соответствующий определитель.
2.2. Метод определения количества ооцист в кале
2.2.1. Аппаратура, материалы и реактивы
2.2.1.1. Для проведения исследования применяют аппаратуру^ материалы и реактивы, указанные в п. 2.1.1, и дополнительно счетную камеру Горяева или Мак-Мастера.
2.2.2. Проведение исследования
2.2.2.1. Исследуемую пробу кала тщательно гомогенизируют. Взвешивают от 3 до 5 г кала (в зависимости от необходимости точности определения) п размешивают в стакане с 45 см 3 воды. Полученную таким образом суспензию фильтруют через сито. 10 см 3 фильтрата помещают в центрифужную пррбирку и центрифугируют с частотой вращения 2000 об/мин в течение 2 мин.
Жидкую часть сливают, к осадку добавляют 10 см 3 флотационного раствора и тщательно перемешивают. Полученной суспензией заполняют счетную камеру. Допускается при отсутствии счетной камеры использовать предметное стекло, на которое наносят 0,15 см 3 суспензии и накрывают покровным стеклом. Заполненную камеру или предметное стекло с 0,15 см 3 суспензии выдерживают в течение 2 мин, чтобы ооцисты могли подняться к поверхности, и подсчитывают количество ооцист. Полученное число, умноженное на 100, представляет собой содержание ооцист в 1 г кала.
Для более точного определения допускается использовать несколько камер и ооцисты подсчитывают в нескольких камерах. При использовании камеры Горяева ооцисты подсчитывают во всех 225 квадратах и полученную сумму умножают на коэффициент 1111. Полученное количество показывает число ооцист в 1 см 3 взвеси.
2.2.3. Обработка результатов
2.2.3.1. У домашней птицы обнаружение единичных ооцист (0—100 ооцист на 1 г кала) свидетельствует о наличии кокцидий в окружающей среде и течении субклинического заболевания.
Наличие 101—1000 ооцист в 1 г кала свидетельствует:
для Eimeria tenella и Eimeria necatux — о заражении средней степени;
для Eimeria maxima — о сильном заражении;
для Е. acervulina — о слабом заражении.
Наличие свыше 1000 ооцист в 1 г кала — признак сильного заражения.
У крупного рогатого скота и овец наличие до 1000 ооцист в 1 г кала (для Е. bovis и Е. zuetnii) свидетельствует о слабой инфек
ции, до 5000 — об инфекции средней тяжести, свыше 5000 —о сильной инфекции.
Для определения вида Eimeria используют существующие определители.
У кроликов наличие до 10000 ооцист на 1 г кала служит признаком слабой инфекции, до 100000 — сильной инфекции, свыше 100000 — очень сильной инфекции.
2.3. Метод исследования павших животных
Сущность метода заключается в выявлении и определении с помощью микроскопа различных стадий кокцидий в пробах, взятых при паталогоанатомическом вскрытии животных. У животных исследуют желудочно-кишечный тракт, при этом учитывают наличие в крови паталогоанатомических изменений, локализацию, а также размер, форму, цвет, структуру стадий развития.
2 3.1. Аппаратура и реактивы
2.3.1.1. Для проведения исследования применяют:
ножницы по ГОСТ 21239—77;
пинцеты по ГОСТ 21241—77;
чашки лабораторные стеклянные по ГОСТ 10973—75;
натрий хлористый по ГОСТ 4233—77;
воду дистиллированную по ГОСТ 6709—72.
2.3.2. Проведение исследования
2.3.2.1. Паталогически измененные части кишок кладут в чашки Петри или другую посуду и разрезают в продольном направлении. Несколько капель содержимого кишки разбавляют на предметном стекле физиологическим раствором, накрывают покровным стеклом и рассматривают под микроскопом. Можно также соскабливать краем предметного стекла слизистую оболочку пораженной кишки. Соскоб разбавляют физиологическим раствором и рассматривают под микроскопом для установления наличия меро-зоитов, шизонтов или гамет кокцидий.
У павших кроликов исследуют беловатые очаги в печени и содержимое желчного пузыря на наличие ооцист кокцидий Eimeria. Очаги разрезают и с помощью пастеровской пинетки наносят их содержимое на предметное стекло. Накрыв препарат покровным стеклом, рассматривают его под микроскопом. Аналогичным образом поступают и с поражениями почек гусей.
2.3 3. Обработка результатов
2.3.3.1. В случае установления единичных стадий развития кокцидий заболевание кокцидиозом рассматривается как вторичная инфекция, которая не играет главную роль в падеже животных. При установлении разных стадий развития патогенных видов кокцидий в большом количестве и исключении других инфекционных заболеваний кокцидиоз считают причиной падежа животных
2.4. Метод исследования подстилки на наличие ооцист кокци-дий
Сущность метода заключается в подсчете количества ооцист в 1 г подстилки и определении по данным подсчета тяжести клинического течения кокцидиоза и резистентности кокцидий к используемому антикокцидиозному препарату.
2.4.1. Аппаратура, материалы и реактивы
2.4.1.1. Для проведения исследования применяют аппаратуру, материалы и реактивы, указанные в п. 2.1.1, и дополнительно:
счетную камеру Горяева или Мак-Мастера;
2.4.2. П р оведение исследования
2.4.2.1. Пробу подстилки хорошо перемешивают. Взвешивают 10 г пробы с погрешностью не более 0,02 г и перекладывают в стакан с 100 см 3 воды, ставят в холодильник, выдерживают в течение 12 ч и гомогенизируют 2—3 мин в электрическом гомогенизаторе с частотой вращения 2000 об/мин. Полученную суспензию фильтруют в течение 5 мин. Жидкую часть сливают, к осадку добавляют 10 см 3 флотационного раствора и тщательно перемешивают, встряхивая пробирку. Наполняют счетную камеру или помещают 0,15 см 3 суспензии на предметное стекло, накрывают ее покровным стеклом и выдерживают в течение 2 мин. Число ооцист умножают на коэффициент 67, что представляет собой количество ооцист в 1 г подстилки.
2.4.3. Обработка результатов
2.4.3.1. Определение вида кокцидий проводят согласно соответствующему определителю.
При наличии до 5000 ооцист Е. acervulina в 1 г подстилки не придают им никакого клинического значения. Наличие до 5000 ооцист Е. tenella или Е. nccatux в 1 г подстилки свидетельствует о слабом течении кокцидиоза у содержавшихся на этой подстилке цыплят или же о снижении действия используемого кокцидиоста-тика. Наличие 1000 ооцист Е. maxima в 1 г подстилки свидетельствует о клиническом течении кокцидиоза и недостаточной эффективности аптикокцидиозного препарата.
2.5. Метод установления интенсивности инфекции
2.5.1. Проведение исследования
2.5.1.1. Интенсивность инфекции ооцистами Eimeria или другими формами развития этого рода устанавливают подсчетом их в микроскопическом препарате и делением полученного числа на 3.
2.5.2. Обработка результатов
2.5.2Л. Подсчитанное число ооцист делят на 3. Это число будет равным числу паразитов в 1 г кала. В зависимости от этого дтч самых патогенных видов Eimeria устанавливают следующие степени интенсивности инфекции:
слабая инфекция ( + ) — 1 —10 ооцист на 1 г кала; средняя инфекция ( + +) —11 — 100 ооцист на 1 г кала; сильная инфекция ( + + +)—больше 100 ооцист на 1 г кала. При оценке интенсивности инфекции следует учитывать не только наличие ооцист различных видов Eimeria, но и присутствие других паразитов.
Изменение 1 ГОСТ 25383—82 Животные сельскохозяйственные. Методы лабораторной диагностики кокцидиоза
Утверждено и введено в действие Постановлением Государственного комитета СССР по стандартам от 27.05.87 № 1714
Дата введения 01.01.88
Пункты 2.1.1.1, 2.1.2.1 изложить в новой редакции:
микроскоп с окулярным микрометром марки МБИ-3 по ГОСТ 8284—78; весы лабораторные общего назначения по ГОСТ 24104—80 с наибольшим пределом взвешивания 206 г;
центрифугу с частотой вращения 5000 мин- 1 ;
стаканы стеклянные вместимостью 150—200 см 3 и 1000 см 3 по Г ОСТ
чашки стеклянные лабораторные по ГОСТ 25336—82; стекла предметные по ГОСТ 9284—75 и покровные пипетки градуированные исполнений 1, 2, 4, 5, 6,
по ГОСТ 6672— 2-го класса точности
стимостью 50 см 3 по ГОСТ 20292—74; посуду лабораторную фарфоровую; воронки стеклянные по ГОСТ 25336—82; штатив для пробирок; петли;
марлю медицинскую по ГОСТ 9442—77;
вату гигроскопическую медицинскую по ГОСТ 5556—81;
фильтры беззольные по ГОСТ 12026—76;
натрий хлористый по ГОСТ 4233—77;
воду дистиллированную по ГОСТ 6709—72.
2.1 2.1. Приготовление флотационного раствора
Пункт 24.2,2 исключить.
Пункт 2.1.3.1 изложить в новой редакции: «2.1.34. Из пробы выделяют навеску кала массой 3—5 г, помещают навеску в ступку, заливают 15—20 см золы. размешивают до жидкой консистенции и процеживают через марлю в-центрифужные пробирки.
Пункты 2 2.2 1, 2.2.34 изложить в новой редакции: «2 2.2.1. Взвешивают 5 г кала, взятого из отобранной пробы, и тщательно размешивают в ступке с 45^см 3 воды. Полученную суспензию фильтруют через один слой марли, осадок отбрасывают. 10 см 3 фильтрата помещают в центрифужную пробирку и центрифугируют в течение 5 мин с частотой вращения 5000 мин- 1 . Жидкую часть сливают, к осадку добавляют 10 см 3 флотационного раствора, тщательно перемешивают и еще раз центрифугируют в течение 5 мин с частотой вращения 5000 мин — 1 . Из пробирки снимают при помощи петли поверхностный слой жидкости и в счетной камере Горяева подсчитывают количество ооцист во всех 225 квадратах. Для определения количества ооцист в 1 г кала, подсчитанное з камере Горяева, число ооцист умножают на 1111.
(Продолжение см. стр. 338)
2.2 ЗЛ. У домашней птицы наличие 50000 ооцист на 1 г кала не влияет на зоотехнические показатели цыплят, обнаружение более 100000 оосцист на 1 г кала свидетельствует о заражении средней степени, обнаружение ооцист в количестве более 300000 на 1 г кала — о высокой степени заражении и малой эффективности применяемого препарата.
У крупного рогатого скота и овец наличие до 100*0 ооцист в 1 г кала свидетельствует о низкой степени заражения, до 5000 — о средней степени заражения, более 5000 — о высокой степени заражения.
Пункт 2.3.1 Л. Заменить ссылку: ГОСТ 1.0*973—75 на ГОСТ 25336—82.
Пункт 2.3 3.1 изложить в новой редакции: «2.З.З.1. Для своевременной диагностики кокцидиоза у домашней птицы подсчет ооцист проводят один раз в 7 дней, начиная в двух-, трехнедельного возраста цыплят. Из каждой группы вскрывают по 4—6 ослабленных птиц. Исследуют соскобы со слизистой и содержимое кишечника в месте перехода дненадцатиперстной кишки в тощую, середины тонкого отдела кишечника и слепых кишок. Несколько капель наносят на предметное стекло, разбавляют водой и накрывают покровным стеклом. Просматривают под микроскопом 20 полей зрения, определяют среднее количество ооцист на. одно поле зрения и проводят идентификацию кокцидий вида Ei.meria в соответствии с ключом идентификации, представленном на схеме. В зависимости от клинических проявлений, степени и характера изменений отделов кишечника, локализации поражения и стадий развития кокцидий определяют виды ооцист Е. tenella, Е. necatrix, Е. acervulina,Е. maxima, Е. ргаесох. (см. схему. См. с. 339)?>.
Раздел 2 дополнить пунктами — 2.3.4, 2.3.4.1:
«2.3.4. Оценка результатов
2.3.4.1. Наличие ооцист видов Е. acervulina менее 50 и ооцист Е. tenella, Е. necatrix, Е. maxima менее 5 кокцидий в поле зрения — признак низкой степени заражения.
Пункты 2.4.3, 2.4.5 исключить.
(Продолжение см. с. 339)
(Продолжение изменения к ГОСТ M3-S2) КЛЮЧ И ИДЕНТИФИКАЦИИ ВИДОВ Eimeria ЦЫПЛЯТ

Эймериоз или кокцидиоз у кур – одно из самых распространённых паразитарных заболеваний, сопровождающееся нарушением функции пищеварения, воспалением слизистой оболочки кишечника и интоксикацией. Оно поражает кур всех возрастов, но наиболее восприимчив к нему молодняк. Инфекция быстро распространяется по ферме и может уничтожить большую часть поголовья за считаные дни. Каждый птицевод должен уметь распознавать симптомы кокцидиоза и знать, как лечить болезнь.

Описание болезни и данные о возбудителе
Кокцидиоз у кур вызывают простейшие одноклеточные микроорганизмы, эймерии. Они изображены на фото. У несушек и бройлеров паразитирует 9 видов кокцидий, большинство из них обитают в тонком кишечнике. Наиболее патогенными считаются эймерии тенелла, максима, некатрикс. Птицы заглатывают ооцисты вместе с водой и кормом. При попадании в пищеварительный тракт их оболочка разрушается, из ооцист выходят спорозоиты, которые внедряются в эпителий стенок тонкой кишки и начинают активно размножаться.
Разрушение слизистой оболочки кишечника приводит к воспалительному процессу, сопровождающемуся геморрагией. Зачастую кокцидиоз осложняется присоединением бактериальной инфекции. У заражённых эймериями кур развивается колибактериоз, сальмонеллёз или клостридиоз. Продукты жизнедеятельности паразитов вызывают у пернатых сильную интоксикацию.

Эймерии под микроскопом
К кокцидиозу чувствительны особи с ослабленной иммунной системой и цыплята, хотя заболеть может птица в любом возрасте. Кокцидии проявляют устойчивость к воздействию внешних факторов и дезсредств. Они сохраняют жизнеспособность при повышенных и пониженных температурах. Уничтожить их невозможно и с помощью щелочных растворов, извести и формалина. После вспышки заболевания паразиты надолго остаются в подстилке, на инвентаре, в щелях между досками. Эймерии быстро гибнут под воздействием огня или крутого кипятка.
Симптомы болезни у молодняка и взрослых кур
Большинство видов кокцидий паразитируют в слизистых оболочках разных отделов кишечника, поэтому при заражении в первую очередь нарушается работа пищеварительной системы. Болезнь может протекать по-разному – в острой или хронической форме. Выраженность симптомов во многом зависит от количества ооцист, проникших в организм, локализации паразитов, скорости их размножения и от возраста и иммунитета птицы.

Кровь в помёте – признак кокцидиоза
Инкубационный период длится около 6–10 суток. У цыплят и особей с ослабленным иммунитетом кокцидиоз протекает в острой форме. Хроническое течение болезни возможно при повторном инфицировании эймериями, а также при заражении небольшим количеством паразитов.
Симптомы кокцидиоза у цыплят:
- угнетённый вид, слабость, апатия;
- взъерошенное, неопрятное оперение;
- помёт становится жидким и содержит слизь и кровяные включения;
- потеря аппетита;
- сильная жажда;
- увеличение зоба;
- побледнение гребня;
- истощение.
Внимание! Нарушение координации движений и паралич лап или крыльев говорит о скорой гибели птицы.
У взрослых особей симптомы выражены слабее. Пернатые теряют аппетит, сидят, нахохлившись, их перья взъерошены. Количество актов дефекации учащается. Помёт приобретает коричнево-красный или зеленоватый оттенок и становится жидким. Иногда в нём содержится кровь. У несушек снижается продуктивность.
Диагностика заболевания
Кокцидиоз диагностируют, учитывая эпизоотическую обстановку, клиническую картину болезни, данные лабораторных исследований и патологоанатомического вскрытия. У павших тушек отмечается утолщение слизистой оболочки кишечника. При поражении эймериями она испещрена геморрагическими очагами и светло-жёлтыми узелками. В тонкой кишке обнаруживается творожисто-кровянистое содержимое.
Методы лечения кокцидиоза у кур
При кокцидиозе применяют кокцидиостатические, сульфаниламидные и нитрофурановые препараты. Поскольку кокцидии способны вырабатывать резистентность к лекарствам, не рекомендуется применять один и тот же препарат долгое время.

Перечень эффективных кокцидиостатиков:
- Ардинон-25;
- Аватек;
- Ампролиум;
- Химкокцид-17;
- Декокс;
- Кокцидин;
- Статил;
- Койден.
Ампролиум используется как для профилактики, так и для лечения эймериоза. Цыплятам его начинают давать с первых дней жизни в небольших дозах, чтобы предотвратить заражение паразитами. Лечебный курс длится не более недели. Дозировка – 0,25 г на 1 кг кормовой смеси.
Если выбран препарат Байкокс 2,5%, то его разводят в воде, которой наполняют поилку. Дозировка для цыплят – 1 мл раствора на каждый литр воды. Курс лечения составляет 3 дня. В особо тяжёлых случаях лечение повторяют после пятидневного перерыва.
Из сульфаниламидов в борьбе с кокцидиозом хорошо зарекомендовал себя сульфадимезин. Его дают несушкам вместе с кормом в дозировке 1 г/1 кг зерносмеси. Длительность курса составляет 3 дня, затем делают перерыв 2 суток, после чего приём препарата продолжают ещё на протяжении 3 дней.

Байкокс для лечения эймериоза у кур
Норсульфазол дают пернатым с водой в дозировке 0,5 г/1 л. Лечебным раствором наполняют поилки. Куры не должны получать другого питья в течение 3 дней.
Внимание! Для восстановления слизистых оболочек во время лечения рекомендуется пропаивать несушек витаминами А и В1.
Обработка курятника
Ооцисты кокцидий нельзя уничтожить формалином, раствором медного купороса или гашеной известью. На них губительно действует:
- аммиак;
- монохлорксиленол;
- ортохлорфенол;
- терпинеол.
Чтобы избавиться от паразитов в клетках, их обжигают паяльной лампой. Это самый эффективный способ уничтожения ооцист. Возбудители выделяются с помётом у больных птиц и особей, которые оправились от болезни, поэтому экскременты следует собирать и обеззараживать биотермическим методом.
Профилактика кокцидиоза
Самую надёжную защиту от кокцидиоза обеспечивает вакцинация. Она проводится в первые дни жизни птицы для выработки иммунитета у цыплят на весь производственный цикл. По мнению ветеринаров, лучшие результаты достигаются при использовании вакцины Иммукокс и Паракокс.

Для профилактики кокцидиоза также используются кокцидиостатики:
- Салиномицин;
- Наразин;
- Ласалоцид.
Комплекс профилактических мер включает уничтожение паразитов во внешней среде – обработку выгулов и курятника дезсредствами, к которым чувствительны эймерии. Нельзя выпускать пернатых на выгул после дождя, так как именно в условиях повышенной влажности чаще всего происходит заражение. Важно соблюдать зоотехнические нормы содержания птицы:
- своевременно осматривать поголовье и изолировать больных особей;
- карантинировать прибывших на ферму птиц;
- держать цыплят отдельно от взрослых кур;
- поддерживать чистоту подстилки;
- нормализовать уровень влажности в помещении.

Домашним птицам оно передается через инвентарь и пищу. Больные куры теряют аппетит, плохо несутся и в итоге гибнут.
Кокцидиоз – это одна из самых распространенных болезней в птицеводстве. Простейшие паразиты, которые и являются возбудителям, размножаются в кишечном тракте.
Из-за этого происходит нарушение пищеварительных процессов. Также наблюдается обезвоживание, повышенная чувствительность к различным инфекциям и потеря крови.
Такое заболевание чаще всего встречается у кур. Кокцидиозом болеют не только домашние птицы, но и дикие. Это куропатки, воробьи и ласточки. Наиболее восприимчивыми к болезни считаются цыплята в возрасте до 2 месяцев.
Что такое кокцидиоз у кур?

Кокцидиоз у кур был обнаружен еще в 19 веке.
Уже тогда птицеводы сталкивались со вспышками заболевания, которому сопутствовала кровяная диарея.
Сложно найти хотя бы одну птицеферму, хозяин которой бы не знал ничего о данном заболевании.
Известно, что наибольшую опасность кокцидиоз представляет в ассоциации с любыми другими инфекциями.
Даже при легкой форме заболевания в промышленном птицеводстве возможны серьезные экономические потери.
В особенности это касается хозяйств, где в ограниченных условиях содержится более 15 тыс. кур.
Возбудители болезни

Возбудители кокцидиоза, то есть кокцидии, широко распространены.
Существует несколько видов этих простейших паразитов.
Их жизненный цикл довольно сложный.
Так, заражение происходит при заглатывании ооцисты вместе с водой или кормом.
В желудочно-кишечном тракте оболочка под воздействием ферментов и желчи разрушается, из-за чего спорозоиты начинают активно размножаться в эпителии кишечника.
Хозяевами некоторых разновидностей кокцидий могут быть только определенные виды птиц, хотя исключения также встречаются.
Хотя наибольшее количество возбудителей встречается у кур, они изучены недостаточно.
Eimeriatenella– это самый распространенный вид, который устойчив к негативным внешним факторам. Она в течение года способна заражать птицу.
При попадании в организм кокцидия повреждает слизистую и нарушает пищеварительные функции. Другие виды обычно развиваются в толстом и тонком отделе кишечника.
Некоторые виды паразитов заражают исключительно цыплят. Это возможно при условии значительной концентрации ооцист. В таком случае они локализуются в двенадцатиперстной кишке.
Течение и симптомы

Заметить кокцидиоз у кур несложно.
Об этом заболевании свидетельствуют такие симптомы:
- постоянное втягивание головы;
- отсутствие аппетита;
- взъерошенные перья;
- отеки;
- жидкий помет светло-коричневого или красноватого оттенка;
- помет с примесью крови.
Эти признаки обычно сохраняются в течение 4-5 дней, после чего больная птица погибает.
Кокцидиоз имеет острую и хроническую форму. В первом случае болезнь длится примерно 2-3 недели. Причем обычно она наблюдается у цыплят.
Основные признаки – это взъерошенные перья, отсутствие аппетита, наличие перьев вокруг клоаки в помете с примесью крови. Также молодняк страдает от анемии и жажды.
Координация движений сильно нарушается. Из-за серьезного истощения птица погибает уже на 2-5 день. При остром течении смертность составляет 50-70%.

Куры Мастер Грей отлично подойдут тем, кто собирается разводить птиц ради мяса.
Одной из самых неприятных болезней у кур является омфалит. В этой статье мы постарались описать омфалит полностью, чтоб у вас не оставалось вопросов.
При хронической форме вышеупомянутые симптомы слабо выражены. Болезнь часто наблюдается у взрослых особей и птенцов от 4-6 месяцев. Случаев гибели практически не бывает, но куры теряют вес, а их яйценоскость снижается.
Основные изменения при кокцидиозе – это истощение и бледность слизистой. Остальные изменения концентрируются в кишечнике.
Их характер во многом зависит от разновидности кокцидий:
- Если это Eimeriatenella, то в слепых кишках отмечается катаральный энтерит.
- Заражение Eimeriaacervulina проявляется в виде белых пятен и полосок в двенадцатиперстной кишке.
- Если заражение произошло из-за Eimeriamaxima, то в тонких кишках наблюдается вязкая слизь с примесью крови.
- Eimerianecatrix приводит к утолщению и некрозу стенок кишечника. Также тут могут находиться сгустки свернутой крови.
Диагностика

На начальной стадии диагностировать кокцидиоз у кур очень сложно.
Этим и объясняется существенный экономический ущерб.
Сначала особь выглядит здоровой, однако со временем ее продуктивность снижается.
Развитие цыплят останавливается, а взрослые куры не прибавляют в весе, хотя расход корма постепенно увеличивается.
Именно эти признаки и должны вызвать беспокойство.
При установлении диагноза необходимо учитывать эпизоотологические прогнозы, возраст больных особей, а также сезонность заболевания.
Помимо этого, следует обратить внимание на клинические признаки и все патологоанатомические изменения. Причину болезни обычно подтверждает наличие ооцист в помете или соскобах со слизистой оболочки кишечника.
После убоя птицы диагноз ставится на основании результатов изучения состояния пищеварительной системы.
Обычно при кокцидиозе отмечается синий цвет тушки, вздутие и значительное заполнение кишечника каловыми массами, а также наличие пенистой массы в слепых отростках.
Лечение
Для лечения кокцидиоза у куриц или любых других птиц часто используют различные кокцидиостатики.
Такие препараты делятся на две группы: ионофорные антибиотики и средства, полученные благодаря химическому синтезу.
Первый вариант считается не самым лучшим, поскольку действие таких препаратов идентичное. Они негативно влияют на проницаемость клеточных мембран.
Больным птицам часто дают такие кокцидиостатики, как ардинон-25, аватек, ригекостат или химкокцид-17. Часто их комбинируют с антибиотиками.
При этом стоит помнить, что многие лекарства не дают существенного лечебного эффекта. Если препарат добавлять в комбикорм, это может привести к гибели птицы, ведь лекарство должно быть распределено равномерно. В домашних условиях сделать это очень сложно.
Известно, что сульфаниламидные препараты также обладают антикокцидными свойствами. Их применяют в течение 3 дней с перерывом на 2 дня. На 1 кг корма достаточно 1 мг препарата. Норсульфазол дают 3 дня по 500 мг на 1 л воды. Следует помнить, что кокцидиоз может поражать одну особь несколько раз при условии, что это разные виды кокцидий.
После выздоровления курица остается паразитоносителем. Она выделяет огромное количество ооцист. Поэтому нужно регулярно убирать помет в птичнике и не допускать контакта между молодняком и взрослыми курицами.
Профилактика и меры безопасности

Самым перспективным направлением в борьбе с заболеванием считается иммунизация.
Однако из-за дороговизны сегодня вакцинируют только несушек и молодняк.
Профилактика помогает избежать распространения заражения и уничтожить кокцидии, которые начали развиваться в организме птицы.
Марганцовокислый калий, гашеная известь, раствор формалина 3%, натриевые и калиевые щелочи в данном случае неэффективны.
Также нужно помнить, что использование только одного препарата не обеспечит успешную профилактику. Для данной цели потребуется минимум 4 разных средства. При этом нужно обращать внимание на то, чтобы их механизм действия отличался.
Повысить иммунитет курицы можно благодаря полноценному питанию. Лучше всего выбирать качественные корма с витаминами и различными питательными добавками.
Проще всего не допустить гибель всего поголовья от кокцидиоза благодаря профилактическим мерам. Вышеуказанные простые рекомендации помогут повысить сопротивляемость пернатых к различным заболеваниям. Также стоит заняться вакцинацией, несмотря на сложность реализации данного метода.
Диагностика. Диагноз устанавливают комплексно с учетом эпизоотологических, клинических данных и патологоанатомических изменений. Их подтверждают лабораторными исследованиями, обнаружением в фекалиях и содержимом кишечника эймерий или стадий их развития -- шизонтов и мерозоитов. Для этого делают мазки из соскобов кишечника или исследуют фекалии по методу Дарлинга, Фюллеборна и др.
При дифференциальной диагностике исключают гистомоноз, боррелиоз, трихомоноз и пуллороз. (Практикум по болезням птиц, 2005).
Диагноз можно поставить лишь при внимательном анализе всех данных по этой болезни. Особенно следует учитывать возраст заболевших птиц. При холере, чуме и спирохетозе, помимо молодняка, болеют и в большом количестве погибают взрослые куры, чего не бывает при кокцидиозе. Решающее значение для диагноза имеют микроскопическое исследование и патологоанатомические данные.
Анализ всего комплекса признаков дает возможность (сугубо ориентировочно) определить и вид возбудителя болезни. (Орлов Н.П., 1956)
Лечение. Для лечения эймериоза предложено значительное количество препаратов - кокцидиостатиков. Однако необходимо иметь в виду, что многие кокцидиостатики вызывают привыкание к себе эймерий и через некоторое время они становятся неэффективными.
Сегодня антиэймериозные средства - это антибиотики, алкалоиды, выделенные из растений, производные различных химических групп и т. д., используемые для угнетения жизнедеятельности или уничтожения эндогенных стадий эймерий.
Классификация учитывает три признака антикокцидийных средств:
Кокцидиостатики по химической структуре подразделяются на:
o антагонисты азотистых оснований (производные холина) - метилбензокват бухинолят, декоквинат;
o производные пиридона - метилхлорпиндол;
o препараты,угнетающие моноаминооксидазу - робинзиден
o антагонисты парааминобензойной кислоты - сульфаниламиды;
o антагонисты цитохрома - нитрофураны;
o производные динитрокарбанилида - никарбазин;
o антибиотики - монензин, лазалоцид, арприноцид и др.
Механизм действия кокцидиостатиков:
· ингибирование процессов биосинтеза;
· замещение витаминов (тиамин, фолиевая кислота, витамин РР, рибофлавин, биотин, витамин К);
· замещение ферментов (цитохром).
При кокцидиозах используют кокцидиостатики двух групп: химические (химкокцид, плурикокцин, диклазурил и др.) и ионофорные антибиотики (одно- и двухвалентные). Механизм действия первых заключается в ингибировании биосинтеза тиамина (витамина B1) у паразитов. Химические кокцидиостатики по своему строению сходны с тиамином, необходимым для жизнедеятельности кокцидий, они быстро проникают в клетку паразита и блокируют активные центры связывания витамина, в результате углеводный обмен нарушается, и паразит погибает. Антикокцидийное действие ионофоров обусловлено их способностью образовывать липофильные комплексы с ионами щелочных металлов и переносить их через клеточную стенку паразита, что приводит к нарушению осмотического баланса и гибели простейших. (Беспалова Н.С., 2006)
В зависимости от действия на эндогенные стадии эймерий, препараты делят на препятствующие и не препятствующие выработке иммунитета. Первые применяют для профилактики эймериоза и дают непрерывно в течение всего периода выращивания и прекращают давать за 3-5 дней до убоя. К этой группе препаратов относят Аватек, Цигро, Цикостат, Мадикокс, Кокцисан 12% гранулят, Монлар 10% гранулят, Кокцистак, Авиакс, Сакокс 120, Элан-когран 100 и др.
Вторая группа препаратов не препятствует выработке иммунитета. Их применяют, как правило, с лечебной целью при появлении первых клинических признаков эймериоза. Это Байкокс, Ампролиум.
Профилактика и меры борьбы. Сложность борьбы с кокцидиозом обусловлена целым рядом биологических особенностей возбудителя, из которых наиболее важны в практическом отношении следующие:
В организме разных видов птиц одновременно могут паразитировать несколько видов кокцидий, различных в иммунологическом отношении, а следовательно, переболевание, вызванное одним видом кокцидий, не предохраняет птиц даже данного вида от заражения другими видами возбудителей кокцидиоза.
Различные виды кокцидий имеют неодинаковую чувствительность к химиопрепаратам из разных классов химических соединений.
Кокцидий обладают способностью к чрезвычайно интенсивному размножению.
Ооцисты весьма устойчивы к воздействию различных физических и химических факторов, а также к изменениям условий внешней среды, где они могут сохраняться в течение года.
Ооцисты кокцидий отличаются высокой устойчивостью кои дезинвазирующим средствам.( Хованских А.Е., Илюшечкин Ю.П., Кириллов А.И., 1990)
Для профилактики кокцидиоза молодняк содержат изолированно от взрослой птицы в хорошо подготовленных сухих помещениях. Лучше всего содержать цыплят до 2-месячного возраста в клетках, на проволочной сетке. Большое значение в профилактике эймериоза имеют очистка помещений, кормушек и их дезинвазия. Для дезинвазии птичников используют 7 %-ный раствор аммиака; 10 %-ный горячий 70 °-ный раствор однохлористого йода; горячую воду и пар (не ниже 80 °С). Спустя 3 ч после применения аммиака и 6 ч после применения однохлористого йода помещение проветривают, а кормушки и поилки моют. (Паразитология и инвазионные болезни сельскохозяйственных животных, 1982). Таким образом, борьба с кокцидиозами в птицеводстве включает качественное выполнение ветеринарно-санитарных мероприятий по подготовке помещений к заселению птицей, проведение специфических мер против ооцист кокцидий и подавление развития паразитов в организме хозяина. Выполнение первых двух задач не решает полностью проблему кокцидиоза, но значительно отдаляет наступление критического уровня обсемененности подстилки.
С 10-дневного возраста рекомендуют, особенно молодняку при содержании его на глубокой подстилке, применять химиопрофилактику. Наибольший успех достигнут в борьбе с эндогенными стадиями развития кокцидий. Однако в последнее время профилактика посредством кокцидиостатиков существенно затруднена, что связано в первую очередь с развитием резистентности у кокцидий к препаратам. К любому из них рано или поздно паразит адаптируется, и информация генетически передается последующим поколениям. Эта проблема актуальна для всех стран мира.
Чтобы избежать связанных с адаптацией потерь, во всем мире постоянно ведется мониторинг чувствительности к препаратам полевых культур. В США, по данным публикаций, адаптация кокцидий кур к препаратам такова: к монтебану - 80% изолятов, к сакоксу - 70, к цикостату - 66, к цигро - 62, к аватеку - 28, к никарбазину - 26 и к клопидоку (фармкокциду) - 24%.
Установили, что в Российской Федерации к клинакоксу и сакоксу адаптировались 60% изолятов, к ампролиуму и цигро - 50, к кокцидину - 40, к авиаксу - 30, к фармкокциду - 10%. И только к никарбазину все культуры были высокочувствительны, потому что этот препарат ранее в птицеводстве страны не применялся.
Параллельно с поиском новых кокцидиостатиков изыскиваются альтернативные средства и методы профилактики. Сейчас практикам предложено 5 вакцин. В состав таких, как кокцивак, культура кокцидий ВНИВИП, иммукокс, входят возбудители кокцидиоза с естественной вирулентностью. Их применение сопровождается кратковременной дачей кокцидиостатика, чтобы предупредить заболевание кокцидиозом цыплят от реинвазии вакцинными штаммами на первом этапе иммунизации. Ливакокс и паракокс созданы из аттенуированных возбудителей, их применение не требует сопровождения кокцидиостатиком. Из-за дороговизны вакцин, трудоемкости их применения сегодня в основном проводят вакцинацию ремонтного молодняка и кур-несушек.
В целях предотвращения потерь необходимо проводить мониторинг ситуации в хозяйстве, для достоверной диагностики, а также профилактические мероприятия.
Читайте также:

