Лабораторная диагностика пастереллеза свиней
Обновлено: 22.04.2024
Пастереллез (геморрагическая септицемия) — инфекционная болезнь млекопитающих многих видов и птиц, характеризующаяся при остром течении симптомами геморрагической септицемии, при подостром и хроническом – крупозной Возбудитель относится к роду Pasteurellа, включающему два самостоятельных вида:
- Pasteurellа multocida (имеет четыре иммунологических типа, патогенных для разных видов животных, А В, Д, Е);
- Pasteurellа haemolytika.
Методы диагностики. Диагноз на пастереллез устанавливают на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений с обязательным бактериологическим исследованием.
Согласно эпизоотологическим данным болеют домашние и дикие животные всех видов (более восприимчив молодняк) и человек. Болезнь проявляется среди кур и кроликов в виде эпизоотии, у животных других видов — в виде энзоотических вспышек. Для пастереллеза характерно формирование стационарных эпизоотических очагов и энзоотичность. При анализе эпизоотической ситуации необходимо учитывать не только вид очага, но и групповую принадлежность возбудителя пастереллёза, так как они являются определяющими эпизоотического процесса.
Заболеваемость и летальность при пастереллёзе сильно варьируют в зависимости от вида и серогруппы пастерелл, вирулентности возбудителя, иммунологической структуры стада, условий содержания и кормления, наличия сопутствующих инфекций. Эпизоотические вспышки пастереллёза с острым проявлением у кр.рог.скота, диких животных вызывает P. multocida типа В (В Африке – тип Е), у птиц – P. multocida типа А. Спорадически (подостро и хронически, по типу энзоотической пневмонии) протекает Пастереллез при участии у телят P. multocida типа А и P. haemolytikа, у свиней - P. multocida типа А и Д и P. haemolytikа.
Болезнь часто регистрируют осенью и весной. Источник возбудителя инфекции — больные и переболевшие животные - пастереллоносители. Для пастереллёза свойственно широкое носительство возбудителя здоровыми животными, а также крысами и мышами. Это может стать причиной спонтанной вспышки пастереллёза без заноса возбудителя извне на фоне воздействия неблагоприятных факторов. У больных животных возбудитель выделяется с истечениями из носа, выдыхаемым воздухом, слюной, фекалиями, молоком.
Клинические признаки болезни зависят от ее течения — сверхострого, острого, подострого и хронического. У больных животных резко повышается температура тела, нарушаются функции дыхательной системы и желудочно-кишечного тракта.
При сверхостром течении клиническая картина не успевает развиться, животное погибает внезапно с признаками нервных и сердечно-сосудистых расстройств. При более затяжном течении наблюдают конъюнктивиты, колиты, поносы, мышечную дрожь. Отмечают серозные, серозно-катаральные риниты, иногда истечения из носовых отверстий с примесью крови, сухой болезненный кашель.
В зависимости от развития патологического процесса различают отечную, грудную, кишечную формы, а в последнее время и менингеальную.
Патологоанатомические изменения зависят от продолжительности и формы болезни. У павших животных обнаруживают геморрагический диатез в большинстве органов. Печень и почки перерождены, с очагами некроза, селезенка слегка опухшая, лимфоузлы увеличены, темно-красного цвета. Легкие отечные, иногда отмечают серозно-фибринозный плеврит. В желудочно-кишечном тракте фибринозно-геморрагическое воспаление.
Лабораторная диагностика включает в себя микроскопию мазков-отпечатков, выделение культур пастерелл и их идентификацию, биопробу. Дифференцируют пастереллез круп.рог. скота и овец от сибирской язвы, пироплазмидозов, эмкара, у молодняка – от стафилококковой и стрептококковой инфекций сальмонеллёза, колибактериоза, респираторных вирусных инфекций (парагриппа-3, инфекционного ринотрахеита). У свиней – от чумы, рожи, сальмонеллёза.
Для исследования в лабораторию направляют 2. 3 трупа мелких животных, от крупных - сердце с перевязанными сосудами, часть селезенки, печени, почек, экссудат из грудной полости и трубчатую кость; при поражении легких — кусочки (5x5 см) на границе нормального и измененного участков, миндалины, бронхиальные, средостенные и заглоточные лимфатические узлы. Материал берут от павших (не позднее 3. 5 ч после гибели) или убитых с диагностической целью животных, не подвергавшихся лечению антибактериальными препаратами.
Для диагностики пастереллеза у птиц в лабораторию направляют кроме свежих трупов 5. 6 живых птиц с явными признаками болезни. Больных птиц убивают в лаборатории и делают высевы из костного мозга, сердца, печени и селезенки.
Мазки-отпечатки из каждого органа фиксируют, окрашивают по Леффлеру или Романовскому—Гимзе и микроскопируют. В мазках из патматериала пастереллы выглядят как овоиды или короткие палочки с закругленными концами и заметной биполярностью, вокруг которых может быть видна прозрачная капсула. В мазках из культур при окраске по Граму бактерии обнаруживают в виде грамотрицательных овоидов или коккобактерий, расположенных одиночно или попарно.
При выделении культур посевы из исходного материала делают в МПБ и на МПА или в бульон и на агар Хоттингера. Выделенные культуры идентифицируют по ферментативным свойствам и подвижности.
Методом биопробы определяют патогенность выделенной культуры и обнаруживают возбудитель в исходном материале.
Двум белым мышам массой 16. 18 г вводят подкожно по 0,2 мл 18. 24-часовой бульонной культуры. Вирулентные штаммы P. multocidа (тип В) вызывают гибель мышей в течение 24. 72 ч; слабовирулентные штаммы серовариантов А и D – в течение 7 сут. P. haemоlytica может вызвать гибель белых мышей только при внутрибрюшинном заражении.
Диагноз считают установленным в случае:
- выделения из исходного материала культуры со свойствами, характерными для возбудителя пастереллеза, и установления ее патогенности на лабораторных животных;
- гибели хотя бы одного лабораторного животного из двух, зараженных исходным материалом и выделения из его органов культуры со свойствами, характерными для возбудителя пастереллеза, если даже в посевах из исходного материала культуры возбудителя не выделено.
Профилактические и оздоровительные мероприятия.Для предупреждения заболевания животных пастереллезом необходимо обеспечить охрану благополучных хозяйств от заноса возбудителя с больными животными, пастереллоносителями, с кормами и т.д. Для этого:
- всех ввозимых в хозяйство животных выдерживают в профилактическом карантине в течение 30 дней;
- комплектуют стадо только животными из хозяйств, благополучных по инфекционным болезням;
- не допускают контакта животных общественного и частного секторов;
- на фермах оборудуют санпропускники и обеспечивают обслуживающий персонал сменной одеждой и обувью;
- на территориях пастбищ организуют мелиоративные работы, так как возбудитель пастереллеза в заболоченных мелких водоемах может сохраняться до 6 мес;
- систематически проводят дератизацию на территории ферм.
В ранее неблагополучных по пастереллёзу животных хозяйствах всех животных вакцинируют против пастереллеза в течение одного года, руководствуясь наставлением по применению соответствующей вакцины и комплектуют только вакцинированным против пастереллеза поголовьем.
При установлении диагноза на пастереллез хозяйство объявляют неблагополучным по данной болезни и вводят ограничения.
Чтобы купировать эпизоотический очаг и ликвидировать заболевание:
- осматривают с термометрией всех животных неблагополучной группы. Больных и подозрительных по заболеванию изолируют и закрепляют за ними обслуживающий персонал, который обеспечивают спецодеждой, обувью, дезсредствами, аптечкой, рукомойником, мылом, полотенцем;
- всем больным и контактировавшим с ними животным вводят противопастереллезную сыворотку типоспецифическую или поливалентную (в зависимости от вида животного и эпизоотической ситуации); лучше сочетанное использование сыворотки и антибиотиков (террамицин, окситетрациклин, биомицин (хлор-тетрациклин), тетрациклин, стрептомицин, левомицетин, пролонгированные антибиотики (дибиомицин, дитетрациклин, дистрептомидазол, бициллин-3)), а также – сульфаниламидных препаратов, глюкозы и других симптоматических средств. Хорошие результаты дает применение пастереллезного фага или полифага;
- поросятам и ягнятам, находящимся под больными пастереллезом матками, вводят гипериммунную противопастереллезную сыворотку в лечебной дозе и назначают курс антибиотиков тётрациклинового ряда. Телятам до 3-месячного возраста, находящимся на территории неблагополучной фермы, вводят сыворотку и дают молоко только от здоровых коров.
- через 14 дней после введения сыворотки всех животных, достигших прививочного возраста, вакцинируют против пастереллеза. Для иммунизации используют одну из далее указанных вакцин в соответствии с наставлением по их применению.
Крупный рогатый скот и буйволов вакцинируют эмульгированной вакциной против пастереллеза крупного рогатого скота, буйволов и овец.
Мелкий рогатый скот - преципитированной формолвакциной против пастереллеза овец и свиней или эмульгированной вакциной против пастереллеза крупного рогатого скота, буйволов и овец.
Кроликов - формолвакциной против пастереллеза кроликов.
Нутрий - сапонинформолвакциной против пастереллеза нутрий.
Свиней - преципитированной формол-вакциной против пастереллеза овец и свиней, эмульгированной вакциной против пастереллеза свиней. Для вакцинации супоросных свиноматок и поросят в возрасте менее 2 мес используют концентрированную поливалентную формолквасцовую вакцину против паратифа, пастереллеза и диплококковой септицемии поросят (ППД) или поливалентную инактивированную вакцину против сальмонеллеза и пастереллеза свиней. В хозяйствах угрожаемой зоны применяют эмульгированную вакцину против пастереллеза свиней.
- в хозяйствах, неблагополучных по пастереллезу, обязательны систематические дезинфекция, дератизация, дезинвазия, дезинсекция. Текущая дезинфекция должна быть ежедневной: после утренней уборки помещения, где содержатся больные и подозрительные по заболеванию животные, и все, с чем они соприкасаются, дезинфицируют одним из следующих средств: 10.. .20%-й взвесью свежегашеной извести или раствором хлорной извести, содержащим 2 % активного хлора, 2%-м раствором гидроксида натрия, 3%-м раствором креолина, 0,5%-м раствором формальдегида.
- трупы животных, павших от пастереллеза, сжигают или перерабатывают на утильзаводах, либо обеззараживают в биотермических ямах; шкуры от павших или убитых животных дезинфицируют 1%-м раствором соляной кислоты, разведенной 20%-м раствором поваренной соли.
- спецодежду дезинфицируют текучим паром при экспозиции 1,5 ч в паровых камерах, кипячением в 2%-м растворе кальцинированной соды в течение 1 ч или погружением на 2 ч в 1%-й раствор хлорамина при расходовании 5 л раствора на 1 кг вещей. Резиновую и кожаную обувь погружают на 2 ч в 5%-й раствор хлорамина или в 4%-й раствор формальдегида.
Ограничения с хозяйства снимают через 14 дней со дня последнего случая заболевания пастереллезом и после поголовной вакцинации, а также выполнения организационно-хозяйственных и ветеринарно-санитарных мероприятий и заключительной дезинфекции.
После снятия ограничений животных вакцинируют против пастереллеза в течение одного года. Вновь поступившее поголовье иммунизируют в хозяйствах-поставщиках или в период профилактического карантина.
Птиц, больных пастереллёзом, не лечат, всю птицу неблагополучного птичника целесообразно забить.
Основана на результатах бактериологического исследования.
1. Общие положения
Пастереллёз – болезнь многих сельскохозяйственных, диких животных и птиц, в зависимости от вида возбудителя характер патологии и течение болезни варьирует. Возбудителями пастереллёзов являются различные виды бактерий рода Pasteurella, семейства Pasteurellaceae. Патогенные свойства доказаны не у всех пастерелл, наибольшее значение в патологии животных имеют следующие виды.
P. multocida – серовара –B является первичным возбудителем геморрагической септицемии различных видов жвачных животных. P. multocida серовара D – обуславливает, обычно как вторичный агент, пневмонии и атрофического ринита свиней. P. multocida серовара А – у крупного рогатого скота участвует в развитии синдрома “транспортной лихорадки”, вызывает пневмонию телят и, иногда, маститных коров, у овец этот серовар пастерелл вызывает пневмонию и маститы, у свиней пневмонию (часто как первичный агент), у кроликов – плевропневмонию, “заразный насморк” , генитальные инфекции, у птицы – “холеру” (первичная инфекция). P. multocida серовара Е – является этиологическим агентом эпизоотической геморрагической септицемии крупного рогатого скота и буйволов в Африке. У индеек изолирована P. multocida типа F , но её этиологическая роль до сих пор не выяснена.
P. haemolytica биотипа А является как первичный или вторичный агент пневмоний, участвует в развитии синдрома “транспортной лихорадки” крупного рогатого скота. P. haemolytica биотипа Т вызывает септицемию у ягнят 5-12 месячного возраста.
У свиней в кишечном тракте обитает P. aerogenes , которую иногда выделяют при абортах данного вида животных.
P. anatipestifer рассматривают как возбудитель фибринозного полисерозита в 1-8 – недельных уток.
У лошадей респираторную патологию, включая пневмонию, может обуславливать P. caballi.
Роль в патологии животных у ряда пастерелл на данное время не доказана.
У собак и кошек периодически изолируют P. pneumotropica , P. canis, P. dagmatis, P, stomatis, но их этиологическая роль в патологиях не доказана.
2. Бактериологическое исследование
2.1. Материал для исследования
Характер материала определяется наблюдаемым синдромом болезни. При септических явлениях объектом исследования являются части селезёнки, печени, почек, сердце с перевязанными сосудами, лимфатические узлы, трубчатая кость, трупы мелких животных направляют в лаборатории целиком. В случае поражения лёгких берут фрагменты на границе здоровой и поражённой ткани, экссудат из рудной полости, регионарные лимфатические узлы, миндалины. Прижизненно для исследования берут гной, экссудат, пробы со слизистой носовой полости, молоко от животных с маститом.
2.2. Микроскопическое исследование исходного материала.
Мазки из материала окрашивают по Грамму и одним из методов позволяющих обнаружить капсулу (Романовского-Гимза, Асффлеру и т.д.). В препаратах пастереллы видны как короткие с закругленными краями (овоидные) грамотрицательные палочки, размер 0,3-1,0 х 1-2 мкм окружённые капсулой, располагающиеся одиночно, парами, в виде коротких цепочек. Достаточно характерно биполярное окрашивание клеток пастерелл, но следует иметь ввиду что ряд энтеробактерий также проявляет склонность к биполярной окраске.
2.3. Выделение и идентификация культур пастерелл.
2.3.1. Посев исследуемого материала на питательные среды, культивирование.
Пастереллы – факультативные анаэробы, температурный оптимум 37 о С (диапазон 25-40 о С), птичьи штаммы растут при 42 о С, оптимум рН питательных сред 7,2-7,4. Для первичного культивирования используют обычные МПА, МПБ, бульон и агар Хоттингера, но лучше обогащённые среды: кровяной, сывороточный агар и бульон. Следует отметить, что большинство штаммов P. avium обладают потребностью в НАД и для культивирования этого вида пастерелл необходимо использовать специальные питательные среды. (см. “Гемофильные бактерии”). Для выделения пастерелл из назальных мазков целесообразно использовать элективную среду клиндамицином. P. anatipestifer требует для своего роста обогащённые среды и 5-10% СО2. Инкубирование посевов проводят в течение 24-48 часов, при при отсутствии роста до 4-5 суток.
Цель занятий. Ознакомить студентов с лабораторной диагностикой пастереллеза, гемофилезного полисерозита и актинобациллезной пневмонии свиней, основными свойствами возбудителей, биопрепаратами.
Оборудование и материалы. Культуры P. multocida в МПБ, на МПА, демонстрация — штативы с тестами, характеризующими видовые ферментативные признаки P. multocida (включая биовары), культуры A. pleuropneumoniae и Н. parasuis на кровяном МПА в чашках Петри с феноменом сателлитного роста, трупы мышей, павших после заражения P. multocida, пипетки Пастера, красители для окраски по Граму, Гинсу, демонстрация — чашки Петри с феноменом подавления роста культуры P. multocida серовара А в присутствии S. aureus, пробирки с отрицательной и положительной трипафлавиновой пробой с культурами P. multocida сероваров А и D, МПА и МПБ в пробирках.
Пастереллез (геморрагическая септицемия). Инфекционная болезнь многих видов млекопитающих и птиц. При остром течении характеризуется септицемией, при подостром и хроническом — в основном поражением легких.
Возбудитель — Pasteurella multocida (включает в себя три подвида), род Pasteurella, семейство Pasteurellaceae.
Лабораторная диагностика пастереллеза основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на культуральные среды и методом биопробы, идентификацию возбудителя по культурально-морфологическим, ферментативным, серологическим и патогенным свойствам.
Материал для исследования. В лабораторию направляют селезенку, печень, почку, кровь сердца, лимфатические узлы, пораженные участки легких и регионарные лимфатические узлы. При необходимости материал консервируют 30%-м водным раствором глицерина, трубчатую кость заворачивают в марлю, пропитанную 5. 10%-м раствором формалина.
Микроскопия препаратов из исходного материала. Мазки-отпечатки окрашивают по Граму и одним из методов для выявления капсулы. Пастереллы представляют собой грамотрицательные короткие палочковидные бактерии размером (0,3. 2) х (0,2. 0,3) мкм, без спор и жгутиков, образуют капсулу.
Возбудитель в препарате из материала обнаруживают в форме мелких (0,3x1,5 мкм) грамотрицательных коротких палочковидных капсулообразующих бактерий с закругленными концами вплоть до коккобактерий. При окраске синькой Леффлера бактериальные клетки более интенсивно окрашены в концевых частях (биполярная окраска). Клетки располагаются единично, попарно, короткими цепочками (рис. 103).

Выделение и идентификация культуры возбудителя. Возбудитель — факультативный анаэроб, температурный оптимум 37 °С (диапазон 25. 40 °С), штаммы птиц растут при 42 ºС, рН 7,2. 7,4. Материал засевают на МПА, в МПБ, лучше — на кровяной или сывороточный МПА, так как нередко возбудитель в первичных посевах плохо растет или не растет на простых питательных средах. Посевы инкубируют в течение 24. 48 ч, при отсутствии роста—в течение 4. 5 сут.

У культур с типичными культурально-морфологическими признаками исследуют ферментативные свойства. P. multocida расщепляет маннит, ксилозу, не разлагает мальтозу, образует индол, орнитиндекарбоксилазу, не синтезирует уреазу, не проявляет зависимости от V-ростового фактора ДПН (дифосфопиридин-нуклеотид). Внутри вида P. multocida дифференцируют по ферментативным особенностям на три подвида: P. multocida subsp. multocida ферментирует сорбит и не разлагает дульцит; P. multocida subsp. septica не ферментирует сорбит и дульцит; P. multocida subsp. gallicida ферментирует сорбит и дульцит.
Серологические свойства изучают для дифференциации культур P. multocida по серовариантной принадлежности. Известны четыре серовара P. multocida (А, В, D, Е). В Европе эпизоотологическое значение имеют три серовара: В, D, А. Их идентифицируют в РНГА по капсульным антигенам, но чаще по присущим сероварам D и А особенностям химического состава клеток. Для этого устанавливают присутствие гиалуроновой кислоты в капсульном веществе и склонность бактерий агглютинировать в растворе трипафлавина.
Трипафлавиновая проба: исследуемую культуру выращивают в бульоне Хоттингера (3 мл) в течение 24 ч, центрифугируют, затем удаляют 2,5 мл культуральной жидкости, седимент ресуспенди-руют и добавляют 0,5 мл водного раствора трипафлавина (1:1000). Суспензию бактерий выдерживают при комнатной температуре 10. 20 мин. Учет результатов: если суспензия стабильна, культуру относят к сероварам А или В; если сформирован осадок, культуру относят к серовару D.
Биопроба. Метод используют для выделения культуры возбудителя из исследуемого материала и определения вирулентности чистых культур.
Исследуемым материалом от крупного рогатого скота, свиней, овец заражают белых мышей и кроликов; материалом, полученным от птиц, заражают голубей, кур, уток. Кроликов перед биопробой исследуют на пастереллоносительство: в течение трех дней вводят интраназально по две капли 0,5%-го водного раствора бриллиантового зеленого. Появление гнойного истечения из носовой полости указывает на пастереллоносительство, и таких животных из опыта исключают.
Суспензию тканевого материала, разведенную физиологическим раствором (1:10), вводят кроликам подкожно по 0,5 мл, белым мышам подкожно по 0,2 мл, голубям внутримышечно по 0,3 мл. При наличии в материале возбудителя животные погибают через 18. 36 ч. Трупы животных подвергают бактериологическому исследованию.
Биопрепараты. Вакцина эмульгированная против пастереллеза крупного рогатого скота представляет собой инактивированные 0,25%-м раствором формальдегида клетки пастерелл серовара В в водно-масляной эмульсии. Контролируют на стерильность, безвредность (белые мыши, кролики) и иммуногенность на кроликах. Кроме того, готовят эмульгированные вакцины против пастереллеза свиней, кроликов, нутрий.
Преципитированная формолвакцина против пастереллеза овец и свиней представляет собой выращенные в реакторе в бульоне Хоттингера культуры пастерелл серовара В, инактивированные формальдегидом, сорбированные алюмокалиевыми квасцами. Контролируют на стерильность, безвредность (белые мыши), иммуногенность на голубях.
Гипериммунную сыворотку против пастереллеза крупного рогатого скота, буйволов, овец и свиней получают гипериммунизацией волов. Контролируют на стерильность, безвредность (белые мыши, морские свинки), на специфическую активность на белых мышах, которым ее вводят по 0,1; 0,05 и 0,03 мл. Сыворотку признают активной, если при контрольном заражении остаются живыми мыши, привитые первыми двумя дозами препарата.
Полужидкая гидроокисьалюминиевая формолвакцина против пастереллеза крупного рогатого скота и буйволов представляет собой культуру пастерелл серовара В, выращенную в полужидкой агаровой среде в реакторе, инактивированную формальдегидом и сорбированную на геле гидроксида алюминия. Контролируют так же, как и преципитированную формолвакцину.
Сухие вакцины против пастереллеза птиц из штаммов АВ и К Краснодарской НИВС представляют собой лиофилизированные реакторные культуры вакцинных штаммов АВ и К. Контролируют на чистоту и типичность роста, безвредность и иммуногенность на курах.
Кроме того, выпускают инактивированные вакцины, содержащие три серовара P. multocida (А, В, D).
Гемофилезный полисерозит. Септическое заболевание поросят раннего послеотъемного периода. Характеризуется серозно-фибринозным воспалением плевры, перикарда, брюшины, суставов, иногда отмечают менингоэнцефалит.
Возбудитель — Haemophilus parasuis, род Haemophilus, семейство Pasteurellaceae.
Лабораторная диагностика гемофилезного полисерозита основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим, ферментативным и патогенным свойствам.
Материал для исследования. Стерильно отбирают серозно-фибринозный экссудат из перитонеальной, плевральной, перикардиальной полостей, пораженных суставов, а также пораженные серозные оболочки.
Микроскопия препаратов из исходного материала. Мазки окрашивают по Граму и на капсулы бактерий. Н. parasuis— мелкие тонкие грамотрицательные палочки, без спор и жгутиков, образуют капсулу. Возбудитель обнаруживают в виде полиморфных грамотрицательных палочек, диплобактерий, коротких цепочек из палочек, а также в виде нитей.
На кровяной МПА (5 % крови барана, кролика, лошади) исследуемый материал засевают шпателем по всей поверхности среды. Затем по диаметру чашки в виде двух прямых линий под углом 90° засевают культуру негемолитического штамма S. epidermidis или Е. coli. Посевы инкубируют при 37. 38 ºС 24. 48 ч в условиях обычной атмосферы.

Рис. 105. Рост сателлитиых колоний гемофильных бактерий:
б— мелкие сателлитные колонии гемофильных бактерий
У культур исследуют уреазную активность посевом на среду Заксе: раствор А: 96%-й этанол —2 мл и дистиллированная вода —4 мл; раствор Б: дистиллированная вода — 100 мл, дигидрофосфат калия —0,1 г, гидрофосфат калия —0,12 г, хлорид натрия—0,5 г, добавляют 1 мл 2%-го раствора фенолового красного. Смешивают растворы А и Б в соотношении 1:19; смесь разливают по 0,1 мл в уленгутовские пробирки и вносят бактериологическую петлю исследуемой культуры. Пробирки выдерживают при 37. 38 °С 30. 40 мин и учитывают результат. В положительном случае раствор за счет расщепления мочевины и защелачивания среды приобретает малиново-красный цвет. Н. parasuis уреазу не вырабатывает.
Биопроба. Метод применяют для определения вирулентных свойств культур Н. parasuis. Суточной агаровой культурой в дозе 2*10 9 микробных клеток заражают внутрибрюшинно морских свинок массой 300. 350 г. Наблюдение за животными ведут в течение 5 сут.
Актинобациллезная (гемофилезная) плевропневмония. Инфекционная болезнь свиней преимущественно двух-трехмесячного возраста и откормочных животных. Характеризуется развитием фибринозно-геморрагической некротизирующей пневмонии и фибринозного плеврита.
Возбудитель — бактерия Actinobacillus pleuropneumoniae, род ActinobaciUus, семейство Pasteurellaceae.
Лабораторная диагностика актинобациллезной плевропневмонии свиней основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим, ферментативным и серологическим свойствам.
Материал для исследования. В лабораторию направляют кусочки пораженных легких, средостенные и бронхиальные лимфатические узлы.
Микроскопия препаратов из исходного материала. Мазки-отпечатки окрашивают по Граму и одним из методов для выявления капсулы. A. pleuropneumoniae — короткие грамотрицательные палочки с закругленными концами, чаще располагаются в виде парных коккобактерий, могут образовывать короткие цепочки, нитевидные формы, формируют капсулу, спор нет. Возбудитель в исследуемом материале обнаруживают в форме мелких коккобактерий, коротких палочек, окруженных капсулой, расположенных единично, парами, в виде коротких цепочек (рис. 106, 107).

Выделение и идентификация культуры возбудителя. Факультативный анаэроб, температурный оптимум 37. 38 °С, рН 7,2. 7,4. Известны два биовара возбудителя: ДПН-зависимый (Первый биовар), ДПН-независимый (Второй биовар).
На сывороточно-дрожжевом МПА колонии возбудителя серо-белые, полупрозрачные, диаметром 1. 2мм, правильной круглой формы, с ровными краями, гладкой поверхностью. При исследовании колоний на этой среде в пучке косопроходящего света в бинокулярной лупе они видны как ярко-зеленые с красноватым оттенком, при наблюдении в косопроходящем свете невооруженным глазом флуоресцируют.
В сывороточно-дрожжевом МПБ возбудитель растет с равномерным, средней интенсивности помутнением среды, позднее (48. 72 ч) на дне пробирки образуется серо-белый осадок.
У культур с типичными для A. pleuropneumoniae признаками изучают ферментативные свойства. Возбудитель выделяет уреазу, щелочную фосфатазу, ДПН-зависимый (Первый биовар), разлагает с образованием кислоты без газа ксилозу, маннит, не утилизирует сорбит, салицин, мелибиозу, цитраты, не образует индол.
Известны 12 сероваров возбудителя. При необходимости устанавливают серовариантную принадлежность культуры в РДП, пробирочной РА.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Описать культуральные свойства P. multocida, Н. parasuis, A. pleuropneumoniae.
Приготовить мазки из культур P. nultocida, Н. parasuis, A. pleuropneumoniae, окрасить по Граму, Гинсу, промикроскопировать, зарисовать.
Изучить ферментативные свойства P. multocida, Н. parasuis, A. pleuropneumoniae и методы определения сероваров пастерелл (демонстрация).
Провести бактериологическое исследование трупов мышей, зараженных P. multocida.
Каковы морфологические и тинкториальные свойства возбудителей пасте-реллеза, гемофилезного полисерозита и актинобациллезной плевропневмонии?
Каковы ферментативные свойства P. multocida, Н. parasuis, A. pleuropneumoniae?
Какими методами определяют ДПН-зависимость Н. parasuis и A. pleuropneumoniae?
1.1. Пастереллезы - различные по локализации и характеру течения инфекционные болезни сельскохозяйственных, домашних и диких животных, птиц и человека, вызываемые бактериями рода Pasteriolla который включает в себя шесть видов: P.multocida, P.haemolytica, P.ureae, P.pneumotropica, P.aerogenes, P.gallinarum.
1.2. Ведущее этиологическое значение в инфекционной патологии животных и птиц принадлежит двум видам: P.muluocide, P.haemolytice.
P.muluocida является возбудителем геморрагической септицемии животных, холеры птиц, а также легочных пастереллезов, осложняющих респираторные инфекции вирусной и микоплазменной этиологии.
P.haemoytica вызывает у крупного рогатого скота и овец всех возрастов пневмонии, а также септицемию новорожденных ягнят.
Кроме перечисленных заболеваний эти два вида могут выделяться у коров и свиноматок при абортах, у овец и коров - при маститах, у телят и ягнят - при артритах и других локальных патологических процессах.
1.3. Краткие сведения о других видах пастерелл.
P.pneumotropica является возбудителем энзоотического заболевания мышей, кроликов и других лабораторных грызунов, которое проявляется поражением органов дыхания и образованием абсцессов.
P.ureae часто выделяют от человека при хроническом атрофическом насморке.
P.gallinarum встречается как комменсал верхних дыхательных путей птиц и иногда крупного и мелкого рогатого скота; имеет низкую вирулентность и чаще ассоциирует с хроническими респираторными инфекциями птиц.
P.aerogenes является постоянным обитателем кишечного тракта свиней.
1.4. Диагноз на пастереллезы устанавливают на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторного исследования.
1.5. Лабораторная диагностика пастереллезов включает микроскопию мазков и отпечатков, выделение культур пастерелл и их идентификацию и при необходимости постановку биопроб.
1.6. Для исследования в лабораторию направляют 2 - 3 трупа мелких животных, от крупных животных - сердце с перевязанными сосудами, части селезенки, печени, почек, экссудат из грудной полости и трубчатую кость. При поражении легких берут также их кусочки (5×5 см) на границе нормального и измененного участков, миндалины, бронхиальные, средостенные и заглоточные лимфатические узлы.
Патологический материал берут от павших (не позднее 3 - 5 ч после гибели) или убитых животных, не подвергавшихся лечению антибактериальными препаратами.
Для диагностики пастереллеза у птиц в лабораторию направляют, кроме свежих трупов, 5 - 6 живых птиц с явными признаками болезни. Больную птицу убивают в лаборатории и делают высевы из костного мозга, сердца, печени и селезенки.
1.7. Взятие и доставку материала осуществляют в соответствии с действующими Правилами взятия патологического материала, крови, кормов, и пересылки их для лабораторного исследования.
2.1. посевы из патологического материала, перечисленного в п. 1.6, делают в МПБ и на МПА или бульон и агар Хоттингера рН 7,2 - 7,4 с добавлением 10 % нормальной сыворотки крови лошади (см. приложение пп. 1 - 4) или 5 - 10 % аминопептида-2.
2.1.1. Посев в пробирки с жидкими и твердыми питательными средами проводят пастеровской пипеткой. Пробирки с посевами инкубируют при 37 - 38° в течение 20 - 48 часов.
2.1.2. Одновременно с посевами из каждого органа делают мазки-отпечатки, фиксируют 10 - 15 мин смесью равных объемов этилового спирта и эфира, окрашивают по Леффлеру или Романовскому-Гимза и микроскопируют. В мазках из патологического материала пастереллы выглядят овоиды или короткие палочки с закругленными концами и заметной биполярностью, вокруг которых может быть видна прозрачная капсула.
2.2. В жидких питательных средах рост пастерелл сопровождается сначала слабым помутнением, затем через 24 - 36 часов возможно просветление среды и выпадение на дно пробирки осадка, поднимающегося при встряхивании в виде косички.
На сывороточном агаре или агаре с аминопептидом-2 пастереллы растут в виде прозрачных, средней (диаметром до 3 мм), округлых с ровными краями колоний слизистой консистенции, серого цвета.
На простых питательных средах без добавления сыворотки крови пастереллы растут не всегда удовлетворительно.
У выделенных культур изучают культуральные, тинкториальные и морфологические свойства. В мазках из культур при окраске по Граму пастереллы имеют вид грамотрицательных овоидов или коккобактерий, расположенных одиночно и попарно.
Идентификацию выделенных культур проводят по ферментативным свойствам и подвижности.
2.3.1. Суточную агаровую культуру высеевают в среды Гисса с глюкозой, маннитам, сахарозой, маннозой, в ПМА, молоко, желатин, на кровяной сывороточной МПА или агар Хоттингера (см. приложение п. 5), в МПБ с 1 % нитрата калия, в среду с мочевиной (см. приложение п. 6).
2.3.2. Для определения редукции нитратов исследуемые культуры засевают в МПБ с 1 % нитрата калия и выращиванием в течение 48 - 72 ч.
Затем в пробирку добавляют 1 см 3 2 %-ного водного раствора крахмала, 1 см 3 1 %-ного раствора йодистого калия и 1 - 2 капли 5 %-ного водного раствора серной кислоты и взбалтывают.
При положительной реакции среда приобретает окраску от темно-синего до коричневого цвета; при отрицательной - цвет среды желтый или слабо синий.
2.3.3. Индол выявляют с помощью индикаторных бумажек или по методу Легаль-Вейла. Индикаторные бумажки готовят из полосок фильтровальной бумаги длиной 10 - 12 см, пропитывая их горячей щавелевой кислотой, высушивают в термостате и хранят в банке с притертой пробкой.
С целью выявления индола в пробирку с МПБ после засева культуры под ватную пробку помещают полоску индикаторной бумажки с таким расчетом, чтобы нижний ее конец не касался среды, и инкубируют при 37 °С 24 - 72 ч. При выделении индола нижняя часть бумажки приобретает розовую окраску.
Метод Легаль-Вейла. В пробирку с суточной бульонной культурой пастерелл вносят 4 - 5 капель 5 %-ного водного раствора нитропруссида натрия, перемешивают и добавляют вначале такой же объем 40 %-ного водного раствора N2OH, а спустя 1 - 2 мин 4 - 5 капель ледяной уксусной кислоты. При наличие индола бульонная культура приобретает сине-зеленую окраску.
2.3.4. Для определения уреазы в пробирку, содержащую среду с мочевиной, закапывают 2 - 3 капли 24-часовой изучаемой бульонной культуры. Посевы культивируют 20 - 24 ч. при 37 °С. При наличии фермента уреазы происходит покраснение среды.
2.3.5. Все виды пастерелл неподвижны, не свертывают молоко, не разжижают желатин, редуцируют нитраты, ферментируют с образованием кислоты без выделения глаза глюкозу, маннозу, сахарозу.
P.agrogenes в отличие от других видов ферментирует углеводы с выделением газа.
На кровяном сывороточном МПА или агаре Хоттингера P.haemolytica образует колонии с отчетливой зоной гемолиза, которая лучше просматривается после снятия колонии со среды. Остальные виды пастерелл гемолиза не вызывает.
2.3.6. Основные дифференцирующие признаки видов рода пастерелла представлены в таблице.
Пастереллез – острое зоонозное инфекционное заболевание бактериального генеза. Протекает с вовлечением кожи, подкожной клетчатки, суставов и костей. Состояние проявляется высокой лихорадкой, выраженной интоксикацией, поражением внутренних органов; описаны случаи хронического течения. Диагностика патологии проводится преимущественно бактериологическими методами, в качестве вспомогательных применяются серологические методики. Лечение пастереллеза включает этиотропную антибактериальную терапию, дезинтоксикационные, жаропонижающие и другие симптоматические средства.
МКБ-10
Общие сведения
Пастереллез (геморрагическая септицемия) относится к инфекциям с контактным механизмом передачи. Впервые нозология была описана в 1878 году. Бактериальная природа возбудителя была установлена в 1880 году Луи Пастером, в честь которого и была названа данная инфекционная патология. Пастереллез распространен повсеместно, четкой сезонности у людей не имеет, заболеваемость преимущественно спорадическая. Группами риска считаются сельскохозяйственные работники, ветеринары, лица пожилого возраста, больные сахарным диабетом, циррозом печени, ХОБЛ, ВИЧ-инфекцией в стадии СПИДа, патологиями сердечно-сосудистой системы и злокачественными новообразованиями, а также пациенты, проходящие гемодиализ. Считается, что пастереллезу наиболее подвержены люди в возрасте 10-19 лет, заболевание чаще регистрируется среди женщин.

Причины
Возбудителем инфекции является бактерия Pasteurella multocida, продуцирующая экзотоксин. Пастереллы устойчивы в окружающей среде, до 2-3 недель сохраняются в воде и навозе, до 4-12 месяцев – в трупах животных и замороженном мясе. Погибают при воздействии солнечного света, кипячении, обработке дезинфицирующими средствами. Источниками инфекции становятся бактерионосители и больные сельскохозяйственные, домашние животные и птицы. Чаще всего пастереллез регистрируется у крупного рогатого скота, кур, кроликов и буйволов, при этом пастереллоносительство отмечается у 80% кошек, 70% коров, 50% овец и кроликов, 45% овец, 35% куриц в неблагополучных хозяйствах. Пастереллы выделяются с калом, мочой, носовым отделяемым, кровью, молоком животного, заражение человека обычно происходит при укусах и оцарапывании кожи кошками и собаками. Описаны воздушно-капельный и трансплацентарный пути инфицирования; предполагается возможность трансмиссивной передачи пастереллеза при укусах зараженных слепней.
Патогенез
При попадании бактерий через поврежденные кожу и слизистые образуется первичный очаг воспаления. Активное размножение пастерелл, выделение экзотоксина и продукты жизнедеятельности микробов провоцируют скопление иммунокомпетентных клеток, развитие гнойного процесса, тромбозы мелких сосудов, отек. Проникновение инфекционных агентов вглубь дермы и подлежащих тканей приводит к распространению процесса на кости и суставы, возникновению артритов и остеомиелита. Гематогенная диссеминация пастерелл наблюдается при вовлечении стенок кровеносных сосудов и проникновении возбудителей в системный кровоток. При попадании в кровь большого количества экзотоксина, продуктов распада бактерий и иммунных клеток возможно развитие инфекционно-токсического шока. Во внутренних органах пастереллы продолжают активно размножаться, нарушая структуру клеток и тканей, что приводит к критическим функциональным расстройствам.
Классификация
Пастереллез протекает остро или хронически. Обычно изменения локализуются в пределах входных ворот инфекции либо приобретают вид вялотекущего воспалительного гнойного процесса. Гематогенное распространение возбудителя возможно только при истощении защитных сил организма. В основе классификации лежит степень инвазивности патологии:
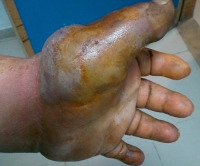
- Кожная форма. Самая распространенная разновидность болезни. Представляет собой гнойное поражение кожи на месте укуса, ослюнения либо царапины, других повреждений кожных покровов, оставленных больным животным, с тенденцией к распространению вглубь подлежащих тканей.
- Легочная форма. При аэрогенном механизме заражения может возникать первично, но чаще является следствием гематогенной диссеминации возбудителя. Клиническая картина обусловлена воспалением стенки бронхов, поражением альвеолярного дерева и соединительной ткани.
- Септическая форма. Жизнеугрожающее состояние, при котором происходит контаминация организма с массивной бактериемией. В пораженных органах развиваются дисфункциональные изменения вплоть до полного прекращения деятельности.
Симптомы пастереллеза
При недостаточном иммунном ресурсе организма возбудитель распространяется по организму с формированием висцеральных гнойных очагов. Лихорадка усиливается, приобретает волнообразный характер. Нарастают признаки интоксикации, Отмечается сильная головная боль, нарушения или изменения сознания, возможны судороги и параличи. Нередко возникает шок, сопровождающийся резким снижением артериального давления, потерей сознания, отсутствием мочевыделения, иногда – спонтанными кровотечениями.
Осложнения
Наиболее частыми осложнениями пастереллеза являются гнойные поражения кожи, мышц, подкожной клетчатки (абсцессы, флегмоны), суставов и сухожильно-связочного аппарата (бурситы, тендовагиниты, артриты), костных структур (остеомиелиты). Хронические бронхоэктазы приводят к амилоидозу внутренних органов. Возможна септикопиемия с формированием гнойных очагов в различных органах, тромбогеморрагические проявления, инфекционно-токсический шок. Описаны единичные случаи фульминантной пурпуры с высокой летальностью. В исходе гнойных артритов (особенно – поражения коленного сустава) нередко наблюдается нарушение функции, обуславливающее необходимость эндопротезирования.
Диагностика
Диагноз устанавливается инфекционистом. В зависимости от имеющейся симптоматики могут потребоваться консультации терапевта, дерматовенеролога, хирурга. При поражении респираторного тракта необходим осмотр пульмонолога, фтизиатра, при наличии жизнеугрожающих состояний – реаниматолога. Перечень диагностических мероприятий включает следующие объективные, лабораторные и инструментальные методики:
- Физикальное исследование. В очаге поражения при кожной форме обнаруживается участок гиперемии, резкая болезненность, отек кожи, пустула с мутным содержимым, струп, нередко определяется флюктуация. При поражении суставов отмечается увеличение их размеров, ограничение движений, вынужденное положение конечности. Интерстициальная пневмония при аускультации проявляется жестким дыханием, крепитацией, укорочением перкуторного звука. При бронхоэктазах наблюдается диффузное ослабление легочного дыхания с обилием влажных хрипов, уменьшающихся при откашливании.
- Лабораторные исследования. В общем анализе крови при пастереллезе выявляется лейкоцитоз с палочкоядерным сдвигом влево, увеличение СОЭ, нередко – тромбоцитопения, анемия. Изменения в биохимических показателях включают повышение АЛТ, АСТ, общего билирубина, СРБ, мочевины, креатинина, снижение общего белка, нарушения со стороны свертывающей системы. Общеклиническое исследование мочи подтверждает увеличение плотности, микрогематурию, лейкоцитурию, реже пиурию. В ликворограмме при патереллезных менингоэнцефалитах обнаруживается нейтрофильный плеоцитоз, клеточно-белковая диссоциация.
- Выявление инфекционных агентов. Основной методикой является ПЦР. Бактериологические методы посева на питательные среды используются с любым биологическим материалом, полученным от больного (отделяемое кожных язв, кровь, спинномозговая жидкость, пунктат абсцесса), включая секционный. ИФА и другие серологические методики необходимы для ретроспективной диагностики пастереллеза, поскольку требуют исследования парных сывороток с интервалом не менее 14 дней для детекции роста титра антител.
- Лучевая диагностика. При поражениях респираторного тракта назначается рентгенография грудной клетки. Часто проводится УЗИ мягких тканей, суставов, костных структур с целью своевременного обнаружения гнойных процессов. Для визуализации септикопиемических очагов в области внутренних органов используется УЗИ органов брюшной полости, почек, малого таза. МРТ и КТ головного мозга применяются при симптомах поражения ЦНС, особенно у иммунодефицитных лиц.
Дифференциальную диагностику проводят с инфекционными болезнями: сибирской язвой, кожным и висцеральным лейшманиозом, эризипелоидом. Кроме того, симптомы пастереллеза схожи с клиникой листериоза, токсоплазмоза, рожи. Генерализованные поражения возможны при туберкулезе, органных микозах и сифилисе, могут наблюдаться при туляремии, цитомегаловирусной, пневмококковой инфекции. Сепсис может быть вызван стафилококками, стрептококками, кокциеллами. В ряде случаев требуется дифференцировка с облитерирующим эндартериитом, трофическими язвами, бактериальными гнойными поражениями. Соматическими заболеваниями, сходными с пастереллезом, являются бронхоэктатическая болезнь, злокачественные новообразования ЦНС, геморрагические инсульты. Иногда необходимо исключить кожные болезни: стафилодермию, псориаз, экзему.
Лечение пастереллеза
Больным геморрагической септицемией показано стационарное лечение, особенно при принадлежности к группе риска. Постельный режим соблюдается до 3-4 дней устойчиво нормальной температуры тела. Режим питания предполагает ограничение трудноперевариваемой пищи, отказ от алкоголя. Обязательным является увеличение количества употребляемой жидкости с целью оральной дезинтоксикации. При наличии признаков артрита рекомендуется наложение бандажей, ортезов, фиксирующих повязок с использованием эластичного бинта.
Этиотропное лечение включает антибактериальные средства. Наиболее эффективными препаратами считаются пенициллины (ампициллин+сульбактам, амоксициллин+клавулановая кислота), цефалоспорины 2-го и 3-го поколения, тетрациклины, фторхинолоны, ко-тримоксазол. У пациентов, страдающих пастереллезной инфекцией вследствие контаминации диализного катетера, были зафиксированы случаи рецидива при прохождении курса монотерапии аминогликозидами, поэтому их применение в качестве единственного средства лечения сомнительно.
План лечения пастереллеза также может предполагать инфузионное введение растворов для уменьшения выраженности интоксикационного синдрома (глюкозо-солевые, сукцинат-содержащие растворы, ацесоль), прием жаропонижающих и обезболивающих препаратов. Хирургическое лечение показано при возникновении ограниченных либо разлитых гнойных процессов. Обычно производится вскрытие и дренирование гнойных очагов. При тяжелых поражениях требуется ампутация конечности.
Прогноз и профилактика
Прогноз при неосложненном варианте пастереллеза и неотягощенном преморбидном фоне благоприятный. Согласно исследованиям, около 70% случаев септического течения болезни наблюдалось у лиц старше 50 лет и лишь в 21% случаев – у больных 20-50 лет. Летальность у животных достигает 80%, у людей – 1,79%. Средняя продолжительность болезни составляет 8 дней. При наличии гнойного поражения суставов и костных структур возможна длительная реабилитация (более 1-2 месяцев), в случае ампутации конечности – инвалидизация.
Специфическая профилактика существует в виде вакцин и гипериммунной сыворотки для животных; вакцинные препараты для людей не разработаны. К мерам неспецифической профилактики относят строгий ветеринарный контроль, изоляцию больных животных, запрет на продажу молока и мяса из очагов пастереллеза. Необходимо использовать средства индивидуальной защиты (маски, щитки, перчатки) при работе с животными, проводить обработку укусов, царапин с помощью антисептических средств, тщательное мытье рук с мылом после контакта с животными.
3. Pasteurella multocida line infection: a case report and review of literature / T. C. S. Martin, J. Abdelmalek, B. Yee, S. Lavergne, M. Ritter // BMC Infecious Diseases – 2018 - №18.
Читайте также:

