Лабораторные обследования при паратифе
Обновлено: 24.04.2024
Паратифы – различные инфекционные кишечные заболевания наподобие брюшного тифа.
Синонимы русские
Синонимы английские
Paratyphoid A and B, рaratyphoid infection, paratyphoid fever, Salmonella paratyphi infection.
Симптомы
Для паратифов А и В характерно острое начало. Симптомынапоминают проявления брюшного тифа, однако в целом паратифы A и B протекают легче. Для начальных стадий паратифа А более характерны неспецифические проявления: кашель, насморк. Первыми признаками паратифа В чаще являются кишечные симптомы.
Для паратифа А и В наиболее характерны следующие симптомы:
Общая информация об исследовании
Инкубационный период, то есть промежуток времени от проникновения инфекции в организм до начала болезни, при паратифах обычно составляет от одного до десяти дней. Сальмонеллы проникают в организм человека через желудочно-кишечный тракт. Попадая в кишечник, они поступают в слизистую и далее в подлежащие ткани. После этого бактерии размножаются, попадают в кровь и выделяют эндотоксин, с действием которого и связаны первые симптомы болезни: лихорадка, недомогание. Затем сальмонеллы могут проникать в другие ткани: в нервную систему, печень, желчные протоки, лимфоидные органы, в том числе брыжеечные лимфатические узлы. С этой стадией связано возникновение характерной сыпи, а также основные кишечные симптомы: боли в животе, нарушения стула. Длительность заболевания обычно составляет 5-7 дней. Возбудитель выделяется из организма в основном с желчью.
Чаще всего паратифы А и В протекают в среднетяжелой форме и заканчиваются полным выздоровлением. Восприимчивость к заболеванию и тяжесть его течения зависят от состояния иммунной системы пациента. Осложнениями паратифов могут стать кишечное кровотечение, перфорация стенки кишечника, менингит и менингоэнцефалит, гепатит, холангит и холецистит, редко миокардит.
Кто в группе риска?
- Дети.
- Пожилые люди.
- Люди с ослабленным иммунитетом.
Диагностика
Характерная клиническая картина в сочетании с анамнезом дают основание предположить наличие паратифа. Однако окончательный диагноз может быть поставлен только после ряда лабораторных исследований, позволяющих определить тип выделенного из организма пациента возбудителя. Сальмонеллы могут быть выделены из крови пациента в первые дни болезни, далее из мочи и фекалий. Помимо непосредственного выделения возбудителя, используются методы определения антител к сальмонеллам.
-
с лейкоцитарной формулой. При паратифах в крови может наблюдаться небольшой нейтрофильный лейкоцитоз.
- Посев кала на патогенную флору (диз. группа и тифо-паратифозная группа). Проводят посев материала на питательную среду. Исследование позволяет не только определить возбудителя заболевания, но и установить его чувствительность к различным группам антибактериальных препаратов. . Определение возбудителя в фекалиях пациента с помощью метода полимеразной цепной реакции. . Это исследование позволяет выявить в крови пациента антитела к определенным сероварам сальмонеллы.
Лечение
Лечение паратифов А и В проводится с помощью антибиотиков в сочетании с симптоматической терапией. Большое значение имеют соответствующий режим и диета. При тяжелом течении заболевания, при осложнениях может потребоваться госпитализация пациента.
Профилактика
Профилактикапаратифов заключается в соблюдении правил личной гигиены, правильном хранении и термической обработке продуктов, своевременном выявлении и лечении бактерионосителей. Вакцинация против брюшного тифа может снизить риск инфицирования паратифом В. Вакцина против паратифа А отсутствует.
ГОСТ Р 53079.4-2008
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Технологии лабораторные клинические
ОБЕСПЕЧЕНИЕ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Правила ведения преаналитического этапа
Clinical laboratory technologies. Quality assurance of clinical laboratory tests. Part 4. Rules for conducting of preanalytical stage
Дата введения 2010-01-01
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Лабораторией проблем клинико-лабораторной диагностики Московской медицинской академии им. И.М.Сеченова Росздрава, кафедрой биохимии Российской медицинской академии последипломного образования Росздрава
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 466 "Медицинские технологии"
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт устанавливает требования к условиям и процедурам ведения преаналитического этапа клинических лабораторных исследований с целью исключения или ограничения влияния эндогенных, экзогенных, ятрогенных и иных факторов, мешающих правильному отражению состояния внутренней среды обследуемых пациентов в результатах клинических лабораторных исследований.
Настоящий стандарт может использоваться всеми организациями, учреждениями и предприятиями, а также индивидуальными предпринимателями, деятельность которых связана с оказанием медицинской помощи.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие национальные стандарты:
ГОСТ Р ИСО 15189-2006 Лаборатории медицинские. Специальные требования к качеству и компетентности
ГОСТ Р ИСО 15190-2007* Лаборатории медицинские. Требования к безопасности
* Вероятно ошибка оригинала. Следует читать ГОСТ Р 52905-2007 (ИСО 15190:2003) Лаборатории медицинские. Требования к безопасности, здесь и далее по тексту. - Примечание изготовителя базы данных.
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Правила ведения преаналитического этапа клинических лабораторных исследований
3.1 Общие положения
Достоверность отражения в результатах лабораторных исследований состояния внутренней среды пациента, содержания искомых компонентов биологических материалов в значительной степени зависит от условий, в которых пациент находился в период, предшествовавший взятию у него образца биоматериала, от условий и процедур взятия образца, его первичной обработки и транспортирования в лабораторию, то есть от факторов преаналитического этапа клинического лабораторного исследования.
С целью исключения или ограничения влияния внелабораторных факторов преаналитического этапа на результаты лабораторных исследований настоящий стандарт регламентирует:
а) условия периода, предшествующего взятию у пациента образца биологического материала (приложение А);
б) условия и процедуры взятия образца биологического материала у пациента;
в) процедуры первичной обработки образца биологического материала;
г) условия хранения и транспортирования образцов биоматериалов в клинико-диагностические лаборатории.
Требования стандарта основаны на:
а) научных данных о постоянных и переменных факторах физического, химического и биологического характера, способных оказать влияние на содержание веществ и клеток в биологических материалах пациентов;
б) обобщенных данных о стабильности компонентов в образцах биологических материалов после их взятия при различных условиях хранения (приложения Б, В, Г);
в) обобщенных данных о влиянии принимаемых пациентом лекарственных средств на результаты лабораторных исследований (приложение Д);
г) требованиях ГОСТ Р ИСО 15189 (раздел 5.4).
Правила предназначены для обеспечения такого качества ведения преаналитического этапа клинических лабораторных исследований, которое необходимо для получения их результатов, достоверно отражающих состояние внутренней среды обследуемых пациентов в момент обследования, путем:
- правильной подготовки пациентов к проведению лабораторных тестов;
- информирования пациентов о требуемых ограничениях в диете, физической активности, курении, о правилах сбора биологических материалов, которые обычно собирает сам пациент (моча, кал);
- инструктирования персонала, участвующего во взятии образцов биологических материалов у пациентов, об особенностях процедур взятия различных видов этих материалов;
- рациональной организации процесса взятия образцов биоматериалов;
- полноценного обеспечения процедур взятия образцов биоматериалов необходимыми инструментами, посудой, средствами первичной обработки и транспортировки.
Принимая во внимание потенциальную биоопасность образцов биологического материала, получаемого от пациентов, персонал, выполняющий эти функции, должен быть информирован и обучен правилам безопасного взятия образцов и должен располагать средствами защиты (перчатки, устройства для безопасного сбора использованных игл и т.п.) в соответствии с требованиями ГОСТ Р ИСО 15190.
Настоящие правила содержат общие положения, которые по отношению к отдельным биологическим материалам и отдельным изучаемым в них аналитам, биологическим объектам могут требовать особых условий и процедур, что должно быть отражено в нормативных документах по технологиям оказания соответствующих простых или комплексных медицинских услуг, применительно к функциям различных категорий клинического персонала.
На основании этих общих правил в каждой медицинской организации следует разрабатывать и вводить для обязательного исполнения внутренние правила ведения преаналитического этапа применительно к каждому виду исследований, выполняемых в лаборатории, учитывающие особенности медицинского профиля и организационной формы учреждения. В случае выполнения исследований в лаборатории другого учреждения правила ведения преаналитического этапа, включая условия транспортирования образцов, применительно к этим исследованиям следует согласовывать с руководителем лаборатории, выполняющей эти исследования. Наличие и исполнение персоналом правил ведения преаналитического этапа лабораторных исследований является одним из обязательных условий при сертификации процессов выполнения исследований в клинико-диагностической лаборатории.
3.2 Требования к условиям и процедурам взятия образца биологического материала
Взятие образца или пробы - это процесс изъятия или образования проб, охарактеризованный процедурой их взятия, то есть оперативными требованиями и/или инструкциями для отбора, изъятия и подготовки одной или нескольких проб из инспектируемого лота для выяснения характеристик этого лота (в лабораторной медицине инспектируемый лот - это обследуемый пациент, а образцы или пробы - это порции того или иного биологического материала).
3.2.1 Биологический материал - кровь
Большая часть клинических лабораторных исследований проводится в образцах крови: венозной, артериальной или капиллярной. Венозная кровь - лучший материал для определения гематологических, биохимических, гормональных, серологических и иммунологических показателей.
Для исследования аналитов в цельной крови, сыворотке или плазме образец крови берут чаще всего из локтевой вены. Показания для взятия крови из пальца на клиническое исследование крови:
- при ожогах, занимающих большую площадь поверхности тела пациента;
- при наличии у пациента очень мелких вен или когда они труднодоступны;
- при выраженном ожирении пациента;
- при установленной склонности к венозному тромбозу;
При взятии образца крови из венозного или артериального катетера, через который проводилось вливание инфузионного раствора, катетер следует предварительно промыть изотоническим солевым раствором в объеме, соответствующем объему катетера, и отбросить первые 5 мл (миллилитров) взятой из катетера крови. Недостаточное промывание катетера может привести к загрязнению образца крови препаратами, вводившимися через катетер. Из катетеров, обработанных гепарином, нельзя брать образцы крови для исследований системы свертывания крови.
В зависимости от назначенного вида исследования образец крови должен собираться при наличии строго определенных добавок [1]. Для получения плазмы кровь собирают с добавлением антикоагулянтов: этилендиаминтетрауксусной кислоты, цитрата, оксалата, гепарина [2]. Для исследований системы свертывания крови применяется только цитратная плазма (в точном соотношении одной части 3,8%-ного (0,129 моль/л) раствора цитрата натрия и девяти частей крови). В большинстве гематологических исследований используют венозную кровь с солями этилендиаминтетрауксусной кислоты (ЭДТА, К или К-ЭДТА). Для получения сыворотки кровь собирают без антикоагулянтов. Для исследования глюкозы кровь собирают с добавлением ингибиторов гликолиза (фтористого натрия или йодоацетата).
Для исследования ряда нестабильных гормонов (остеокальцина, кальцитонина, адренокортикотропного гормона) используют ингибитор апротинин.
Для получения из образцов крови вариантов проб для различных видов исследований рекомендуется следующая последовательность наполнения пробирок:
- кровь без добавок - для получения гемокультуры, используемой в микробиологических исследованиях;
- кровь без антикоагулянтов - для получения сыворотки, используемой при клинико-химических и серологических исследованиях;
- кровь с цитратом - для получения плазмы, используемой при коагулологических исследованиях;
- кровь с гепарином - для получения плазмы, используемой при биохимических исследованиях;
- кровь с ЭДТА - для получения цельной крови, используемой для гематологических исследований, и плазмы, используемой для некоторых клинико-химических исследований.
С целью сохранения в образце крови эритроцитов применяют смесь антикоагулянтов с добавками, например, АЦД (антикоагулянт - цитрат-декстроза или кислота-цитрат-декстроза).
Во избежание ятрогенной анемизации пациентов объем забираемой для исследований крови должен быть рационально рассчитан, исходя из того, что в конечном итоге непосредственно для анализа расходуется лишь половина от первоначально взятого объема (с учетом использования сыворотки или плазмы при гематокрите 0,5).
При использовании современных анализаторов достаточны следующие объемы образцов:
- для биохимических исследований: 4-5 мл; при использовании гепаринизированной плазмы: 3-4 мл;
- для гематологических исследований: 2-3 мл крови с ЭДТА;
- для исследований свертывающей системы: 2-3 мл цитратной крови;
- для иммуноисследований, включая исследования белков и др.: 1 мл цельной крови для 3-4 иммуноанализов;
- для исследования скорости оседания эритроцитов: 2-3 мл цитратной крови;
- для исследования газов крови: капиллярная кровь - 50 мкл (микролитров); артериальная или венозная кровь с гепарином - 1 мл.
Рационально применение пробирок для взятия крови небольшого объема (4-5 мл) при соотношении диаметра и высоты пробирки 13 на 75 мм. Использование плазмы вместо сыворотки дает увеличение на 15%-20% выхода анализируемого материала при одном и том же объеме взятой у пациента крови. Взятие венозной крови облегчается применением вакуумных пробирок. Под влиянием вакуума кровь из вены быстро поступает в пробирку, что упрощает процедуру взятия и сокращает время наложения жгута.
Для обозначения содержимого пробирок с различными добавочными компонентами применяют цветное кодирование закрывающих их пробок. Так, для пробирок с антикоагулянтами лиловый цвет пробки означает наличие ЭДТА, зеленый цвет - гепарина, голубой - цитрата. Добавление в пробирку ингибиторов гликолиза (фторида, йодацетата) как одних, так и в комбинации с антикоагулянтами (гепарином, ЭДТА), кодируется пробкой серого цвета (см. таблицу 1).
4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Бактериологическая диагностика брюшного тифа и паратифов А, В и С
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: ФГУН Санкт-Петербургский НИИЭМ им. Пастера Роспотребнадзора (Л.А.Кафтырева, З.Н.Матвеева, Г.Ф.Трифонова); ГОУВПО "Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова" Федерального агентства по здравоохранению и социальному развитию (А.Г.Бойцов).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Лабораторным Советом Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24.12.07 N 11фц/5327).
3. УТВЕРЖДЕНЫ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 29 декабря 2007 г. 0100/13745-07-34
4. ВВЕДЕНЫ В ДЕЙСТВИЕ с момента утверждения.
5. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1.1. В методических рекомендациях изложены основные принципы и особенности бактериологической диагностики брюшного тифа и паратифов А, В и С; содержатся современные сведения о биологических свойствах возбудителей, резистентности к антибактериальным препаратам, о питательных средах для их выделения и особенностях дифференциации возбудителей брюшного тифа и паратифов от других серологических вариантов сальмонелл.
1.2. Методические рекомендации предназначены для специалистов микробиологических лабораторий, проводящих соответствующие исследования.
2. Список сокращений
АБП - антибактериальный препарат
ВСА - висмут-сульфит агар
ЛПУ - лечебно-профилактическое учреждение
МПК - минимальная подавляющая концентрация
РИФ - реакция иммунофлюоресценции
ЦНС - центральная нервная система
"+" - положительная реакция в первые сутки;
"-" - отрицательная реакция на 4-20 сутки;
"(+)" - замедленная положительная реакция на 2-20 сутки;
d - различные ферментативные реакции.
Возможна дифференциация на ферментативные варианты.
3. Общие положения
3.1. Брюшной тиф и паратифы А, В и С являются антропонозными кишечными инфекциями, вызываемыми микроорганизмами Salmonella Typhi, Salmonella Paratyphi A, Salmonella Paratyphi В и Salmonella Paratyphi С. В настоящее время чаще регистрируется брюшной тиф, реже - паратиф В, редко - паратиф А и крайне редко - паратиф С.
3.2. Заболевания характеризуются язвенным поражением лимфатической системы тонкой кишки, бактериемией, лихорадкой, циклическим клиническим течением с выраженной интоксикацией, розеолезной сыпью на кожных покровах туловища, гепато- и спленомегалией. Более характерен запор, нежели диарея. Изъязвление пейеровых бляшек подвздошной кишки примерно в 1% случаев приводит к кишечному кровотечению и прободению кишечника с самыми неблагоприятными последствиями для больного.
3.3. Диагноз брюшного тифа и паратифов А, В и С ставится на основании клинических признаков болезни с учетом эпидемиологического анамнеза и данных комплексного лабораторного обследования, которое включает классические бактериологический и серологический методы. Бактериологическая диагностика имеет приоритетное значение, т.к. в этом случае удается получить наиболее полную информацию о биологических свойствах возбудителя, включая его чувствительность к антибактериальным препаратам.
3.4. Применение антимикробных препаратов для этиотропной терапии брюшного тифа и паратифов позволило, с одной стороны, снизить летальность с 10-20% до уровня менее 1%, а с другой стороны - осложнило лабораторную диагностику, т.к. нередко забор материала для лабораторного исследования осуществляется уже после начала антибиотикотерапии. Этот факт заставляет более тщательно подходить к вопросу выбора материала для исследования, взятия исследуемого материала, техники исследования.
3.5. Современной особенностью эпидемиологии брюшного тифа является резкое увеличение частоты завоза (заноса) инфекции с эндемичных по этому заболеванию территорий, стран ближнего и дальнего зарубежья, а также заражение жителей России при выезде в эти страны и в процессе миграции внутри страны. Другой особенностью является наличие обширного контингента высокого эпидемиологического риска в виде лиц без определенного места жительства, среди которых регистрируется высокая заболеваемость брюшным тифом.
3.6. Данные методические рекомендации составлены с целью унификации методов бактериологической диагностики брюшного тифа и паратифов А, В и С, а также правильной интерпретации результатов лабораторного исследования с учетом современных особенностей клиники, лечения и эпидемиологической обстановки на конкретных территориях.
4. Показания к проведению бактериологической диагностики
Показанием к проведению бактериологического исследования биологического материала на наличие возбудителей брюшного тифа и паратифов А, В и С является необходимость обследования:
4.1) больных с подозрением на тифопаратифозное заболевание, а также с лихорадкой неясной этиологии, продолжающейся 5 и более дней;
4.2) лиц, общавшихся с больными брюшным тифом и паратифами А, В, С;
4.3) работников отдельных профессий, производств и организаций при поступлении на работу и по эпидемиологическим показаниям;
4.4) лиц перед поступлением в стационары и специализированные санатории по клиническим и эпидемиологическим показаниям;
4.5) лиц при оформлении на стационарное лечение в больницы (отделения) психоневрологического (психосоматического) профиля, дома престарелых, интернаты для лиц с хроническими психическими заболеваниями и поражениями ЦНС, в другие типы закрытых учреждений с круглосуточным пребыванием;
4.6) больных брюшным тифом и паратифами после исчезновения клинических симптомов перенесенного заболевания перед выпиской из стационара;
4.7) лиц, переболевших брюшным тифом и паратифами, во время диспансерного наблюдения;
4.8) хронических бактерионосителей, выявленных среди работников отдельных профессий, производств и организаций, при повторном поступлении на работу на указанные предприятия и объекты;
4.9) секционного материала при подозрении на заболевание брюшным тифом и паратифами.
5. Материально-техническое обеспечение метода
5.1. Стандартное испытательное и вспомогательное оборудование, средства измерения для микробиологических лабораторий.
5.2. Питательные среды, диагностические сыворотки и химические реагенты для культивирования, выделения, идентификации и определения чувствительности к антибактериальным препаратам возбудителей брюшного тифа и паратифов А, В и С.
5.3. Для лабораторной диагностики тифо-паратифозных заболеваний и выявления бактерионосителей должны использоваться питательные среды и реагенты, разрешенные к применению на территории Российской Федерации в установленном порядке.
6. Лабораторная диагностика брюшного тифа и паратифов
6.1. Принцип бактериологического метода основан на обнаружении живых микроорганизмов в различных биологических субстратах (кровь, моча, кал, желчь, костный мозг, розеолы) в зависимости от стадии заболевания. Для этого производят посев определенного количества биологического материала на специальные питательные среды с последующей инкубацией в термостате и идентификацией выросших колоний микроорганизмов, характерных для S. Typhi, S. Paratyphi A, S. Paratyphi В и S. Paratyphi С, по культурально-ферментативным свойствам и антигенной характеристике.
6.2. Только бактериологическое исследование может обеспечить точную постановку этиологического диагноза и контроль освобождения организма от возбудителя. В отношении дифференциальной диагностики брюшного тифа и паратифов единственным методом является лабораторное исследование биологического материала с выделением возбудителя и идентификация его до уровня серологического варианта, т.к. клиническое течение инфекционного процесса не всегда позволяет различить эти нозологические формы.
7. Бактериологическое исследование
7.1. Выделение возбудителей брюшного тифа и паратифов А, В и С проводят по одной и той же схеме бактериологического исследования биоматериалов.
7.2. Порядок сбора материала для лабораторных исследований на тифо-паратифозные заболевания определен СП 3.1.1.2137-06.
7.3. Техника сбора и транспортирования биоматериалов в микробиологические лаборатории описана в МУ 4.2.2039-05.
7.4. Материалом для бактериологического исследования с целью диагностики брюшного тифа и паратифов являются:
желчь (дуоденальное содержимое).
Возбудители могут быть также выделены из:
Материалом для бактериологического исследования с целью выявления бактерионосителей, согласно СП 3.1.1.2137-06, являются:
желчь (дуоденальное содержимое).
7.5. Исследование секционного материала проводится с целью уточнения диагноза.
7.6. Сбор биологического материала для лабораторных исследований осуществляется до начала этиотропного лечения: медицинским работником, заподозрившим тифо-паратифозную инфекцию; при групповой и вспышечной заболеваемости - специалистами учреждений Роспотребнадзора и персоналом лечебно-профилактических учреждений. От госпитализируемых больных материал для бактериологического исследования забирается в приемном отделении стационара.
7.7. От лиц, общавшихся с больными или носителями (контактными), сбор материала проводится медицинскими работниками ЛПУ и других организаций и учреждений по месту выявления больных.
7.8. Биоматериал для лабораторного исследования сопровождают специальным направлением. Доставка материала самими обследуемыми не допускается. При невозможности своевременной доставки материала используют консерванты и транспортные среды (табл.1).
8. Бактериологическое исследование крови
Показанием к исследованию крови является подозрение на тифо-паратифозные заболевания или лихорадочное состояние невыясненного происхождения (лихорадка неясного генеза), наблюдающееся в течение 5 и более дней (СП 3.1.1.2137-06).
Соотношение кровь - питательная среда должно быть 1:10-1:60. Количество независимо отбираемых проб крови и время их взятия определяется лечащим врачом согласно МУ 4.2.2039-05 при лихорадке неясного генеза или согласно МУ 04-723/3 МЗ СССР (1984) при подозрении на тифо-паратифозные заболевания. У больных, получающих антибактериальные препараты, пробы необходимо собирать непосредственно перед введением (приемом) следующей дозы препарата.
При наличии лихорадки оптимальным является взятие крови на фоне повышения температуры тела (но не на пике температуры!). Посев на питательные среды проводят непосредственно у постели больного.
При подозрении на тифо-паратифозные заболевания для посева крови можно использовать среду Рапопорт, 20%-й желчный бульон, мясопептонный бульон с добавлением 1%-й глюкозы (во флаконах по 100 мл). Ранее использовали посев крови в стерильную дистиллированную (водопроводную) воду. Однако предпочтительнее использовать специальные среды для посева крови.
Количество засеваемой крови в разгар лихорадки может составлять 10 мл, в более поздние сроки - до 20 мл (у детей - до 5 мл).
При лихорадке неясного генеза продолжительностью более 5 дней, как правило, должны исследоваться несколько проб крови. Взятие крови из вены проводят согласно МУ 4.2.2039-05. Это необходимо для дифференциации истинной бактериемии от случайной контаминации крови при венопункции (вероятность загрязнения пробы вследствие случайного прокола сальной или потовой железы составляет 3%). Для посева крови в этом случае используют две среды: 1) среду для аэробов и факультативных анаэробов и 2) среду для облигатных анаэробов (например, "двойная" среда + тиогликолевая среда согласно приказу МЗ СССР от 12.04.85 N 535) или универсальную среду для аэробов и анаэробов.
Предпочтительно использовать промышленно произведенные среды, разрешенные к применению в России.
Посевы инкубируют при 37 °С в течение 10 суток с ежедневным просмотром. При этом флаконы с "двойной" средой наклоняют, омывая плотную часть среды.
Паратифы А и В - острые инфекционные заболевания, сходные по клиническому течению с брюшным тифом, вызываемые кишечными бактериями рода Salmonella. Клиника паратифа А характеризуется лихорадочным синдромом, катаральными явлениями, обильной розеолезной сыпью на теле; паратиф В протекает с повышением температуры тела, кожными высыпаниями, признаками гастроэнтерита. В целях диагностики паратифов А и В проводится бактериологическое исследование кала, крови, мочи, рвотных масс, а также серологические реакции (РНГА, реакция Видаля). Лечение включает диетотерапию, назначение антибактериальных препаратов (хлорамфеникола), проведение дезинтоксикационной терапии.
Общие сведения
Паратифы А и В – инфекции тифо-паратифозной группы, протекающие с температурной реакцией, интоксикационным синдромом, кожными высыпаниями, диспепсическими расстройствами различной степени выраженности. Заболеваемость паратифами в мире составляет 0,02 случая на 100 тыс. населения; в структуре тифо-паратифозных заболеваний на их долю приходится 10-15%. Для тифо-паратифозных инфекций характерна резко выраженная летне-осенняя сезонность. Чаще болеют лица мужского пола в возрасте от 15 до 45 лет. Распространенность и заболеваемость паратифами А и В выше в регионах с низким уровнем санитарной культуры населения и неудовлетворительными бытовыми условиями.

Характеристика возбудителя
Возбудителем паратифа А является бактерия Salmonella paratyphi, паратифа В - Salmonella schotmulleri. Они представляют собой неподвижные, факультативно анаэробные, грамотрицательные, палочковидные микроорганизмы, сходные по своим морфологическим свойствам с возбудителем брюшного тифа. Возбудители паратифов при посеве на питательных средах иногда продуцируют газ. Паратифозные палочки довольно устойчивы во внешней среде, могут оставаться жизнеспособными вне организма до недели, в воде и почве выживают в течение нескольких месяцев. Способны размножаться в пищевых продуктах, к примеру, в молоке и твороге, мясном фарше. Охлаждение сальмонеллы переносят неплохо, при кипячении быстро погибают. Хорошо поддаются дезинфекции.
Резервуаром в случае паратифа А является человек, больной или носитель, а для возбудителя паратифа В – домашний скот, птица. Паратифы передаются с помощью фекально-орального механизма пищевым, водным или бытовым путем. Для паратифа А более характерен водный путь заражения, для В – пищевой (в особенности при употреблении молочных продуктов). Люди и животные выделяют микроорганизм в окружающую среду на протяжении всего периода клинических проявлений и около 2-3 недель после (реконвалесценция). Бессимптомное бактерионосительство при паратифах развивается чаще, чем при брюшном тифе.
Люди обладают высокой естественной восприимчивостью к заболеванию, после выздоровления остается типоспецифический иммунитет. Заболеваемость паратифом А преимущественно отмечается в Юго-Восточной Азии, Африке, паратиф В не имеет региональной очаговости. Отмечают как единичные случаи, так и эпидемические вспышки.
Симптомы паратифов
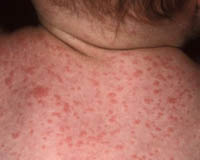
Инкубационный период при паратифе А составляет обычно от 6 до 10 дней, начало острое, отмечается быстрое повышение температуры тела, насморк. Кашель. При осмотре выявляется гиперемия лица, инъекции склер, иногда высыпания наподобие герпеса на губах и крыльях носа. В отличие от брюшного тифа лихорадка не настолько постоянная, менее продолжительна, часто приобретает неправильный характер. В разгар заболевания могут отмечаться озноб и потливость. На 4-7 день болезни появляется сыпь, чаще всего розеолезного характера, но может быть и петехиальной или кореподобной. Сыпь обильно покрывает кожу живота, груди, конечностей, отличается полиморфизмом элементов, с течением заболевания экстенсивно распространяется. Обычно течение паратифа А среднетяжелое, с умеренной, более кратковременной, чем брюшетифозная, интоксикацией. Иногда паратиф может приобретать рецидивирующий характер.
Паратиф В характеризуется инкубационным периодом около 5-10 дней, отличается преимущественно кишечными проявлениями в начальном периоде. На фоне повышения температуры отмечается боль в животе, тошнота, рвота, диарея. Нередко первоначальная клиническая картина напоминает симптоматику пищевой токсикоинфекции. Вскоре присоединяется сыпь, подобная таковой при паратифе А. В остальном виды паратифов сходны по своему течению. Паратиф В в редких случаях может протекать тяжело с развитием осложнений, таких как септицемия, воспаления мозговых оболочек.
При поражении лиц с ослабленными защитными механизмами организма могут развиться миокардит, вторичная пневмония, гнойный менингит и менингоэнцефалит, септикопиемия. Возможны кишечные кровотечения, перфорации стенки кишечника.
Диагностика паратифов
Предварительная диагностика осуществляется на основании жалоб, данных эпидемиологического анамнеза и физикального осмотра. Возбудителя паратифов выделяют из крови, рвоты, кала, мочи, желчи. Специфическая серологическая диагностика осуществляется с помощью РНГА (становится положительной на 5-6 день заболевания), является достаточно чувствительной и специфичной. Реакция Видаля часто отрицательная или поздняя и в низких титрах. Общий анализ крови может показывать некоторую лейкоцитопению, чаще – эозинофилию.
Лечение паратифа
Лечение паратифов включает диетическое питание: щадящая легкоусвояемая диета с исключением раздражающих кишечник компонентов. При частой диарее – стол №4, после нормализации температуры тела – стол №13, расширение рациона производят постепенно. Рекомендовано частое дробное питье.
Этиотропное лечение подразумевает назначение антибиотиков (хлорамфеникол) до 10 дня после стихания лихорадки. В комплексе с антибиотикотерапией назначают стимулирующие защитные свойства организма препараты, вакцинацию тифо-паратифозной вакциной В, усиливая тем самым иммунную резистентность. В качестве средств симптоматической терапии при необходимости применяют регидратационные смеси, сердечно-сосудистые средства.
Прогноз и профилактика паратифа
Паратифы А и В имеют обычно благоприятный прогноз, при адекватной терапии происходит полное выздоровление, в качестве профилактики развития бактерионосительства используют вакцинацию. Ухудшение прогноза возможно в случае развития осложнений.
Общие меры профилактики заключаются в санитарно-гигиенических мероприятиях, направленных на контроль состояния водных источников, канализационных стоков, заготовки, хранения и транспортировки пищевых продуктов, борьбу с мухами и санитарное просвещение. Индивидуальная профилактика подразумевает соблюдение личной гигиены, мытье продуктов питания (овощей, фруктов, зелени), употребление воды из проверенных источников. Работники предприятий пищевой промышленности и общественного питания подлежат профилактическому обследованию на предмет носительства и выделения возбудителя. В случае выявления фактов носительства они отстраняются от работы с продуктами питания.
Читайте также:

