Лабораторный метод золотой стандарт в диагностике сифилиса
Обновлено: 24.04.2024
Заболевание распространяется не только половым путем, но и при использовании зубной щетки, кухонной посуды, полотенца и других бытовых предметов вместе с больным человеком. Иногда болезнь может протекать бессимптомно (пассивный вид), при этом остается риск заражения окружающих. Сдать анализ на сифилис можно в районной поликлинике и частном врачебном кабинете анонимно. Как называется анализ и где его можно сдать.
Материал для исследования
Наиболее часто для анализа на сифилис используется кровь пациента. Иногда в крови содержатся антитела, вызывающие ложноположительную реакцию.
В таких случаях возможный диагноз может быть подтвержден исследованиями другого биологического материала:
- Распространяются по организму и затрагивают спинной мозг. Специальный анализ крови на сифилис Реакция по Вассерману, может подтвердить наличие болезни
- Жидкость, взятая из язвы (твердого шанкра). Исследование вещества имеет высокую достоверность и может быть назначено по клиническим показаниям
- Лимфоузлы в паховой области при развитии болезни воспаляются и увеличиваются. Обследование воспаленных участков может помочь диагностике
- Венозная или артериальная кровь. Кровь на сифилис должна сдаваться натощак из вены или пальца в зависимости от типа анализа
Чтобы узнать, где сдать все анализы на сифилис, нужно обратиться к врачу при первых признаках заболевания. Лабораторные исследования проводятся во многих частных и государственных лабораториях. Сдачу крови на сифилис можно провести в медицинском учреждении или вызвать лаборанта на дом. Должный вид теста определяет врач. Лаборатория проведет тест на сифилис и исследование покажет наличие и отсутствие болезни.
Прямые тесты
Какие анализы сдают на сифилис, этот вопрос часто можно услышать от пациентов. Сегодня существует несколько видов тестов, которые могут показать наличие инфекции в крови. Анализ крови на сифилис, известный как темнопольная микроскопия, является современным методом диагностики с достаточно высокой достоверностью результатов. Исследуемый материал изучается при большом увеличении и специальном подсвечивании образца.
Исследование выявляет наличие бледных трепонем (возбудителя сифилиса) на более темном фоне.
При простом исследовании образца под микроскопом достоверность метода составляет 97% и позволяет обнаружить болезнь у 8 из 10 зараженных. Если анализ крови при сифилисе показывает отрицательный результат, но у пациента имеются ярко выраженные клинические симптомы сифилиса, назначается дополнительное исследование.
Самые точные исследования называются ПЦР анализы на сифилис или полимеразная цепная реакция. Для проведения исследования требуется современное медицинское оборудование и квалифицированные специалисты. Где же можно сдать анализы на сифилис по данному методу? К сожалению, анализ ПЦР могут предложить только частные лаборатории. Ввиду сложности проведения и высокой стоимости анализа, немногие лаборатории предлагают исследование с помощью полимеразной цепной реакции.
В предоставленном образце крови определяется наличие или отсутствие молекул ДНК возбудителя болезни. Достоверность ПЦР на сифилис приближена к 100% и является основой для подтверждения или опровержения диагноза лечащим врачом. Современное молекулярное исследование позволяет обнаружить в исследуемом образце наличие всего двух молекул заболевания. Получить самый точный результат ПЦРа на сифилис можно только при соблюдении всех правил и норм лабораторных исследований. Тест на сифилис может быть готов уже через 5 часов после забора крови. Стоит отметить, что общий анализ крови не выявляет данную инфекцию.
Нетрепонемные исследования
Серологическая диагностика сифилиса предусматривает анализ крови на наличие антител. Существует несколько видов исследований, кровь на которые можно сдать в лаборатории. При проведении медицинских осмотров и обследовании большого количества пациентов назначаются, как правило, один из нетрепонемных (неспецифических) анализов. Если в крови обнаруживаются антитела к сифилису, результат анализа считается положительным. Какие анализы на сифилис следует сдавать пациенту, зависит от клинической картины. На сифилис анализ должен быть назначен квалифицированным врачом.
Слабоположительный результат маркируется одним или двумя плюсами (+, ++), положительный тремя плюсами (+++) и четыре плюса (++++) означают резко положительную реакцию.
Также к нетрепонемным методам исследований относится RPR тест. Это исследование считается более современным и точным по отношению к RW анализу. RPR проводится на венозной крови пациента и выявляет наличие антител к фосфолипидам цитоплазматической мембраны. РПР тест можно сделать в частной клинике.
Похожим способом является реакция микропреципитаци, которую используют в современных лабораториях.
Микрореакция преципитации (МРП или ) проводится спустя 4–5 недель после предполагаемого заражения. Для исследования используется капиллярная кровь. Микрореакция на сифилис не относится к точным методам диагностики. Положительная серологическая реакция на сифилис по МРА должна быть подтверждена одним из специфических тестов. Отрицательный результат теста означает начальную стадию или отсутствие заболевания.
Трепонемные исследования
Почему нужно сдавать анализ на сифилис повторно? Часто трепонемные исследования используются в качестве контрольного анализа, чтобы подтвердить или опровергнуть диагноз после нетрепонемного теста. Сомнительный результат первого теста означает, что придется сдать анализы на сифилис повторно.
Реакция пассивной агглютинации (РПГА, РНГА). Анализ на сифилис РПГА является быстрым методом исследования, результат можно узнать уже через час. Чтобы проверить кровь на наличие сифилиса по , анализ проводится спустя месяц после контакта с больным. Гемагглютинация может давать ложноположительный результат при мононуклеозе и ряде других заболеваний.
Для диагностики болезни на ранних стадиях применяется Реакция иммунофлюоресценции (). Анализ крови из пальца или вены с помощью РИФ может выявить заболевание спустя 1,5–2 месяца после контакта с больным.
Во время проведения антитела четко выделяются свечением в ультрафиолетовом свете.
При беременности или наличии системных заболеваний соединительной ткани (ревматоидный артрит и пр.) может оказаться ложноположительным. Поэтому очень важно предоставить врачу достоверную информацию о себе и медицинскую карту. Положительная реакция обозначается знаками «+" от одного до четырех.
Реакция иммобилизации бледной трепонемы, также известная как пользуется высокой популярностью. Серодиагностика по методу РИБТ достоверна в 99% случаев. Однако анализы крови могут быть назначены только спустя 12 недель после контакта с носителем болезни.
проводится спустя 3,5–4 месяца после возможного заражения. Заболевание определяется с вероятностью 99%.
Иммуноблотинг способен дать 100% результат и реагирует даже на очень маленькое содержание антител в крови пациента.
Иммуноферментный анализ или ИФА способен выявить болезнь уже спустя 3 недели после возможного заражения. Достоверность положительного результата составляет 98%. Этот анализ называют одним из самых точных. Как же очистить кровь от сифилиса? Как лечат сифилис какие нужны повторные обследования скажет квалифицированный врач. Не занимайтесь самолечением!
Набор РМП на сифилис состоит из пластиковой формы с тестовой полоской, острого инструмента для прокалывания кожи на пальце, одноразовой пластиковой пипетки, бутылочки с раствором для разведения крови и подробной инструкции на русском языке. Перед проведением анализа нужно придерживаться тех же правил, что и в медучреждении, очищать руки и поверхность стола перед работой.
При помощи острого приспособления из набора прокалывают палец, одноразовой пипеткой набирают 1 каплю крови и помещают на обозначенное место . Затем добавляют 2 капли раствора и оставляют на 10 минут. Спустя указанное время, будет готов результат. Какие могут быть варианты? Результата всего два: одна полоса означает отсутствие заболевание, две полосы свидетельствуют о положительной реакции и являются поводом обратиться к врачу.
Подтвердить или опровергнуть результаты домашнего теста может серодиагностика.
Стоит отметить, что тест может показать положительный результат и уже после успешного лечения сифилиса. Все дело в том, что организм помнит о перенесенной инфекции еще несколько лет и продолжает вырабатывать антитела к сифилису. Однако количество этих антител постепенно снижается, и при отсутствии повторного заражения перестают вырабатываться в среднем в течение 2–3 лет после успешного лечения. Однако некоторые факторы могут замедлять этот процесс. К ним относится прием алкоголя и наркотических средств. Поэтому задумываясь, как очистить кровь после сифилиса, в первую очередь откажитесь от вредных привычек.
Лечение
Как избавиться от сифилиса и какое лечение нужно пройти? Сразу стоит отметить, что лечение должен назначать только опытный врач. Терапия от сифилиса проводится с помощью антибиотиков в течение долгого времени. Чтобы кровь очистилась от антител нужно не менее 2 лет. Кровь очищается медленно и постепенно. То есть после полученного лечения антитела вырабатываются все меньше и в конце концов перестают определяться в крови. Чтобы контролировать этот процесс пациентам приходится сдавить анализы в течение 3 лет.
Исследование крови на сифилис обязательно для людей многих профессий (врачи, военные, повара и пр.) для получения допуска к работе. В таком случае постоянно, при каждом медосмотре, будет назначена серология или другой тип анализа. При беременности также обязательно проводится исследование на сифилис, анализы назначает врач. Некоторые типы анализов, например РИФ, часто бывает ложноположительным. Какие сегодня самые точные анализы на сифилис, вам подскажет врач.

Хотите читать всё самое интересное о красоте и здоровье, подпишитесь на рассылку!
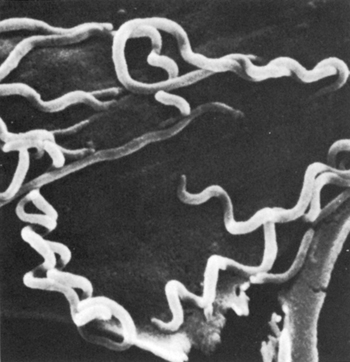
Прямые методы диагностики служат для выявления бледной трепонемы (Т. pallidum) или генетического материала этого возбудителя в образцах, взятых из очагов поражения. Прямое выявление возбудителя сифилиса является абсолютным доказательством наличия заболевания. Найденный генетический материал (ДНК/РНК) может свидетельствовать как об активном, так и о ранее леченном сифилисе.
На ранней стадии болезни, возбудитель сифилиса активно размножается в очаге инфицирования, при этом антитела к антигенам бледной трепонемы (Treponema pallidum) начинают появляться только со второй недели после инфицирования. Бледная трепонема располагается в тканевых щелях, между волокнами соединительной ткани, вокруг лимфатических и кровеносных сосудов, в стенках и даже просветах лимфатических капилляров.
При медицинском обследовании, у пациентов с подозрением на сифилис, все высыпания на коже или слизистых оболочках следует считать сифилитическими. Исследованию на бледную трепонему подлежат все эрозивные и язвенные шанкры, мокнущие и эрозивные папулы, широкие кондиломы на коже и слизистых оболочках рта, половых органов и анальной области.
Материалом, который необходим для бактериологического исследования на бледную трепонему, является тканевая жидкость (серум). Если нет возможности исследовать высыпания (например, в случаях раннего сифилиса), то рекомендуется проводить пункцию увеличенного регионарного лимфатического узла с соблюдением всех правил асептики, то есть стерильными инструментами и соблюдая правила, направленные на предотвращение распространения микроорганизмов. Кроме того, образцы могут быть получены путем взятия спинномозговой жидкости (ликвора) или плодной жидкости.
Важным условием для обнаружения бледной трепонемы в пат. материалах является правильное взятие проб из сифилитических элементов. Затем содержимое полученных проб изучают в лаборатории.
Обнаружение бледной трепонемы методом темнопольной микроскопии (ТПМ).
В России в качестве рутинного метода прямой визуализации T. pallidum традиционно используется метод темнопольной микроскопии (ТПМ, dark field microscopy, DFM).
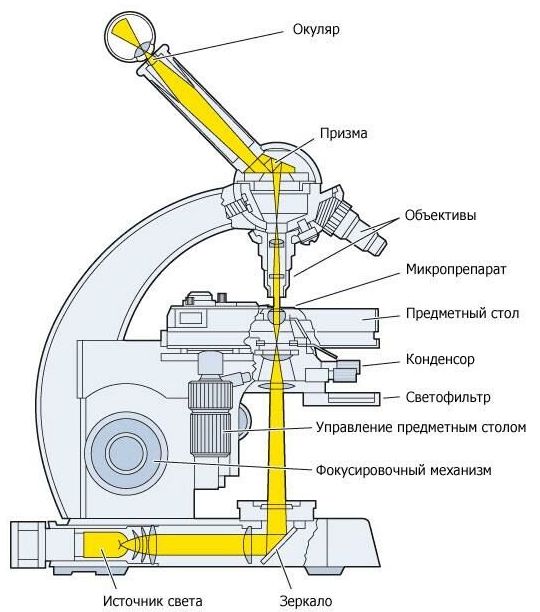
1. Конденсор темного поля
Исследование на бледную трепонему в темном поле зрения проводится с помощью стандартного микроскопа, снабженного конденсором темного поля.
Конденсор представляет собой двояковыпуклую линзу, прикрепляемую снизу предметного столика с таким расчетом, чтобы линза конденсора располагалась под отверстием предметного столика. Конденсор служит для собирания (конденсации) пучка световых лучей, что обеспечивает наибольшее освещение исследуемого предмета.
Неокрашенные живые бледные трепонемы не видны в световой микроскоп при обычном освещении препарата. Необходимые условия создаются путем замены обычного конденсора микроскопа особым конденсором, в котором центральная часть затемнена и проникновение лучей света происходит через узкую щель.
Вследствие получающегося при этом бокового освещения достигается отраженное свечение всех твердых частиц на темном поле (это называется "эффектом Тиндаля"), в том числе бледной трепонемы. Для получения темного поля необходим сильный источник света.
2. Бледная трепонема, характерные особенности при темнопольной микроскопии
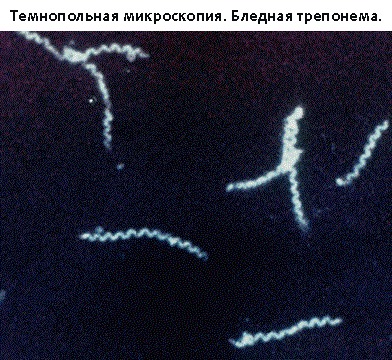
Исследование в темном поле микроскопа позволяет изучать бледную трепонему (БТ) в живом виде, а также достоверно отличать её от других трепонем как по морфологическим признакам, так и по характерным особенностям движения.
Чтобы отличать бледную трепонему от морфологически сходных типов сапрофитных трепонем, бледные трепонемы при исследовании должны быть живыми. Темнопольное исследование взятого материала должно быть проведено немедленно, сразу после получения образца, поэтому оборудование должно быть подготовлено заранее.
В затемненном поле зрения бледная трепонема выглядит, как движущаяся тонкая спираль или тонкий нежный пунктир с серебристым оттенком, слабо преломляющие свет. Помимо этих бактерий, в препарате все поле зрения усеяно массой мельчайших светящихся точек, находящихся в хаотичном броуновском движении.
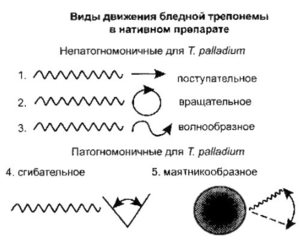
Бледные трепонемы движутся характерным образом: вращаются вокруг своей продольной оси, перемещаются в одном направлении, качаются наподобие маятника или совершают волнообразные, сократительные или сгибательные движения ("шагающая трепонема"). Бледная трепонема движется плавно, что является важной особенностью этого микроогранизма.

T. phagedenis, электронная микроскопия
В полости рта и на половых органах встречаются сапрофитные трепонемы: T . refringens и T. phagedenis (reiteri) в урогенитальном тракте и T. denticola в полости рта.
Непатогенные трепонемы морфологически сходны с T. pallidum. От них бледную трепонему отличает толщина, характер движения и форма завитков.
T.refringens колонизирует наружные половые органы. Эта бактерия движется быстро и неравномерно, отличается большей толщиной, отсутствием сгибательных движений, и более пологими и широкими завитками. T.denticola является представителем нормальной микрофлоры полости рта, ее завитки короче и направлены под более острым углом. В нормальной флоре наружных половых органов человека встречается также T. phagedenis.
Наличие непатогенных трепонем затрудняет исследования материала, взятого из поражений в полости рта или прямой кишке. При дифференциации трепонем может ошибиться даже опытный исследователь, поэтому присутствие этих микроорганизмов делает малодостоверным проведение исследования с данным материалом. Если необходимо провести тестирование материала, полученного из одного из указанных выше мест, то предпочтительнее выполнить DFA или NAAT (лучше отдать предпочтение методу ПИФ или молекулярно-биологическим методам).
Методом темнопольной микроскопии невозможно отличить бледную трепонему от патогенных возбудителей других трепонематозов — T. pallidum carateum (пинта), T. pallidum pertenue (фрамбезия), T. pallidum endemicum (беджель).
3. Применение темнопольной микроскопии для диагностики сифилиса
Микроскопию в темном поле можно применять для диагностики первичных и вторичных поражений кожи при сифилисе в результате заражения половым путем. В редких случаях этот метод можно использовать при третичном сифилисе (в последнем случае — если материал взят из глубины инфильтрата или со дна язвы).
Также с помощью этого метода исследуют поражения при раннем врожденном сифилисе, когда заражение плода бледной трепонемой произошло в утробе матери. Чтобы подтвердить диагноз "врожденный сифилис", для приготовления препарата для микроскопии можно использовать ткань пуповины, органы плода, выжатый сок плаценты, амниотическую (плодную) жидкость, отделяемое слизистой оболочки носа, содержимое пузырей (при ладонно-подошвенной сифилитической пузырчатке), тканевой жидкости (серума) с раздраженных папул.
Метод темнопольной микроскопии, используемый для диагностики сифилиса, отличается простотой, дешевизной, быстротой и достаточно высокой чувствительностью. Однако у него есть известные недостатки – невозможность диагностики скрытых и поздних форм сифилиса и непригодность для контроля излеченности. Даже многократный отрицательный результат микроскопического исследования на бледную трепонему не может исключить сифилис.
Кроме того, для проведения исследования методом ТПМ микроорганизмы T. pallidum должны быть подвижными. В условиях применения пациентами различных антибактериальных препаратов, в том числе для лечения других заболеваний, диагностическая чувствительность ТПМ снижается. В подобных случаях необходимо исследование методом прямой иммунофлюоресценции (ПИФ) или проведение серологического обследования на сифилис.
Для повышения информативности лабораторной диагностики разрабатываются более чувствительные и специфичные прямые тесты на основе молекулярно-биологических технологий, например различные модификации метода ПЦР.
Метод прямой иммунофлюоресценции (ПИФ)
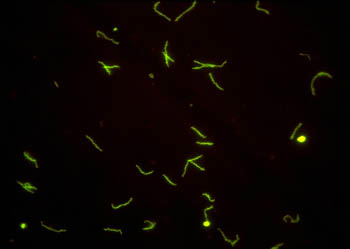
При необходимости микроскопия возбудителя в темном поле может быть дополнена прямой реакцией иммунофлюоресценции (ПИФ, direct fluorescent antibody test, DFA).
Прямой метод иммунофлюоресценции (по Кунсу) основан на взаимодействии антител, меченых флюорохромом, с антигеном, который находится на клетке, в клетке или в тканях. В качестве флюорохрома используют флюоресцеинизотиоционат (ФИТЦ).
Метод прямой иммунофлюоресценции предусматривает прямое выявление T. pallidum в образце при обработке материала специфическими моноклональными антителами. При этом на запарафинированные мазки или биопсийный материал накладываются противотрепонемные антитела, меченные флюоресцирующим красителем. Затем, образующиеся комплексы антиген—антитело исследуют под люминесцентным микроскопом.
В результате взаимодействия анти- T.pallidum антител, меченных ФИТЦ, и бледной трепонемы при люминесцентной микроскопии наблюдается специфическое ярко-зеленое свечение: бледная трепонема флюоресцирует ярко-зеленым цветом, сохраняя все морфологические признаки спирохеты.
Забор образцов производится таким же образом, как и для темнопольной микроскопии, при этом сам метод ПИФ является более точным, чувствительным и специфичным, чем ТПМ.
Метод ПИФ имеет преимущества перед темнопольной микроскопией для выявления бледной трепонемы. Флюоресцирующие микроорганизмы проще детектировать, вероятность спутать их с другими видами трепонем снижена. При этом возможна дифференцировка патогенных трепонем от непатогенных при исследовании материала со слизистых полости рта и прямой кишки, фиксация препаратов перед транспортировкой в лабораторию. Для исследования может быть использован материал, полученный при биопсии или аутопсии.
Кроме того, применение ПИФ ограничено из-за отсутствия промышленного производства и сертификации соответствующих ингредиентов в ряде стран, в частности, ФИТЦ-меченых моноклональных антител к патогенной бледной трепонеме.
Метод полимеразной цепной реакции (ПЦР)

Для диагностики сифилиса применяется прямой метод определения ДНК бледной трепонемы — метод ПЦР; это один из методов амплификации нуклеиновых кислот (МАНК, nucleic acid amplification test, NAAT).
Метод полимеразной цепной реакции (ПЦР) позволяет исследовать различные образцы (отделяемое сифилидов, биопсийный материал, биологические жидкости) в свежем, замороженном, фиксированном и парафинированном виде. В качестве объекта исследования методом ПЦР могут быть использованы соскобы шанкров и других высыпаний (папул, широких кондилом и т.д.), спинномозговая, амниотическая жидкость, сыворотка крови.
ПЦР–тесты для выявления ДНК бледной трепонемы были разработаны в 1991 году одновременно в нескольких лабораториях. Этот метод позволяет выявить и идентифицировать единственную молекулу ДНК бледной трепонемы среди сотен тысяч других молекул, что делает потенциально возможной диагностику нейросифилиса, третичного, врожденного сифилиса при наличии единичных трепонем в исследуемом материале.
Метод ПЦР высокоспецифичен, чувствителен и воспроизводим при правильном проведении и подготовке образцов. Однако, применительно к диагностике сифилиса, методы МАНК пока используется в исследовательских целях.
- PCR в режиме реального времени (PCR-RT). Учет полученных результатов происходит автоматически в режиме реального времени по уровню свечения флюорохромных меток;
- методика PCR-анализа с помощью обратной транскриптазы (PCR-ОТ);
- мультиплексная PCR (PCR-М, М-ПЦР), которая позволяет в биологической пробе одновременно определять наличие возбудителей нескольких заболеваний.
Основными достоинствами метода ПЦР и его модификаций является универсальность (возможность обнаружить любые нуклеиновые кислоты), весьма высокая чувствительность (80 – 94,7 %) и высокая специфичность (до 100 %). Результат получается быстро, для анализа необходима проба малого объема (несколько микролитров). Современные методы ПЦР позволяют одновременно исследовать нескольких возбудителей заболеваний, а также получать документальный ответ в виде фотографий и вносить результаты диагностики на компьютерные информационные носители. К недостаткам метода ПЦР-анализа следует отнести высочайшие требования к оснащению лаборатории, качеству тест–наборов и регламенту исследования.
Метод ПЦР является дополнительным и может быть рекомендован, главным образом, для исследования отделяемого эрозивных и язвенных высыпаний при подозрении на первичный сифилис, особенно при их локализации на слизистой оболочке рта; при применении пациентами местных и системных антибактериальных средств накануне обращения к врачу; при отрицательных результатах серологических тестов в начале первичного периода, когда ошибка метода ТПМ особенно значима.
Развитие высокочувствительного метода ПЦР и разработка его модификаций, оценивается как весьма перспективное. Особую важность этот метод приобретает при диагностике первичного серонегативного сифилиса (при котором серологические исследования дают отрицательный результат), раннего скрытого, врожденного сифилиса и нейросифилиса.
Препятствием к широкому внедрению метода ПЦР для диагностики сифилиса является отсутствие в массовой доступности тест-систем, разрешенных к медицинскому применению. В США применение ПЦР рекомендовано лабораториям, располагающим соответствующими тест-системами (в том числе созданными в самих лабораториях, in house). В России и странах Восточной Европы широкое использование метода лимитируется небольшим количеством наборов реагентов, прошедших валидацию и разрешенных к медицинскому применению на территории соответствующих государст
NASBA
NASBA - Nucleic Acid Sequence-Based Amplification, амплификация, основанная на последовательности нуклеиновых кислот (другие переводы - реакция амплификации на основе нуклеотидной последовательности нуклеиновых кислот, реакция транскрипционной амплификации). Методика NASBA основана на выделении РНК микроорганизма (в отличие от полимеразной цепной реакции, где используется ДНК). Этот метод тестирования считается одним из самых перспективных и многообещающих направлений молекулярной диагностики.
Использование в качестве мишени для NASBA видоспецифических участков рибосомальной РНК обеспечивает методу высокую специфичность. Так как РНК — менее стабильный по сравнению с ДНК тип генетического материала, который быстрее деградирует при разрушении клеток, то на основании результатов выявления РНК можно судить о наличии в образце жизнеспособных микроорганизмов, например, после проведенного лечения. С практической точки зрения важно, что для проведения NASBA в лабораторных условиях используется то же оборудование, что и для проведения ПЦР в реальном времени (PCR-RT). Кроме того, исходный биоматериал после ПЦР может исследоваться методом NASBA. В результате этого существует возможность интегрирования указанного метода в протокол лабораторного обследования, что позволит верифицировать возбудителя
Отдельные исследовательские коллективы уже получают достаточно перспективные результаты при изучении сифилитической инфекции методом NASBA и NASBA-RT, используя в качестве качестве мишени фрагмент гена 16s рРНК бледной трепонемы. Полученные данные позволяют отнести метод NASBA к диагностически перспективным в изучении сифилитической инфекции наряду с имеющимися методами диагностики.
Заражение сифилисом лабораторных животных
Задолго до открытия бледной трепонемы многие ученые стали проводить эксперименты по заражению сифилисом разнообразных животных. В естественных условиях животные сифилисом не болеют, но возможно искусственное заражение некоторых их видов. Первые успешные опыты были проведены на шимпанзе в начале 20-го века. Дальнейшие опыты на обезьянах привели к ряду блестящих научных открытий, но ввиду трудностей содержания и дороговизны обезьян, основными лабораторными животными стали кролики. Опыты с другими животными (холоднокровными, птицами, различными млекопитающими) давали отрицательный или недостаточный для практического применения результат. Некоторое значение имели только данные, полученные на морских свинках и мышах.
Заражение сифилисом кроликов является старейшим методом прямого выявления бледной трепонемы, т.к. кролик является наиболее чувствительным и удобным лабораторным животным для привития сифилиса. Заражение кроликов производят инокуляцией (введением микроорганизмов в ткани, от латинского inoculatio - "прививка") инфекционного материала в яичко. Чувствительность кроликов к инфекции Treponema pallidum практически 100%, если во взятом для прививки материале содержится достаточное количество бледных трепонем.
Московская медицинская академия им. И.М. Сеченова
Современные лабораторные методы и алгоритмы диагностики сифилиса
Журнал: Клиническая дерматология и венерология. 2015;14(6): 56‑61
Дано описание современных подходов к лабораторной диагностике сифилиса. Описаны прямые тесты (темнопольная микроскопия, прямая иммунофлюоресценция Treponema pallidum, полимеразная цепная реакция), позволяющие выявить самого возбудителя или его генетический материал. Приведены наиболее часто применяемые нетрепонемные и трепонемные тесты, используемые в серологической диагностике сифилиса; показания и ограничения к их применению. Дано описание двух современных алгоритмов, применяемых при серологическом обследовании больного с подозрением на сифилис: традиционного и реверсионного, описаны их достоинства и недостатки. Статья представляет интерес для практических врачей — дерматовенерологов, урологов, акушеров-гинекологов, врачей клинической лабораторной диагностики, в поле зрения которых могут оказаться больные манифестными и скрытыми формами сифилиса.
Московская медицинская академия им. И.М. Сеченова
Сифилис — системное инфекционное заболевание, вызываемое бледной трепонемой (Treponema pallidum, subspecies pallidum), остается общемировой проблемой здравоохранения.
В Москве в последние годы отмечена стойкая тенденция к снижению заболеваемости сифилисом. В 2013 г. уровень заболеваемости сифилисом составил 20,4 на 100 000 населения. Однако эпидемиологическая ситуация продолжает оставаться напряженной: в структуре сифилиса преобладают скрытые формы, растет число поздних форм инфекции, что диктует необходимость усиления эпидемиологического контроля над распространением заболевания и широкого применения врачами-дерматовенерологами современных высокочувствительных и специфичных методов лабораторной диагностики сифилиса [1].
Все лабораторные методы диагностики сифилиса подразделяются на прямые, позволяющие выявлять возбудителя или его генетический материал непосредственно в очагах поражения, и непрямые — для выявления антител к возбудителю сифилиса в сыворотке крови (серологическая диагностика).
При назначении пациенту лабораторного обследования по поводу сифилиса не следует забывать о том, что абсолютным критерием постановки диагноза является непосредственное выявление возбудителя заболевания — бледной трепонемы (T. pallidum) или его генетического материала [2].
T. pallidum в образцах, полученных из райц-серума сифилидов или инфицированных лимфоузлов при раннем сифилисе, можно обнаружить с помощью следующих прямых методов исследования:
• микроскопия в темном поле микроскопа, или темнопольная микроскопия (ТПМ);
• прямая иммунофлюоресценция (ПИФ) (для образцов из поражений в полости рта или из других очагов, где возможна контаминация трепонемами-комменсалами);
• полимеразная цепная реакция (ПЦР).
Наиболее убедительным доказательством инфицирования сифилисом является прямая визуализация T. pallidum в темном поле зрения [3].
Материалом для темнопольной микроскопии является серозное отделяемое с поверхности эрозии, язвы, мацерированной или экскориированной, эрозированной папулы или бляшки, иногда — содержимое пунктата лимфоузла. При исследовании в темном поле бледная спирохета выглядит в виде нежной подвижной спирали, слабо светящейся серебристым блеском. Исследование в темном поле микроскопа позволяет изучать T. pallidum в живом виде, а также дифференцировать ее от других трепонем как по морфологическим признакам, так и по характерным особенностям движения, что позволяет поставить диагноз даже без учета данных серологических тестов.
Вторым методом выявления возбудителя сифилиса в очагах поражения является метод ПИФ. В результате взаимодействия моноклональных антител анти-T. pallidum, меченных ФИТЦ, и бледной трепонемы, полученной из очагов поражения и помещенной на предметное стекло, при люминесцентной микроскопии наблюдается специфическое ярко-зеленое свечение. Метод удобен при исследовании материала, полученного со слизистой оболочки полости рта и прямой кишки, при биопсии или аутопсии. За счет использования видоспецифических моноклональных антител метод позволяет дифференцировать патогенную T. pallidum от трепонем-комменсалов [4]. В России данный метод не применяют ввиду отсутствия промышленного производства и сертификации соответствующих ингредиентов, в частности, моноклональных антител к патогенной бледной трепонеме, меченных ФИТЦ.
ПЦР позволяет обнаружить единственную молекулу ДНК возбудителя среди миллионов других молекул. Метод основан на принципе естественной репликации ДНК и заключается в размножении (амплификации) в пробирке определенных участков ДНК возбудителя в процессе повторяющихся температурных циклов. На каждом этапе вновь синтезированные молекулы копируются ферментом ДНК-полимеразой, благодаря чему происходит многократное удвоение специфических фрагментов ДНК [5].
Источниками обнаружения генетического материала возбудителя при постановке ПЦР у больных сифилисом могут являться: райц-серум (тканевая жидкость) генитальных язв, биопсийный материал кожных сифилидов, спинномозговая жидкость, амниотическая жидкость, плацента, периферическая кровь и семенная жидкость. Наиболее адекватным для исследования является райц-серум генитальных язв.
Чувствительность и специфичность метода ПЦР при исследовании райц-серума сифилидов при первичном сифилисе достигает 94,7—98,6%, при вторичном 80—98,6% и более выражена по сравнению с темнопольной микроскопией [6].
Широкое применение при обследовании на сифилис получили непрямые, серологические методы исследования, принцип которых заключается в выявлении в сыворотке или плазме крови или спинномозговой жидкости пациентов антител, ассоциированных с сифилитической инфекцией.
Первой серологической реакцией для диагностики сифилиса была реакция связывания комплемента, предложенная в 1906 г. Вассерманом, Нейсcером и Бруком [7]. Однако в настоящее время этот метод, ставший в свое время революционным и положивший начало серологической диагностике сифилиса, считается морально устаревшим: он длительно выполняется, субъективно интерпретируется, часто дает ложноотрицательные и ложноположительные результаты и не подлежит стандартизации.
Современные серологические тесты, применяемые для диагностики сифилиса, подразделяются на две большие группы: нетрепонемные (НТТ) и трепонемные (ТТ).
В НТТ на сифилис используется антиген нетрепонемного происхождения — кардиолипин-холестерол-лецитиновый комплекс [8, 9].
Основными видами НТТ, рекомендуемыми к применению на территории России, в настоящее время являются:
— РМП — реакция микропреципитации с плазмой и инактивированной сывороткой;
— RPR — тест быстрых плазменных реагинов (Rapid Plasma Reagins), или быстрый, или ускоренный плазмареагиновый тест;
— VDRL (Venereal Disease Research Laboratory) — тест исследовательской лаборатории венерических заболеваний.
Могут быть также использованы следующие их аналоги при условии, если тест-система имеет разрешение к медицинскому применению на территории Российской Федерации:
TRUST — тест с толуидиновым красным и непрогретой сывороткой (Toluidin Red Unheated Serum Test);
RST — тест на скрининг реагинов (Reagin Screen Test);
USR — тест на реагины с непрогретой сывороткой (Unheated Serum Reagins) [10, 11].
Показаниями к применению НТТ на сифилис являются:
• проведение скрининга населения на сифилис;
• контроль эффективности терапии (по титру антител в парных сыворотках, полученных до и после лечения);
• определение активности инфекции (по высоте титра антител).
НТТ просты в исполнении, недороги, не требуют специального оборудования и длительного времени; при этом реакции являются высоко чувствительными и специфичными.
Чувствительность РМП варьирует в зависимости от стадии заболевания: от 81% при первичном сифилисе до 94—99% при вторичном и скрытых формах сифилиса. Чувствительность зарубежных тестов варьирует от 59 до 100%, специфичность — от 93 до 99%.
После адекватного специфического лечения сифилиса содержание антител к возбудителю сифилиса, выявляемых в НТТ, постепенно снижается, тесты из резко положительных становятся слабоположительными, а затем отрицательными. В связи с этим НТТ используют для оценки эффективности лечения.
Ограничениями применения НТТ являются ранние стадии сифилиса (период инкубации, начало первичного периода), так как данные реакции становятся позитивными лишь спустя 2—3 нед после появления твердого шанкра, и поздние стадии (поздний скрытый и третичный сифилис, сифилис с поражением внутренних органов и нервной системы), так как лабильные преципитины первыми элиминируются из организма при длительном течении сифилитической инфекции. К числу недостатков НТТ следует отнести также субъективный визуальный учет, хотя в настоящее время разработаны системы для видеоцифровой регистрации результатов с их переводом в цифровые данные.
Следует иметь в виду, что антитела, определяемые в НТТ на сифилис, могут выявляться при ряде острых и хронических инфекционных и соматических заболеваний, которые сопровождаются гибелью клеток и разрушением тканей, что может стать причиной ложноположительных результатов НТТ, которые встречаются при скрининге населения на сифилис в 1—3% случаев [12].
В ТТ применяется антиген трепонемного происхождения — патогенная бледная трепонема, рекомбинантные белки, полученные генно-инженерным способом или пептиды, полученные путем искусственного химического синтеза.
Основными ТТ, рекомендуемыми к применению на территории России, в настоящее время являются:
ИФА — иммуноферментный анализ (ELISA — Enzymelynced immunosorbent assay, EIA – Enzyme immunoassay);
РПГА — реакция пассивной гемагглютинации (ТРНА, TPPA — Treponema pallidum hemagglutination assay, Treponema pallidum partiсle agglutination assay);
РИФ — реакция иммунофлюоресценции (FTA Fluorescent treponemal antibody);
ИХЛ — иммунохемилюминесценция (СLIA — Chemiluminescence Immunoassay);
Простые быстрые тесты у постели больного — ПБТ (РОС — point of care tests);
РИБТ (РИТ) — реакция иммобилизации бледных трепонем (TPI — Treponema pallidum immobilization test) [13, 14].
Показаниями к применению ТТ являются:
• подтверждение положительных результатов НТТ;
• дополнительное подтверждение в случае расхождения результатов скринингового ТТ и последующего НТТ;
• скрининг населения на сифилис (ИФА, РПГА, простые быстрые тесты).
К числу несомненных достоинств ТТ относится их высокая чувствительность и особенно специфичность, возможность подтверждения (верификация) результатов НТТ.
Часть ТТ (ИФА, ИХЛ, иммуноблоттинг) может быть автоматизирована и выполняться на анализаторах с получением объективного отчета в электронном виде. Для РПГА имеется возможность видеоцифровой регистрации результатов.
ТТ могут быть использованы для подтверждения клинического диагноза сифилиса на ранних стадиях инфекции, когда НТТ еще отрицательны, но есть клинические, эпидемиологические или анамнестические подозрения на сифилис. Однако чувствительность при первичном сифилисе этих тестов в совокупности недостаточна (76—86%) в основном за счет РИБТ, которая становится позитивной, начиная со второй половины первичного периода сифилиса.
Ранние стадии сифилиса (начало первичного периода сифилиса, период инкубации) могут быть диагностированы при использовании IgM-тестов, которые выявляют ранние трепонемоспецифические IgM, первыми появляющимися в организме больного сифилисом в ответ на внедрение возбудителя (варианты РИФ-абс IgM, ИФА-IgM, ИХЛ-IgM, IgM-иммуноблоттинга) [15—19].
Трепонемные методы хорошо выявляют вторичный и скрытый сифилис (чувствительность составляет 98—100%) [20].
ТТ могут быть использованы для установления ретроспективного диагноза сифилиса, а также для распознавания ложноположительных результатов НТТ.
С использованием ряда ТТ (ИФА, РПГА, ИХЛ, ПБТ) можно проводить скрининг отдельных категорий населения на сифилис (доноры, беременные, больные офтальмологических, психоневрологических, кардиологических стационаров, ВИЧ-инфицированные).
ТТ не могут быть использованы для контроля эффективности лечения, так как длительно остаются положительными после окончания лечения сифилиса (в особенности РИБТ, РПГА). Они сложнее в техническом отношении, чем НТТ, что несколько ограничивает их применение.
В настоящее время существуют два основных подхода к проведению скрининга и обследования больных на сифилис: первый подход характеризуется началом обследования с назначения НТТ, второй — когда обследование начинается с ТТ.

Рис. 1. Традиционный алгоритм серологического скрининга на сифилис (из лекции Фриго Н.В. на цикле усовершенствования врачей, РМАПО, 2012).
Контрольное обследование после лечения проводится с помощью РМП или ее модификации в полуколичественном варианте. По снижению ее титра судят об эффективности терапии
Заключительное обследование проводят не ранее чем через 1 год. Ставится та же специфическая реакция, что и при первичном обследовании. Наличие ее положительных результатов не является препятствием для снятия пациента с учета [13].
Традиционный алгоритм скрининга на сифилис имеет свои преимущества и недостатки. Несомненным преимуществом является то, что он выявляет активную инфекцию. Однако данный алгоритм дает высокий процент ложноположительных результатов, нуждается в подтверждении ТТ и может пропустить ранний первичный сифилис или пролеченную инфекцию.

Рис. 2. Реверсионный алгоритм серологического скрининга на сифилис (из лекции Фриго Н.В. на цикле усовершенствования врачей, РМАПО, 2012).
При положительном результате ТТ следует постановка НТТ с определением титра антител.
Если НТТ дает отрицательный результат, проводится дополнительное тестирование с использованием второго чувствительного и специфичного (подтверждающего) ТТ (например, РПГА).
При отрицательном результате дополнительного подтверждающего теста (РПГА–) делается вывод о том, что человек не болен сифилисом; при этом положительный результат скринингового ТТ (первый) расценивается как ложноположительный.
При положительном результате (РПГА+) делается вывод о том, что у человека имеется сифилис в настоящем или был перенесен в прошлом.
Можно привести ряд аргументов в пользу использования реверсионного алгоритма:
• возможность автоматизации ТТ;
• высокая производительность (до 180 тестов в час);
• отсутствие или сведение до минимума ручных манипуляций (безопасность персонала и высокое качество исследований);
• низкая себестоимость при больших объемах тестирования (поток);
• отсутствие ложнонегативных реакций и феномена прозоны (высокая чувствительность);
• возможность детекции IgM антител — потенциальная возможность диагностики раннего сифилиса.
Главным преимуществом реверсионного алгоритма является то, что он выявляет ранний или пролеченный сифилис, что может быть пропущено при традиционном скрининге. Вместе с тем он также имеет ряд недостатков: реверсионный алгоритм нуждается в постановке НТТ для подтверждения активной инфекции и контроля эффективности терапии, может давать ложноположительные результаты (из-за недостаточно высокой специфичности тестов), не позволяет дифференцировать активную и пролеченную инфекцию (и это его основной недостаток!).
Проблемы возникают чаще всего при наличии положительного результата ТТ и отрицательного результата НТТ. Тактика в этом случае должна быть следующей.
• При несовпадении результатов скринингового ТТ и НТТ (ТТ+, НТТ–) необходима постановка дополнительного подтверждающего ТТ.
• Подтверждающий Т.Т. должен иметь чувствительность не ниже, а специфичность — выше, чем скрининговый ТТ.
• В качестве дополнительного подтверждающего теста в этих случаях может быть рекомендована РПГА (РИФабс не рекомендуется ввиду более низкой аналитической чувствительности в сравнении с другими ТТ) [24].
• Результаты скрининга следует анализировать с учетом клинической картины заболевания и анамнестических данных пациентов (в частности, полноты и качества проведенного специфического лечения по поводу ранее перенесенного сифилиса).
Таким образом, приведенные данные свидетельствуют о том, что в распоряжении дерматовенерологов и врачей других специальностей в настоящее время имеется большой арсенал как прямых, так и непрямых лабораторных методов исследования для диагностики сифилиса. Рациональное использование имеющихся технологий и алгоритмов диагностики позволяет осуществлять эпидемиологический надзор и контроль над распространением сифилиса на территории города Москвы и других субъектов Российской Федерации.
Лабораторные методы диагностики сифилиса: современное состояние и перспективы на будущее
Сифилис-это многоэтапное заболевание, вызываемое Treponema pallidum (T. pallidum). Для эффективного контроля за распространением сифилиса особенно важен точный и эффективный метод диагностики сифилиса.
С увеличением числа пациентов, инфицированных сифилисом за последние 20 лет, ранняя диагностика и раннее лечение имеют важное значение для снижения распространенности сифилиса. Из-за своих разнообразных проявлений, которые могут наблюдаться и при других инфекциях, это заболевание часто приводит клиницистов в замешательство. Поэтому чувствительный метод выявления T. pallidum является основополагающим для быстрой диагностики сифилиса.
Морфологическое наблюдение, иммуногистохимический анализ, тест на инфекционность кроликов, серологические тесты и анализы амплификации нуклеиновых кислот применяются для диагностики сифилиса. Морфологическое наблюдение, включая микроскопию в темном поле, окрашивание серебром и прямое флуоресцентное окрашивание антител к T. pallidum, может быть использовано в качестве метода прямого обнаружения образцов шанкра при первичном сифилисе.
Иммуногистохимия - это высокочувствительный и специфичный анализ, особенно при биопсии очага вторичного сифилиса. Тест на инфекционность кроликов рассматривается как чувствительный и надежный метод выявления T. pallidum в клинических образцах и используется в качестве исторического стандарта для диагностики сифилиса.
Серологические тесты на сифилис широко применяются с использованием нетрепонемных или трепонемных тестов по традиционному или обратному алгоритму и остаются золотым стандартом в диагностике пациентов с сифилисом. Кроме того, анализ амплификации нуклеиновых кислот способен обнаруживать ДНК T. pallidum в образцах пациентов с сифилисом. Примечательно, что ПЦР, вероятно, является перспективным методом, но его еще предстоит усовершенствовать. Все упомянутые выше методы играют важную роль на различных стадиях сифилиса. Цель предлагаемого вниманию обзора - дать краткое описание характеристик эффективности методов выявления сифилиса.
Laboratory Diagnostic Tools for Syphilis: Current Status and Future Prospects (nih.gov)
Luo Y, Xie Y, Xiao Y. Laboratory Diagnostic Tools for Syphilis: Current Status and Future Prospects. Front Cell Infect Microbiol. 2021 Feb 8;10:574806. doi: 10.3389/fcimb.2020.574806. PMID: 33628742; PMCID: PMC7897658.
Читайте также:


