Лактозный оперон у кишечной палочки
Обновлено: 23.04.2024
Оперон, обеспечивающий у E.coliспособность к сбраживанию молочного сахара – лактозы, состоит из промотора, оператора и трех структурных генов. Ген lac Z кодирует фермент- генгалактозидазу, катализирующую гидролиз лактозы до глюкозы и галактозы; ген lac Y-галактозидпермеазу, обеспечивающую транспорт различных сахаров, включая лактозу, мелибиозу и рафинозу, в клетку; ген lac А –тиогалактозидтрансацетилазу, роль которой обычно в утилизации лактозы не ясна. Все три белка обычно присутствуют в клеткахЕ.coliв следовых количествах. Однако при выращивании бактерий на среде, в которой единственным источником углерода и энергии служит лактоза, количество указанных ферментов увеличивается в 1000 раз.
Ген–регулятор лактозного (lac) оперона, обозначаемый lac 1, кодирует белок–репрессор. В активной форме это тетрамер, образованный четырьмя копиями продукта гена lac 1 – полипептидами, состоящими из 360 аминокислот. Клетки с мутациями в гене lac 1 конститутивны по синтезу ферментов, кодируемых генами lac Z, Y и A.

Конститутивный синтез продуктов этих генов возможен не только в случае lac 1 -мутаций в гене репрессоре, но и в случае мутаций в операторе, обозначаемых О. Такие мутации всегда цис–доминантны, поскольку, в отличие от гена–репрессора, оператор может влиять на возможность транскрипции структурных генов только тогда, когда он находится непосредственно рядом с промотором. Если в клетке находится индуктор, он конкурирует с оператором за молекулы репрессора, причем репрессор в первую очередь связывается с индуктором.
В качестве индукторов могут служить различные соединения. Лактоза представляет собой индуктор и одновременно субстрат. В нормальных клетках даже в отсутствие индуктора остаточная активность пермеазы и –галактозидазы обеспечивают возможность проникновения в клетку минимального количества лактозы, которая в результате реакции, катализируемой–галактозидазой, переходит в аллолактозу. Последняя связывается с репрессором, обусловливая его отсоединение от оператора, что, в свою очередь, открывает путь РНК–полимеразе для связывания с промотором и транскрипции генов lac Z, Y и A. К соединениям, являющимся только индукторами, но не субстратами, относятся изопропил–D–тиогалактопиранозид (ИПТГ) и тиометил––D–галактопиранозид (ТМГ), часто используемые для исследования регуляции lac–оперона.
Мутации в промоторе в отличие от мутаций в гене–репрессоре и в операторе не влияют на индуцируемость оперона, однако они регулируют уровень его экспрессии, изменяя эффективность присоединения РНК–полимеразы, и тем самым частоту инициации транскрипции lac–оперона.
Наряду с негативной системой регуляции, lac–оперон контролируется и с помощью позитивно действующих элементов. Их обнаружение связано с исследованием феномена Ж. Моно диаусией, суть которого состоит в том, что утилизация лактозы начнется лишь после того, как будет использована вся имеющаяся в среде глюкоза. Этот феномен, как установили Б. Магазаник с соавторами, - одно из проявленийкатаболитной репрессии или глюкозного эффекта, известного еще с 40-х годов и выражающегося в неспособностиE.coli, катаболизировать различные углеводы (лактозу, арабинозу, галактозу и др.) в присутствии глюкозы, как более эффективного источника энергии.
Расшифровать механизм глюкозного эффекта сумели Р. Перлман и А. Пастан, обнаружившие, что транскрипция lac–оперона контролируется двумя элементами: небольшой молекулой–эффектором, циклическим аденозинмонофосфатом (цАМФ) и белком–активатором САР (от первых букв англ. Catabolite fctivator protein– белок-активатор катаболизма), называемым также белком–рецептором цАМФ. У эукариот цАМФ является медиатором действия гормонов. Оказалось, что добавление цАМФ к растущим в среде с глюкозой клеткам E .coliхотя и замедляет скорость их роста, но снимает катаболическую репрессию, обусловливая тем самым возможность экспрессии лактозного оперона в условиях одновременного присутствия в среде лактозы и глюкозы. Позднее была показана обратная зависимость между содержанием в клетке цАМФ и глюкозы: глюкоза подавляет активность фермента, синтезирующего цАМФ из АТФ. Этот фермент, названныйаденилатциклазой, кодируется геномсуа.

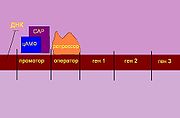
В структуре промотора lac–оперона выявлено два сайта связывания. Один из них взаимодействует с РНК – полимеразой, другой – с комплексом САР–цАМФ. Присоединение комплекса САР–цАМФ к своему сайту на промоторе – условие индукции оперона. Следовательно, этот комплекс позитивно контролирует транскрипцию lac–оперона. Белок САР состоит из двух идентичных субъединиц с общей Моколо 45000, кодируемых геном САР, илиCRP. Мутации в генесарнарушают участок связывания белка с цАМФ, либо расширяют спектр кофакторов, объединение с которыми обеспечивает индукцию ферментов lac–оперона. У некоторых мутантов в генесартаким кофактором наряду с цАМФ может служить и цГМФ.
В норме, то есть в присутствии глюкозы и в отсутствии цАМФ, белок САР не может объединяться с промотором lac–оперона. В свою очередь, РНК–полимераза не способна эффективно связываться с этим промотором, если к нему не присоединен комплекс САР–цАМФ. Некоторые мутации в промоторе обусловливают независимость экспрессии lac – оперона от глюкозного эффекта, снижая сродство промотора к комплексу САР–цАМФ.
Таким образом, транскрипция lac–оперона на самом деле находится под двойным – негативным и позитивным– контролем. Комплекс САР–цАМФ позволяет РНК–полимеразе присоединиться к матричной ДНК до начала транскрипции. Репрессор – продукт гена lac 1–препятствует инициации синтеза иРНК.
В настоящее время расшифрована полная нуклеотидная последовательность регуляторной области lac–оперона, включающая промотор и оператор. Более того, ДЖ. Шапиро и ДЖ. Беквит с соавторами (1969) сумели выделить чистую ДНК этого оперона, включающую фрагмент гена lac1, полностью промоторную и операторную последовательности, ген lac Z , а также фрагмент гена lac Y. Выяснение структурной организации оператора lac–оперона показало, что существенную роль во взаимодействиях мультимерных белков типа lac–репрессора или РНК–полимеразы с ДНК играют симметричные структуры – палиндромы. Оператор lac–оперона состоит из 26 п.н., из которых 14 представляют собой палиндром: в различных цепях они читаются одинаково, но в противоположных направлениях. Палиндром обнаружен и в участке промотора, связывающемся с комплексом САР–цАМФ.
Лактозный оперон, или lac оперон - участок генома бактерий, отвечающий за усвоение клеткой (гидролиз)лактозы.
Регуляция гидролиза лактозы у бактерий, а точнее, у кишечной палочки (Escherichia coli) была исследована в 1960х годах учеными Ф. Жакобом и Ж. Моно (получившими в 1965 году Нобелевскую премию совместно с А. Львовым). Суть ее заключается в том, что лактоза не используется клеткой, если есть достаточное количество более удобоваримой пищи — глюкозы. Если нет ни того, ни другого, синтез ферментов для усвоения лактозы также не ведется.
Достигается это благодаря подавлению специальным белком-репрессором генов, ответственных за синтез фермента, разлагающего лактозу на глюкозу и галактозу, и транспортного белка, доставляющего лактозу в клетку.
Содержание
Структура лактозного оперона
Лактозный оперон (lac operon) состоит из трех структурных генов, промотора, оператора и терминатора. Принимается, что в состав оперона входит также ген-регулятор, который кодирует белок-репрессор. Структурные гены лактозного оперона - lacZ, lacY и lacA.
- lacZ кодирует фермент β-галактозидазу - фермент, расщепляющий дисахарид лактозу на глюкозу и галактозу.
- lacY кодирует β-галактозид пермеазу, мембранный транспортный белок, который переносит лактозу внутрь клетки.
- lacA кодирует β-галактозид трансацетилазу, фермент, преносящий ацетилную группу от ацетил-КoA на бета-галактозиды.
Для катаболизма лактозы необходимы только продукты lacZ и lacY, роль продукта lacA не ясна.
Механизм регуляции
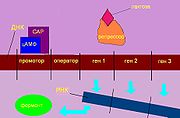
Нужные для обмена лактозы белки синтезируются, как и все белки, на рибосомах. Эти белки закодированы в полицистронной матричной (информационной) РНК. Та, в свою очередь, синтезируется другим ферментом - ДНК-зависимой РНК-полимеразой по матрице ДНК. Процесс копирования мРНК с ДНК называют транскрипцией. ДНК-зависимая РНК-полимераза начинает транскрипцию с определенного участка ДНК — промотора. За ним следует другой участок — оператор, и только потом структурные гены (отвечающие собственно за синтез белков). При небольшом количестве лактозы в клетке оператор непрочно соединяется с репрессором — белком, мешающим контакту РНК-полимеразы и ДНК и, следовательно, подавляющим синтез мРНК. То есть, если нет субстрата для реакции, не производится и катализатор для нее.
Здесь действует принцип положительной прямой связи — чем больше в клетке лактозы, тем больше ферментов для ее усвоения вырабатывается, — а также отрицательной обратной связи: чем больше ферментов, тем меньше лактозы остается (она расщепляется), следовательно, тем меньше ферментов вырабатывется в следующий отрезок времени (следует также добавить, что ферменты недолговечны — они разлагаются через некоторое время).
Биологический смысл системы регуляции лактозного оперона
Благодаря этому механизму бактерия экономит энергию, имея возможность синтезировать ферменты не все время, а только тогда, когда это необходимо. Сходный механизм регуляции имеется у большинства прокариот; у эукариот он устроен значительно сложнее.

Лактозный оперон (lac оперон) — полицистронный оперон бактерий, кодирующий гены метаболизма лактозы.
Регуляция экспрессии генов метаболизма лактозы у кишечной палочки (Escherichia coli) была впервые описана в 1961 году учеными Ф. Жакобом и Ж. Моно [1] (получившими в 1965 году Нобелевскую премию совместно с А. Львовым). Бактериальная клетка синтезирует ферменты, принимающие участие в метаболизме лактозы, лишь в том случае, когда лактоза присутствует в окружающей среде и клетка испытывает недостаток глюкозы.
Содержание
Структура
Лактозный оперон (lac operon) состоит из трех структурных генов, промотора, оператора и терминатора. Принимается, что в состав оперона входит также ген-регулятор, который кодирует белок-репрессор.
Структурные гены лактозного оперона — lacZ, lacY и lacA:
- lacZ кодирует фермент β-галактозидазу, которая расщепляет дисахарид лактозу на глюкозу и галактозу,
- lacY кодирует β-галактозид пермеазу, мембранный транспортный белок, который переносит лактозу внутрь клетки.
- lacA кодирует β-галактозид трансацетилазу, фермент, переносящий ацетильную группу от ацетил-КoA на бета-галактозиды.
Для катаболизма лактозы необходимы только продукты генов lacZ и lacY, роль продукта гена lacA не ясна. Возможно, что реакция ацетилирования дает бактериям преимущество при росте в присутствии определенных неметаболизируемых аналогов бета-галактозидов, поскольку эта модификация ведет к их детоксикации и выведению из клетки.
Регуляция




РНК-полимераза начинает транскрипцию с промоторного района, который перекрывается с операторным районом. В отсутствие или при низкой концентрации лактозы в клетке белок-репрессор, который является продуктом моноцистронного оперона LacI, обратимо соединяется с операторным районом и препятствует транскрипции. Таким образом, в отсутствие лактозы в клетке ферменты для метаболизма лактозы не синтезируются.
Даже в случае, когда в плазматической мембране клетки отсутствует фермент β-галактозидпермеаза, лактоза из окружающей среды может попадать в клетку в небольших количествах. В клетке две молекулы лактозы связываются с белком-репрессором, что приводит к изменению его конформации и далее к диссоциации белка-репрессора от операторного участка. Может осуществляться транскрипция генов лактозного оперона. При снижении концентрации лактозы новые порции белка-репрессора взаимодействуют с операторными последовательностями и препятствуют транскрипции. Данный механизм регуляции активности лактозного оперона называют позитивной индукцией. Веществом-индуктором служит лактоза; при её связывании с белком-репрессором происходит его диссоциация от операторного участка.
Итак, ферменты для усвоения лактозы синтезируются в клетке кишечной палочки при двух условиях: 1) наличие лактозы; 2) отсутствие глюкозы. Регуляция работы лактозного оперона в зависимости от концентрации лактозы происходит по принципу отрицательной обратной связи: чем больше лактозы — тем больше ферментов для её катаболизма (положительная прямая связь); чем больше ферментов — тем меньше лактозы, чем меньше лактозы — тем меньше производится ферментов (двойная отрицательная обратная связь).
Биологический смысл
Благодаря описанному механизму регуляции транскрипции генов, входящих в состав лактозного оперона, бактерии оптимизируют энергетические затраты, синтезируя ферменты метаболизма лактозы не постоянно, а лишь тогда, когда клетке это необходимо. Сходный механизм регуляции имеется у большинства прокариот; у эукариот он устроен значительно сложнее.
Лактозный кишечной палочки (Escherichia coli) была исследована в 1960х годах учеными Ф. Жакобом и Ж. Моно (получившими в 1965 году А. Львовым ). Суть ее заключается в том, что лактоза не используется клеткой, если есть достаточное количество более удобоваримой пищи — генов, ответственных за синтез фермента, разлагающего лактозу на глюкозу и галактозу, и транспортного белка, доставляющего лактозу в клетку.
Содержание
Структура лактозного оперона
Механизм регуляции
Случай, когда есть глюкоза, и нет лактозы
Случай, когда есть глюкоза, и есть лактоза
Случай, когда нет глюкозы, и нет лактозы
Случай, когда нет глюкозы, и есть лактоза
Нужные для обмена лактозы белки синтезируются, как и все белки, на рибосомах. Эти белки закодированы в РНК. Та, в свою очередь, синтезируется другим ферментом - ДНК-зависимой РНК-полимеразой по матрице ДНК. Процесс копирования мРНК с ДНК называют отрицательной обратной связи: чем больше ферментов, тем меньше лактозы остается (она расщепляется), следовательно, тем меньше ферментов вырабатывется в следующий отрезок времени (следует также добавить, что ферменты недолговечны — они разлагаются через некоторое время).
Но синтез ферментов зависит не только от концентрации лактозы — он не ведется, если в клетке есть достаточное количество Биологический смысл системы регуляции лактозного оперона
Благодаря этому механизму бактерия экономит энергию, имея возможность синтезировать ферменты не все время, а только тогда, когда это необходимо. Сходный механизм регуляции имеется у большинства прокариот; у эукариот он устроен значительно сложнее.
См также
Источники\Ссылки
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Лактозный оперон. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
Лактозный оперон (lac оперон) — полицистронный оперон бактерий, кодирующий гены метаболизма лактозы.
Регуляция экспрессии генов метаболизма лактозы у кишечной палочки (Escherichia coli) была впервые описана в 1961 году учеными Ф. Жакобом и Ж. Моно (получившими в 1965 году Нобелевскую премию совместно с А. Львовым). Бактеральная клетка синтезирует ферменты, принимающие участие в метаболизме лактозы, лишь в том случае, когда лактоза присутствует в окружающей среде и клетка испытывает недостаток глюкозы.
Структура. Лактозный оперон (lac operon) состоит из трех структурных генов, промотора, оператора и терминатора. Принимается, что в состав оперона входит также ген-регулятор, который кодирует белок-репрессор.
Структурные гены лактозного оперона — lacZ, lacY и lacA:
lacZ кодирует фермент β-галактозидазу, которая расщепляет дисахарид лактозу на глюкозу и галактозу,
lacY кодирует β-галактозид пермеазу, мембранный транспортный белок, который переносит лактозу внутрь клетки.
lacA кодирует β-галактозид трансацетилазу, фермент, переносящий ацетильную группу от ацетил-КoA на бета-галактозиды.
Для катаболизма лактозы необходимы только продукты генов lacZ и lacY, роль продукта гена lacA не ясна.
Регуляция. РНК-полимераза начинает транскрипцию с промоторного района, который перекрывается с операторным районом. В отсутствие или при низкой концентрации лактозы в клетке белок-репрессор, который является продуктом моноцистронного оперона LacI, обратимо соединяется с операторным районом и препятствует транскрипции. Таким образом, в отсутствие лактозы в клетке ферменты для метаболизма лактозы не синтезируются.
Даже в случае, когда в плазматической мембране клетки отсутствует фермент β-галактозидпермеаза, лактоза из окружающей среды может попадать в клетку в небольших количествах. В клетке две молекулы лактозы связываются с белком-репрессором, что приводит к изменению его конформации и далее к диссоциации белка-репрессора от операторного участка. Может осуществляться транскрипция генов лактозного оперона. При снижении концентрации лактозы новые порции белка-репрессора взаимодействуют с операторными последовательностями и препятствуют транскрипции. Данный механизм регуляции активности лактозного оперона называют позитивной индукцией. Веществом-индуктором служит лактоза; при её связывании с белком-репрессором происходит его диссоциация от операторного участка.
Итак, ферменты для усвоения лактозы синтезируются в клетке кишечной палочки при двух условиях: 1) наличие лактозы; 2) отсутствие глюкозы. Регуляция работы лактозного оперона в зависимости от концентрации лактозы происходит по принципу отрицательной обратной связи: чем больше лактозы — тем больше ферментов для её катаболизма (положительная прямая связь); чем больше ферментов — тем меньше лактозы, чем меньше лактозы — тем меньше производится ферментов (двойная отрицательная обратная связь).
Биологический смысл. Благодаря описанному механизму регуляции транскрипции генов, входящих в состав лактозного оперона, бактерии оптимизируют энергетические затраты, синтезируя ферменты метаболизма лактозы не постоянно, а лишь тогда, когда клетке это необходимо. Сходный механизм регуляции имеется у большинства прокариот; у эукариот он устроен значительно сложнее.
Читайте также: