Лечение альвеококкоза у кошек
Обновлено: 25.04.2024
Заболевание, которое у плотоядных не вызывает клинических признаков, но является серьёзной проблемой для здоровья человека и животных, вызываемое ленточными гельминтами семейства Taeniidae.
Цестоды в стадии имаго паразитируют в тонком отделе кишечника плотоядных животных, а личиночная стадия проходит в паренхиматозных органах промежуточных хозяев.
Распространённость.
В связи с контролем мяса сельскохозяйственных животных Е. granulosis во многих странах встречается весьма редко. Более часто эти цестоды встречаются на Балканах, в Италии, Греции, Испании, из других материков встречается в Америке, Африке и Азии. В России наибольшее распространение эхинококкоз имеет в сельской местности.
Альвеококкоз – наиболее распространён в США, Канаде, Азии, Австралии. В Европе встречается в основном в Альпийских странах, то есть во Франции, Германии, Швейцарии, Австрии и в Южной Европе.
Биология развития. Происходит с участием дефинитивных хозяев (собак, волков, шакалов, лисиц).
Для обеих цестод промежуточными хозяевами являются крупный и мелкий рогатый скот, верблюды, свиньи, лошади, лоси, олени, и др. Однако для альвеококкуса облигатными промежуточными хозяевами являются домовые мыши, суслики, крысы, белки, зайцы, бобры, нутрии.
Заражение.
Промежуточные хозяева, у которых в паренхиматозных органах образуется пузырчатая стадия цестод, заражаются яйцами гельльминтов, заглатывая их вместе с кормом или водой.
Дефинитивные хозяева заражаются при поедании внутренних органов промежуточных хозяев, пораженных пузырями эхинококкуса и альвеококкуса. В тонком отделе кишечника собак эхинококкусы развиваются до имаго за 68—97 суток, альвеококкусы — за 32—52 суток. Продолжительность жизни цестод обеих видов в кишечнике дефинитивных хозяев составляет около 5—7 мес. Человек заражается личинками обоих гельминтов, нередки смертельные случаи. Альвеококкоз чаще регистрируется у охотничьих собак.
В печени, лёгких, иногда и в других органах развивается самый большой тип ларвоцисты – эхинококк, который может вырастать до размеров головы ребёнка и для своего хозяина исключительно патогенен. Внешнюю оболочку образует непрозрачная ткань, внутренний слой – прозрачная зародышевая стенка, в которой образуются сколексы и дочерние пузырьки, в которых также могут образовываться сколексы.
Схема развития представлена на рисунке:
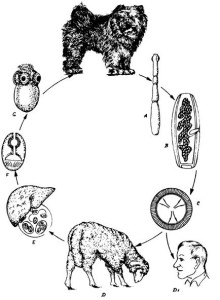
Рис.: Цикл развития Echinococcus granulosis. Взрослый гельминт (А), который паразитирует у собак, отличается последним зрелым члеником (В). Членик наполнен яйцами (С), морфологически схожими с родом Taenia. Этими яйцами заражаются промежуточные хозяева – сельскохозяйственные животные (D), а также человек (D1). Ларвоциста (Е) чаще всего образуется в печени и содержит инвагинированные сколексы (F). При поедании дефинитивным хозяином сколексы активизируются и развиваются (G).
Симптомы.
Собаки могут носить в кишечнике несколько тысяч взрослых гельминтов, причём клинические признаки заболевания могут быть минимальными.
Гельминты, внедряясь глубоко в слизистую кишечника, оказывают механическое воздействие на окружающую ткань, вызывая атрофические изменения ворсинок. Нарушается секреторно-моторная функция пищеварительного канала, ухудшается и извращался аппетит, наблюдаются поносы, запоры и исхудание собак. В области ануса появляется зуд. В крови больных собак уменьшается число эритроцитов, снижается уровень гемоглобина, проявляется лейкоцитоз и эозинофилия.
Диагноз.
Болезнь диагностируют комплексно. Прижизненный диагноз ставят исследованием фекалий, обнаружением сегментов гельминта и яиц тениидного типа, но только в том случае, если паразиты обитают в кишечнике, локализацию пузырей в паренхиматозных органах выявляют сканированием.
Лечение и профилактика.
Для лечения эхинококкоза и альвеококкоза пригодны далеко не все антигельминтики, обычно рекомендуемые против цестод плотоядных. Из множества цестодоцидных химиопрепаратов наиболее эффективным и надежным является празиквантел.
Внутренние препараты в виде таблеток, суспензий и паст:
- Дронтал (пирантел-эмбонат + празиквантел) – для кошек
- Дронтал + (Празиквантел + Пирантел-эмбонат + Фебантела) – для собак
- Дирофен – паста (празиквантел + пирантела памоат)- для собак и кошек
- Азинокс (празиквантел) – для собак и кошек
- Квантум (мебендазол + празиквантел) – для собак
- Диронет (пирантела памоат + празиквантел + ивермектин) – для собак и кошек
- Празицид – суспензия (празиквантел + пирантела памоат) – для собак и кошек
- Празитаб (празиквантел + пирантел памоат) – для кошек
- Празитаб + (празиквантел +пирантел памоат + фебантел) – для собак
Наружные препараты (на холку):
- Профендер ( эмодепсид + празиквантел) – для кошек
Даже если вы не наблюдаете у питомца явных признаков инвазии, рекомендуется производить дегельминтизацию 1 р.\ 3 мес., чтобы предотвратить возможное развитие паразитов, а также обезопасить свою семью от заражения. Дегельминтизацию следует производить и в тех случаях, если животное совсем не гуляет на улице, поскольку яйца паразита может принести любой человек на подошве обуви.
С точки зрения профилактики не следует кормить собак сырыми внутренностями сельскохозяйственных животных. Можно достигнуть девитализации эхинококков тщательной тепловой обработкой – варкой или замораживанием до – 18…– 20 °C минимально за 3 дня.
Предупреждение.
Эхинококк (гидатид) развивается у человека после проглатывания яиц, которые находятся в зрелом членике, выделяемом с калом собак. При распаде членика яйца рассеиваются и контаминируют окружающую среду, где они остаются инвазионно способными несколько месяцев.
Следует помнить: возбудители эхинококкоза и альвеококкоза представляют для человека чрезвычайную опасность сравнимую со злокачественной опухолью. Поэтому профилактика этих заболеваний имеет как экономическое, так и социальное значение. В неблагополучных районах ягоды, фрукты, грибы, а также зелень тщательно промывают проточной чистой водой и употребляют в пищу только после обработки горячей водой или варки.
В настоящее время при обнаружении у собак эхинококкоза они подлежат уничтожению под контролем ветработника.
Контрольные мероприятия основываются на регулярной обработке собак с целью уничтожения взрослых цестод и предотвращения инвазии собак путем исключения из их рациона продуктов животных, содержащих гидатидов. Это достигается путем недопущения собак к бойням, а где возможно, в недоступном хранении туш овец на фермах. В некоторых странах проведение этих мероприятий прописаны в законе, а при их несоблюдении налагаются штрафы.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
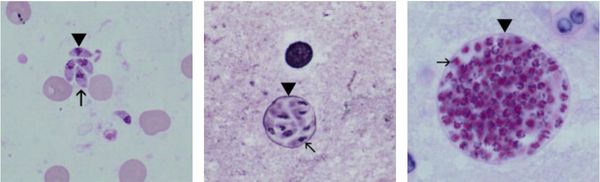
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
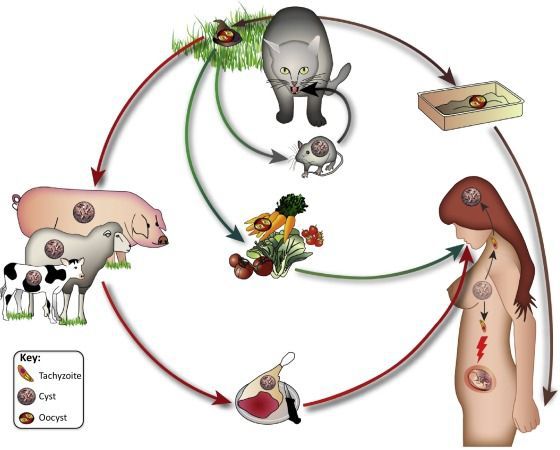
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
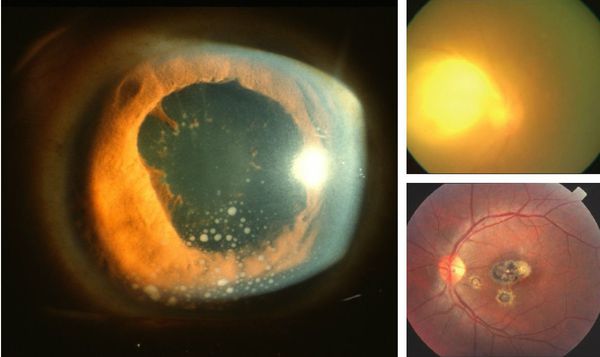
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
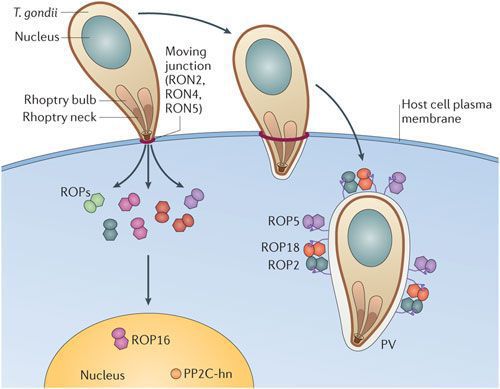
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Альвеококкоз - это паразитарное заболевание, вызываемое личинками ленточного гельминта альвеококка и протекающее с формированием первичного очага в печени. В неосложненной стадии проявления альвеококкоза включают крапивницу, кожный зуд, гепатомегалию, тяжесть и боль в правом подреберье, горечь во рту, отрыжку, тошноту. Осложнениями альвеококкоза могут выступать нагноение паразитарной опухоли, прорыв образования в брюшную или плевральную полости, механическая желтуха, портальная гипертензия, метастазирование альвеококка в головной мозг и легкие. Для диагностики альвеококкоза используется УЗИ и сцинтиграфия печени, ангиография, рентгенография/КТ брюшной полости и грудной клетки. Хирургическое лечение альвеококкоза дополняется противопаразитарной терапией.
МКБ-10
Общие сведения
Альвеококкоз (альвеолярный или многокамерный эхинококкоз) – цестодоз, возбудителем которого выступает личиночная стадия гельминта Alveococcus multilocularis, вызывающего опухолевидное поражение печени с последующим инфильтративным ростом или метастазированием в легкие, головной мозг и другие органы. Альвеококкоз человека относится к числу редко встречающихся природно-очаговых гельминтозов, заболеваемость которым в эндемичных районах составляет 0,01-0,08%. Случаи альвеококкоза встречаются в Канаде, США, Европе (Германии, Австрии, Франции, Швейцарии), Азии, России (Якутии, Камчатке, Чукотке, Западной Сибири, Поволжье). Альвеококкозом чаще заражаются лица молодого и среднего возраста, главным образом, занимающиеся охотой.

Причины альвеококкоза
Для человека опасность представляет личиночная стадия гельминта Alveococcus multilocularis, относящегося к плоским червям подсемейства Echinococcine. Половозрелые формы альвеококка по строению близки к эхинококку, однако отличаются количеством крючьев на сколексе (обычно 28–32 шт.), отсутствием боковых ответвлений в матке, расположением полового отверстия в передней части членика. Основное отличие паразитов заключается в строении финны, которая у альвеококка имеет форму гроздьевидных пузырьков, заполненных студенистой массой. Дочерние пузырьки образуются путем почкования и растут наружу, а не внутрь, как у эхинококка.
Взрослый альвеококк имеет размеры 1,6-4 мм, состоит из головки с 4 присосками и крючьями, 2-3-х члеников. В последнем членике располагается шаровидная матка, содержащая около 400 яиц. Ленточный гельминт паразитирует в кишечнике песца, волка, лисицы, собаки, кошки, которые являются основными хозяевами альвеококка. Зрелые яйца с фекалиями животных выделяются в окружающую среду, откуда попадают в организм промежуточных хозяев (мышей, ондатр, речных бобов, нутрий и человека), где протекает личиночное развитие паразита. Заражение человека альвеококкозом может происходить при занесении в рот онкосфер гельминта во время охоты, разделки туш диких животных, снятия и обработки шкур, контакта с домашними питомцами, употребления в пищу лесных ягод и трав, загрязненных яйцами гельминта.
Патогенез
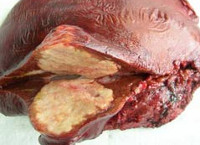
В организме человека личинка альвеококка выходит из яйца и с кровотоком заносится в печень, где почти всегда задерживается. Первичный альвеококкоз других органов встречается крайне редко. В печени личинка трансформируется в пузырек диаметром 2-4 мм, который начинает размножаться путем экзогенного почкования. Постепенно в соединительнотканной строме печени формируется плотная, мелкобугристая паразитарная опухоль диаметром от 0,5 до 30 см и более.
На разрезе узел альвеококка имеет вид ноздреватого сыра (или пористого свежего хлеба), состоящего из большого количества хитиновых пузырьков. Аналогично злокачественной опухоли, паразитарный узел способен прорастать в окружающие ткани и органы (сальники, диафрагму, поджелудочную железу, правую почку, надпочечник, легкое и др.), лимфатические пути и кровеносные сосуды, распространяясь с током крови по организму и образуя отдаленные метастазы, чаще всего в головном мозге.
Симптомы альвеококкоза
В развитии альвеококкоза выделяют бессимптомную, неосложненную и осложненную стадии. Характер течения альвеолярного эхинококкоза может быть медленно прогрессирующим, активно прогрессирующим и злокачественным. Доклиническая стадия альвеококкоза может длиться долгие годы (5-10 лет и более). В это время больных беспокоит крапивница и кожный зуд. Выявление альвеококкоза в этот период обычно происходит с помощью УЗИ, выполняемого по поводу другого заболевания.
В раннюю манифестную стадию симптомы альвеококкоза малоспецифичны, включают гепатомегалию, тяжесть и тупые боли в правом подреберье, давление в эпигастрии, горечь во рту, тошноту. При осмотре нередко обнаруживается увеличение и асимметрия живота; при пальпации печени определяется плотный узел с неровной бугристой поверхностью. Больные ощущают слабость, ухудшение аппетита, похудание. При альвеококкозе возможны периодические приступы печеночной колики, диспепсические явления.
Осложнения
Наиболее частым осложнением альвеококкоза служит механическая желтуха, обусловленная компрессией желчных путей. В случае присоединения бактериальной инфекции может развиваться абсцесс печени, что сопровождается усилением болей в правом подреберье, появлением гектической лихорадки, ознобов, проливных потов. При прорыве паразитарной полости может развиваться гнойный холангит, перитонит, эмпиема плевры, перикардит, плевропеченочные и бронхопеченочные свищи, аспирационная пневмония.
В случае сдавления опухолевым конгломератом ворот печени возникает портальная гипертензия, сопровождающаяся варикозным расширением вен пищевода, пищеводными и желудочными кровотечениями, спленомегалией, асцитом. При заинтересованности почек развивается протеинурия, гематурия, пиурия, присоединяется инфекция мочевыводящих путей. Следствием иммунопатологических процессов служит формирование хронического гломерулонефрита, амилоидоза и хронической почечной недостаточности.
Метастазирование альвеококка чаще всего происходит в головной мозг; в этом случае возникают очаговые и общемозговые симптомы (джексоновские приступы, моно- и гемипарезы, головокружения, головные боли, рвота). Тяжелое и скоротечное течение альвеококкоза наблюдается у пациентов с иммунодефицитом, беременных, лиц, страдающих тяжелыми сопутствующими заболеваниями. Нередко альвеолярный эхинококкоз заканчивается летально.
Диагностика
При обследовании больных с подозрением на альвеококкоз выясняется эпидемиологический анамнез (проживание в эндемичных зонах, занятие охотой, сбором дикорастущих ягод, обработка шкурок и тушек диких животных, профессиональные риски и пр.). Подтверждают диагноз:
- Аллергологические маркеры. Для ранних стадий характерны положительные аллергические тесты (эозинофилия, реакция Казони с эхинококковым антигеном).
- Анализы. Специфические методы лабораторной диагностики альвеококкоза включают иммунологические реакции (РИГА, РЛА, ИФА), ПЦР.
- Инструментальные методы. Для выявления альвеолярного эхинококкоза печени, величины и расположения паразитарного узла используется обзорная рентгенография брюшной полости, УЗИ и допплерография печени. Неинвазивной альтернативой артериографии и спленопортографии является компьютерная томография. В сложных ситуациях используется сцинтиграфия печени, диагностическая лапароскопия.
При подозрении на альвеококкоз исключаются другие очаговые поражения печени: опухоли, гемангиомы, поликистоз, цирроз, эхинококкоз. Для выявления метастазов проводится рентгенография грудной клетки, МРТ головного мозга, УЗИ почек и надпочечников и т. д.
Лечение альвеококкоза
При альвеококкозе печени показано хирургическое лечение, дополненное противопаразитарной терапией. Чаще всего операцией выбора служит резекция печени в пределах здоровых тканей (сегментэктомия, лобэктомия), однако радикальное удаление паразитарной опухоли возможно лишь в 15-25% случаев. При невозможности радикального иссечения узла производится его частичная резекция или вылущивание с последующей инфильтрацией дезинфицирующими препаратами или разрушением паразитарной ткани с помощью криовоздействия. В отдельных случаях используется операция марсупиализации паразитарной каверны, стентирование желчевыводящих протоков. Системная противопаразитарная терапия альвеококкоза осуществляется производными имидазотиазола.
Прогноз и профилактика
Медленное и бессимптомное развитие паразитарной опухоли приводит к тому, что в большинстве случаев альвеококкоз диагностируется поздно, что часто не позволяет провести радикальное лечение. Прогноз при альвеолярном эхинококкозе достаточно серьезный: без лечения 10-летняя выживаемость не превышает 10-20%. Гибель больных наступает вследствие гнойных осложнений, печеночной недостаточности, профузного кровотечения, прорастания опухоли в близлежащие органы с нарушением их функций, отдаленного метастазирования в головной мозг и др.
Профилактика альвеококкоза сводится к проведению дегельминтизации домашних животных, ветеринарному надзору, соблюдению мер предосторожности при взаимодействии с дикими животными, санитарно-просветительной работе с населением эндемичных районов. Лица, подвергающиеся повышенному профессиональному риску заражения альвеококкозом (пастухи, охотники, работники звероферм и др.), подлежат регулярному скрининговому обследованию.
2. Выбор оптимальной тактики хирургического лечения альвеококкоза печени/ Сейсембаев М.А., Токсанбаев Д.С., Баймаханов Ж.Б.// Вестник хирургии Казахстана. - 2012.
3. Хирургическое лечение осложненных форм альвеококкоза печени/ Бебезов Б.Х., Мамашев Н.Д., Уметалиев Т.М.// Вестник Казахского Национального медицинского университета. - 2012.
Паразитарные заболевания печени – группа разнородных болезней, вызываемых паразитами и гельминтами. Самые распространенные паразитозы печени: аскаридоз, эхинококкоз, амебиаз, описторхоз и др. К общим симптомам относят истощение, дистрофические изменения кожи и волос, повышенную утомляемость, нарушения сна, неприятный запах изо рта. В диагностике используют дуоденальное зондирование, исследование дуоденального содержимого, анализ кала на яйца гельминтов, УЗИ, КТ, сцинтиграфию печени. Лечение консервативное, заключающееся в назначении антипаразитарного препарата (специфического либо широкого спектра действия), либо оперативное.
Общие сведения
Паразитарные заболевания печени вызываются протозоозами и глистными инвазиями. Всемирная организация здравоохранения считает, что не менее 25% населения Земли заражено теми или иными паразитами. Паразитозы и гельминтозы занимают четвертое место среди заболеваний, приносящих наибольший вред здоровью человека. На данный момент не существует исследований, которые бы отражали истинную заболеваемость паразитарными болезнями и гельминтозами в России. По мнению экспертов в области инфекционных заболеваний и гастроэнтерологии, паразитарные инвазии могут быть выявлены не менее чем у двадцати миллионов россиян. Учитывая тот факт, что паразиты и глисты могут персистировать в организме долгие годы, заболевание нередко накладывает отпечаток на всю жизнь: вызывает задержку роста и развития в детском возрасте, ухудшает умственные способности школьников, провоцирует снижение работоспособности и активности взрослого населения.
Причины паразитарных заболеваний печени
Все паразитарные заболевания печени возникают либо при протозойном инфицировании, либо в результате глистной инвазии. Поражение печени в этой ситуации выступает одним из проявлений генерализованной инфекции. Среди протозойных инфекций печень чаще всего поражается при токсоплазмозе, амебиазе, лейшманиозе, малярии. Гельминтозы представлены нематодозами, цестодозами, трематодозами. Нематодозы вызываются круглыми червями (аскаридоз, стронгилоидоз, токсокароз, трихинеллез); трематодозы – сосальщиками (фасциолез, клонорхоз, описторхоз); цестодозы – ленточными глистами (альвеококкоз, эхинококкоз).
Разнообразие клинических проявлений паразитарных заболеваний печени обусловлены не только видом паразита либо гельминта, но и их жизненным циклом, местом внедрения в организм, локализацией различных жизненных форм, реакцией иммунитета на возбудителя.
Сосальщики обычно локализуются в желчевыводящих протоках, желчном пузыре. Присосками сосальщиков повреждается эпителий протоков, в которых образуются кисты, воспалительная реакция, формируется холангит и холестаз. При фасциолезе личинки с током крови проникают в ткань печени, затем мигрируют в желчевыводящие пути и там превращаются в половозрелого паразита. В дальнейшем гельминты повреждают ткань печени, формируя микроскопические гнойники в паренхиме и желчных ходах. Схожий патогенез заболевания имеет и аскаридоз.
При эхинококкозе и амебиазе в печени формируются объемные образования. Шистосомозы приводят к фиброзированию паренхимы печени. Заражение малярийным плазмодием, трипаносомами, шистосомами приводит к значительному увеличению размеров печени, воспалительному процессу, печеночной недостаточности.
Главную роль в поражении печеночной паренхимы играют патологические иммунные реакции. Паразиты и гельминты выделяют антигены, которые провоцируют избыточные иммунные реакции, приводящие к значительному поражению клеток и микрососудов печени. Личинки и взрослые особи глистов, находящиеся в ткани печени, выделяют ряд ферментов, повреждающих гепатоциты и стимулирующих синтез фибрина. Хроническое персистирование паразитов рано или поздно приводит к фиброзированию печени, хронической печеночной недостаточности. Ниже рассмотрены основные виды паразитарных заболеваний печени, встречающиеся в России.
Виды паразитарных заболеваний печени
Эхинококкоз печени
Эхинококкоз занимает ведущее место среди всех паразитарных заболеваний печени. В подавляющем большинстве случаев поражается правая половина печени, практически у половины пациентов эхинококковых кист несколько. У людей эхинококкоз печени может быть гидатидным (личиночная стадия, кистозная форма, человек является промежуточным хозяином) и альвеококковым. Основным хозяином являются псовые, в организме которых эхинококк созревает, а его терминальные членики с огромным количеством яиц попадают в окружающую среду, вызывая заражение человека фекально-оральным либо контактным путем. Попадая в желудок, оболочка яиц растворяется и гельминты проникают через стенку желудка или кишечника в кровь. С током крови возбудители мигрируют в печень, а затем и в другие органы, формируя в них кисты (изначально – около 1 мм диаметром). Эхинококковая киста печени имеет две оболочки, внутренняя продуцирует жидкую составляющую кисты, образует дочерние пузыри. Наружная оболочка может кальцифицироваться, содержимое ее может нагнаиваться. Кисты огромных размеров сдавливают паренхиму печени и сосуды, желчевыводящие пути.
Гидатидный эхинококкоз. В первые годы после заражения эхинококкоз может никак не проявляться. Первые клинические проявления обычно возникают по достижению кистой больших размеров – боли в правом боку, тошнота и рвота, слабость, исхудание, хроническая диарея, аллергические высыпания на коже, ломкость волос. Размеры печени увеличиваются, при поверхностном расположении кисты ее можно даже пропальпировать. Желтуха развивается только при сдавлении кистой протоков печени. Возможен прорыв кистозного образования в брюшную или грудную полость, сопровождающийся сильной болью, анафилактическим шоком (реакция на всасывание содержимого кисты). Нагнаивание содержимого кисты сопровождается болезненностью печени, лихорадкой, ухудшением общего состояния.
Диагностика эхинококкоза включает сбор анамнеза (контакт с собакой), пальпацию печени и выявление эхинококковой кисты. Специфическим методом диагностики является реакция Казони (положительна в 85% случаев), латекс-агглютинации (90%). Визуализировать паразита помогут УЗИ печени и желчного пузыря, ангиография чревного ствола, МРТ печени и желчевыводящих путей, статическая сцинтиграфия печени, диагностическая лапароскопия.
Лечение только оперативное. Производится иссечение эхинококковых кист печени, предварительно в кисту вводят формалин и отсасывают ее содержимое. Полость кисты ушивают наглухо. В последующем может сформироваться непаразитарная киста, гнойник. При маленьких размерах и краевом положении кисты возможна резекция печени вместе с кистой.
Альвеолярный эхинококкоз. Является более редкой формой паразитарного заболевания печени, вызываемого эхинококком. Возбудитель альвеококкоза отличается своей личиночной стадией. Заражение происходит при обработке шкур основного хозяина (лисы и др.), употреблении зараженных продуктов. Особенностью альвеококкоза является образование множества мелких кист, которые инфильтрируют паренхиму печени, плотно прилегая друг к другу и образуя опухолевидный узел в ткани печени. Пузырьки паразита способны прорастать в паренхиму печени, сосуды, желчные пути, соседние органы. В центре очага альвеококкоза формируется некроз, в дальнейшем альвеококковый очаг может обызвествляться. Дифференцировать заболевание следует с раком печени, циррозом печени.
Клиническая картина альвеококкоза сходна с гидатидной формой заболевания, однако имеет большую частоту механической желтухи. Лечение альвеококкоза печени имеет определенные особенности. Проведение операции затруднено инфильтративным ростом паразитов, прорастанием сосудов, желчных путей, круглой связки печени. Обычно операция назначается при значительном поражении печени, нагноении и прорыве кист. Чаще всего производится частичная резекция печени, оставшиеся кисты обрабатываются химиопрепаратами или формалином, подвергаются криодеструкции.
Аскаридоз печени и желчных путей
На сегодняшний день аскаридоз печени встречается достаточно редко. Человек заражается при употреблении в пищу зараженных яйцами аскарид продуктов. Попадая в кишечник, возбудители через кишечную стенку проникают в кровеносное русло, с током крови попадают в печень. В печени из-за персистирования паразитов формируются некрозы, микроабсцессы. В дальнейшем возбудители могут мигрировать по организму, попадая в другие органы и системы, а в кишечнике превращаясь в половозрелые формы.
Основными проявлениями аскаридоза являются холангиты, холестаз, абсцессы печени. Специфических симптомов аскаридоза не существует. Диагноз аскаридоза печени устанавливается на основании обнаружения аскарид и их яиц в рвотных массах, кале; также возможна визуализация гельминтов при УЗИ, КТ печени.
Лечение аскаридоза желчевыводящих путей только хирургическое. Применение противоаскаридозных средств при закупорке желчных путей противопоказано, так как приводит к кратковременной активизации паразитов и их дальнейшему проникновению в желчные пути и паренхиму печени. Для уточнения степени поражения протоков во время операции проводят РХПГ. Для профилактики персистирования аскаридоза, образования конкрементов желательно провести холецистэктомию. В послеоперационном периоде по дренажам вводят антиаскаридозные препараты для уничтожения оставшихся гельминтов.
Описторхоз печени
Данное паразитарное заболевание печени встречается достаточно редко, заражение человека происходит через сырую рыбу, зараженные водоемы. Размножение гельминта в желчных путях приводит к их расширению. Ткань печени становится очень плотной, расширенные внутрипеченочные протоки видны сквозь капсулу печени. Персистирование инвазии приводит к утолщению стенок желчных путей, формированию грубых рубцовых изменений вокруг них, которые напоминают цирроз печени, часто приводят к перфорации желчных протоков и перитониту. Закупорка желчных ходов благоприятствует застою и воспалительным изменениям в них. У пациентов с описторхозом часто в будущем развивает рак печени.
Описторхоз, как и другие паразитарные заболевания печени, не имеет специфической клиники. Частыми проявлениями являются увеличение и уплотнение печени, боли в правом подреберье, жидкий стул. В случае присоединения инфекции пациента беспокоят лихорадка, озноб, липкий пот.
Диагноз ставится на основании выявления особей и яиц гельминтов в кале и дуоденальном соке, полученном при зондировании. Лечение описторхоза печени хирургическое, заключается в дренировании протоков, введении антипаразитарных препаратов в дренажи.
Амебиаз печени
Заболевание часто встречается в тропических странах. Характеризуется преимущественным поражением толстого кишечника, диссеминацией возбудителя в паренхиматозные органы. Цисты амеб попадают в организм человека с зараженной водой, фруктами и овощами, зеленью.
Амебы вызывают образование язв в кишечнике, через которые возбудители попадают в кровоток, а затем в печень, приводя к формированию абсцессов печени примерно в 10% случаев. Особенность амебных абсцессов в том, что они не имеют капсулы, содержат в себе расплавленные ткани, кофейного цвета гной. Состояние пациентов обычно очень тяжелое, печень увеличена и болезненна. Кожные покровы иктерично-серые, сухие.
В диагностике абсцесса печени используют УЗИ гепатобилиарной системы, сцинтиграфию печени, КТ, пункционную биопсию печени (с целью выявления амеб). Лечение амебиаза обычно комплексное: антиамебные, антибактериальные и дезинтоксикационные препараты. Хирургическое лечение проводится при неэффективности консервативных мероприятий, возникновении осложнений.
Прогноз и профилактика паразитарных заболеваний печени
Прогноз при паразитарных заболеваниях печени зависит от многих факторов: длительности паразитарной инвазии, обширности поражения печени, наличия осложнений. При длительном течении паразитарного поражения печени с формированием фиброза, развитием печеночной недостаточности прогноз неблагоприятный.
Профилактика всех паразитарных заболеваний печени заключается в соблюдении правил личной гигиены (мыть руки после контакта с животными, пить только кипяченую воду, тщательно мыть овощи и фрукты перед употреблением в пищу, проводить термическую обработку мяса и рыбы), контроле за состоянием водоемов, из которых производится забор питьевой воды.
Эхинококкоз – это паразитарная инвазия личиночной стадией ленточного гельминта эхинококка, протекающая с поражением внутренних органов (печени, легких, сердца, головного мозга и др.) и образованием в них эхинококковых кист. Неспецифические симптомы эхинококкоза включают слабость, крапивницу, преходящее повышение температуры; специфические зависят от места локализации паразита и могут быть представлены локальными болями, тошнотой, желтухой, кашлем, очаговой неврологической симптоматикой, кардиалгией, аритмией и пр. Диагностика эхинококкоза основывается на данных инструментальных исследований (рентгена, сцинтиграфии, УЗИ, КТ) и серологических проб. Лечение эхинококкоза хирургическое.
МКБ-10
Общие сведения
Эхинококкоз – гельминтное заболевание из группы цестодозов, вызываемое паразитированием в организме человека эхинококка в стадии онкосферы. В мире наибольшая заболеваемость эхинококкозом отмечается в Австралии, Новой Зеландии, Северной Африке, Южной Америке, Южной Европе, Центральной Азии. В России гельминтоз встречается в Поволжье, Приуралье, Ставропольском и Краснодарском крае, Западной Сибири, на Дальнем Востоке.
В эндемичных регионах заболеваемость населения эхинококкозом достигает 5-10%. Распространенность эхинококкоза тесно связана с развитием животноводства. Учитывая тот факт, что при эхинококкозе могут поражаться различные внутренние органы, а единственно радикальным методом лечения является операция, заболевание лежит в сфере интересов торакоабдоминальной хирургии, нейрохирургии, кардиохирургии.

Причины эхинококкоза
Эхинококкоз человека вызывается личиночной стадией ленточного гельминта Echinococcus granulosus - лавроцистой. Окончательными хозяевами половозрелых гельминтов выступают животные (собаки, лисицы, волки, львы, рыси и др.), в кишечнике которых паразитируют цестоды. Человек, домашние и дикие травоядные животные (рогатый скот, свиньи, лошади, олени, лоси и др.) являются промежуточными хозяевами личиночных стадий и одновременно биологическим тупиком, поскольку не выделяют яйца эхинококка в окружающую среду и не могут служить источником инвазии.
Взрослые особи эхинококка – это мелкие гельминты длиной 2,5-8 мм и шириной 0,5-10 мм, имеющие головку с четырьмя присосками и двумя рядами крючьев, шейку и несколько члеников. В зрелых члениках содержатся яйца эхинококка с онкосферами и шестикрючной личинкой-зародышем внутри. Онкосферы выживают в большом диапазоне температур (от -30°С до +30°С), несколько месяцев сохраняются в почве, но вскоре погибают под действием солнечного света.
Из кишечника окончательного хозяина яйца с испражнениями выделяются во внешнюю среду. Заражение людей эхинококкозом происходит алиментарным (при употреблении загрязненных фекалиями овощей и фруктов, воды) или контактным путем (при разделке туш или контакте с животными, инвазированными эхинококком). Высокий риск заболеваемости эхинококкозом имеют лица, занятые животноводством и уходом за животными (животноводы, охотники, работники скотобоен и др.).
Патогенез
В ЖКТ человека под действием пищеварительных ферментов оболочка яйца и онкосферы растворяется, и наружу выходит личинка. С помощью крючьев она внедряется в слизистую кишки, откуда попадает в венозный кровоток и в портальную систему. Большая часть онкосфер оседает в печени; иногда через нижнюю полую вену онкосферы попадают в правые отделы сердца, а оттуда – в малый круг кровообращения и легкие. Реже через легочные вены и левые отделы сердца зародыши оказываются в большом круге кровообращения и могут быть занесены в любой орган: головной мозг, селезенку, почки, мышцы и др. В результате инвазии примерно в 70-80% случаев развивается эхинококкоз печени, в 15% - эхинококкоз легких, в остальных случаях происходит поражение других органов.
После оседания зародыша эхинококка в том или ином органе начинается пузырчатая или гидатидозная стадия развития паразита. Эхинококковый пузырь представляет собой кисту, покрытую двухслойно оболочкой, состоящей из внутреннего (зародышевого) и наружного (хитинового) слоев. Киста медленно увеличивается в размерах (примерно на 1 мм в месяц), однако спустя годы может достигать гигантских размеров. Внутри эхинококкового пузыря содержится прозрачная или беловатая опалесцирующая жидкость, в которой плавают дочерние пузыри и сколексы. Дочерние пузыри эхинококка могут образовываться и снаружи хитиновой оболочки; их общее количество может достигать 1000.
Проявления эхинококкоза связаны с сенсибилизирующим влиянием паразитарных антигенов и механическим давлением кисты на органы и ткани. Паразитирование эхинококка сопровождается выделением продуктов обмена, что приводит к развитию интоксикации и аллергической реакции замедленного типа. В случае полного разрыва кисты происходит истечение ее содержимого в плевральную или брюшную полость, что может вызвать анафилактический шок. Увеличивающаяся в размерах эхинококковая киста давит на окружающие структуры, нарушая функции пораженного органа. В некоторых случаях развивается нагноение кисты; реже возможно самопроизвольная гибель эхинококка и выздоровление.
Симптомы эхинококкоза
Эхинококкоз может бессимптомно протекать годами и десятилетиями; в случае возникновения клинической симптоматики патогномоничные признаки отсутствуют. Независимо от локализации паразита в организме, эхинококкоз проходит в своем развитии три стадии:
- I - бессимптомную. Течение латентного периода начинается от момента внедрения онкосферы в ткани и продолжается до тех пор, пока не появляются первые клинические признаки эхинококкоза.
- II - стадию клинических проявлений. Во время II стадии больных беспокоят боли в месте локализации кисты, слабость, крапивница, кожный зуд, а также специфические симптомы, обусловленные паразитированием кистозной формы эхинококка в том или ином органе.
- III - стадию осложнений. В стадии осложненного эхинококкоза может произойти разрыв кисты и истечение содержимого в брюшную или плевральную полость с развитием перитонита, плеврита. При нагноении эхинококковой кисты присоединяются высокая лихорадка, тяжелая интоксикация. Сдавление кистой органов и тканей может вызывать развитие механической желтухи, асцита, вывихов, патологических переломов.
Эхинококкоз печени
Для эхинококкоза печени характерны жалобы на тошноту, снижение аппетита, периодически возникающую диарею, тяжесть и боли в правом подреберье. Объективно обнаруживается гепатоспленомегалия; иногда эхинококковая киста печени пальпируется в виде округлого плотного образования. В случае сдавления кистой желчных протоков развивается механическая желтуха; при компрессии воротной вены возникает асцит, портальная гипертензия. Присоединение вторичной бактериальной флоры может приводить к формированию абсцесса печени. Наиболее тяжелым осложнением эхинококкоза печени служит перфорация кисты с развитием клиники острого живота, перитонита и тяжелых аллергических реакций. При этом происходит диссеминация эхинококков, в результате чего развивается вторичный эхинококкоз с множественный локализацией.
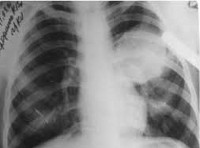
Эхинококкоз легких
Эхинококкоз легких протекает с повышением температуры тела, интоксикационным синдромом, болью в груди, кашлем, кровохарканьем. Давление кисты на легочную ткань приводит к формированию ателектазов легких. При прорыве пузыря в бронхи развивается сильный кашель, цианоз, нередко - аспирационная пневмония. Крайне опасным осложнением легочного эхинококкоза является прорыв кисты в плевру и перикард, что может привести к анафилактическому шоку, резкому смещению средостения, тампонаде сердца и внезапной смерти. Инфицирование эхинококковой кисты сопровождается формированием абсцесса легкого.
Эхинококкоз сердца
При эхинококкозе сердца беспокоят загрудинные боли, напоминающие стенокардию. Компрессия кистами венечных артерий может вызвать развитие инфаркта миокарда. Часто возникают нарушения ритма и проводимости: желудочковая тахикардия, неполная и полная блокады ножек пучка Гиса, полная поперечная блокада сердца. Причинами гибели пациента с эхинококкозом сердца могут стать злокачественные аритмии, сердечная недостаточность, тампонада сердца, кардиогенный шок, ТЭЛА, постэмболическая легочная гипертензия и др.
Эхинококкоз головного мозга
Клинка эхинококкоза головного мозга характеризуется гипертензионным синдромом и очаговой неврологической симптоматикой (нарушением чувствительности, парезами конечностей, эпилептиформными приступами).
Диагностика
Правильной диагностике эхинококкоза способствует подробно собранный эпидемиологический анамнез, указывающий на тесный контакт человека с животными, эндемичность заражения. При подозрении на эхинококкоз любой локализации назначаются серологические исследования крови (ИФА, РНИФ, РНГА), позволяющие обнаружить специфические антитела к эхинококку. Специфичность и чувствительность тестов достигает 80-98%. Примерно в 2/3 случаев оказывается информативной кожно-аллергическая проба - реакция Казони.
Диапазон инструментальной диагностики эхинококкоза включает ультразвуковые, рентгеновские, томографические, радиоизотопные методы. Перечень исследований зависит от локализации поражения:
- При эхинококкозе печени информативны УЗИ гепатобилиарной системы, ангиография чревного ствола (целиакография), МРТ печени, сцинтиграфия, диагностическая лапароскопия и др.
- Распознать эхинококкоз легких позволяет проведение рентгенографии легких и КТ грудной клетки, бронхоскопии, диагностической торакоскопии.
- Ведущими методами диагностики эхинококкоза головного мозга служат КТ или МРТ.
- При подозрении на поражение сердца выполняется ЭхоКГ, коронарография, вентрикулография, МРТ сердца.
При прорыве эхинококковой кисты в просвет полых органов сколексы паразита могут быть обнаружены в исследуемом дуоденальном содержимом, мокроте. Также в этих случаях прибегают к выполнению бронхографии, холецистографии, пункционной холангиографии. Эхинококковую кисту необходимо дифференцировать от альвеококкоза, бактериальных абсцессов, кист непаразитарной этиологии, опухолей печени, легких, головного мозга и пр.
Лечение эхинококкоза
Радикальное излечение эхинококкоза возможно только хирургическим путем. Оптимальным способом является проведение эхинококкэктомии – вылущивания кисты без нарушения целостности хитиновой оболочки. При наличии крупного пузыря вначале производится его интраоперационная пункция с аспирацией содержимого. Остаточная полость тщательно обрабатывается антисептическими растворами, тампонируется, дренируется или ушивается наглухо. В процессе операции важно не допустить попадания содержимого пузыря на окружающие ткани во избежание диссеминации эхинококка.
В случае невозможности иссечения кисты при эхинококкозе легкого выполняется клиновидная резекция, лобэктомия, пневмонэктомия. Аналогичная тактика используется при эхинококкозе печени. Если иссечение эхинококковой кисты печени представляется технически невозможным, осуществляется краевая, сегментарная, долевая резекция, гемигепатэктомия. В до- и послеоперационном периоде назначается противопаразитарная терапия препаратами празиквантел, альбендазол, мебендазол.
Прогноз и профилактика
В случае радикального удаления эхинококковых кист и отсутствия повторного заражения прогноз благоприятный, рецидивов эхинококкоза не возникает. В случае интраоперационной диссеминации сколексов через 1-2 года может возникнуть рецидив заболевания с формированием множественных эхинококковых пузырей и неблагоприятным прогнозом.
Эхинококкоз - лечение в Москве

Комментарии к статье
Вы можете поделиться своей историей болезни, что Вам помогло при лечении эхинококкоза.
Читайте также:

