Лечение инфекционного эндокардита протезированного клапана
Обновлено: 11.05.2024
Инфекционный ( септический ) эндокардит : Прогноз.
При отсутствии лечения больные с септическим эндокардитом выздоравливают редко. Однако при проведении адекватной антибактериальной терапии выживают около 70 % больных с инфицированием собственных клапанов и 50 % больных с инфицированием протезированных клапанов. При стафилококковом эндокардите правого сердца, развившемся вследствие внутривенного введения наркотиков, прогноз благоприятный. Факторами, ухудшающими прогноз болезни, являются наличие застойной сердечной недостаточности, пожилой возраст больных, вовлечение в процесс клапана аорты или нескольких клапанов сердца, полимикробная бактериемия, невозможность идентификации этиологического агента вследствие получения отрицательных результатов при культивировании крови, резистентность возбудителя к нетоксичным бактерицидным препаратам, позднее начало терапии. Наличие протезированных клапанов, обнаружение грамотрицательных микроорганизмов, наличие грибкового эндокардита свидетельствуют об особенно неблагоприятном прогнозе.
Наиболее частой причиной смерти больных с эндокардитом даже в случае адекватного лечения является сердечная недостаточность, развившаяся вследствие деструкции клапана или повреждения миокарда. Кроме того, летальный исход может ускориться эмболией сосудов жизненно важных органов, развитием почечной недостаточности или микотической аневризмы, осложнениями после хирургического вмешательства. Тем не менее многие больные выздоравливают без видимого усугубления существовавшего ранее заболевания сердечно-сосудистой системы. В том случае, если антимикробная терапия оказывается неэффективной вследствие резистентности возбудителя, развивается возвратный эндокардит, и в процесс обычно вовлекается тот же клапан, что и при первичном поражении.
Снижению смертности от септического эндокардита способствуют адекватное хирургическое лечение в комбинации с антибактериальной терапией для подавления инфекции и своевременная замена пораженных клапанов у больных с застойной сердечной недостаточностью.
Инфекционный ( септический ) эндокардит : Профилактика.
Больным с подозрением на врожденный или приобретенный порок сердца, с протезированными клапанами сердца, оперированным по поводу наличия межпредсердного шунта, с септическим эндокардитом в анамнезе в обязательном порядке показана профилактическая антимикробная терапия в отношении зеленящего стрептококка непосредственно перед любыми стоматологическими процедурами, которые могут вызвать кровотечение, хирургическими вмешательствами в полости рта, тонзиллэктомией, удалением аденоидов. Противоэнтерококковую терапию следует проводить также больным с повышенным риском развития инфекционного эндокардита перед катетеризацией мочевого пузыря, цистоскопией, простатэктомией, акушерскими или гинекологическими манипуляциями в области инфицированных тканей, хирургическими вмешательствами на прямой или толстой кишке. У больных с пролапсом митрального клапана, асимметрической гипертрофией межжелудочковой перегородки, пороками правого предсердно-желудочкового клапана или клапана легочного ствола риск развития септического эндокардита ниже. Однако и они должны получать профилактическую антимикробную терапию в указанных выше случаях.
Антимикробная профилактика не требуется больным с атеросклеротическими бляшками в сосудах, больным, перенесшим операцию аортокоронарного шунтирования, лицам с наличием систолического щелчка, изолированными дефектами межжелудочковой перегородки, имплантированными трансвенозными водителями ритма. Всем упомянутым выше больным с высоким риском развития септического эндокардита при проведении хирургических манипуляций на инфицированных органах следует назначать селективную терапию, направленную против наиболее вероятного инфицирующего агента.
Необходимость антимикробной профилактики объясняется тем, что при появлении бактериемии вероятность развития септического эндокардита чрезвычайно высока. Наиболее удачные результаты экспериментальных исследований свидетельствуют о том, что для профилактики септического эндокардита, вызываемого зеленящим стрептококком, наиболее эффективны пенициллины, создающие высокие концентрации препарата в течение длительного времени. Показано, что пенициллин и стрептомицин обладают синергическим бактерицидным действием. Эти данные свидетельствуют об эффективности следующего режима профилактики септического эндокардита: за 30 мин до хирургических стоматологических манипуляций вводят внутримышечно 1 200 000 ЕД пенициллина G в водном растворе новокаина в комбинации с 1 г стрептомицина. После этого назначают пенициллин V внутрь по 0,5 г каждые 6 ч, всего 4 приема. Аналогичный эффект, по-видимому, дает однократное назначение перед вмешательством 3 г амоксициллина. Больным с повышенной чувствительностью к пенициллину следует назначать ванкомицин по 1 г внутривенно в течение 30 мин за 1 ч до процедуры или эритромицин в дозе 1 г внутрь за 1 ч до процедуры. После этого в обоих случаях назначают эритромицин внутрь в дозе 0,5 г каждые 6 ч, всего 4 дозы. Для профилактики энтерококкового эндокардита лучше всего использовать ампициллин в комбинации с гентамицином. С этой целью ампициллин вводят внутримышечно в дозе 1 г в комбинации с гентамицином в дозе 1 мг/кг (но не более 80 мг), вводимым внутримышечно или внутривенно за 30-60 мин до процедуры. После этого введение обоих препаратов следует повторить дважды с интервалом 8 ч. Больным с повышенной чувствительностью к пенициллину следует назначать ванкомицин в дозе 1 г внутривенно и гентамицин в дозе 1 мг/кг внутримышечно за 30-60 мин до процедуры. Через 12 ч препараты вводят повторно. Антистафилококковую профилактику следует проводить во время хирургических вмешательств, сопровождающихся имплантацией сердечных клапанов или каких-либо материалов в полость сердца, сосудистых протезов. С этой целью вводят цефазолин внутривенно в дозе 1 г за 30 мин до операции, затем повторяют введение каждые 6 ч, но в течение не более чем 24 ч.
Профилактическое назначение пенициллина в целях предотвращения инфекции стрептококком группы А и профилактики рецидивов ревматизма не предупреждает развития септического эндокардита. Назначение бензатина пенициллина для профилактики ревматизма не предрасполагает к развитию септических эндокардитов, вызванных пенициллиноустойчивыми микроорганизмами, в то время как пенициллин V, назначаемый внутрь, не способствует появлению пенициллиноустойчивой флоры в полости рта. Всех больных с высоким риском развития септического эндокардита следует предупреждать о необходимости соблюдать гигиену полости рта, избегать орошения полости рта струёй воды, а также о том, что в случае любого инфекционного заболевания необходимо быстро начинать соответствующее лечение.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Категории МКБ: Кандидозный эндокардит (B37.6+) (I39.8*), Острый и подострый эндокардит (I33), Острый ревматический эндокардит (I01.1), Эндокардит и поражения клапанов сердца при болезнях, классифицированных в других рубриках (I39*), Эндокардит, клапан не уточнен (I38)
Общая информация
Краткое описание
Инфекционный эндокардит – это инфекционное полипозно-язвенное воспаление эндокарда, сопровождающееся образованием вегетаций на клапанах или подклапанных структурах, их деструкцией, нарушением функции и формированием недостаточности клапана [1].
Код по МБК-10:
В37.6 Кандидозный эндокардит
(I39.8) I01.1 Острый ревматический эндокардит
I33 Острый и подострый эндокардит
I38 Эндокардит, клапан не уточнен
I39 Эндокардит и поражения клапанов сердца при болезнях, классифицирумых в других рубриках
Пользователи протокола: врачи общей практики, терапевты, педиатры, кардиологи, кардиохирурги, ревматологи, врачи скорой помощи.
Классификация
- Инфекционный эндокардит с положительными культурами крови. Возбудителями чаще всего являются стафилококки, стрептококки и энтерококки.
- Инфекционный эндокардит с отрицательными культурами крови из-за предварительного лечения антибиотиками.
- Инфекционный эндокардит с отрицательными культурами крови, часто ассоциирующийся с негативными культурами крови (питательно- дефектный вариант стрептококков; грамотрицательные палочки группы HACEK: Haemophilus parainfluenzae, H.aphrophilus, H.paraphrophilus, H.influenzae, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae, и K. Denitrificans ; Brucella и грибы).
- Инфекционный эндокардит с отрицательными культурами крови Bartonella spp., Chlamydia spp., Brucella spp., Legionella spp., Nocardia spp., все грибы, кроме Candida spp. (в основном Aspergillus spp.) относят к редким возбудителям ИЭ, которые не растут на обычных средах или требуют серологической диагностики.
- Инфекционный эндокардит с полимикробной ассоциацией при ИЭ встречается редко и наблюдается в основном у наркоманов.
ИЭ в зависимости от локализации инфекции, наличия или отсутствия внутрисердечного устройства (материала):
− ИЭ, связанный с внутрисердечными устройствами (временный кардиостимулятор или кардиовертер- дефибриллятор)
− Нозокомиальный: ИЭ, развивающийся у госпитализированных более 48 часов пациентов до развития признаков / симптомов ИЭ
− Ненозокомиальный: признаки / симптомы ИЭ развиваются в течение менее чем 48 часов после обращения пациента за медицинской помощью, и определяется как:
- связанный с уходом на дому или внутривенной терапией, гемодиализом или переливанием крови в течение менее чем 30 дней до развития первых проявлений ИЭ;
- ИЭ, развившийся у лиц, проживающих в домах престарелых или находящихся длительное время в хосписах хронических больных
− Внебольничный ИЭ: признаки и / или симптомы ИЭ развиваются в течение менее 48 часов после обращения у пациента без критериев инфекции, приобретенной в результате оказания медико-санитарной помощи
− ИЭ, связанный с внутривенным введением лекарственных препаратов (наркоманы): ИЭ у активного внутривенного наркомана без других источников инфицирования.
− Гистопатологические доказательства активного ИЭ
− Рецидив: повторные эпизоды ИЭ, вызванные теми же микроорганизмами менее чем через6 месяцев после первичного инфицирования
− Повторное инфицирование: инфицирование другими возбудителями; повторные эпизоды ИЭ, вызванные теми же бактериями более чем через 6 месяцев после первичного инфицирования
Степень тяжести ИЭ устанавливается на основании оценки объективного клинического статуса пациента и наличия осложнений.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Обоснование использования основных и дополнительных диагностических методов представлено в Приложении 1.
- обзорная рентгенограмма органов грудной клетки.
- Ультразвуковая диагностика комплексная (печень, желчный пузырь, поджелудочная железа, селезенка, почек).
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию:
7. Обзорная рентгенограмма органов грудной клетки.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностические обследования, не проведенные на амбулаторном уровне):
Дополнительные диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностические обследования непроведенные на амбулаторном уровне):
12. Антистрептококковые антитела (антистрептолизин-О, антистрептокиназа, антистрептогиалуронидаза) в сыворотке крови
Мы продолжаем обсуждение проблемы инфекционного эндокардита (см. "Мир Медицины" NN 9-10, 1998; 5-6, 1999; 9-10, 1999). О современных подходах к профилактике этого заболевания рассказывает ведущий научный сотрудник, руководитель отделения некоронарогенной патологии сердца СПб НИИ кардиологии МЗ РФ, доцент кафедры факультетской терапии, руководитель курса повышения квалификации врачей по кардиологии и функциональной диагностике факультета постдипломного обучения СПбГМУ им. акад. И.П. Павлова Виктор Васильевич Федоров.
Инфекционный эндокардит (ИЭ) - заболевание, характеризующееся полиморфизмом клинической симптоматики, разнообразием поражений многих органов и систем, трудностями выбора рациональной лечебной тактики и чрезвычайно серьезным прогнозом. Частота возникновения новых случаев ИЭ не имеет отчетливой тенденции к снижению, несмотря на уменьшение (в некоторых регионах мира) числа больных с ревматическими поражениями сердца и разработку мер профилактики ИЭ.
Delahaye F. и соавторы (1), проанализировавшие 116 госпитальных случаев ИЭ, пришли к неутешительным выводам: профилактика ИЭ не проводилась вообще у половины (47.0%) из числа нуждавшихся в ней пациентов, а осуществлялась правильно лишь у 15.7% больных. Наши наблюдения за 525 больными ИЭ, получавшими медицинскую помощь в стационарах Санкт-Петербурга, мало отличаются от представленных данных: антибактериальная профилактика осуществлялась у трети нуждавшихся в ней больных (33.7%) и только у каждого десятого пациента (9.9%) проводилась препаратами, имевшими адекватный антимикробный спектр, дозу и режим применения.
Современные представления о гетерогенности популяции больных ИЭ диктуют необходимость рассмотрения вопросов его профилактики в трех основных аспектах:
- профилактика ИЭ нативного клапана;
- профилактика ИЭ протезированного клапана;
- профилактика рецидива ИЭ после его успешного хирургического лечения
Наибольшее значение для врачей общей практики и кардиологов имеют вопросы профилактики ИЭ нативного клапана. В связи с этим в статье они обсуждаются более подробно. Риск ИЭ нативного клапана определяется:
- массивностью и длительностью бактериемии, возникающей после лечебно-диагностических манипуляций и процедур;
- состоянием эндотелия (клапанного и пристеночного), определяющим возможность фиксации и колонизации микробных тел;
- иммунологическим статусом макроорганизма
По мнению экспертов Американской Ассоциации кардиологов, профилактика ИЭ рекомендована после:
- стоматологических вмешательств, осложненных кровотечением;
- тонзилэктомии, аденоидэктомии;
- хирургического удаления участка слизистой оболочки желудочно-кишечного или респираторного тракта;
- склеротерапии варикозно расширенных вен пищевода и его дилатации;
- дилатации мочеточника;
- хирургического лечения патологии мочевыводящих путей (включая простатэктомию);
- длительной катетеризации мочевого пузыря, осложненной инфекцией;
- вагинальной гистерэктомии;
- инфицированных родов;
- рассечения и дренирования инфицированных тканей (2)
- не осложненных кровотечением стоматологических манипуляций;
- инъекции локальных анестетиков;
- введения тимпаностомической трубки;
- введения эндотрахеальной трубки;
- бронхоскопии мягким эндоскопом (с биопсией слизистой или без нее);
- пункции мочевого пузыря
- неинфицированной катетеризации уретры;
- работы кюреткой во влагалище;
- неосложненных родов и абортов, проводимых в лечебно-профилактическом учреждении;
- удаления внутриматочных спиралей;
- стерилизационных процедур;
- лапароскопии;
- удаления молочных зубов
Наиболее высок риск ИЭ у пациентов, имеющих:
- эпизоды ИЭ в анамнезе;
- имплантированный клапанный протез;
- врожденные пороки сердца "синего" типа;
- открытый артериальный проток;
- пороки митрального и аортального клапанов с регургитацией;
- дефект межжелудочковой перегородки;
- коарктацию аорты;
- ятрогенный аорто-пульмональный шунт
- и страдающих пороками сердца с оставшимися после хирургической коррекции резидуальными нарушениями
- пролапсом митрального клапана с регургитацней;
- "чистым" митральным стенозом;
- трикуспидальным пороком сердца;
- пульмональным стенозом;
- асимметричной гипертрофией межжелудочковой перегородки;
- дегенеративными болезнями клапанов в молодом возрасте
- и имеющие бикуспидальный аортальный клапан или комбинированный аортальный порок с минимальными гемодинамическими нарушениями;
- минимальные резидуальные нарушения в первые 6 месяцев после коррекции порока сердца (3)
- с пролапсом митрального клапана без регургитации;
- с пролапсом митрального клапана с регургитацией, определяемой только инструментальными методами;
- имеющих высокие изолированные дефекты межпредсердной перегородки;
- с коронарной болезнью сердца;
- с ревматическими поражениями сердца без клапанной дисфункции;
- перенесших аорто-коронарное шунтирование;
- имевших хирургическую коррекцию пороков сердца с минимальными резидуальными поражениями (спустя 6 месяцев после операции)
Таблица 1. Показания к профилактике инфекционного эндокардита
| Характеристика ятрогенной бактеримии | Риск инфекционного эндокардита | ||
| высокий | умеренный | минммальный | |
| Массивная, длительная | + | + | + |
| Массивная, кратковременная | + | + | - |
| Малая, длительная | + | +/- | - |
| Малая, кратковременная | + | - | - |
"-" - профилактика не показана;
"+/-" - профилактика осуществляется у лиц с дополнительными факторами риска (наркоманов, злоупотребляющих внутривенными инъекциями).
Таблица 2. Режимы профилактики инфекционного эндокардита (2)
| Режим | Препарат | Разовая доза | Пути введения | Способ применения |
| Стандартный | амоксициллин | 3.0 г 1.5 г | Per os | за 1 час до процедуры спустя 6 часов после назначения первой дозы |
| При наличии аллергии | эритромицин стеарат | 1.0 г 0.5 г | Per os | за 2 часa до процедуры спустя 6 часов после назначения первой дозы |
| При невозможности пероральной терапии | ампициллин | 2.0 г 1.0 г | в/м (в/в) | за 30 минут до процедуры спустя 6 часов после назначения первой дозы |
| При аллергии к пенициллину, амокссициллину, ампициллину и при невозможности приема пероральных препаратов | клиндамицин | 300.0 мг 150.0 мг | в/в | за 1 час до процедуры после приема первой дозы |
| При плановых операциях на мочеполовом и желудочно-кишечном трактах | ампициллин + гентамицин амоксициллин | 2.0 г 85 мг 1.5 г | в/в Per os | за 30 минут до процедуры спустя 6 часов после назначения первой дозы |
| При наличии аллергии к ампициллину, амоксициллину | ванкомицин + гентамицин | 1.0 г 80 мг | в/в | за 1 час до процедуры и через 8 часов после первой дозы |
Профилактика ИЭ протезированного клапана
Инфекционный эндокардит протезированного клапана (ИЭПК) - одна из самых грозных разновидностей гнойно-септических осложнений в кардиохирургии. Ранний ИЭПК возникает в первые 30 суток после операции с частотой 0.3-1.02 / 100 пациенто-лет; поздний - у 0.12-0.4% больных в год. Профилактика ИЭПК начинается почти сразу после операции и осуществляется у лиц с высоким риском в течение 4 недель, умеренным - 2 недель, минимальным - 5 суток после операции. Крайне высоким риском ИЭПК характеризуются больные:
- с клинико-бактериологической симптоматикой интраоперационной бактериемии - гектической лихорадкой в первые сутки после операции, сопровождающейся ознобами и проливными потами, имеющие положительную гемокультуру;
- оперированные по поводу активного ревматического вальвулита или инфекционного эндокардита;
- с длительностью искусственного кровообращения свыше 130 минут;
- с концентрацией С-реактивного белка в крови (СRВ) свыше 190 мг %
- после имплантации двух клапанов;
- при концентрации CRB 120-190 мг %
- после имплантации одного клапана;
- не имеющие признаков интраоперационной бактериемии;
- с концентрацией CRB менее 120 мг %
Профилактика рецидива ИЭ после его успешного хирургического лечения
Рецидив ИЭ - возникновение нового случая заболевания после успешного хирургического лечения - возможен у больных:
- с длительностью заболевания более 6 месяцев;
- при остром или подостром течении ИЭ;
- с клинико-бактериологическими признаками интраоперационной бактериемии;
- с концентрацией CRB более 90 мг %;
- с наличием микробных колоний на клапане
Ссылки:
Возбудителями этой формы эндокардита служат зеленящий стрептококк у больных с естественными сердечными клапанами и дифтерийные бактерии или Staphylococcus epidermidis у больных с протезированными сердечными клапанами. Заболевание может также быть вызвано энтерококками и многими другими микроорганизмами. В редких случаях причиной подострого септического эндокардита может стать золотистый стафилококк. Заболевание обычно развивается исподволь, больные затрудняются назвать точное время появления первых его симптомов. У некоторых больных началу болезни предшествуют недавняя экстракция зуба, вмешательства на уретре, тонзиллэктомия, острые респираторные инфекции, проведение аборта.
Слабость, быстрая утомляемость, уменьшение массы тела, лихорадка, потливость по ночам, потеря аппетита, артралгии - обычные проявления подострого септического эндокардита. Эмболии могут вызывать параличи, боль в грудной клетке вследствие миокардита или инфаркта легких, острую сосудистую недостаточность с болями в конечностях, гематурию, острую абдоминальную боль, внезапную потерю зрения. Боли в пальцах конечности, болезненные поражения кожных покровов, озноб также служат важными симптомами заболевания. Развиваются преходящие нарушения мозгового кровообращения в виде ишемии мозга, токсическая энцефалопатия, головная боль, абсцессы мозга, субарахноидальные кровоизлияния как следствие разрыва микотической аневризмы, гнойный менингит.
При физикальном обследовании выявляются самые разнообразные симптомы, ни один из которых, однако, в отдельности не является патогномоничным для подострого септического эндокардита. В ранние сроки заболевания физикальное обследование может вообще не выявить никаких признаков болезни. Тем не менее сочетание различных клинических признаков создает достаточно характерную картину подострого септического эндокардита. Внешний вид больного обычно свидетельствует о наличии хронически протекающего заболевания, выявляются бледность кожных покровов, повышение температуры тела. Лихорадка обычно носит ремиттирующий характер с подъемами в дневные или вечерние часы. Пульс учащен. При наличии сопутствующей сердечной недостаточности частота пульса, как правило, больше, чем можно было бы ожидать при данном повышении температуры тела.
Нередки кожно-слизистые поражения различного характера. Чаще этого петехии небольшого размера, красного цвета, имеющие вид геморрагий, не белеющие при надавливании, ненапряженные и безболезненные. Локализуются петехии на слизистой оболочке полости рта, глотки, конъюнктивы, на других участках туловища, в частности на коже верхней части грудной клетки спереди. Для петехий, локализованных на слизистых оболочках или конъюнктиве, характерна зона побледнения в центре. Петехии имеют некоторое сходство с ангиомами, однако в отличие от последних они постепенно приобретают коричневый оттенок и исчезают. Часто появление петехий отмечают даже в период выздоровления. Под ногтями появляются линейные геморрагии, которые, однако, трудно отличить от травматических повреждений, особенно у людей, занятых физическим трудом. Все эти поражения кожи и слизистых оболочек неспецифичны для септического эндокардита и могут наблюдаться у больных с выраженной анемией, лейкозом, трихинеллезом, сепсисом без эндокардита и другими болезнями. Как следствие эмболий на ладонях, кончиках пальцев рук, пятках, в некоторых других местах появляются эритематозные, болезненные, напряженные узелки (узелки Ослера). Эмболии в более крупные периферические артерии могут вызвать гангрену пальцев конечностей или даже более значительных их частей. При длительно текущем септическом эндокардите наблюдается изменение пальцев рук по типу барабанных палочек. В редких случаях развивается слабовыраженная желтуха.
При обследовании сердца выявляют признаки его заболевания, на фоне которого возник септический эндокардит. Значительные изменения характера сердечных шумов, впервые возникший диастолический шум могут быть следствием изъязвления клапана, дилатации сердца или клапанного кольца, разрыва клапанных хорд или формирования очень больших вегетации. Незначительные изменения характера систолических шумов обычно имеют меньшую диагностическую значимость. Иногда шум в сердце вообще не выслушивается. В таких случаях следует подозревать наличие эндокардита правого сердца, инфицирование пристеночного тромба или наличие артериовенозной фистулы в легочном или периферическом кровотоке.
При подостром течении септического эндокардита часто развивается спленомегалия. Реже селезенка бывает напряженной. При инфаркте селезенки в области ее расположения можно выслушать шум трения. Печень обычно бывает неувеличенной до тех пор, пока не разовьется сердечная недостаточность.
Относительно часто встречаются артралгии и артриты, напоминающие остро протекающий ревматизм.
Эмболии могут поддерживать инфекционный процесс. Внезапное появление гемиплегии, односторонних болей, сопровождающихся гематурией, болей в животе с развитием мелены, плевральных болей с кровохарканьем, болей в верхней левой части живота, сопровождающихся появлением шума трения селезенки, слепоты, моноплегии у больного с лихорадкой и наличием шумов в сердце заставляет подозревать у него септический эндокардит. Легочные эмболии при эндокардитах правого сердца могут быть ошибочно приняты за пневмонию.
Острые бактериальные инфекционные эндокардиты.
Появлению эндокардита обычно предшествует гнойная инфекция. Например, инфицирование сердца может развиться как осложнение пневмококкового менингита, септического тромбофлебита, панникулита, вызванного стрептококком группы А, стафилококкового абсцесса. Можно сказать поэтому, что источник инфицирования сердечно-сосудистой системы обычно достаточно очевиден.
Острый эндокардит чаще развивается у лиц, не страдающих какими-либо заболеваниями сердца. Подострое же его течение свойственно лицам с сопутствующим поражением отделов сердца; лицам, которые часто вводят наркотики внутривенно; лицам, у которых ранее имелись недиагностированные поражения клапана аорты. Острая инфекция характеризуется молниеносным течением, выраженной интермиттирующей лихорадкой, имеющей (как при гонококковом эндокардите) два пика температуры в течение суток, ознобами. Появляются многочисленные петехии. Эмболический синдром достигает большой выраженности. В области сетчатки выявляются небольшие, иногда имеющие форму пламени свечи геморрагии с бледным пятном в центре (пятна Рота). Узелки Ослера встречаются редко, однако на мягких тканях пальцев рук нередко можно обнаружить ненапряженные подкожные эритематозные макулопапулезные поражения (пятна Джейнуэя), склонные к изъязвлению. При эмболическом повреждении почек возникает гематурия. Возможно развитие диффузного гломерулонефрита. Деструкция клапанов сердца может осложниться разрывом клапанных хорд или перфорацией створок, что быстро приводит к прогрессированию сердечной недостаточности. После септической эмболии часто возникают септические абсцессы.
Эндокардиты, поражающие правое сердце.
У лиц, вводящих наркотики парентерально, развиваются панникулиты или септические флебиты, приводящие к возникновению эндокардита правого предсердно-желудочкового клапана, реже - клапана легочного ствола или слизистой аневризмы легочного ствола. Инфекционный эндокардит правого сердца может быть следствием инфицирования в результате использования периферических или центральных катетеров или трансвенозных проводников. При этом источником инфекции служат кожа (золотистый стафилококк, Candida albicans) или инъецируемые растворы (Pseudomonas aeruginosa, Serratia marcescens). В качестве возбудителя чаще всего выделяют золотистый стафилококк. У наркоманов, как правило, поражается правый предсердно-желудочковый клапан. Клинические проявления сходны с таковыми острого эндокардита, сопровождающегося инфарктом легкого и образованием абсцесса. Наиболее частыми симптомами являются выраженная лихорадка, сохраняющаяся в течение нескольких недель, боль в грудной клетке плеврального характера, кровохарканье, отделение мокроты, одышка при физической нагрузке, недомогание, анорексия, слабость. Может выслушиваться шум недостаточности правого предсердно-желудочкового клапана, усиливающийся при вдохе. Одновременно может наблюдаться пульсация шейных вен и печени. Чаще всего, однако, шум не выслушивается или выслушивается с трудом. Подтвердить наличие вегетации на эндокарде поможет секторальная эхокардиография. Вероятность выделения бактерий методом культивирования при эндокардитах правого и левого сердца одинакова. Рентгенография грудной клетки обычно выявляет наличие клиновидной формы инфильтратов с полостями на периферии легких. У больных с эндокардитом правой половины сердца прогноз обычно лучше. Это объясняется тем, что при данной форме эндокардита не наблюдается эмболий сосудов жизненно важных органов, не развивается острая декомпенсация кровообращения вследствие клапанной деструкции. Немаловажную роль играют также более молодой возраст больных и лучшее состояние их здоровья до развития инфекционного эндокардита, а также высокая эффективность антимикробной терапии. При наличии вегетации большого размера (диаметром более 1 см) или в том случае, если антимикробная терапия оказалась безуспешной, могут потребоваться частичная резекция клапана или его полное иссечение.
Эндокардиты протезированных клапанов.
Инфекционное поражение протезированных клапанов сопровождается симптомами, неотличимыми от таковых при поражении естественных клапанов, однако в первом случае относительно часто поражается клапанное кольцо. Это приводит к разрывам клапана или пенетрации инфекции в миокард или окружающие ткани. Следствием этого могут быть развитие абсцесса миокарда, нарушение проводимости, появление аневризмы синуса Вальсальвы или фистулы в правые отделы сердца или в перикард. Удлинение интервала Р-R, впервые возникшая блокада левой ножки пучка Гиса или блокады правой ножки пучка Гиса, сочетающейся с блокадой передней ветви левой ножки пучка Гиса, при инфицировании клапана аорты свидетельствуют о вовлечении в процесс межжелудочковой перегородки. Распространение инфекции из области митрального кольца может сопровождаться появлением непароксизмальной функциональной тахикардии, сердечной блокады 2-й или 3-й степени с узкими комплексами QRS. Стеноз протезированных клапанов, развившийся вследствие сужения клапанного кольца вегетациями или связанный с экскурсией клапана, диагностируют с помощью аускультации или при эхокардиографии. Появление шума регургитации при аускультации или регистрация аномальной позиции клапана или его смещения при рентгеноскопии или эхокардиографии свидетельствуют о частичном разрыве протезированного клапана. Инфицирование протезированного клапана, осложнившееся его стенозом, разрывом, сочетающееся с застойной сердечной недостаточностью, повторными эмболиями, резистентностью к антибактериальной терапии, признаками вовлечения миокарда, требует неотложного хирургического вмешательства. Больным, получающим антикоагулянты для профилактики эмболии, при развитии эндокардита следует продолжать их прием в том случае, если риск эмболизации без назначения антикоагулянтов высок. Риск развития внутричерепного кровоизлияния составляет в таких случаях 36 %, а последующая летальность- 80 %. При рецидивах бактериальной инфекции после адекватного лечения антимикробными препаратами или при наличии грибковой инфекции также требуются неотложное хирургическое вмешательство и удаление инфицированного протеза.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
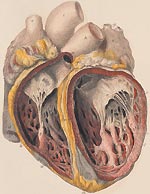
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:

