Лечение красной волчанки моноклональными антителами
Обновлено: 18.04.2024
Аутоиммунные заболевания включают более 80 нозологических форм и относятся к числу наиболее распространенных и тяжелых болезней человека, частота которых в популяции составляет 5–8%. Для лечения аутоиммунных заболеваний используется широкий спектр препаратов, обладающих противовоспалительной (глюкокортикоиды – ГК), цитотоксической или иммуносупрессивной (в низких дозах) активностью, большая часть из которых создавалась для лечения злокачественных новообразований или подавления отторжения трансплантата. Рациональное применение этих препаратов на ранних этапах болезни, в сочетании с экстракорпоральными методами очищения крови в период обострения, позволило существенно улучшить непосредственный и отдаленный прогноз, однако во многих случаях не позволяет контролировать прогрессирование заболевания, развитие угрожающих для жизни осложнений или ассоциируется с тяжелыми побочными эффектами.
- ослабление антиген–презентирующей функции В–клеток в отношении индукции пролиферации и синтеза цитокинов CD4+ Т–клетками;
- деструкция аберрантных ростковых центров, что приводит к снижению образования аутоантиген–специфичных В–клеток памяти, плазматических клеток и синтеза антител;
- истощение предшественников плазматических клеток, что приводит к подавлению синтеза антител и образования иммунных комплексов;
- модуляция активности других аутореактивных кле ток за счет нарушения функции Т–клеток;
- активация Т–регуляторных клеток (CD4+ CD25+).
Рис.1 Механизмы действия ритуксимаба
В настоящее время возможность эффективного контроля аутоиммунных патологических состояний путем истощения (и/или модуляции функции) В–клеток доказана в клинических исследованиях. Об этом свидетельствует высокая эффективность ритуксимаба при наиболее распространенном и тяжелом аутоиммунном ревматическом заболевании – ревматоидном артрите (РА), что послужило основанием для регистрации препарата для лечения этого заболевания. Детальный анализ результатов клинических исследований ритуксимаба при РА представлен в предыдущих публикациях [7,11,12].
В последние годы очень быстро накапливается клинический опыт применения ритуксимаба для лечения других аутоиммунных заболеваний человека [13–15].
Следует особо подчеркнуть, что в большинстве случаев ритуксимаб назначали пациентам с очень тяжелым течением болезней, которые были резистентны к стандартной глюкокортикоидной и цитотоксической терапии, внутривенному иммуноглобулину, экстракорпоральным методам очищения крови, нередко по жизненным показаниям.
Системная красная волчанка
Системная красная волчанка (СКВ) – аутоиммунное ревматическое заболевание, в основе патогенеза которого лежат дефекты иммунорегуляции, приводящие к неконтролируемой гиперпродукции аутоантител к компонентам собственных тканей и развитию хронического воспаления, затрагивающего многие органы и системы. При этом В–лимфоциты играют ключевую роль в развитии иммунопатологических процессов при этом заболевании [16].
В настоящее время имеются данные о применении ритуксимаба более чем у 100 пациентов с СКВ, как взрослых, так и детей, результаты которых суммированы в обзоре [17]. Результаты проведенных исследований позволяют сделать следующие основные выводы:
Синдром Шегрена
Синдром Шегрена (СШ) – системное аутоиммунное заболевание, поражающее экзокринные железы и проявляющееся персистирующей сухостью рта и глаз, связанное с нарушением функции слюнных и слезных желез [18]. СШ весьма распространен в популяции, встречается с частотой 0,6%–3,3% или 4 новых случая на 100 000 населения в год. СШ чаще развивается у женщин среднего возраста, соотношение женщин к мужчинам колеблется от 14:1 до 24:1. Выделяют первичный синдром (болезнь) Шегрена и вторичный СШ, развивающийся у больных РА и другими аутоиммунными ревматическими и неревматическими заболеваниями.
СШ – потенциально тяжелое заболевание, характеризующееся развитием широкого спектра экстрагландулярных (системных) проявлений и высоким риском лимфом, что отражает фундаментальную роль В–клеточной гиперреактивности в иммунопатогенезе болезни [3]. Полагают, что первичный СШ представляет собой уникальную модель для изучения процессов, лежащих в основе трансформации поликлональной В–клеточной активации в олиго– (моно–) клональную пролиферацию В–клеток, приводящую, в конечном счете, к развитию злокачественных В–клеточных лимфопролиферативных заболеваний. В настоящее время патогенетически обоснованная терапия СШ практически не разработана и сводится к симптоматическому лечению сухого кератоконъюнктивита и ксеростомии и применению ГК и цитостатиков у пациентов с тяжелыми системными проявлениями болезни. Попытки назначения ингибиторов ФНО–α дали противоречивые результаты и патогенетически недостаточно обоснованы. Данные, касающиеся эффективности ритуксимаба при СШ, суммированы в таблице 1.
Таблица 1. Результаты применения ритуксимаба при первичном синдроме Шегрена
| Авторы | Число и характеристика больных | Тип исследования | Результаты |
| J.E. Gottenberg et al. [20] | n=6; лимфома (2); системные проявления (4) | Ретроспективное | Эффективен |
| J. Pijpe et al. [21] | n=15; активное заболевание длительность ( < 4 лет), MALT–лимфома (7) | Открытое (фаза III) | Эффективен |
| R. Seror et al. [22] | n=16; лимфома (5); системные проявления (11), в том числе криоглобулинемия (5), поражение легких (2), артрит (4), тромбоцитопения (1), множественный мононеврит (1) | Ретроспективное | Эффективен |
| V. Davauchelle– Pensek et al. [23] | n=16; активное заболевание | Открытое | Эффективен |
Влияние лечения ритуксимабом на проявления сухого кератоконъюнктивита и ксеростомии анализировалось в 3–х исследованиях. По данным J.E. Gottenberg и соавт. [20], у 3 пациентов наблюдалось существенное улучшение, а у 2 – стабилизация клинической симптоматики. Сходные результаты получены J. Pijpe и соавт. [21]. В то же время R. Seror и соавт. [22] не выявили существенного влияния лечения на проявления сухого синдрома. В исследовании V. Davauchelle–Pensec и соавт. [23] установлена эффективность ритуксимаба в отношении таких проявлений заболевания, как слабость, сухость во рту, поражение суставов, общее состояние (SF–36), функционального состояния легких (1 пациент).
Особенно выраженный эффект отмечен в отношении системных проявлений заболевания. По данным J.E. Gottenberg и соавт. [20], существенная положительная динамика обнаружена у 5 из 6 пациентов, что позволило существенно снизить дозу ГК. R. Seror и соавт. [22] продемонстрировали высокую эффективность ритукси-маба в отношении системных проявлений у 9 из 11 больных.
Несомненный интерес представляют материалы, касающиеся эффективности ритуксимаба у пациентов с СШ и лимфомами. В исследовании J.E. Gottenberg и соавт. [209] полная ремиссия отмечена у 1 пациента, а по данным J. Pijpe и соавт. [21], полная ремиссия достигнута у 3, а частичная – у 2–х пациентов. Прогрессирование болезни имело место только у 1 больного. По данным R. Seror и соавт. [22], развитие ремиссии имело место у 4 из 5 пациентов с лимфомой. Кроме того, имеются данные о высокой эффективности ритуксимаба в качестве адъювантной терапии при агрессивных В–клеточных лимфомах. M. Vougarelis и соавт. [24] представили результаты о длительной ремиссии агрессивной диффузной В–клеточной лимфомы у 6 пациентов с пер вичным СШ, получавших комбинированную терапию циклофосфамидом, доксорубицином, винкристином, преднизолоном (CHOP) и ритуксимабом. В целом эффективность терапии была выше, чем в группе сравнений, у пациентов, получавших только цитотоксическую терапию без ритуксимаба.
Идиопатические воспалительные миопатии (ИВМ)
Идиопатические воспалительные миопатии (ИВМ) – группа аутоиммунных ревматических заболеваний, которые могут встречаться как в виде самостоятельных нозологических форм, так и в качестве синдрома при различных ревматических заболеваниях [25]. Наиболее частыми формами ИВМ являются полимиозит (ПМ) и дерматомиозит (ДМ). В основе патогенеза ИВМ лежит аутоиммунное поражение мышц, которое имеет свои особенности при ПМ и ДМ. При ПМ в клеточном инфильтрате преобладают CD 8+ Т–лимфоциты и макрофаги, а при ДМ – CD 4+ Т–лимфоциты. Развитие ИВМ может сопровождаться синтезом широкого спектра аутоантител, которые получили название миозит–специфических. Лечение ПМ/ДМ в значительной степени остается эмпирическим и обычно состоит из сочетания ГК и иммуносупрессивной терапии, однако у многих пациентов лечение недостаточно эффективно. Поэтому опыт применения ритуксимаба при ИВМ представляет несомненный интерес (табл. 2).
Таблица 2. Эффективность ритуксимаба при идиопатических воспалительных миопатиях
| Авторы | Диагноз/ число больных | Предшествующая терапия | Эффективность |
| T.D. Levine [26] | ДМ–7 | ГК, ЦсА, МТ, ВИГ | Увеличение мышечной силы (36%–113%); снижение КФК; купирование кожных проявлений, улучшение функции легких |
| E. Noss et al. [27] | ДМ–1 ПМ–2 | ГК, МТ, МФМ | Увеличение мышечной силы (нормализация – у 2–х), нормализация КФК, снижение дозы ГК |
| O. Lambotte et al. [28] | Антисинтетазный синдром – 1 | ГК, МТ, азатиоприн, ВИГ | Увеличение мышечной силы, нормализация КФК, улучшение функции легких |
| L. Brulhart [29] | Антисинтетазный синдром – 1 | ГК, МТ | Увеличение мышечной силы, нормализация КФК, купирование альвеолита |
| M.A. Cooper et al. [30] | Ювенильный ДМ – 4 | ГК, МТ, ВИГ | Увеличение мышечной силы, нормализация КФК, купирование кожных проявлений |
| C.C. Mok et al. [31] | ПМ – 4 | ГК (4), пульс МП (2), аза (4), МТ (1), МФМ (4), ЦсА (3), такролимус (1), ВИГ (1) | Нормализация мышечной силы и КФК – 2 Нормализация КФК, умеренное увеличение мышечной силы – 2 |
Примечание: МТ – метотрексат, ЦсА – циклоспорин А, ВИГ – внутривенный иммуноглобулин, АЗА – азатиоприн; МФМ – микофенолата мофетил; МП – метилпреднизолон
Как видно из таблицы, лечение ритуксимабом было эффективным у большинства больных, что проявлялось в нормализации (или существенном увеличении) мышечной силы и снижении концентрации КФК. У больных с ДМ во всех случаях отмечено купирование кожных проявлений. У пациентов с антисистетазным синдромом отмечена нормализация функции легких.
Cистемные васкулиты
Системные васкулиты, ассоциирующиеся с синтезом антинейтрофильных цитоплазматических антител (АНЦА), – группа системных аутоиммунных заболеваний, характеризующихся преимущественно васкулитом мелких сосудов и синтезом АНЦА [32]. Выделяют 2 основные формы этих васкулитов: гранулематоз Вегенера (ГВ), для которого характерно образование гранулем и деструктивное поражение верхних дыхательных путей, и микроскопический полиангиит (МПА), при котором эти проявления, как правило, не наблюдаются.
Применение ритуксимаба при АНЦА–ассоциированных системных васкулитах теоретически оправдано и определяется важной патогенетической ролью АНЦА (антитела к протеиназе 3 и антитела к миелопероксидазе) в развитии системного поражения сосудов. Кроме того, В–клетки участвуют в образовании гранулем при ГВ, а увеличение их уровня в периферической крови ассоциируется с активностью заболевания.
В настоящее время проведено очень большое число клинических исследований, свидетельствующих об эффективности ритуксимаба при ГВ и МПА (табл. 3).
Таблица 3. Эффективность ритуксимаба при АНЦА–ассоциированных системных васкулитах
| Авторы | Характеристика | Эффективность | Обострение |
| O. Flossman et al. [33] | Проспективное n=11 (5 ГВ, 5 МПА, 1 синдром Чарга–Стросса) | Полная ремиссия – 9 Частичная ремиссия – 1 Отсутствие эффекта – 1 | У 6 (в среднем через 16,5 мес.) |
| K.A. Keogh et al. [34] | Проспективное n=10 (ГВ) | Полная ремиссия – 10 | 1 (9 мес.) |
| P.M. Aries et al. [35] | Проспективное n=7 | Полная ремиссия – 1 Частичная ремиссия – 1 Отсутствие эффекта – 5 | Нет данных |
| K.A. Keogh et al. [36] | Ретроспективное n=11 (10 ГВ, МПА – 1) | Полная ремиссия – 11 | 2 (7 и 12 мес.) |
| P. Eriksson et al. [37] | Ретроспективное n=9 (2 ГВ, 5 МПА) | Полная ремиссия – 1 Частичная ремиссия – 2 | 2 (2 и 13 мес.) |
| R. Omdal et al. [38] | Ретроспективное n=3 (ГВ) | Полная ремиссия – 3 | 3 (8, 12 и 27 мес.) |
| J–E Gottenberg [20] | Ретроспективное n=2 (ГВ) | Полная ремиссия – 1 Частичная ремиссия – 1 | Нет данных |
Примечание: ГВ – гранулематоз Вегенера; МПА – микроскопический полиангиит
Криоглобулинемический васкулит
Лечение СК практически не разработано. У пациентов с инфекцией ВГС монотерапия интерфероном (ИФН)–α недостаточно эффективна и часто сопровождается развитием обострений. Более эффективна комбинированная терапия ИФН–α и рибавирином, на фоне которой почти у 80% пациентов развивается ремиссия, однако у некоторых пациентов имеют место тяжелые побочные эффекты. Применение ГК, циклофосфамида и плазмафереза у пациентов, резистентных к противовирусной терапии, также имеет ограниченную эффективность и сопровождается тяжелыми побочными эффектами.
В настоящее время проведена серия исследований (всего 57 пациентов), которые суммированы в обзоре P. Cocoub и соавт. [39], свидетельствующих о высокой эффективности ритуксимаба при КВ (табл. 4).
Таблица 4. Эффективность ритуксимаба при криоглобулинемическом васкулите [39]
| ВГС (+) n=43 | ВГС (-) n=14 | |||
| n | % | n | % | |
| Поражение кожи • Полная/частичная ремиссия | 33 27 | 81,8 | 5 3 | 60 |
| Артралгии • Полная/частичная ремиссия | 30 24 | 80 | 4 3 | 75 |
| Нейропатия • Полная/частичная ремиссия | 25 23 | 92 | 4 4 | 100 |
| Криоглобулинемия • Полная/частичная ремиссия | 15 13 | 86,6 | 7 5 | 71,4 |
У двух третей больных был КВ, связанный с инфекцией ВГБ, а у остальных – ессенциальная смешанная криоглобулинемия (ЕСК). Основными клиническими проявлениями КВ были поражение кожи (84%), артралгии (61,4%), периферическая нейропатия (54,4%), гломерулонефрит (31,6%), которые были рефрактерны у противовирусной (более чем у половины больных) и иммуносупрессивной терапии у остальных. Как видно из таблицы 4, ритуксимаб был эффективен в отношении основных клинических проявлений КВ, причем у 80–93% пациентов развилась полная (или частичная) ремиссия. Однако у 39% больных развилось обострение в среднем через 6,7 мес. после последней инфузии. При этом у 8 из 14 удалось достигнуть ремиссии на фоне повторного курса терапии. Примечательно, что ритуксимаб был одинаково эффективен как у пациентов с ЕСК, так и с КВ, связанным с ВГС.
Идиопатическая тромбоцитопеническая пурпура
Идиопатическая тромбоцитопеническая пурпура (ИТП) – частое гематологическое аутоиммунное заболевание, связанное с синтезом антитромбоцитарных антител, характеризующееся тромбоцитопенией и риском кровотечений. В настоящее время проведено 19 исследований (всего 313 пациентов), в которых изучалась эффективность ритуксимаба, и 29 исследований (306 пациентов), посвященных безопасности терапии, результаты которых обобщены в недавно опубликованном систематическом обзоре [40]. Проведенный анализ продемонстрировал очень высокую эффективность ритуксимаба (62,5%) в отношении нормализации концентрации тромбоцитов (табл. 5).
Таблица 5. Эффективность ритуксимаба при ИТП [41]
| Число тромбоцитов х10 9 | Эффективность, % |
| Всего (>50) | 62,5 |
| Полный ответ (>150) | 46,3 |
| Частичный ответ (50–150) | 24,0 |
Длительность эффекта в среднем составила 10,5 мес. У большинства пациентов применялась стандартная схема лечения, состоящая из 4 еженедельных инфузий препарата в дозе 375 мг/м 2 . Примерно у половины пациентов до назначения ритуксимаба была проведена спленэктомия, которая была неэффективна.
Пузырчатка
Заболевания почек
Как уже отмечалось, ритуксимаб зарекомендовал себя как эффективный препарат для лечения волчаночного нефрита. Поэтому представляют особый интерес результаты применения ритуксимаба при других формах почечной патологии.
Мембранозная нефропатия (МН) – наиболее частая причина (20%) идиопатического нефротического синдрома (ИНС) [46]. Несмотря на то что у трети пациентов могут развиваться спонтанные ремиссии, почти в 40% случаев процесс прогрессирует, приводя к развитию хронической почечной недостаточности в течение 10 лет после начала болезни, даже несмотря на проводимую иммуносупрессивную терапию [47,48].
По данным P. Ruggenenti и соавт. [50], лечение ритуксимабом ассоциируется с достоверным снижением протеинурии, увеличением концентрации сывороточного альбумина у пациентов с ИНС, резистентным к длительной терапии ингибиторами ангиотензинпревращающего фермента (АПФ). Отмечена связь между эффективностью терапии ритуксимабом и тяжестью интерстициального фиброза и атрофии канальцев, по данным морфологического исследования в динамике [51].
Кроме того, предварительные результаты свидетельствуют о высокой эффективности ритуксимаба у детей с стероидрезистентным нефротическим синдромом [52] и очаговым сегментарным гломерулосклерозом, нередко развивающимся после пересадки почки [53]. Эти данные свидетельствуют о перспективах применения ритуксимаба в нефрологии и трансплантологии [54].
Таким образом, ритуксимаб является чрезвычайно эффективным и относительно безопасным препаратом для лечения РА и других тяжелых аутоиммунных заболеваний. Его внедрение в клиническую практику по праву можно считать крупным достижением медицины начала XXI века, которое имеет не только важное клиническое, но и теоретическое значение, поскольку способствует расшифровке фундаментальных звеньев патогенеза аутоиммунных заболеваний человека.
Фактически ритуксимаб является родоначальником нового направления в лечении аутоиммунных заболеваний человека, в основе которого лежит модуляция В–клеточного звена иммунитета.
Системная красная волчанка (СКВ) - хроническое, прогрессирующее полисиндромное заболевание, характеризующееся генетически обусловленным несовершенством иммунорегуляторных процессов, приводящим к неконтролируемой продукции антител к собственным клеткам и их компонентам, с развитием аутоиммунного и иммунокомплексного хронического воспаления.
Код МКБ 10 - М.32.
Этиология и патогенез СКВ недостаточно изучены. Предполагается сочетанное воздействие факторов внешней среды (фотосенсибилизации, стресса, нарушений питания, курения), генетических и гормональных. Возможно, что пусковым механизмом СКВ является активация вирусов (в первую очередь ретровирусов и близких к ним).
Среди конкретных механизмов развития болезни доказано влияние иммунных нарушений в Т-клеточном репертуаре и в продукции цитокинов, которые принимают участие в активации и дифференциации В-лимфоцитов в антителопродуцирующие клетки. Последнее ведет к гиперпродукции различных антител (в том числе и аутоантител), образованию циркулирующих иммунных комплексов, которые, откладываясь на базальных мембранах клеток различных органов, вызывают повреждение тканей с воспалительной реакцией и высвобождением новых антигенов, к которым формируются антитела, образуются иммунные комплексы, создавая порочный круг.
Клиническая картина СКВ характеризуется полиморфизмом симптомов и прогрессированием, при отсутствии лечения возможен летальный исход в связи с недостаточностью функции того или иного органа или присоединением вторичной инфекции.
В клинической практике при постановке диагноза СКВ используются диагностические критерии Американской ревматологической ассоциации, включающие 11 признаков:
1) эритема на лице ("бабочка");
2) дискоидная волчанка;
3) фотосенсибилизация;
4) язвы полости рта;
5) артрит;
6) серозит;
7) поражение почек (протеинурия 0,5 и более грамм в сутки, наличие цилиндров в моче);
8) неврологические нарушения (судороги или психоз);
9) изменения крови:
-
а) гемолититческая анемия,
б) содержание лейкоцитов 4х10 9 /л и ниже при двух и более исследованиях,
в) лимфопения 1,5х10 9 /л при двух и более исследованиях,
г) тромбоцитопения 100х10 9 /л;
При наличии любых 4 критериев диагноз СКВ считается достоверным.
СКВ поражает преимущественно женщин детородного возраста (20-30 лет). Многие годы беременность при СКВ считалась противопоказанием из-за существовавшего мнения, что она может быть причиной обострения и летального исхода заболевания, а также высокой частоты неонатальных осложнений. Однако совершенствование диагностики болезни, разработка современных методов ее лечения и, как следствие этого, - улучшение прогноза заболевания позволили изменить представления о беременности при СКВ.
Влияние беременности на СКВ
У многих больных СКВ беременность завершается успешно и не приводит к обострению заболевания вообще или обострение не сопровождается существенным ухудшением состояния больной и легко подавляется.
Среди факторов, определяющих вероятность обострения СКВ в период гестации, первое место занимает активность заболевания на момент зачатия.
Установлено, что наступление беременности при низкой активности СКВ в большинстве случаев не ухудшает заболевание. На прогноз заболевания не влияют длительность болезни и дозы кортикостероидных препаратов, предшествующие наступлению гестации. Зачатие в период высокой активности волчаночного процесса с тяжелыми органными поражениями почек, центральной нервной системы, легких и сердца, тем более симптомы функциональной недостаточности любого из этих органов резко увеличивают вероятность неблагоприятного исхода и СКВ, и беременности.
Для определения степени активности СКВ применяется классификация В.А.Насоновой (1972), учитывающая ряд клинико-лабораторных показателей заболевания (см. таблицу). Отсутствие активности СКВ или I (минимальная) степень активности позволяют разрешить беременить больной СКВ.
"Критическими" с точки зрения обострения заболевания, когда велика вероятность активации СКВ являются I триместр и первая половина беременности. Заслуживают внимания и первые 2-3 месяца после родоразрешения.
Клиническо-лабораторная характеристика активности патологичекого процесса при СКВ.
Влияние СКВ на течение беременности
Фертильность (способность к зачатию) у больных СКВ обычно не страдает, но тяжелые обострения заболевания и использование высоких доз кортикостероидов, умеренная почечная недостаточность вызывают субфертильность (олиго- и аменорею). К потере фертильности у больных СКВ может привести использование цитостатика циклофосфамида. Данных о влиянии других лекарственных препаратов, обычно используемых при лечении СКВ, на фертильность не имеется.
СКВ может неблагоприятно сказываться на беременности и ее исходе, что проявляется повышенной частотой самопроизвольных абортов, преждевременных родов, мертворождений и гипотрофий новорожденных, а также высоким процентом аномалий родовой деятельности и послеродовых осложнений. Поздний токсикоз у беременных с СКВ встречается в 2,8 раз чаще, чем у здоровых беременных, у 18,6% больных в последовом и раннем послеродовом периодах возникают кровотечения. Клиника гестоза может напоминать таковую при волчаночном гломерулонефрите. Только учет клинико-лабораторной картины заболевания, времени ее проявления могут быть решающими при проведении дифференциального диагноза. Различная тактика ведения больных с активным волчаночным нефритом (назначение иммуносупрессивной терапии) и гестозом (симптоматическая терапия) обусловливает практическую значимость правильной и своевременной диагностики этих состояний.
Большое значение в улучшении течения и исходов беременности и родов при СКВ имеет предшествующая гестации длительная (не менее 6-12 месяцев) ремиссия заболевания.
СКВ и антифосфолипидный синдром.
В последнее десятилетие проблема неблагоприятных акушерских исходов при СКВ приобрела новое направление, связанное с обнаружением у 30-40% больных СКВ особой группы антител - антифосфолипидных (АФА), к которым относятся: волчаночный антикоагулянт, антикардиолипиновые антитела и антитела, обусловливающие появление ложноположительной реакции Вассермана. Присутствие АФА у больных СКВ может приводить к формированию антифосфолипидного синдрома, одним из проявлений которого является привычное невынашивание беременности.
Антифосфолипидный синдром (АФС) впервые был описан при СКВ, а затем при некоторых других (преимущественно аутоиммунных) заболеваниях и состояниях. Основными диагностическими критериями АФС считают:
-венозные и артериальные тромбозы,
-привычное невынашивание беременности,
-тромбоцитопению.
При этом под "привычным невынашиванием беременности" подразумевается не менее двух случаев плодных потерь, не связанных с гинекологической или сугубо акушерской патологией.
Наличие одного из этих клинических признаков и повторных положительных анализов на волчаночный антикоагулянт и/или IgG-, IgM-антикардиолипиновые антитела позволяет диагностировать АФС.
Одновременное присутствие волчаночного антикоагулянта и антикардиолипиновых антител имеется у 60-80% больных. АФА могут исчезать или их титры уменьшаются в период между беременностями, а затем вновь появляться в очередную беременность.
Присутствие АФА у больных СКВ обусловливает до 90% случаев плодных потерь, при этом риск последних нарастает при наличии в анамнезе самопроизвольных выкидышей. Если гестация у беременных с АФС и не заканчивается смертью плода, которая чаще наступает в первой половине беременности, то у таких больных нередко наблюдаются поздний гестоз (в том числе пре- и эклампсия) и преждевременные роды. Описан и "послеродовый АФА-зависимый синдром", который проявляется тромбозами крупных и средних сосудов с соответствующей симптоматикой.
Таким образом, обнаружение АФА у беременных с СКВ в большинстве случаев осложняет течение беременности и послеродового периода и является одной из главных причин плодных потерь. Поэтому своевременная диагностика АФС, адекватная терапевтическая и акушерская тактика необходимы для улучшения исходов беременности у больных СКВ с сопутствующим АФС.
Влияние СКВ на плод (неонатальная волчанка)
Неонатальная волчанка (НВ) - следствие пассивно приобретенного аутоиммунного заболевания, серологическими маркерами которого являются антитела к растворимым антигенам тканевых рибонуклеопротеинов - Ro/Lа-антитела. С НВ связано около 1% всех случаев плодных потерь при "СКВ-беременности".
Пассвная трансплацентарная передача Ro/Lа-антител во время беременности плоду ведет к развитию у него поражения кожи и/или сердца -двум основным признакам НВ. Редко НВ сопровождается другими проявлениями (гепатомегалией, печеночной дисфункцией, спленомегалией, лимфоаденопатией, пневмонитом, тромбоцитопенией, анемией), которые обычно носят преходящий характер.
Кожные высыпания - наиболее частый синдром НВ, появляются обычно в течение первых 2-х месяцев жизни, типично - на лице и верхних конечностях, нередко после инсоляции или ультрафиолетового облучения по поводу неонатальной желтухи. Часто по форме сыпь представлена ограниченными округлыми пятнами и бляшками, нередко имеет сходство с подострой кожной красной волчанкой. Поражение обычно регрессирует в течение 6 месяцев, оставляя в отдельных случаях гипопигментацию.
Терапии НВ в большинстве случаев не требует, симптоматика стихает по мере естественного выведения материнских антител (кроме, ВППБ). Профилактическое назначение медикаментозных средств также не рекомендуется. Необходимость в дополнительной терапии возникает при наличии у матери ранее рожденных детей с НВ и предполагает применение высоких доз дексаметазона (как неинактивирующегося в плаценте) и плазмафереза в течение беременности.
Акушерская и терапевтическая тактика
1. Наступление и вынашивание беременности у больной СКВ могут быть разрешены при клинической ремиссии или минимальной клиникоиммунологической активности заболевания (I степени, по классификации В.А.Насоновой), продолжающейся не менее 6-12 месяцев до зачатия, и отсутствии симптомов функциональной недостаточности любого органа или системы.
2. Противопоказаниями для беременности при СКВ являются наличие высокой активности заболевания, симптомы волчаночного нефрита (протеинурия более 3 г/сут.), нефротический синдром, почечная недостаточность (сывороточный креатинин более 130 мкмоль/л), артериальная гипертензия, недостаточный сердечно-легочный резерв, также как функциональная недостаточность любого органа и поражение центральной нервной системы.
3. Использование медицинского аборта при СКВ как метода предупреждения обострения болезни в период гестации неоправдано. Более того, он может явиться провоцирующим фактором активации СКВ. Однако терапевтический аборт показан в случаях тяжелой почечной, сердечной или легочной недостаточности у больных СКВ.
4. Наличие АФС или отдельных его синдромов у больной СКВ требует проведения повторных исследований на АФА (как на волчаночный антикоагулянт, так и на антикардиолипиновые антитела) на этапе планирования беременности и мониторинг их при наступлении последней с целью своевременной коррекции титров АФА во избежание осложнений течения заболевания и гестационного процесса.
5. У анти-Rо/Lа-позитивных беременных с СКВ показано повторное проведение ультразвукового исследования плода и допплерометрии пупочных сосудов после 18 недели гестации для ранней диагностики нарушений сердечной деятельности плода и определения показаний для срочного родоразрешения.
6. Доза кортикостероидного препарата при условии стабильности состояния больной должна оставаться неизменной в течение всей беременности и не менее 2-х месяцев после родоразрешения. При обострении СКВ - терапия кортикостероидами усиливается до адекватной степени активности болезни. Вопрос о прерывании беременности решается индивидуально.
7. Госпитализация в родильный дом должна быть не позднее 36-37 недели гестации. В более ранние сроки при обострении течения болезни женщину целесообразно госпитализировать в ревматологический или терапевтический стационар.
8. При наличии клинических признаков активности заболевания родоразрешение производится преждевременно, что следует учитывать при определении срока госпитализации в родильный дом. В период родов показано дополнительное парентеральное введение гидрокортизона (30-100 мг/сут.) с последующим постепенным снижением этой дозы в течение 3-5 дней после родов или аборта.
9. Показаниями для оперативного родоразрешения (кесарева сечения) беременных с СКВ, кроме акушерской патологии, являются:
СПИСОК ЛИТЕРАТУРЫ
Системная красная волчанка (СКВ) - классическое аутоиммунное ревматичес кое заболевание, в основе патогенеза которого лежат дефекты иммунорегуляции, приводящие к неконтролируемой гиперпродукции В лимфоцитами аутоантител к компонентам собственных тканей и развитию хронического вос паления, затрагивающего многие органы и системы. Прогрессирующее поражение жизненно важных органов определяет жизненный и социальный прогноз больных СКВ, при "катастрофическом" течении летальность достигает 40% в год, в связи с чем принципиальное значение имеет разработка новых методов патогенети ческой терапии этого заболевания.
В последние десятилетия сформиро ваны основные принципы терапии СКВ, в основе которых лежит применение раз личных режимов глюкокортикоидной (ГК) терапии и цитотоксических препаратов. Современные терапевтические схемы с использованием пульс-терапии метилпреднизолоном и циклофосфаном (ЦФ) значительно улучшили отдаленную выжи ваемость и высокоэффективны при развитии угрожающих состояний у больных СКВ. Наиболее ярким примером повыше ния качества лечения СКВ является более чем пятикратное увеличение 5-и летней выживаемости у больных с волчаночным нефритом. Однако, отдаленный жизненный прогноз у этой категории больных остается неблагоприятным. Так, 20-и летняя выжи ваемость при развитии люпус-нефрита, даже при использовании современных терапевтических программ, не превышает 20%. Значительно отягощает кратко срочный и отдаленный жизненный прогноз у больных СКВ развитие таких угрожающих состояний как цитопенических криз, поражение центральной и периферической системы, пневмонит, катастрофическое течение АФС и генерализованный (криоглобулинемический) васкулит. Основными факторами, влияющими на развитие неблагоприятного исхода при СКВ, является резистентность к высоким дозам ГК и циклофосфана и торпидное, прогрес сирующее течение болезни. В тоже время применение высоких доз ГК и ЦФ ассоциируется с повышением риска воз никновения тяжелых вирусных и бакте риальных инфекций, что в значительной степени лимитирует их назначение.
Безусловно, "сверхзадачей" терапии СКВ и других аутоиммунных заболеваний, является создание препаратов селективно влияющих на ключевые звенья патогенеза. В этой связи перспективным направ лением фармакотерапии СКВ являются препараты, блокирующие пролиферацию В - клеток, среди которых одним из наиболее изученных, безусловно является Ритуксимаб (Rituxumab, MabTHera, Roch,), который представляет собой рекомби-нантные химерные (мышь-человек) моноклональные антитела к поверхностным рецепторам В-лимфоцитов - CD20. Пред полагаемый механизм действия ритуксимаба, направленный на подавление активности В клеток, может реализовываться за счет антитело-зависимой клеточной цитотоксичности, комплемент-зависимой цитотоксичности, ингибиции клеточной пролиферации и индукции апоптоза В лимфоцитов. Молекулярные взаимодействия связывания CD20 могут приводить к перестройке мембранных липидов, активации ферментов и регу ляции синтеза интерлейкина 10. Основной мишенью ритуксимаба являются клетки предшественники, незрелые, зрелые и "наивные" В-лимфоциты. На плазмати ческие клетки препарат не оказывает влияния, из-за отсутствия их на мембране CD20.
Впервые ритуксимаб был применен для лечения больных злокачественной В-клеточной лимфомой в 1997 г. Моно терапия ритуксимабом В-клеточных лимфом эффективна у 50% больных и в 10% случаев наблюдается клиническая ремис сия, в тоже время при комбинации его с химиотерапией эффективность лечения возрастает до 81-97%, а частота ремиссий достигает 74%.
В настоящее время, по данным литературы, ритуксимаб применялся в лечении более чем 200 больных СКВ. Назначение препарата в дозах от 1000 до 2000 мг (обычно РМ назначается по 375 мг/м 2 еженедельно в течение 4 недель) оказалось высокоэффективным у больных с поражением суставов, кожи, слизистых оболочек, полисерозитом, лихорадкой и гематологическими нарушениями. Особо го внимания заслуживает тот факт, что высокая эффективность ритуксимаба (око ло 80%) отмечалась при развитии прогрессирующего волчаночного нефрита, тяжелом поражении ЦНС, гематоло гическом кризе, пневмоните и катастро фическом течении АФС - при неэффек тивности пульс-терапии ГК, ударных доз циклофосфана, иммуносорбции, плазмафереза, мофетила микофенолата и цик лоспорина.
В настоящее время проведено нес колько открытых пилотных испытаний эффективности ритуксимаба у больных с волчаночным нефритом. Так, в одном из них (P. Sfikakis et al.) препарат был назначен 10 больным с активным пролиферативным люпус-нефритом (III-IV класс по класси фикации ВОЗ), без признаков почечной недостаточности. До включения в ис следование все пациенты получали вы сокие дозы глюкокортикоидов (ГК), пульс-терапию циклофосфаном (ЦФ) или мофетила-микофенолат (МФ) без существен ного эффекта. Инфузии РМ по 375 мг/м - проводились еженедельно в течение 4-х недель. В результате проведенного лечения частичная ремиссия (улучшение на 50% клинико-лабораторных параметров нефрита) зафиксирована у 8 больных через 1-4 месяца. В последующем полная ремиссия (протеинурия В большинстве исследований пока зано, что эффект терапии этим препаратом при волчаночном нефрите развивается не сразу, как правило значимое уменьшение протеинурии, повышение клубочковой фи льтрации, увеличение содержания альбу мина в сыворотке крови, наблюдается на 2-3 месяце от начала лечения и достигает своего максимума к 5-6 месяцу. Одно временно наблюдается уменьшение ин дексов активности СКВ (BILAG, SLEDAI), антител к ДНК, повышение комплемента. Напротив, применение Ритуксимаба у больных с высокой активностью, обус ловленной внепочечными проявлениями СКВ - цитопенией, полиартритом, серозитом, пневмонитом и АФС, может при вести к развитию положительной динамики уже через несколько дней.
Отчетливый быстрый эффект ритукси маба отмечен у больных с критическим течением СКВ, обусловленным пораже нием ЦНС. Поражение ЦНС (нейролюпус), сопровождающееся развитием состояния угрожающего жизни у больных СКВ, наблюдается достаточно редко, в 2-4% случаев. Терапия таких тяжелых прояв лений волчаночного поражения ЦНС, как судорожный синдром, демиелинизирующая нейропатия, поперечный миелит, психоз - представляет большие трудности, стандартных терапевтических алгоритмов не существует, а летальность превышает 50%. В этой связи особый интерес вызывает публикация Tokunaga, в которой сообщается о применении ритуксимаба у 10 больных СКВ по жизненным пока заниям. У всех описываемых больных наблюдались различные проявления пора жения ЦНС: потеря сознания, судороги, дезориентация, атаксия, сенсорная ней ропатия, психоз. Во всех случаях наз начение ритуксимаба привело к быстрому улучшению, развившемуся в течение нес кольких дней от начала лечения. Авторы отмечают быстрый выход из коматозного состояния, уменьшение и исчезновение двигательных и чувствительных наруше ний, купирование судорожного синдрома, психоза и депрессии. Нарастание поло жительной динамики, переходящее в стабильное улучшение наблюдалось в течение 6-7 месяцев, у всех больных за этот период удалось существенно снизить дозу преднизолона и отменить иммунодепрессанты. Полученные данные свидетельствуют о высокой эффективности инфузий ритуксимаба при СКВ с развитием критических состояний, непосредственно угрожающих жизни пациентов. Особенно важным представляется то, что высокая эффективность терапии наблюдалась у больных с тяжелым, прогрессирующим поражением ЦНС с неэффективностью интенсивной терапии, включающей ударные дозы ГК, ЦФ в комбинации с плазмаферезом и иммуносорбцией.
Применение ритуксимаба у больных СКВ не только индуцирует развитие клинического улучшения, продолжитель ностью от нескольких месяцев до 1 года, но и приводит к появлению различных иммунологических феноменов. Практи чески все исследователи отмечают развитие лимфопении, подавление В-лимфоцитов, наблюдаемое практически сразу после проведения курса лечения ритуксимабом. Leandro, Anolik сообщают о значительном подавлении В лимфоцитов, продолжающееся в среднем около 4 месяцев от начала терапии и корре лирующее с развитием клинического эффекта, нормализацией гемоглобина, СОЭ, комплемента. По мнению авторов, появление на фоне терапии антихиме рических антител может провоцировать развитие аллергических реакций. Те же авторы не выявили достоверного снижения антител к ДНК. Оценивая влияние ритуксимаба на активность люпус-нефрита Stifakis et al. так же обращают внимание на подавление 99% В лимфоцитов у 8 из 10 больных, наблюдаемое от 1 до 7 месяцев. Продолжительность угнетения В клеток соответствовала длительности ремиссии и, напротив, их регенерация предшество вала развитию обострения.
Большинство исследователей отме чают достаточно хорошую переносимость препарата. Подавляющее большинство побочных реакций возникающих во время или после проведения инфузий, так или иначе могут быть связаны с "биоло гической", белковой основой препарата. Как правило, наблюдаются такие явления как озноб, лихорадка, гипотензия, одышка. Обычно такие побочные реакции устра няются более медленной скоростью введения, дробным введением. Для профилактики может использоваться пара цетамол, антигистаминовые препараты или ГК в небольших дозах. Сложившимся правилом, позволяющим практически пол ностью устранять "инфузионные" реакции, является использование инфузомата и внутривенное введение 100-250 мг метипреда непосредственно перед инфузией.
В большинстве исследований посвя щенных применению ритуксимаба как в онкологии, так и при аутоиммунных заболеваниях, не находит свое под тверждение концепция об увеличении риска развития оппортунистических инфекций. Вероятно это связано с тем, что несмотря на значительное снижение циркулирующих В лимфоцитов после инфузии РМ, не наблюдается сколь либо существенного снижения продукции иммуноглобулинов, что в свою очередь можно объяснить наличием значительного количества долгоживущих плазматических клеток.
Российский регистр больных СКВ получающий терапию ритуксимабом
Прогностически неблагоприятные варианты течения СКВ и состояния угрожающие жизни
| • Прогрессирующий нефрит (III-IV класс по ВОЗ) • Поражение ЦНС (поперечный миелит, судороги, кома, психоз) • Геморрагический альвеолит • Гематологический криз • КАФС (тромбозы, мультиорганное поражение) • Генерализованный (fulminant) некротизирующий васкулит | • "Стандартные" методы терапии • Пульс-терапия метилпреднизолоном и циклофосфаном • Внутривенный иммуноглобулин • Плазмаферез • Антикоагулянты • Реанимационные мероприятия Смертельные исходы в течение 1-го года до 40% |
Изменение 5-и летней выживаемости у больных С IV классом ВН (J.Cameron 1998)
| Годы | Выживаемость % |
| 1953-1969 отсутствие патогенетической терапии | 17% |
| 1970-1979 средние и большие дозы ГКС, пульс-терапия | 55 (в 3 раза!) |
| 1980-1983 + циклофосфан | 80 |
| 1990-1995 + мофетила микофенолат, циклоспорин, комбинированная ПТ | 82 |
| XXI век: МабТера, А-BLyS, Октембра . | ? |
20-летняя выживаемость больных СКВ
Анти-В клеточная терапия Ритуксимаб (МабТера, ROCHE)
Показания для назначения Ритуксимаба при СКВ
Неконтролируемая активность болезни
Влияние ритуксимаба на показатели активности СКВ
| Британский Индекс активности СКВ | Антитела к двухспирапьной ДНК |
Эффективность РМ у больных с волчаночным нефритом
Показатели активности волчаночного нефрита после терапии Ритуксимабом
Изменение морфологической активности нефрита через год после терапии Ритуксимабом
 | До лечения Индекс активности 10 |
 | Через год Индекс активности 1-2 |
Эффективность Ритуксимаба при неиролюпусе
М. Тikunаgа et al. 2006
| Клинические проявления | Результат и скорость достижения эффекта | Длительность эффекта |
| 6 больных Кома, судороги, каталепсия, психоз, нейропатия, галлюцинации, головные боли | Выздоровление 2- 5 дней | 4-29 месяцев |
| 4 больных Депрессия, психоз, нейропатия | Улучшение 1-4 недели | 7-14 месяцев |
Побочные эффекты и осложнения ритуксимаба
- Инфузионные реакции (озноб, гипотония, отеки, высыпания, зуд, лихорадка) могут наблюдаться у 10-20% больных. Возможно обусловлены образованием антихимерных антител (антител против РМ). Вероятность развития при повторных инфузиях уменьшается. Профилактика - метилпреднизолон 100 мг в/в до инфузии.
- Тяжелые, требуюшие антимикробной терапии инфекции редки. Чаще наблюдаются ОРВИ, герпетичекая инфекция.
ЛИТЕРАТУРА
1. Lipsky PE. Systemic lupus erythe matosus: an autoimmune disease of B cell hyperactivity. Nat Immunol. 2001;2:764-766.
2. Silverman GJ. Anti-CD20 therapy in systemic lupus erythematosus: a step closer to the clinic. Arthritis Rheum. 2005;52:371-377
3. Vasoo S, Hughes GRV Perspectives on the changing face of lupus mortality. Autoimmun Rev. 2004;3:415-417.
4. Pryor BD, Bologna SG, Kahl LE. Risk factors for serious infection during treatment with cyclophosphamide and high-dose corti costeroids for systemic lupus erythemato sus. Arthritis Rheum. 1996;39:1475-1482.
5. Chambers SA, Isenberg DA Anti - B cell therapy (Rituximab) in the treatment of autoimmune disease. Lupus. 2005;14:210-214.
6. John Looney, Jennifer H. Anolik, Debbie Campbell, Raymond E. Felgar et al. B Cell Depletion as a Novel Treatment for Systemic Lupus Erythematosus A Phase I/II Dose-Escalation Trial of Rituximab Arthritis Rheum. 2004;Aug;8:2580-2589.
7. Sfikakis PP, Boletis JN, Lionaki S., Vigklis V., Fragiadaki KG, Iniotaki A., and Moutsopoulos HM Remission of Proliferative Lupus Nephritis Following B Cell Depletion Therapy Is Preceded by Down-Regulation of the T Cell Costimulatory Molecule CD40 Ligand An Open-Label Trial. Arthritis Rheum. 2005;52(2):501-513.
8. Mikiko Tokunaga et al. Efficacy of rit uximab (Anti-CD20) for refractory systemic lupus erythematosus involving the central nervous system. 15 Nov 2006; Ann Rheum Dis
9. С.К. Соловьев, Е.Л. Насонов, М.А.Котовская. Ритуксимаб в лечении системной красной волчанки. Русский Медицинский журнал, 2005, 26, 1731-1736.
10. Е.Л. Насонов, С.К. Соловьев. Перспективы применения моноклональных антител к В-лимфоцитам (ритуксимаб) при воспалительных ревматических заболеваниях. Научно-практическая ревматология 1, 2007, 4-8.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
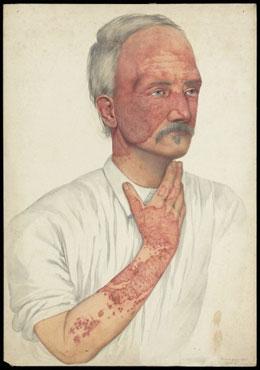
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди

Обзор
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
Автор
Редакторы


Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.

Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).

Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.

Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.

Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].

Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.

Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].

Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).

Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:

