Лечение микоплазмы и трихомониаза у
Обновлено: 19.04.2024
Вопросы антибиотикотерапии урогенитальной микоплазменной инфекции активно дискутируются. Многочисленные исследования посвящены разработке рекомендаций по терапии микоплазменной инфекции. Но по-прежнему наиболее сложным и актуальным на сегодняшний день ост
В последние десятилетия наряду с ростом заболеваемости урогенитальной патологией отмечаются значительные изменения в ее структуре. По данным эпидемиологических исследований, более чем у 40% больных с воспалительными заболеваниями урогенитального тракта выявляется микоплазменная инфекция [1].
Урогенитальная микоплазменная инфекция довольно широко распространена в популяции. Человек является естественным хозяином, по крайней мере, одиннадцати видов микоплазм, из них три вида (Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum) способны вызывать воспалительные заболевания урогенитального тракта. Носительство М. hominis и U. urealyticum среди населения варьирует от 10% до 50% [1].
В настоящее время все большее внимание в отечественной и зарубежной литературе уделяется виду U. urealyticum. Данный вид включает в себя два биовара: PARVO (серотипы 1, 3, 6 и 14) и T-960 (серотипы 2, 4, 5, 7, 8, 9, 10, 11, 12, 13). Оба биовара способны инициировать патологические проявления. Так, с биоваром PARVO связывают выраженную лейкоцитарную реакцию при микроскопии мазка, кольпит, пиелонефрит, дистрофические изменения плаценты, а также рождение детей с массой тела менее 3 кг.
Биовар Т-960 считается ответственным за проявления негонококкового уретрита у мужчин, патологические выделения из влагалища у женщин и, в редких случаях, внутриутробную гибель плода [3].
Отличительными особенностями микоплазм и уреаплазм являются отсутствие клеточной стенки и способность паразитировать на мембране клеток хозяина.
Основной путь передачи микоплазменной инфекции — половой. Чаще всего микоплазмы обнаруживаются у лиц с повышенной половой активностью. Для развития инфекционного процесса важное значение имеет не столько сам факт наличия или отсутствия микоплазм, сколько широта и массивность их диссеминации. К факторам, провоцирующим развитие инфекционного процесса, относятся: присоединившаяся инфекция другой природы, изменение гормонального фона, беременность и роды; нарушения иммунного и интерферонового статусов организма. Немаловажную роль в развитии инфекции играет и вирулентность конкретного штамма.
Кроме того, широко распространено бессимптомное носительство микоплазм. Во многих случаях они вызывают латентную инфекцию, которая под влиянием различных стрессовых факторов может перейти в хроническую рецидивирующую или острую форму.
Клиническая картина мико- и уреаплазменной инфекции неспецифична и, как правило, не отличается от клинических проявлений инфекций, вызванных другими возбудителями урогенитальных инфекций.
Таким образом, воспалительные заболевания мочеполовых органов, обусловленные патогенными и условно-патогенными микоплазмами, продолжают оставаться серьезной проблемой в связи с возможностью развития тяжелых осложнений, связанных с репродуктивной функцией. Несмотря на неоднозначность мнений исследователей в отношении патогенной роли мико- и уреаплазменной инфекции, в этиологической классификации Всемирной организации здравоохранения (ВОЗ) 2006 г. и синдромальной классификации CDC (Centers for Disease Control and Prevention, центры по контролю и профилактике заболеваний США) эти микроорганизмы выделены как возможные этиологические агенты неспецифических негоноккоковых уретритов, воспалительных заболеваний органов малого таза и бактериального вагиноза [2].
Современные международные и российские рекомендации по лечению микоплазменной инфекции
Одним из наиболее сложных на сегодняшний день остается вопрос эффективности терапии урогенитальных инфекций.
Многочисленные исследования посвящены разработке схем и методик применения тех или иных антимикробных препаратов. Оптимизируют антибактериальную терапию с помощью иммуномодуляторов, ферментных и других лекарственных средств. В целом, терапия инфекций, передаваемых половым путем, должна быть комплексной, а применяемые препараты — обладать широким спектром действия. К препаратам, используемым для лечения инфекций, передаваемых половым путем, ВОЗ выдвинуты следующие требования:
- эффективность не менее 95%;
- хорошая переносимость и малая токсичность;
- безопасность использования во время беременности;
- медленное развитие резистентности микроорганизмов к средствам терапии;
- доступная цена.
Основные принципы медикаментозной терапии:
- основные препараты (препараты выбора) — обеспечивают наилучшее соотношение между эффективностью лечения и доказанной безопасностью лечебного средства;
- альтернативные препараты — обеспечивают приемлемые результаты лечения при отсутствии возможности использования основных схем лечения (беременность, кормление грудью, индивидуальная непереносимость лекарственного средства, сопутствующие заболевания и т. д.).
Рациональный выбор антибиотиков для эмпирической терапии следует осуществлять с учетом следующих критериев:
- спектр активности, соответствующий предполагаемому возбудителю;
- фармакокинетика, определяющая проникновение антибиотика в очаг воспаления, кратность введения и длительность курса лечения;
- эффективность при урогенитальных инфекциях, доказанная в рандомизированных клинических исследованиях;
- противопоказания и частота побочных эффектов;
- удобство применения для пациента (повышает аккуратность соблюдения режима лечения);
- фармакоэкономические аспекты лечения.
Вопросы антибиотикотерапии урогенитальной микоплазменной и уреаплазменной инфекции также активно дискутируются. В то же время адекватная антибиотикотерапия должна проводиться лишь с учетом чувствительности конкретного штамма возбудителя [5–6].
С учетом вышеуказанных пунктов можно выделить следующие перспективные группы антибиотиков для лечения мико- и уреаплазменной инфекции: тетрациклины, макролиды, фторхинолоны, азалиды.
Критериями назначения этиотропной терапии при выявлении генитальных микоплазм, по мнению большинства исследователей, являются:
1) клинические и лабораторные признаки воспалительного процесса в органах мочеполовой системы;
2) результаты комплексного микробиологического обследования на наличие патогенных и условно-патогенных микроорганизмов с количественным обнаружением генитальных микоплазм более 104 КОЕ/мл;
3) предстоящие оперативные или другие инвазивные мероприятия на органах мочеполовой системы;
4) бесплодие;
5) беременность (оценка акушерско-гинекологического анамнеза).
Среди наиболее часто применяемых антибиотиков сохраняется стабильно высокая чувствительность мико- и уреплазменной инфекции к джозамицину (94,8% 5 лет назад и 94,4% в настоящее время) и отмечается увеличение числа штаммов, чувствительных к доксициклину, с 93,2% до 97,2%. Вместе с тем чувствительность к другому антибиотику этой же группы, тетрациклину, снизилась с 92,5% до 83,3%.
Препараты, указанные в альтернативных схемах, не имеют каких-либо преимуществ между собой и рассматриваются как равнозначные.
Рекомендованными препаратами в соответствии с Европейским руководством по ведению беременных женщин, инфицированных микоплазмами [7], являются: эритромицин по 500 мг 4 раза в день в течение 7 дней; или амоксициллин 500 мг внутрь 3 раза в день 7 дней; или джозамицин 500 мг 2 раза в день 7 дней.
Для лечения беременных [2] применяется следующая схема: джозамицин по 500 мг внутрь 3 раза в сутки в течение 10 дней (табл. 1 и 2).
Эффективность и безопасность отдельных препаратов, используемых для терапии микоплазменной инфекции
Тетрациклины
Одним из основных препаратов для лечения инфекций, передаваемых половым путем, остается представитель группы тетрациклинов — доксициклин. При этом эталоном эффективности различных режимов терапии является пероральный прием доксициклина (100 мг 2 раза в день в течение 10 дней). Доксициклин отличается от тетрациклина лучшими фармакокинетическими свойствами и большей безопасностью. В основе механизма антибактериального действия доксициклина, как и других тетрациклинов, лежит подавление им биосинтеза белка микробной клетки на уровне рибосом [8]. Среди солей доксициклина предпочтение следует отдавать моногидрату, который, в отличие от гидрохлорида, не вызывает развития эзофагита и оказывает минимальное воздействие на микрофлору кишечника [4]. Наиболее удобной в применении является форма доксициклина моногидрата в виде таблеток диспергируемых, которая позволяет применять препарат как в форме таблеток, так и суспензии или раствора. Кроме того, лекарственная форма диспергируемой таблетки обеспечивает стабильное всасывание доксициклина и равномерное нарастание его концентрации в крови. При негонококковом уретрите, вызванном U. urealyticum, M. hominis или M. genitalium, доксициклин применяют в дозе 100 мг 2 раза в день в течение 7–14 дней [4]. Хорошие результаты были получены при применении доксициклина у женщин, инфицированных различными видами микоплазм и страдающих бесплодием или привычным невынашиванием беременности. В ряде случаев после применения доксициклина наступала беременность, которая заканчивалась нормальными родами в срок и без осложнений [4].
С клинической точки зрения наиболее актуальным представляется выбор тех препаратов, к которым U. urealyticum демонстрирует наивысшую чувствительность. Выделение устойчивых к действию доксициклина инфектов отмечается крайне редко. Рост числа штаммов, чувствительных к доксициклину, можно объяснить тем, что в последние годы этот препарат несколько потеснили макролиды (кларитромицин, рокситромицин, азитромицин), активно применяемые в терапии урогенитальной инфекции.
Сохранение высокой чувствительности возбудителя к доксициклину доказывает обоснованность его применения в лечении микоплазмозов. При его применении могут наблюдаться отдельные побочные эффекты, чаще со стороны желудочно-кишечного тракта (ЖКТ). К недостаткам доксициклина относится невозможность его назначения детям до 8 лет и беременным женщинам, а также женщинам в период лактации.
Макролиды
Другие группы антибиотиков, применяемые для лечения микоплазмозов, представлены, в частности, макролидами. Для макролидов в целом характерны более низкие минимальные подавляющие концентрации (МПК), чем для фторхинолонов. По мнению ряда исследователей, при мико- и уреаплазменной инфекции макролиды должны использоваться в качестве препаратов первого ряда [9].
Препарат группы макролидов эритромицин в течение длительного времени применялся в качестве альтернативы тетрациклинам, однако этот препарат часто плохо переносится больными. Согласно опубликованным результатам терапия эритромицином остается достаточно эффективной — 83–95%. Тем не менее многие авторы отмечают, что выраженные побочные эффекты со стороны ЖКТ, а также высокая курсовая доза и необходимость многократного приема (4 раза в день по 500 мг) снижают целесообразность выбора этого антибиотика.
В группе макролидов самые низкие МПК для уреаплазм имеют кларитромицин и джозамицин. Прием 250 мг кларитромицина 2 раза в день в течение 7 дней, как правило, приводит к исчезновению M. hominis, U. urealyticum из половых путей мужчин и женщин. Применение рокситромицина (300 мг 1 раз в день) не уступает по эффективности стандартному режиму приема доксициклина.
Джозамицин обладает широким спектром антибактериального действия, включающим не только все клинически значимые возбудители микоплазмоза (M. hominis, M. genitalium, U. urealyticum), но и другие частые этиологические агенты при урогенитальных инфекциях — хламидии и Neisseria gonorrhoeae.
Преимуществом 16-членных макролидов, к которым относится джозамицин, перед эритромицином и другими препаратами этой группы является более редкое развитие к ним устойчивости у ряда микроорганизмов, например S. pneumoniae [10]. Аналогичная тенденция прослеживается и в отношении внутриклеточных возбудителей. Несмотря на широкое применение джозамицина, клинические штаммы микоплазм и уреаплазм сохраняют высокую чувствительность к нему как за рубежом [11], так и в России [3]. Например, в период с 2001 по 2003 г. был отмечен рост количества устойчивых штаммов к рокситромицину, кларитромицину, левофлоксацину и клиндамицину, в то время как уровень антибиотикорезистентности к джозамицину за это время не изменился [7]. Аналогичные данные были получены и в исследовании, проведенном в Красноярске, где было показано сохранение стабильно высокой чувствительности U. urealyticum к джозамицину на протяжении последних 5 лет [12]. Более высокая активность джозамицина в отношении уреаплазм по сравнению с другими макролидами продемонстрирована и в других отечественных исследованиях [4].
В зарубежном сравнительном исследовании чувствительности к семи антибактериальным препаратам (джозамицин, доксициклин, миноциклин, спарфлоксацин, рокситромицин, офлоксацин и азитромицин) возбудителей смешанной инфекции U. urealyticum и M. hominis, выделенных у больных негонококковым уретритом, также была показана их высокая чувствительность к джозамицину, превышающая таковую к препаратам сравнения [13]. При подобных инфекциях уровень резистентности возбудителей особенно высок, в связи с чем выбор препаратов для их лечения должен проводиться наиболее тщательно. Например, резистентность к азитромицину в данном исследовании составила 90,48%.
Джозамицин накапливается в лимфатических узлах и половых органах, причем его концентрации в этих органах при воспалительных процессах повышаются, т. к. он способен проникать внутрь фагоцитарных клеток (макрофагов, фибробластов, полиморфноядерных гранулоцитов) и переноситься ими в очаг воспаления [14]. Концентрация препарата в полиморфноядерных лейкоцитах человека, моноцитах и альвеолярных макрофагах приблизительно в 20 раз выше, чем во внеклеточном пространстве [15].
В отличие от большинства других макролидов, джозамицин наряду с хорошим проникновением внутрь клеток создает и высокие концентрации в сыворотке крови, что имеет важное значение при системном проявлении инфекции [16]. Препарат не связывается с изоферментами цитохрома Р-450 и не влияет на НАДФ-цитохром-С-редуктазу, поэтому обладает значительно более низким риском лекарственных взаимодействий, чем эритромицин и кларитромицин, и не оказывает отрицательного влияния на функцию печени. Для джозамицина характерны выраженные иммуномодулирующие свойства, которые могут способствовать усилению терапевтического эффекта у больных с воспалительными заболеваниями [17].
После приема внутрь джозамицин быстро абсорбируется из ЖКТ. Сmax достигается через 1–2 ч после приема. Через 45 мин после приема дозы 1 г средняя концентрация джозамицина в плазме составляет 2,41 мг/л. Связывание с белками плазмы не превышает 15%. Прием препарата с интервалом в 12 ч обеспечивает сохранение эффективной концентрации джозамицина в тканях в течение суток. Равновесное состояние достигается через 2–4 дня регулярного приема.
Одним из преимуществ джозамицина является быстрое создание высокой концентрации препарата в клетках и тканях за счет его высокой липофильности. При пероральном применении концентрация препарата в лейкоцитах, моноцитах, фагоцитах, макрофагах и клетках эпителия приблизительно в 20 раз выше, чем в межклеточном пространстве.
Поскольку микоплазмы и уреаплазмы являются внутриклеточными паразитами, вышеуказанные свойства джозамицина делают его идеальным препаратом для лечения инфекций, вызванных этими патогенами.
Доказана также высокая клиническая эффективность джозамицина. По данным Института исследования инфекционных кожно-венерических заболеваний (Австрия), степень излечения микоуреаплазмоза при применении джозамицина составляет 97% (для сравнения: эффективность применения доксициклина при данной патологии составляет 50%, азитромицина — 55,5%) [1].
Достаточно широкий спектр антимикробного действия антибиотика делает его эффективным при лечении смешанных инфекций, включающих анаэробные, к которым женщины особенно восприимчивы. Для лечения урогенитального микоуреаплазмоза рекомендуемая доза препарата — по 500 мг 2 раза в сутки в течение 7–10 дней.
Азитромицин является полусинтетическим антибиотиком широкого спектра действия, первым представителем подкласса азалидов. Подобно другим макролидам, обладает в основном бактериостатическим эффектом, но благодаря способности создавать очень большие внутриклеточные концентрации может действовать бактерицидно. К достоинствам азитромицина следует отнести его хорошую переносимость. Результаты клинических исследований показали, что азитромицин и доксициклин обладают практически одинаковой эффективностью при уреа- и микоплазменной инфекциях (94,9% и 95,9% соответственно).
Фторхинолоны
Фторхинолоны в лечении микоплазмозов относятся к альтернативным препаратам. Среди них предпочтение стоит отдавать офлоксацину и его левовращающему изомеру — левофлоксацину.
Амоксициллин
Согласно рекомендациям американского Центра по профилактике и контролю за заболеваниями, к альтернативным препаратам, применяемым при урогенитальных инфекциях (табл. 1), относится амоксициллин. Однако несмотря на приводимые относительно высокие показатели излечения амоксициллином — 82–94%, нельзя забывать, что in vitro пенициллины оказывают неполный ингибирующий эффект по отношению к внутриклеточным возбудителям, в частности, M. hominis, U. urealyticum.
Резюмируя вышесказанное, необходимо отметить, что на сегодняшний день существует множество рекомендаций и схем лечения микоплазменной инфекции. Эффект лечения зависит от многих причин, поэтому обязательным условием успеха лечения является комплексное обследование пациента до назначения лекарственного препарата с обязательным определением чувствительности выявленного патогена к антибактериальным препаратам. Установление клинико-микробиологических критериев излеченности урогенитальных инфекций, вызванных микоплазмами, проводится через 1 месяц после окончания лечения. При отсутствии клинических проявлений заболевания и выявлении возбудителя в количестве менее 104 КОЕ/мл осуществляется динамическое наблюдение за больными, в больших количествах — повторное лечение с заменой антибиотика [18].
С учетом общих принципов лечения инфекционных больных, терапия микоплазменной инфекции должна быть комплексной, этиологически, патогенетически и симптоматически обоснованной и дифференцированной в соответствии с видом возбудителя, клинической формой и характером болезни, наличием осложнений и остаточных явлений.
Литература
В. Н. Кузьмин 1 , доктор медицинских наук, профессор
М. И. Гусейнзаде
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Abstract. The questions of antimicrobial therapy of urogenital mycoplasma infections are actively discussed. Numerous studies devoted to the development of recommendations for mycoplasma infections treatment. But one of the most difficult and up-to-date questions is the choice of effective therapy.
Что такое трихомониаз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агапова Сергея Анатольевича, венеролога со стажем в 39 лет.
Над статьей доктора Агапова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Урогенитальный трихомониаз — это передающаяся половым путём инфекция мочеполовой системы, вызванная влагалищной трихомонадой (Trichomonas vaginalis).
Насколько распространён трихомониаз
Что такое трихомониаз, трихомонады и их виды
Причиной заболевания является инфицирование мочеполовых органов влагалищной трихомонадой — одноклеточным жгутиковым простейшим организмом изменчивой формы, который в естественных условиях может существовать и размножаться только в организме человека. Помимо вагинальной трихомонады у человека могут паразитировать ещё два вида — кишечная трихомонада (Pentatrichomonas hominis) и ротовая (Trichomonas tenax), однако их роль в возникновении заболеваний мочеполовой системы не установлена.
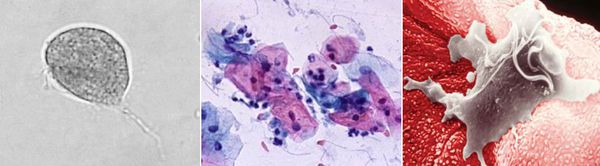
Трихомонада, так как не образует цист и других устойчивых форм, быстро погибает во внешней среде вследствие высыхания, легко разрушается при кипячении, воздействии антисептиков и этилового спирта. Однако может сохранять некоторое время жизнеспособность во влажной среде. Исследованиями установлено, что трихомонады могут выживать до 45 минут на сидениях унитазов, нижнем белье и в воде ванны. [3]
Как можно заразиться трихомониазом
Пути передачи инфекции:
Факторами риска являются:
- случайные половые связи;
- половой контакт, незащищённый барьерной контрацепцией (презервативом);
- злоупотребление алкоголем и наркомания; [7]
- атрофия шейки матки — вследствие снижения защитных свойств из-за уменьшения эстрогенов в тканях; [8]
- наличие других половых инфекций, таких как ВИЧ-инфекция, бактериальный вагиноз, вульвовагинальный кандидоз, генитальный герпес, хламидиоз. [9]
Защищает ли презерватив от трихомониаза
Использование презервативов снижает вероятность заражения. Однако микроорганизмы могут попасть на области, не закрытые ими, поэтому презервативы не могут полностью защитить от трихомониаза [52] .
Передаётся ли трихомониаз во время орального секса
Микроорганизмы способны поражать различные части тела, например, руки или рот. Оральный секс с инфицированным партнёром может привести к заражению трихомониазом ротовой полости [52] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы трихомониаза
Чаще трихомониаз диагностируется у женщин, чем у мужчин. У 10-30 % женщин и у 45-50 % мужчин отмечается асимптомное течение заболевания . [10]
Симптомы трихомониаза у женщин
У женщин трихомонады преимущественно поражают влагалище, откуда они могут проникать в уретру, бартолиновы железы, мочевой пузырь и канал шейки матки. В редких случаях трихомонады паразитируют в полости матки, маточных трубах, почечных лоханках и прямой кишке. [11]
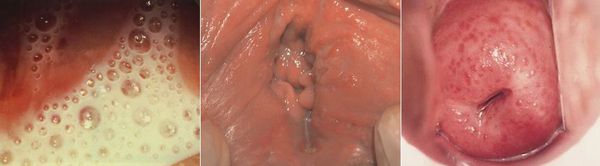
Основными симптомами трихомониаза у женщин являются:
Редкими проявлениями трихомониаза у женщин являются:
- макулярный кольпит (клубничный цервикс) — кровоизлияния в слизистую влагалища и шейку матки, напоминающее ягоду клубники; [12]
- эрозивно-язвенные поражения вульвы и преддверия влагалища. [13]
Симптомы трихомониаза у мужчин
У мужчин трихомонады поражают слизистую оболочку мочеиспускательного канала, нередко проникая в уретральные железы и лакуны. Ввиду неблагоприятных условий для существования в мужской уретре трихомонад, заболевание часто носит транзиторный (временный) характер. Этим же объясняется и большой процент асимптомных форм трихомониаза у мужчин. [14]
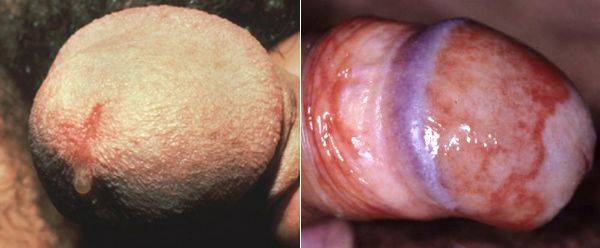
Основными симптомами трихомониаза у мужчин являются:
Редким проявлением трихомониаза у мужчин является баланопостит (воспаление головки и крайней плоти полового члена). Описаны его эрозивно-язвенные формы. [15]
Патогенез трихомониаза
Проникая в урогенитальный тракт человека, трихомонады прикрепляются к эпителиальным клеткам, что приводит к повреждению и воспалительной реакции клеток эпителия. В этой реакции важное значение имеет адгезин — белок, продуцируемый паразитом. [16]
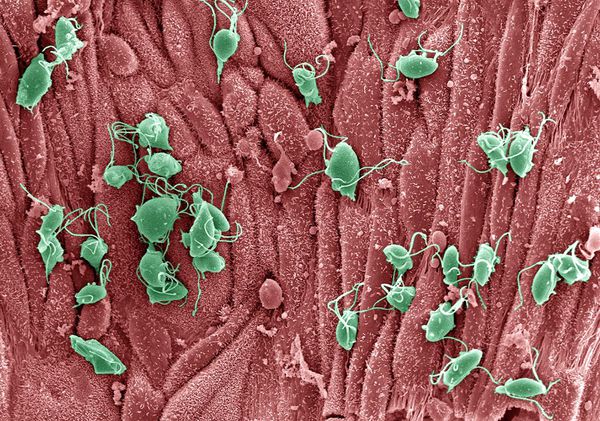
Трихомонады выделяют многочисленные протеолитические ферменты, которые участвуют в цитотоксичности, гемолизе (разрушении эритроцитов и выделении гемоглобина) и уклонении от иммунных реакций. Ферменты находятся во влагалищных выделениях инфицированных женщин вместе с антителами, которые их распознают. Важную роль играет фермент муциназа, который значительно облегчает проникновение трихомонад в слизистые оболочки. [17]
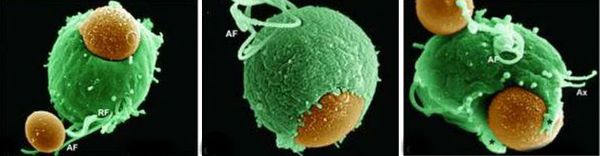
Трихомонадная инфекция вызывает клеточный, гуморальный и секреторный иммунные ответы. Однако эти реакции не способны защитить пациентов от реинфекции, поэтому повторное инфицирование встречается часто. Антитела и компоненты комплемента, присутствующие в сыворотке крови и секрете половых желез у некоторых больных, могут воздействовать на паразита путём стимуляции нейтрофилов, которые способствуют уничтожению трихомонад через классическую систему комплемента. Также антитела могут блокировать адгезию (прилипание) паразита к поверхности слизистой оболочки. [21]
Классификация и стадии развития трихомониаза
По Международной классификации болезней 10-го пересмотра трихомониаз разделяют на:
A59.0 Урогенитальный трихомониаз;
- Бели (вагинальные выделения), вызванные Trichomonas vaginalis; (N51.0), вызванный Trichomonas vaginalis;
A59.8 Трихомониаз других локализаций;
A59.9 Трихомониаз неуточнённый.
Стадии заболевания
После скрытого (инкубационного) периода, продолжающегося от 4 до 28 дней с момента заражения, приблизительно у 40-50% мужчин появляются признаки уретрита в виде слизистых выделений из уретры, а у 70-90% женщин — признаки вульвовагинита, характеризующегося зудом, жжением и наличием обильных мутных выделений из влагалища. [10] В остальных случаях болезнь протекает первоначально бессимптомно. В дальнейшем, если вовремя не получено лечение, развитие заболевания происходит по следующим сценариям:
- Длительное бессимптомное носительство, при котором нет никаких субъективных и объективных симптомов.
- Длительное рецидивирующее течение, при котором симптомы заболевания могут временно возобновляться и самопроизвольно исчезать.
- Ранее развитие осложнений может возникать как при течении заболевания с клиническими симптомами, так и при бессимптомном течении.
- Позднее развитие осложнений возникает при длительно текущем бессимптомном или хроническом рецидивирующем процессе.
Осложнения трихомониаза
В отличии от других половых инфекций – хламидийной и гонококковой — осложнения при трихомониазе встречаются гораздо реже.
Осложнения у мужчин
Эпидидимит — воспаление придатка яичка, очень редкое осложнение трихомонадной инфекции. Чаще всего это хронический процесс, хотя встречаются описания острых форм. [22]
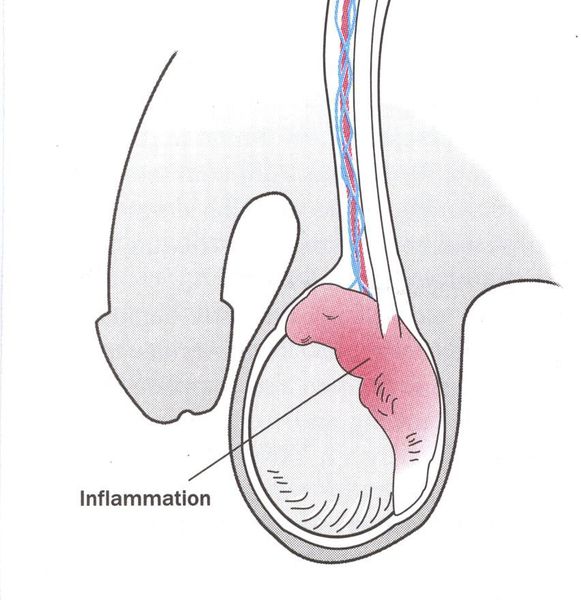
Редким осложнением трихомониаза является простатит. Сообщается о нескольких случаях хронического простатита, вызванного трихомонадной инфекцией. [23]
Нарушение фертильности. Проведенные исследования показывают негативное воздействие трихомонад на сперматозоиды мужчин в виде снижения их подвижности. [24]
Сообщается также о случае трихомонадного двухстороннего конъюнктивита. [31]
Осложнения у женщин
Воспалительные заболевания малого таза, вызванные вагинальной трихомонадной инфекцией, являющиеся причиной трубного бесплодия и синдрома хронической абдоминальной боли, описаны, в основном, у ВИЧ-позитивных женщин. [25]
Проведённые исследования указывают на повышенный риск преждевременных родов, рождения ребёнка с низким весом у инфицированных влагалищной трихомонадой женщин. [26]
Также трихомонадная инфекция в 2-3 раза увеличивает риск заражения ВИЧ. [32]
Очень редким осложнением трихомониаза является цистит. В медицинской литературе описано всего несколько случаев. [33]
Прочие осложнения
Сообщалось о паранефральном абсцессе [27] , абсцессе головного мозга [28] у новорождённого, абсцессе срединного шва полового члена [29] у мужчины, вызванных вагинальной трихомонадой.
Описаны случаи неонатальной трихомонадной пневмонии у новорождённых, успешно вылеченных метронидазолом. [30]
Диагностика трихомониаза
Для диагностики трихомониаза применяются микроскопические, цитологические, бактериологические, молекулярные лабораторные тесты и инструментальные методы обследования.
Показаниями для диагностики трихомониаза являются [2] :
- наличие признаков воспалительного процесса мочеполовых органов;
- беременность (при постановке на учёт по поводу беременности, при сроке беременности 27-30 недель и 36-40 недель, при поступлении на роды без документов о результатах обследования на половые инфекции);
- предстоящие оперативные вмешательства на половых органах и органах малого таза;
- бесплодие и выкидыши в анамнезе;
- половые контакты с больными половыми инфекциями;
- сексуальное насилие.
Микроскопическое исследование
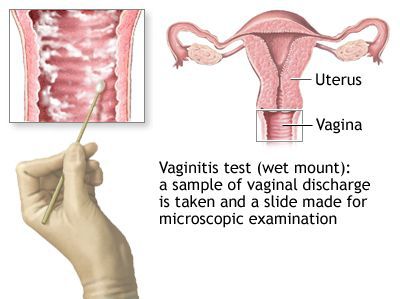
Микроскопия окрашенного препарата (окраска по Романовскому, Папаниколау) не рекомендуется из-за субъективизма при интерпретации результатов исследования. [2]
Культуральное исследование
Молекулярно-биологические методы
Материалом для исследования методом ПЦР при диагностике трихомониаза являются:
- у женщин: выделения из уретры, канала шейки матки, влагалища, первая порция мочи);
- у мужчин: выделения или соскоб из уретры, первая порция мочи, секрет предстательной железы, в редких случаях — сперма. [2]
Требования для получения достоверных результатов исследования:
- Забор материала должен осуществляться не ранее чем через месяц после полученного лечения.
- При отсутствии или скудных выделениях из уретры забор материала должен проводиться через 2-3 часа после последнего мочеиспускания, а при наличии обильных выделений — через 10-15 минут после мочеиспускания.
- Во время менструации забор материала для исследования проводить запрещается.
- Должны быть соблюдены сроки и условия доставки образцов в лабораторию.
Серологическое исследование
Метод иммуноферментного анализа (ИФА) для обнаружения антител классов IgA, IgM и IgG к антигенам T. vaginalis применять не допустимо. [2]
Применение биологических (парентеральное введение пирогенала, гоновакцины), химических (внутриуретральное введение растворов серебра) и алиментарных провокаций (приём алкоголя и острой пищи) с целью повышения выявляемости трихомонад при проведении лабораторных тестов нецелесообразно, так как эффективность этого метода не доказана. [2]
Лечение трихомониаза
Многочисленными исследованиями и клиническими испытаниями было установлено, что наиболее эффективными препаратами для лечения трихомониаза являются препараты группы 5-нитроимидазолов, а среди них — метронидазол, тинидазол и орнидазол.
Современными отечественными и зарубежными руководствами предложены следующие схемы лечения этими препаратами.
Метронидазол (Трихопол, Метрогил, Флагил) — эффективность его применения составляет 90-95%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 7 дней [36] или 2,0 г перорально однократно. [37]
Для осложнённых форм: 500 мг перорально 3 раза в сутки в течение 7 дней или 2,0 г внутрь 1 раз в сутки в течение 5 дней. [38]
Для беременных: 2,0 г однократно (лечение проводится не ранее II триместра беременности). [39]
Для детей: 10 мг на кг массы тела перорально 3 раза в сутки в течение 5 дней. [40]
Тинидазол (Фазижин, Тиниба) — эффективность применения составляет 86-100%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 5 дней или 2,0 г перорально однократно. [35]
Для осложнённых форм: 2,0 г перорально 1 раз в сутки в течение 3 дней. [37]
Орнидазол (Тиберал, Гайро, Дазолик) — эффективность применения составляет 90-100%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 5 дней [41] или 1,5 г перорально однократно. [42]
Для осложнённых форм: 500 мг перорально 2 раза в сутки в течение 10 дней. [38]
Для детей: 25 мг на кг массы тела перорально 1 раз в сутки в течение 5 дней. [39]
Другие препараты из группы 5-нитроимидазолов — менее распространены и изучены, чем вышеизложенные препараты, однако применяются в клинической практике:
- Тенонитрозол (Атрикан) — 250 мг перорально 2 раза в день в течение 4 дней; [43]
- Ниморазол (Наксоджин) — схемы применения при неосложнённом трихомониазе: 2,0 г перорально однократно или 1,0 г перорально через каждые 12 часов – три приёма, или 250 мг перорально 2 раза в день в течение 6 дней. [44]
- Секнидазол (Тагера) — 2,0 г перорально однократно (эффективность 97%). [45]
Причины неудач в лечении
В 5 % случаев трихомонады устойчивы (резистентны) к перечисленным препаратам [46] . Центры по контролю за заболеваемостью (США) в таких случаях рекомендуют увеличить дозировку и длительность применения медикаментов [47] : Метронидазол — 2,0 г перорально однократно в сутки в течении 7 дней или Тинидазол 2,0 г перорально однократно в сутки в течении 7 дней.
Дисульфирам-подобная реакция на препараты
Нитроимидазолы блокируют и снижают выработку фермента алкоголь-дегидрогеназы, что приводит к повышению уровня и накапливанию токсического ацетальдегида в крови. При приёме алкоголя в любых концентрациях во время лечения препаратами, входящими в группу нитроимидазолов, через 10-20 минут возникает реакция в виде тошноты, рвоты, головной боли, затруднения дыхания, судорог. Длительность её составляет несколько часов. Реакция наблюдается при приёме метронидазола, тинидазола [48] и орнидазола [49] .
Помимо исключения алкоголя, рекомендаций по изменению привычек или особенностям питания при лечении трихомониаза нет.
Установление излеченности трихомонадной инфекции
Проводится через две недели после окончания лечения микроскопией и культуральным посевом и через 4 недели методом ПЦР. При отрицательных результатах лабораторных тестов пациенты дальнейшему наблюдению не подлежат. [2]
Можно ли заниматься сексом при трихомониазе
Заниматься сексом можно через 7-10 дней после завершения лечения трихомониаза. Примерно каждый пятый выздоровевший заражается вновь в течение трёх месяцев после окончания лечения. Чтобы избежать повторного заражения, лечение должны пройти все сексуальные партнеры. Если симптомы возникли снова, нужно пройти повторное обследование [52] .
Прогноз. Профилактика
Прогноз при раннем выявлении и вовремя начатом лечении благоприятный. При неосложнённых формах трихомонадной инфекции после однократного курса выздоровление составляет 95-100%. Лица с осложнёнными формами и метронидазол-устойчивыми формами заболевания после проведённого лечения должны находиться под динамическим наблюдением.
Половые партнёры больных трихомониазом должны быть пролечены независимо от результатов их обследования на наличие трихомонад.
Самой эффективной мерой профилактики является использование презервативов при случайных половых контактах.
Ввиду бессимптомного течения инфекции лицам, имеющим несколько половых партнёров в год или случайные половые связи, рекомендовано ежегодное обследование на наличие трихомонад.
В настоящее время вакцины, предотвращающей заражение трихомониазом, не создано. В 80-е годы прошлого века была создана коммерческая вакцина Солкотриховак, состоящая из лиофилизата Lactobacillus acidophilus, которая по утверждению фирмы-производителя оказывает положительный эффект при рецидивирующем трихомониазе и бактериальном вагинозе. [50] Однако последующими исследованиями предположение о том, что защитный механизм действия вакцины связан на антигенном сходстве применяемых штаммов лактобацилл и вагинальной трихомонады, было отвергнуто. [51]
Проблема роста инфекций, передаваемых половым путем и воспалительных заболеваний органов малого таза, является традиционно актуальной на протяжении последних лет.
В структуре гинекологических нозологий воспалительные заболевания половых органов занимают первое место и составляют 60-65% всех гинекологических больных. В свою очередь, в 60%, причиной ВЗОМТ являются инфекции, передаваемые половым путем. По данным ВОЗ (июнь 2000 г) – 60-70% всех ВЗОМТ за счет хламидиоза и гонореи
(C. trachomatis – 30%; N. gonorrheaе – 40-50%). Часто причиной ВЗОМТ является также Trichomonas vaginalis (частота выявления значительно варьирует), микоуреаплазменная инфекция (12-20%). Этиологическим фактором развития воспалительных заболеваний органов малого таза могут являться факультативная и облигатная анаэробная флора бактериального вагиноза и другие Гр+ и Гр- анаэробные и аэробные бактерии. В 20% случаев ВЗОМТ возбудителей выявить не удается.
Распространение ИППП в мире. (ВОЗ, 1999 г., Donovan B., Lancet, 2004 г.)
Трихомониаз – 174 млн., хламидиоз – 92 млн., гонорея – 62 млн., сифилис – 12 млн.
Отмечено, что U. urealyticum, также как и трихомониаз, была обнаружена у 174 млн.
Наибольший пик заболеваемости ВЗОМТ приходится на период с 15-24 лет.
После 20 лет, особенно после 30 лет, частота регистрации ВЗОМТ значительно уменьшается. Такая закономерность может быть обусловлена как изменением полового поведения, так и появлением защитных антител в цервикальном канале. Отмечена четкая связь между распространением случаев ВЗОМТ и ИППП. В тех странах или регионах, где удается снизить число заболевших гонореей, трихомониазом, хламидиозом, отмечено существенное снижение числа ВЗОМТ.
Воспаление - комплексная сосудисто-мезенхимальная реакция на повреждение ткани. Эта реакция направлена на уничтожение агента, вызвавшего повреждение, и на восстановление поврежденной ткани. Воспаление – это защитно-приспособительная реакция, исход которой может быть не благоприятным.
Состояние и функция верхних отделов репродуктивного тракта во многом зависит от механизмов защиты влагалища:
- Физиологические бели – в норме 1-2 мл/сут.
- Физиологическая десквамация эпителия (вместе с ним выводятся и бактерии)
- Микрофлора влагалища (за счет конкурирования с патагентами за питательные вещества)
- Рецепторы адгезии
- Выделение бактериоцинов
- Стимуляция иммунной системы
- Создание кислой среды
- Секреторные иммуноглобулины
- Лизоцим слизистой.
Слизистая пробка цервикального канала обеспечивает механическую преграду за счет вязкости, а также содержит антимикробные субстанции и антитела (секреторный Ig А, лизоцим).
Также важную защитную роль играет менструация (отторжение функционального слоя эндометрия, формирование на его месте лимфоцитарного вала, препятствует длительному пребыванию патогенных микроорганизмов).
Под действием эндогенных и экзогенных факторов нарушаются защитные механизмы, что приводит к развитию воспалительных процессов во влагалище. Их не эффективное лечение или не диагностирование является одной из причин ВЗОМТ.
Пути и механизмы проникновения инфекции:
- половой – 99%
- восходящий (каналикулярно – через цервикальный канал, полость матки, маточные трубы на брюшину и органы брюшной полости)
- гематогенный (о чем свидетельствует наличие экстрагенитальных осложнений)
- лимфогенный, с развитием пельвиоперитонитов и дальнейшим лимфогенным распространением
- по протяжению (распространяясь по брюшине из первичного патологического очага, например при аппендиците).
- В восхождении инфекции могут также играть роль сперматозоиды, трихомонады, ВМК.
- Отрицательный заряд сперматозоидов притягивает бактерии. Наибольшей тропностью к ним обладает кишечная палочка
- Активно проникая при половом контакте, далее микроорганизмы могут распространяться пассивно из нижних отделов в верхние, путем сократительной деятельности матки и/или за счет изменения давления в ее полости, которое связано с движением диафрагмы при дыхании
- ВМК – риск развития ВЗОМТ зависит от времени использования ВМК, от его типа.
Риск наиболее высок в течение первого месяца использования:
- занос инфекции при введении спирали
- распространение бактерий по нитям ВМК
- нарушение процессов слущивания эндометрия
- подавление фагоцитоза и других факторов иммунной защиты
- ВМК способствует появлению микроэрозий и перифокальной
воспалительной реакции стромы.
Некоторые особенности возбудителей ИППП на современном этапе.
- N.gonorrheaе
- Одна из основных причин ВЗОМТ
- До 90% женщин, страдающих гонореей, не имеют никаких клинических симптомов
- Гонококк чаще обнаруживается при смешанном инфицировании
- Вызывает поражения урогенитального тракта, схожие по характеру с хламидиозом, но большей степени выраженности
Chlamydia trachomatis
Причины внимания к урогенитальному трихомониазу
Trichomonas vaginalis
- указанные клинические симптомы могут быть также проявлением инфекций урогентального тракта;
- характерный для трихомониаза "клубничный" симптом встречается только у 2% пациенток;
- пенистые выделения, которые можно связать с активным ростом влагалищных трихомонад, наблюдаются примерно у 12% инфицированных женщин.
В связи с тем что клинические симптомы трихомонадной инфекции довольно часто не отражают реальной картины заболевания, необходимо применять лабораторные методы диагностики.
Современные особенности ВЗОМТ
Острое начало воспалительного процесса наблюдается редко,протекает с переходом в хроническую форму или выздоровление. Как правило, постепенное развитие, без клинических проявлений приводит к хроническому течению ВЗОМТ.
И все же клинические проявления могут быть в виде:
- периодических болей внизу живота, с усилением перед, либо в конце menses
- иррадиации боли в область промежности, поясничный и крестцовый отделы.
- часто боль по интенсивности не соответствует изменениям в половых органах.
- зуд в промежности, возникающий из-за воспаления, раздражения выделениями из вышележащих отделов
- чувство распирания жара в области промежности, в области малого таза
- нарушение менструального цикла (мено-метроррагии, олигоопсоменорея, дисменорея, предменструальные, постменструальные мажущие выделения
- психо-эмоциональные расстройства
- изменение либидо, аноргазмия, вагинизм, диспареуния
- бели: чаще слизисто-гнойные, слизистые
- повышение температуры тела, общая утомляемость, слабость
- частое мочеиспускание с чувством покалывания, резями
- может быть частая дефекация (как проявление дисфункции прямой кишки).
- периаппендицит ( у женщин моложе 20 лет, с хламидиозом)
- негормональное бесплодие, эктопическая беременность в анамнезе.
Диагностика ИППП при ВЗОМТ
- ПЦР (хламидии, уреаплазмы, микоплазмы, гарднереллы, вирусы, гонококк, ВИЧ,
ЛЦР Tbs, сифилис)
В нашей стране, согласно действующих нормативных документов, для подтверждения диагноза: трихомониаз используется в основном цитологический и культуральные методы. Другие методы диагностики, в настоящее время, не включены в действующие регламентирующие документы, в связи, с чем диагноз, установленный с их помощью, не будет считаться юридически правомочным со всеми вытекающими последствиями.
- Иммунофлюоресцентный анализ (ПИФ, НПИФ). Определяет моноклональные антитела, меченные флюоресцентом. Чувствительность метода – 98%, специфичность – 90%.
(Хламидиоз, микоуреаплазменная инфекции).
- Культуральный метод (Стандарт обнаружения всех видов инфекции. Его применение ограничено, т.к. сложно, неудобно транспортировать).
Последствия генитальной инфекции.
- Внематочная беременность
- Бесплодие
- Невынашивание беременности
- Осложненное течение беременности
- Аномалии родовой деятельности
- Патология плаценты
- Антифосфолипидный синдром
- Аутоиммунная патология
- Анти-ХГ-синдром
- Инфицирование новорожденного
- Мертворожденность
- Увеличение риска заражения ВИЧ
- Тазовые боли
- Диспареуния
- Нарушение менструального цикла
- Спаечный процесс
- Послеоперационные воспалительные осложнения
- Эктопия шейки матки
- Эндометриоз
- Полипы цервикального канала и эндометрия
- Миома матки
Наиболее частыми и грозными последствиями генитальной инфекции являются бесплодие и внематочная беременность. Так бесплодие, при наличии хламидий, встречается у 50%, при наличии гонококка – 30-40%, уреаплазм – 30% и более, трихомонад – 45-50%.
Эктопическая беременность встречается в 9-30% случаев при наличии хламидий, в 40% - при наличии гонококка.
После 1 случая ВЗОМТ – одна из 12 женщин – бесплодна, после второго случая ВЗОМТ – каждая 5 женщина. Если было три и более случаев ВЗОМТ – 50-60% женщин – бесплодны. По данным ВОЗ, у замужних женщин бесплодие встречается в 4,5% в возрасте 16-20 лет, 31,8% - в возрасте 35-40 лет, в 70% - если возраст 40 лет.
Факторы, обусловливающие необходимость госпитализации.
- Не исключены состояния, требующие срочного хирургического вмешательства, такие как аппендицит, внематочная беременность и др.
- Пациентка беременна
- Безуспешное лечение пероральными антимикробными средствами
- Неспособность пациентки соблюдать или переносить амбулаторный пероральный режим
- Тяжело протекающее заболевание, тошнота, рвота, или высокая температура
- Тубоовариальный абсцесс
- Наличие иммунодефицита (ВИЧ – инфекция с низким количеством CD4, иммуносупрессивная терапия или другие заболевания)
В мировой врачебной практике 13 пациенткам из 1000 ежегодно ставится диагноз воспалительного заболевания органов малого таза. Только 10% из них госпитализируются.
Лечение смешанных генитальных инфекций
В настоящее время общепризнанно, что терапия должна быть прямо направлена против аэробного и анаэробного компонентов полимикробной флоры, которую чаще всего выделяют у больных с инфекциями малого таза.
В настоящее время стандартное лечение трихомониаза (рекомендации ВОЗ, CDC) включает прием метронидазола. Для лечения ВЗОМТ (офлоксацин, доксициклин).
ТРИХОПОЛ - Противопротозойный препарат с антибактериальной активностью, производное 5-нитроимидазола. Механизм действия заключается в биохимическом восстановлении 5-нитрогруппы метронидазола внутриклеточными транспортными протеинами анаэробных микроорганизмов и простейших. Восстановленная 5-нитрогруппа метронидазола взаимодействует с ДНК клетки микроорганизмов, ингибируя синтез их нуклеиновых кислот, что ведет к гибели микроорганизмов.
Метронидазол поступает в клетку диффузией и активируется гидрогеносомах влагалищных трихомонад. Здесь нитрогруппа препарата отщепляется посредством пируват-ферродоксин-оксиредуктазы, в результатечего цитотоксические нитро-радикальные ионные интермедиаты расщепляют нити ДНК. Ответ возникает быстро. Клеточное деление и подвижность клетки прекращается в течение 1 часа, а сама клетка (по данным культурального исследования) погибает в течение примерно 8 часов. Препарат активен в отношении Trichomonas vaginalis, Gardnerella vaginalis, Giardia intestinalis, Entamoeba histolytica, облигатных анаэробных бактерий: Bacteroides spp. (в т.ч. Bacteroides fragilis, Bacteroides distasonis, Bacteroides ovatus, Bacteroides thetaiotaomicron, Bacteroides vulgatus), Fusobacterium spp., Veillonela spp.; некоторых грамположительных бактерий: Eubacterium spp., Clostridium spp., Peptococcus spp., Peptostreptococcus spp. Основной метаболит (2-оксиметронидазол) также оказывает противопротозойное и антибактериальное действие. T1/2 составляет 8 ч.
Метронидазол хорошо сорбируется на большинстве мембран слизистых; эффективность его поступления в клетки эпителия вагины при приеме внутрь доказана.
Учитывая все вышеперечисленное, в амбулаторной практике, мы использовали
Трихопол 250 мг – 2 раза в день + Трихопол (вагинальные таблетки) 500 мг 1 раз на ночь в течении 7 дней + Антибиотики различных групп (Офлоксацин или Доксициклин или Джозамицин) по 1 таб. или капсуле 2 раза в день, в течении 10 дней. Такая схема является наиболее оптимальным вариантом комбинированного комплексного лечения, учитывая, что пероральный прием трихопола является наиболее эффективным, а вагинальный – наиболее щадящим.
Активность современных антибактериальных препаратов в отношении возбудителей ВЗОМТ

Инфекций, передающихся половым путем много, но особое внимание мы обратим сейчас на Хламидию, уреаплазму и микоплазму. Т.к.в организме каждого человека эти инфекции находятся в латентном состоянии, и часто начало заболевания проходит без каких-либо ярко выраженных симптомов. Поэтому женщины узнает о заболевании совершенно случайно, когда обращаются по поводу лечения осложнений, вызванных этими инфекциями. Между тем, без лечения эти инфекции приводят к серьезным осложнениям и ухудшают качество жизни.
Основной способ проникновения этих инфекций в организм мужчин и женщин – половой акт. При этом барьерные методы (презервативы) не защищают на 100% - заражение часто носит экстрагенитальные формы (хламидийный конъюктивит, пневмония, для микоплазмы и уреаплазмы еще поражение слизистой оболочки глотки, плацентарная форма проникновения в организм).

Хламидиоз (хламидиаз) — инфекционное заболевание, передающееся половым путём, вызываемое хламидиями(Chlamydia trachomatis). По статистике ежегодно хламидиозом в мире заболевает 100 млн человек, а число инфицированных хламидиями людей на всем земном шаре по самым скромным подсчётам достигает одного миллиарда. По данным ВОЗ и многочисленных отечественных и зарубежных исследователей, урогенитальный хламидиоз является одним из самых распространённых заболеваний, передаваемых половым путём. По разным данным, от 5 до 15 % молодых сексуально активных людей заражены хламидийной инфекцией.
Хламидии относят к группе бактерий, но у них присутствуют черты, схожие с вирусами. Отличительной особенностью хламидий является то, что они могут инфицировать клетки организма и размножаться непосредственно внутри них. Именно поэтому первичное инфицирование часто проходит незаметным. Бактерии очень устойчивы к различным неблагоприятным воздействиям. Внедряясь в живую клетку, бактерия наделяется способностью делиться и расти в этой клетке, надежно защищенная от иммунной системы человека. После формирования новых клеток хламидии покидают клетку-хозяина и она через некоторое время погибает. Такой процесс размножения и деления продолжается в течение 2-3 дней, и хламидии начинают искать новые клетки-жертвы. При отсутствии лечения, или не полном лечении заболевание всегда переходит в хроническую форму и наблюдается поражение как нижних, так и верхних отделов мочеполовой системы.
Метод заражения. Попадание бактерий в организм может происходить при анальном, вагинальном и оральном сексе и даже через бытовые предметы и внутриутробно: от матери – к ребенку. При внутриутробном заражении у детей отмечается хламидийный конъюктивит и пневмония.
Очень часто хламидийная инфекция соседствует в организме с микоплазмами, анаэробами, гонококками и другими инфекциями, т.к. поражение хламидиями снижает защитные способности организма человека.

Симптомы: Болевые ощущения в нижней части живота, дискомфорт в паху и промежности, скудные выделения из влагалища и уретры, жжение и зуд в области наружных половых органов и мочеиспускательном канале.
Осложнения. У женщин хламидии приводят к появлению сактосальпинксов – спаечного процесса в малом тазу, и, как следствие, трубному бесплодию, внематочной беременности. У мужчин заболевание может поражать придатки яичек, семенные пузырьки и простату.

Уреаплазмоз описан как заболевание, вызываемое условно-патогенной микрофлорой — микоплазмами видов Ureaplasma urealyticum и Ureaplasma parvum. Уреаплазмы широко распространены (10–80% среди разных групп населения) и часто обнаруживаются у людей, не имеющих клинических симптомов, наряду с Mycoplasma hominis выявляются в гениталиях у 5–20% клинически здоровых людей.
Уреаплазма былает нескольких видов. Самой болезненной разновидностью считают Ureaplasma urealyticum. Она локализуется преимущественно на слизистых оболочках мочеполовой системы, но иногда и на слизистых ротовой полости и глотки. Уреаплазмозом болеют и мужчины и женщины. Ureaplasma urealyticum активно влияет на среду обитания, довольно легко расщепляет мочевину с выведением аммиака. Это приводит к обширному воспалительному процессу и скоплению солей мочевой кислоты в почках. Что, в свою очередь, может привести к болезненному мочеиспусканию, циститу, задержке жидкости в организме.
Ureaplasma parvum менее агрессивная разновидность инфекции. Она провоцирует воспалительный процесс лишь при общем снижении общего и местного иммунитета у женщин. Например, если присутствуют другие инфекции в малом тазу, во время беременности, после медицинского вмешательства (гистероскопии, аборта, биопсии), при эрозии шейки матки и др. бактерия имеет слабо выраженную мембрану и легко внедряется в слизистые половых органов и мочевыводящих путей. Во время беременности Ureaplasma parvum становится агрессивной и опасной, тк. Может проникать через плаценту и представлять угрозу развития плода.
Метод заражения. Плацентарный, может передаться от матери к ребенку, попасть в половые пути новорожденного и сохраняться в них в течение всей жизни, находясь в неактивном состоянии. При вагинальном, анальном и оральном сексе.
Факторы риска. Частая смена половых партнеров, продолжительный прием антибиотиков (активизируются скрытые формы из-за снижения иммунитета), наличие других инфекций, перепады температуры.
Симптомы. Выделения из мочеиспускательного канала после задержки мочи, жжение при мочеиспускании и во время полового акта, болевые ощущения внизу живота, ненормальные влагалищные выделения, аммиачный запах, тянущая боль в области мочевого пузыря и почек.
При отсутствии лечения длительная и вялотекущая инфекция может вызвать развитие серьезных осложнений. Бактерии могут поражать яички и простату у мужчин, придатки, матку и влагалище у женщин. Отсутствие лечения приводит к развитию простатита, аднексита, эндометрита, кольпита и цистита.
При глубоком поражении уреаплазмой систем и органов лечение длительное и не всегда эффективное.

Микоплазмоз — это хроническое заболевание, которое вызывают паразитирующие в организме человека мелкие бактерии – микоплазмы. Микоплазмы - микроорганизмы, занимающие промежуточное положение между бактериями, грибами и вирусами. Обычно микоплазмы прикрепляются на клетки эпителия - слизистой выстилки кишечного, дыхательного и мочеполового трактов. Паразитируют в клетках хозяина. Среди достаточно большого количества микоплазм, встречающихся у человека только 4 вида могут при определенных условиях вызвать болезнь.
Микоплазма опасна тем, что при создании определенных условий (снижение общего и местного иммунитета) активизирует воспалительный процесс в малом тазу и становится причиной развития такой патологии, как микоплазмоз. Эта болезнь без лечения активно передается половым путем и может стать причиной серьезных осложнений как у мужчин, так и у женщин.
Микоплазму по свойствам можно отнести как к вирусам (из-за размера), так и к бактериям (из-за структуры). Как у вирусов у микоплазмы отсутствует клеточная стенка, и она может спокойно внедряться в клетки организма и паразитировать на них.
Метод заражения. Основной путь заражения – половой контакт, но в редких случаях и бытовой путь, плацентарный, может передаться от матери к ребенку.
Инкубационный период от 3 до 5 недель.
Симптомы. У мужчин выделения из уретры, дискомфорт при мочеиспускании, у женщин белые, желтые или прозрачные выделения из влагалища, болевой синдром, жжение при мочеиспускании и половом акте, покраснения половых органов.
При отсутствии лечения симптоматика усиливается. У мужчин может появиться болевой синдром в области мошонки, прямой кишки и промежности, а у женщин дискомфорт в области малого таза и поясницы.
У женщин после перенесенного заболевания может развиться хронический эндометрит. Во время беременности микроорганизмы могут передаваться от матери к ребенку, что часто становится причиной выкидышей в первом триместре, а на последних неделях беременности – преждевременные роды. У детей микоплазма провоцирует развитие патологий органов дыхания и мочеполовой системы.
Лечение таких заболеваний, как уреаплазмоз, микоплазмоз и хламидиоз – довольно длительный процесс. Но рекомендациями врача пренебрегать нельзя, тк без лечения, или при неполном лечении могут развиться серьезные осложнения заболевания (См. статью "Причины, симптомы и методы лечения эндометрита" ).
Мировая медицинская практика показывает, что избавиться от этих инфекций за один курс медикаментозного лечения довольно проблематично, т.к. чаще всего из-за скрытого начала течения заболевания пациенты обращаются несвоевременно. После тщательного обследования врачи подбирают курс медикаментозной терапии, но наилучшие результаты дает комплексный подход: физиотерапия с лекарственными препаратами местного действия. Многие врачи считают, что при устранении таких инфекций важно не навредить иммунной системе и желудочно-кишечному тракту, поэтому при лечении нужно минимизировать воздействие сильнодействующих препаратов на организм. Т.к. при снижении иммунитета эти заболевания начинают активно размножаться в организме. Это означает, что курс лечения лучше проходить в медицинском центре, где есть ультразвуковая санация лекарственными препаратами (ГИНЕТОН), лазеротерапия, магниты, электростимуляция (БТЛ) и иммунокоррекция внутривенным лазером (ВЛОК).
При лечении уреаплазмоза, хламидиоза, микоплазмоза необходимо отказаться от употребления спиртосодержащих напитков, от половой жизни, острых, жирных и сладких блюд. Принципиально важно не допустить инфицирование микроорганизмами, которые вызывают развитие половых инфекций.
ВАЖНО! Т.к. Хламидии, уреаплазма, микоплазма из-за своей двойственной структуры способны проникать внутрь живых клеток, оставаясь долгое время незаметными для иммунной системы человека (без симптомов) важно: сдавать анализ ПЦР на эти инфекции раз в год, даже если нет симптомов, проверять и лечить обоих партнеров одновременно, проходить полный курс лечения – минимум 10-14 дней медикаментозный курс совместно с физиопроцедурами, тк дозировка препаратов рассчитана на лечение от этих инфекций и закрепление результата, т.е. воздействие на инфекции в активной фазе размножения и в скрытой (внутриклеточной).
Профилактика хламидиоза, уреаплазмоза и микоплазмоза. В первую очередь нужно отказаться от случайных половых связей и проходить регулярные исследования на половые инфекции. Профилактика половых инфекций включает повышение защитных сил организма (общего и местного иммунитета) и сохранение нормальной микрофлоры в половых органах. Для этих целей в нашей клинике вы можете пройти полную диагностику методом ПЦР в современной лаборатории. Срок готовности анализов 2-3 дня. А также пройти профилактический курс ультразвуковой санации на аппарате ГИНЕТОН с маслом чайного дерева, иммуностимулирующими и противовирусными препаратами. ГИНЕТОН мягко очищает шейку матки, восстанавливает естественную микрофлору влагалища и поднимает местный иммунитет. Для поднятия общего иммунитета эффективен внутривенный лазер ВЛОК. Для профилактики достаточно проходить курс из 10 процедур раз в 6 месяцев.
Читайте также:

